左归丸靶向C-X-C趋化因子受体4对人脐带间充质干细胞体外迁移的影响
2023-12-20杨丽晓李亦晗芦现杰
焦 存 杨丽晓 张 艳 王 哲 李亦晗 芦现杰
(1 山东省聊城市人民医院,聊城,252000; 2 山东大学附属聊城人民医院,聊城,252000; 3 山东中医药大学,济南,250355)
卵巢早衰(Premature Ovarian Failure,POF)是指女性在40岁以前出现闭经、促性腺激素水平升高和雌激素水平降低,常伴有不同程度的围绝经期症状。中医辨证多与肾虚有关。左归丸始于《景岳全书》,是中医补肾的经典方剂,具有滋阴补肾、填精生髓的功效,近年来广泛应用于卵巢早衰等生殖疾病的治疗[1]。干细胞具有多向分化的特性,人脐带间充质干细胞(Human Umbilical Cord Mesenchymal Stem Cells,hUC-MSCs)作为组织损伤修复与再生的理想种子细胞之一,在治疗卵巢早衰方面亦得到大量研究[2-3]。左归丸和hUC-MSCs相结合为卵巢早衰治疗提供了新的思路。研究发现,干细胞归巢率低等问题严重制约其治疗效果,基质细胞衍生因子-1(Stromal Cell-derived Factor-1,SDF-1)/C-X-C趋化因子受体4(C-X-C Chomekine Receptor 4,CXCR4)信号通路在间充质干细胞(Mesenchymal Stem Cells,MSCs)迁移和归巢中发挥着关键作用[4-5]。左归丸可能通过调控骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)的体内迁移与归巢从而增强其治疗效果[6]。但是,关于左归丸对hUC-MSCs体外迁移作用及与CXCR4表达关系的研究,国内外鲜见报道。因此,本研究拟探讨左归丸对hUC-MSCs体外迁移的影响及可能的分子机制,以期为左归丸联合hUC-MSCs治疗卵巢早衰提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞 hUC-MSCs,采用组织块法分离培养健康产妇足月分娩胎儿的脐带样本,经聊城市人民医院伦理委员会批准(伦理审批号:2019016)。培养液为DMEM/F12培养液(含10% FBS和1%双抗),条件为37 ℃和5%CO2。
1.1.2 药物 左归丸(仲景宛西制药股份有限公司,批号:181012)。
1.1.3 试剂与仪器 杜尔贝科改良伊格尔培养基/营养混合物F-12(Dulbecco′s modified Eagle Medium/Nutrient Mixture F-12,DMEM/F12)(货号:11330032)、青霉素-链霉素(货号:15140122)、TrypLE酶(货号:12605010),以上均购自美国Gibco公司;胎牛血清(Fetal Bovine Serum,FBS)(ScienCell公司,美国,货号:0510);普乐沙福(AMD3100)(MCE公司,美国,货号:HY-10046);CD34抗体(货号:348057)、CD45抗体(货号:555483)、CD73抗体(货号:561014)、CD90抗体(货号:555595),以上均购自美国BD公司;PrimeScriptTMRT Master Mix(Takara公司,日本,货号:RR036A);SYBR Green Master Mix(Thermo Fisher公司,美国,货号:4309155);结晶紫染色液(货号:E607309)、一步法动物细胞活性蛋白提取试剂盒(货号:C500022)、改良BCA法蛋白质浓度测定试剂盒(货号:C503051)、ECL超敏化学发光试剂盒(货号:D601039),以上均购自生工生物工程(上海)股份有限公司;CCK-8试剂盒(货号:C0037)、SDF-1α(货号:P6537)、QuickBlockTMWestern溶液套装(货号:P0239)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(货号:A0216),以上均购自碧云天公司;β-actin抗体(货号:sc-47778)、CXCR4抗体(货号:sc-53534)、CXCR4-FITC抗体(货号:sc-53534 FITC),以上均购自美国Santa Cruz公司。CO2培养箱(Thermo Fisher公司,美国,型号:371);超净工作台(苏净安泰公司,型号:SW-CJ-1FD);光学显微镜(Nikon公司,日本,型号:TS100-F);离心机(Eppendorf公司,德国,型号:5810);流式细胞仪(BD公司,美国,型号:FACS AriaIII);荧光定量PCR仪(ABI公司,美国,型号:7500);酶标仪(型号:iMark)、电转电泳系统(型号:PowerPac)、凝胶成像分析系统(型号:ChemiDoc),以上均购自美国Bio-Rad公司。
1.2 方法
1.2.1 hUC-MSCs分离培养 剔除脐带动静脉血管,分离出华通氏胶,机械剪切约3 mm组织块,覆盖无菌玻片,置于含10% FBS的DMEM/F12培养液中培养。每2~3天换液1次,待细胞融合度为80%~90%,用TrypLE酶消化5 min,加入完全培养液中止消化,201×g,离心5 min,去除上清液,按1∶3进行传代,记为P1。此后每4~5天按1∶3比例传代,进行扩增培养。
1.2.2 hUC-MSCs流式鉴定 取第3代对数期hUC-MSCs,制成单细胞悬液,调整细胞浓度为1×106/mL。取200 μL细胞悬液于样本管,分别加入CD34、CD45、CD73和CD90荧光抗体各2 μL,充分混匀后常温避光孵育30 min。杜氏磷酸盐缓冲液(Dulbecco′s Phosphate-buffered Saline,DPBS)洗涤2次,201×g,离心5 min,弃上清液,加入500 μL DPBS混匀,细胞筛过滤后用流式细胞仪进行分析。
1.2.3 CCK-8检测 取第3~5代对数期hUC-MSCs,按2×103/孔细胞量接种到96孔板,24 h后加入不同培养液各200 μL,分为空白组(不加细胞)、对照组和左归丸组(浓度分别为0.1、0.2、0.5、1.0 mg/mL),培养48 h后弃上清液,每孔加入无血清培养液90 μL和CCK-8 10 μL,继续培养2 h。用酶标仪测定波长450 nm的吸光度值。每组均设5个复孔。
1.2.4 细胞划痕实验 取第3~5代对数期hUC-MSCs,按2×105/孔细胞量接种于6孔板,48 h后用1 mL枪头划痕,DPBS洗涤3次,分别加入不同的无血清培养液,分为对照组、左归丸0.1 mg/mL组、左归丸0.2 mg/mL组和左归丸+普乐沙福组(左归丸0.2 mg/mL+普乐沙福10 μmol/L),继续培养24 h后观察细胞迁移情况。利用Image J软件分别计算0 h和24 h的划痕面积,采用划痕愈合面积百分比比较各组细胞的迁移能力。
1.2.5 Transwell实验 用无血清培养液调整hUC-MSCs密度为1×105/mL,加100 μL到24孔Transwell上室(孔径8.0 μm),下室为500 μL含100 ng/mL SDF-1α的正常培养液,分为对照组、左归丸0.1 mg/mL组、左归丸0.2 mg/mL组和左归丸+普乐沙福组(左归丸0.2 mg/mL+普乐沙福10 μmol/L),培养1天后取出小室,用棉签轻轻擦去膜上层细胞,DPBS洗涤3次,4% PFA固定15 min,结晶紫染色10 min。
1.2.6 实时聚合酶链反应(Real-time PCR) TRIzol提取细胞RNA,利用PrimeScriptTMRT Master Mix逆转录为cDNA。β-actin(Forward:CATGTACGTTGCTATCCAGGC,Reverse:CTCCTTAATGTCACGCACGAT)和CXCR4(Forward:GGGCAATGGATTGGTCATCCT,Reverse:TGCAGCCTGTACTTGTCC)引物,均由生工生物工程(上海)股份有限公司合成。反应体系为10 μL SYBR Green Master Mix(2×)、1 μL cDNA、8 μL RNase-free dd H2O及正反向引物(10 μmol/L)各0.5 μL。反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,40个循环。以β-actin作为内参,采用公式2-△△Ct计算CXCR4基因的相对表达量。
1.2.7 蛋白质印迹法 裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取10 μg蛋白上样,在SDS聚丙烯酰胺凝胶电泳胶上电泳(浓缩胶5%:80 V,30 min;分离胶10%:120 V,60 min),250 mA转聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜1 h。常温封闭30 min,加入CXCR4抗体(1∶100)和β-actin抗体(1∶1 000),常温孵育2 h,洗膜后加HRP标记的二抗(1∶1 000),常温孵育1 h,ECL显影。利用Image J软件进行灰度分析。
1.2.8 CXCR4表达流式分析 取各组hUC-MSCs,制成单细胞悬液(浓度为1×106/mL)。取500 μL细胞悬液于样本管,加入CXCR4-FITC抗体5 μL,充分混匀后常温孵育1 h。DPBS洗涤2次,201×g,离心5 min,弃上清液。加入500 μLDPBS混匀,细胞筛过滤后上机检测。

2 结果
2.1 hUC-MSCs的分离培养与流式鉴定 分离的hUC-MSCs形态多为梭形(图1A),增殖力强,传代后4~5天即可长满。利用流式细胞仪分析第3代hUC-MSCs表面标志物,发现hUC-MSCs高表达CD73(87.3%)和CD90(99.4%),极低表达CD34(0.3%)和CD45(0.2%)。见图1B。分离培养的细胞符合hUC-MSCs的特征。
2.2 左归丸对hUC-MSCs增殖的影响 应用不同浓度左归丸处理hUC-MSCs 48 h后,CCK-8检测发现,与对照组比较,0.1、0.2 mg/mL左归丸能明显促进hUC-MSCs增殖(P<0.05),0.5 mg/mL左归丸对细胞增殖无明显影响,而1.0 mg/mL左归丸则明显抑制hUC-MSCs增殖(P<0.05),其中0.2 mg/mL为最佳浓度(图2A)。合适浓度的左归丸对hUC-MSCs增殖有明显促进作用。

图2 左归丸对hUC-MSCs增殖和体外迁移的影响
2.3 左归丸对hUC-MSCs体外迁移的影响 细胞划痕实验结果显示:左归丸0.1、0.2 mg/mL组细胞划痕愈合速度显著快于对照组,最佳作用浓度为0.2 mg/mL(P<0.05);加入普乐沙福(CXCR4拮抗剂)后,与左归丸0.2 mg/mL组比较,细胞划痕愈合速度则显著下降(P<0.05)。见图2B和2C。Transwell实验结果显示:左归丸0.1、0.2 mg/mL组迁移细胞数量明显多于对照组,最佳作用浓度为0.2 mg/mL(P<0.05);加入普乐沙福后,与左归丸0.2 mg/mL组比较,迁移细胞数量则明显下降(P<0.05)。见图2D和2E。合适浓度的左归丸对hUC-MSCs体外迁移有明显促进作用,最佳作用浓度为0.2 mg/mL,应用CXCR4拮抗剂则能抑制左归丸诱导的hUC-MSCs促迁移作用。
2.4 左归丸对hUC-MSCs中CXCR4表达的影响 实时PCR分析发现,左归丸0.2 mg/mL组CXCR4 mRNA表达水平明显高于对照组(P<0.05);与对照组比较,普乐沙福组CXCR4 mRNA表达水平明显下降(P<0.05);与左归丸0.2 mg/mL组比较,左归丸+普乐沙福组CXCR4 mRNA表达水平明显下降(P<0.05)。见图3A。蛋白质免疫印迹法结果显示,与对照组比较,左归丸0.2 mg/mL组CXCR4蛋白表达水平显著高于对照组(P<0.05),普乐沙福组CXCR4蛋白表达水平显著下降(P<0.05);与左归丸0.2 mg/mL组比较,左归丸+普乐沙福组CXCR4蛋白表达水平明显下降(P<0.05)。见图3B和3C。流式细胞术分析发现,与对照组比较,左归丸0.2 mg/mL组CXCR4阳性率显著升高(P<0.05),普乐沙福组CXCR4阳性率显著下降(P<0.05);左归丸+普乐沙福组CXCR4阳性率显著高于普乐沙福组(P<0.05),左归丸0.2 mg/mL组CXCR4阳性率显著高于左归丸+普乐沙福组(P<0.05)。见图3D和表1。左归丸能上调hUC-MSCs中CXCR4 mRNA和蛋白表达水平,并促进CXCR4蛋白在细胞膜的表达,左归丸通过上调CXCR4表达促进hUC-MSCs体外迁移。

表1 各组CXCR4表达
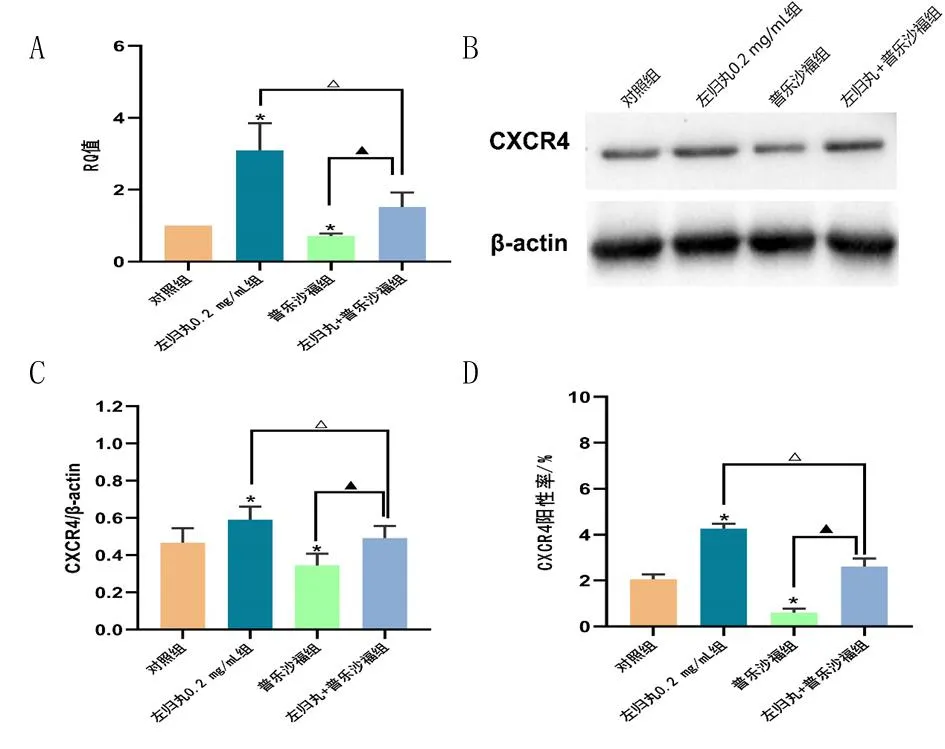
图3 左归丸对hUC-MSCs中CXCR4表达的影响
3 讨论
卵巢早衰发病呈上升和年轻化趋势,严重损害育龄女性的生殖健康。目前西医主要采用激素替代疗法治疗卵巢早衰,虽然能改善患者临床症状,但是其长期疗效欠佳,且有一定不良反应[1]。肾藏精,主生殖。左归丸由熟地黄、菟丝子、牛膝、龟甲胶、鹿角胶、山药、山茱萸和枸杞子组成,其补肾填精的功效能够显著改善卵巢功能[7]。崔晓萍教授遵循月经阴阳周期规律,取左归丸“纯补无泻,阳中求阴”之义,辨证运用左归丸加减治疗卵巢早衰,帮助患者重建正常的月经周期,临床疗效显著[8]。临床研究发现,左归丸联合地屈孕酮通过调节“肾-天癸-冲任-胞宫”的平衡功能,促进卵巢早衰患者卵巢功能恢复,并改善围绝经期症状,有效降低不良反应发生率[9]。干细胞具有自我更新和多向分化的潜能,是“先天之精”在细胞层次的存在形式[10]。hUC-MSCs具有取材方便、增殖能力强、免疫原性低和无伦理学争议等特点,能够分化为成骨细胞、软骨细胞、生殖细胞及神经细胞等不同类型细胞,且具有旁分泌及免疫调节作用[2-3]。2018年,世界首例hUC-MSCs治疗卵巢早衰临床研究在南京鼓楼医院获得成功,为hUC-MSCs移植治疗卵巢早衰打下坚实的基础。近年来,中国科学院联合北京妇产医院、广州医科大学附属第三医院合作开展hUC-MSCs干预卵巢早衰的多中心临床试验,结果显示hUC-MSCs移植能够改善患者卵巢内血流,恢复卵巢功能,促进卵泡活动[11]。左归丸“肾主生殖”理论与干细胞“先天之精”属性是相通的,中西医结合疗法将左归丸和hUC-MSCs相结合,即补肾填精和再生修复相结合,有望为治疗卵巢早衰提供新的方案。
干细胞定向迁移归巢至损伤组织是其发挥治疗作用的前提,SDF-1/CXCR4的相互作用在MSCs迁移、归巢至损伤组织及组织再生修复过程中具有关键作用,提高MSCs中CXCR4表达能够促进其归巢至损伤组织。研究发现,损伤组织中SDF-1表达升高,能够募集参与血液循环的CXCR4阳性细胞的定向迁移与归巢[4,12]。LUO等[13]发现卵巢早衰小鼠卵巢组织中SDF-1表达水平显著升高,SDF-1/CXCR4通路激活及细胞凋亡同卵巢损伤的发展密切相关。但是经过体外扩增培养的MSCs表面CXCR4表达率很低,限制其在体内的定向迁移[14]。虽然基因修饰和酶修饰能提高MSCs中CXCR4表达,但是存在影响细胞功能和活力的问题。利用低氧、化合物和细胞因子等预处理MSCs增强其CXCR4表达,正在成为促进MSCs定向迁移与归巢的重要手段[15-16]。ZHENG等[17]研究发现,雷帕霉素通过上调hUC-MSCs的CXCR4表达促进其体外迁移和体内归巢至损伤部位,从而改善hUC-MSCs移植的治疗效果。
现代药理学探讨了左归丸及其组分对BMSCs的增殖和迁移的影响及可能的机制。张晨[18]研究发现左归丸水煎液能促进BMSCs体外衰老模型的增殖能力,其机制可能与p21和干细胞因子表达有关。李杰斌[10]发现,左归丸能够促进BMSCs的体内定向归巢,可能机制为促进BMSCs分泌SCF。牛膝提取物杯苋甾酮可能通过上调CXCR4表达促进大鼠BMSCs的体外迁移[19];龟甲水提物能激活SDF-1/CXCR4轴促进BMSCs迁移[20]。这些研究结果证实,左归丸及其组分能够促进BMSCs增殖和迁移。但是,左归丸对hUC-MSCs体外迁移的影响及作用机制仍不清楚。
本研究利用组织块法对hUC-MSCs进行分离培养,流式细胞术分析其表面标志物(CD34、CD45、CD73和CD90)表达情况,说明分离培养的细胞符合hUC-MSCs的特征。CCK-8实验结果提示,左归丸具有类生长因子作用,能促进hUC-MSCs增殖。细胞划痕和Transwell实验结果提示,合适浓度的左归丸对hUC-MSCs体外迁移有明显促进作用,其具体机制可能与CXCR4表达有关。实时PCR、蛋白印迹法和流式细胞术分析发现,左归丸能上调hUC-MSCs中CXCR4 mRNA和蛋白表达水平,并促进CXCR4蛋白在细胞膜表达,证实左归丸通过上调CXCR4表达促进hUC-MSCs体外迁移。上述研究结果提示,左归丸干预将有利于hUC-MSCs定向迁移至组织损伤区域。
综上所述,左归丸能促进hUC-MSCs体外增殖和迁移;左归丸促进hUC-MSCs迁移的机制可能与上调CXCR4表达、激活SDF-1/CXCR4信号通路有关,但其作用机制有待进一步研究。本研究结果提示,左归丸干预不仅能够增强hUC-MSCs增殖活力,还可以促进hUC-MSCs定向迁移与归巢,从而改善细胞移植治疗效果,为左归丸联合hUC-MSCs治疗卵巢早衰提供理论和实验依据。
致谢:感谢聊城市人民医院韩发彬和谷万里主任的指导,感谢干细胞与再生医学重点实验室和中原生物医学研究院提供的实验平台。
利益冲突声明:无。
