含香豆素结构的1,4-戊二烯-3-酮类衍生物的合成及生物活性
2023-12-19王晓斌王瑞颖严莉莉顾一飞程青芳
王晓斌,王瑞颖,董 雪,严莉莉,张 娟,顾一飞,,程青芳,,薛 伟
(1.江苏海洋大学药学院,江苏省海洋药物活性分子筛选重点实验室,连云港 222005;2.江苏省海洋资源开发研究院,连云港 222005;3.贵州大学教育部绿色农药与生物工程重点实验室,贵阳 550025)
众所周知,天然产物具有结构新颖、活性广泛、作用方式独特及环境友好的特点,对其结构进行理性改造通常能获取一些性能更卓越的二次先导[1,2].这些二次先导在继承了天然产物独特作用方式和生态环保特性的同时,其生物活性和物化性质也能得到显著改善[3,4].如,通过对青蒿素(Artemisinin)、紫杉醇(Paclitaxel)和康帕尼(Compactin)等天然产物的结构进行系统优化,已相继开发出蒿甲醚(Artemether)、多西他赛(Docetaxel)和普伐他汀(Pravastatin)等数百种功能各异的药物[5~7].作为我国传统中药姜黄(Curcuma longa L.)的有效成分,姜黄素(Curcumin)因具有抗氧化、抑菌、抗病毒、抗肿瘤、抗炎及杀虫等广谱药理活性而在药物创制领域备受青睐[8,9].然而,姜黄素本身难溶于水,其分子中存在的β-二酮结构易在中性和碱性条件下发生异构化,使其难以被有机体吸收和有效利用[10,11].在此背景下,药物创制工作者对姜黄素分子结构进行了多维度的改造,发现1,5-二芳基-1,4-戊二烯-3-酮分子不仅可以有效保持姜黄素分子的多种生物活性,其结构稳定性和毒副作用也得到显著改善,可作为优势抗肿瘤先导分子进行深度的结构发掘[12,13].近年来,本课题组报道了一系列含有吡啶[14]、喹唑啉酮[15]、苯并三嗪酮[16]、亚磷酸酯[17]、肟酯[18]、喹唑啉[19]和磺酰胺[20]等片段的1,4-戊二烯-3-酮分子,并发现上述分子在抗病毒、抗肿瘤、抗细菌、抗真菌及抗炎等方面具有潜在的开发价值[Scheme 1(A)].
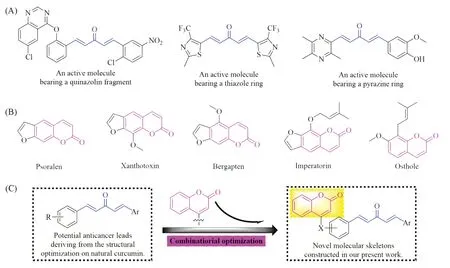
Scheme 1 Reported penta-1,4-dien-3-one derivatives with casing anticancer activities(A),natural coumarin derivatives with anticancer activities(B) and design strategy of title compounds(C)
香豆素(Coumarin)是植物在受到环境胁迫后产生的苯骈α-吡喃酮类次生代谢产物.该物质可以在植物受胁迫部位快速富集,有效促进植物对营养成分的吸收及抵御病原微生物的侵染,最终起到降低环境胁迫对作物植株损伤程度的效果[21].迄今,近千种结构各异的香豆素分子相继在伞形科、瑞香科、豆科、菊科、桑科及茄科等植物中发现,这些香豆素分子通常以游离态或糖苷形式存在于植物的根、茎、叶等部位,表现出抑菌、抗病毒、杀虫、抗凝血、抗炎、抗氧化及抗癌等多种生物活性[22,23].近年来,研究人员发现补骨脂素(Psoralen)[24]、花椒毒素(Xanthotoxin)[25]、香柑内酯(Bergapten)[26]、欧前胡内脂(Imperatorin)[27]和蛇床子素(Osthole)[28]等香豆素分子[Scheme 1(B)]可通过调节多种细胞信号通路的方式有效抑制肿瘤细胞的增殖,上述分子的抗肿瘤活性与苯骈α-吡喃酮母核上存在的取代基类型和位置密切相关,使香豆素分子在抗肿瘤药物创制方面具有巨大的潜力[29,30].
鉴于香豆素结构在抗癌领域的广泛应用,本文利用醚键将此天然抗癌单元有机融入1,4-戊二烯-3-酮分子骨架中,构建了16个结构新颖的单羰基姜黄素衍生物[结构见Scheme 1(C)],并采用甲基四氮唑盐(MTT)比色法测试了目标化合物对胃癌SGC7901细胞和肝癌HepG2细胞的体外抑制活性.
1 实验部分
1.1 试剂与仪器
4-羟基香豆素、2-羟基苯甲醛、4-羟基苯甲醛、芳基甲醛、氢氧化钠、无水乙醇、碳酸钾和乙腈,分析纯,上海泰坦科技股份有限公司;三氯氧磷和胰蛋白酶,纯度98%,上海泰坦科技股份有限公司;36%盐酸和98%丙酮,成都市科隆化学品有限公司;胎牛血清,天津市灏阳生物制品科技有限公司;MTT,北京鼎国生物技术发展有限公司.
JEOL-ECX 500 型核磁共振波谱仪(NMR),日本电子株式会社;4000QTRAP 型三重四级杆液相色谱质谱联用仪(HRMS),美国AB Sciex公司;X-4型数显熔点测定仪,北京泰克仪器有限公司;BSA124S型电子天平,德国Sartorius公司;MCO-18AC型CO2培养箱,日本SANYO公司;BIO-RAD680型96孔板酶标仪,美国Bio-Rad公司;细胞培养板,美国Corning Incorporated公司;SW-CJ-2FD型超净工作台,苏州净化工程有限公司;ELX800型酶标仪,美国Bio-Rad公司.
1.2 实验过程
1.2.1 含香豆素结构1,4-戊二烯-3-酮类衍生物(4a~4q)的合成 化合物4a~4q的合成路线见Scheme 2.

Scheme 2 Synthetic routes of target compounds 4a—4p
在冰浴条件下,将50 mmol 2-羟基苯甲醛或4-羟基苯甲醛溶于60 mL丙酮中,搅拌30 min后缓慢加入100 mL质量分数为5%的氢氧化钠溶液.室温下反应24 h后,将反应物转移至500 mL烧杯中,加入适量冰块后用质量分数为5%的盐酸溶液调节体系pH值为5~6,析出大量黄色固体.过滤,滤饼用质量分数为30%的乙醇溶液重结晶,再次过滤,得到中间体4-(2-羟基苯基)-3-丁烯-2-酮(1a)或4-(4-羟基苯基)-3-丁烯-2-酮(1b)黄色固体.
将25 mmol 中间体1 和30 mmol 芳基甲醛溶于50 mL 乙醇中,冰浴条件下缓慢滴加50 mL 质量分数为5%的氢氧化钠溶液,用薄层色谱(TLC,石油醚/乙酸乙酯体积比3∶1)追踪反应.待反应完成后,将反应物转移至500 mL烧杯中,加入适量冰块后用质量分数为5%的盐酸溶液调节体系pH值为5~6,析出大量黄色固体.过滤,滤饼用质量分数为30%的乙醇溶液重结晶,再次过滤,得到中间体2a~2p黄色固体.
将50 mmol 4-羟基香豆素溶于100 mL三氯氧磷中,加入30 mL三乙胺,加热至回流反应5 h.随后,将反应液转移至烧杯中,用浓氢氧化钠溶液调节体系pH值至中性,用二氯甲烷萃取(50 mL×3),无水硫酸钠干燥有机相,减压蒸馏除去溶剂,经柱层析(石油醚/乙酸乙酯体积比10∶1)分离得到中间体3白色固体.
将2 mmol 中间体2、2 mmol 中间体3 和6 mmol 碳酸钾加入60 mL 乙腈中,搅拌下加热至回流,用TLC(石油醚/乙酸乙酯体积比3∶1)追踪反应进程.待反应完成后过滤,滤液减压蒸馏除去多余溶剂,经柱层析(石油醚/乙酸乙酯体积比3∶1)分离得到目标分子4a~4p.
中间体及目标化合物的理化性质如表1所示,目标化合物的1H NMR 和13C NMR 数据见表2,谱图见支持信息图S1~S48.

Table 1 Appearance,yields,melting points and HRMS data of compounds 1—4
1.2.2 抗肿瘤活性测试 以商品化抗肿瘤药物表柔比星(Epirubicin)为阳性对照,利用MTT 比色法测定了目标分子4a~4p对胃癌SGC7901细胞和肝癌HepG2细胞的体外抑制活性[31,32],上述细胞株均购自中国科学院上海细胞库.取对数生长期细胞,用质量分数为0.05%的胰蛋白酶消化后,重悬于含体积分数为10% FBS 的RPMI 1640 培养基中,以4×104cell/mL 的终浓度接种于96 孔培养板中,每孔100 μL.将培养板置于37 ℃,5%CO2的饱和湿度培养箱中培养24 h,待细胞贴壁后吸掉培养基,加入含既定浓度待测药物的培养基,继续培养72 h,同时以等量的二甲基亚砜(DMSO)作为空白对照,每孔200 μL.注意培养基中DMSO 终浓度不能超过0.1%.去除上层清液,加入100 μL 含MTT 质量浓度为0.5 mg/mL的培养基,于37 ℃继续培养4 h,再补加100 μL质量分数为10%的十二烷基硫酸钠溶液.在37 ℃下培养10 h后取出,微振荡5 min,室温下放置30 min 后,在492 nm 波长下测定其OD 值,并基于OD值计算各化合物对肿瘤细胞的抑制活性.上述实验每个样本浓度重复6个孔,每个实验重复3次,取平均值为最终结果.随后,通过光学显微镜观察了高活性分子在作用24,48和72 h后对肿瘤细胞的形态学影响.
2 结果与讨论
2.1 目标分子的合成及结构表征
邻羟基苯甲醛或对羟基苯甲醛在氢氧化钠的作用下与丙酮发生羟醛缩合反应,得到中间体1a 或1b.随后,中间体1a或1b继续在氢氧化钠的作用下与芳基甲醛发生羟醛缩合反应,得到在苯环邻位或对位含有羟基的5-芳基-1,4-戊二烯-3-酮衍生物2a~2p.上述两步羟醛缩合反应条件温和、操作简便、产率均大于75%.同时,在三乙胺存在下,香豆素4位的羟基能在热的三氯氧磷溶液中转变为氯原子.值得注意的是,若用氯化亚砜代替三氯氧磷,反应则无法顺利得到重要中间体4-氯香豆素.最后,中间体2a~2p酚羟基上的氢原子被碳酸钾拔除,所得氧负离子随即进攻4-氯香豆素4位碳正离子,得到目标分子4a~4p.
以目标分子4o 的1H NMR,13C NMR 和HRMS 数据解析为例进行具体分析如下:δ8.01 处的双峰为香豆素5 位质子氢的信号峰;δ7.88 处的双峰为戊二烯酮1 位与苯环相连烯烃质子氢的信号峰;δ7.74~7.70处的多重峰为噻吩5位和苯环邻位质子氢的信号峰;δ7.62处的三重峰为香豆素7位上质子氢的信号峰;δ7.42和7.09处的双峰和三重峰分别为噻吩3位和4位质子氢的信号峰;δ7.39~7.34处的多重峰为香豆素6 位和8 位以及戊二烯酮5 位烯烃质子氢的信号峰;δ7.23 处的双峰为戊二烯酮1 位苯环间位质子氢的信号峰;δ7.03 和6.88 处的双峰分别为戊二烯酮2 位和4 位烯烃质子氢的信号峰;δ5.46处的单峰为香豆素3位质子氢的信号峰.在化合物4o的13C NMR谱图中,δ188.06处的吸收峰为戊二烯酮3位酮羰基碳的信号峰;δ165.98和162.41处的吸收峰为香豆素4位和2位碳的信号峰;δ94.02处的吸收峰为香豆素3位碳的信号峰;δ153.91~115.31处的吸收峰为其余芳环碳和烯烃碳的信号峰.化合物4o的HRMS谱图显示,[M+H]+离子峰为m/z401.0838,与其分子式C24H17O4S[M+H]+的计算值m/z401.0842非常接近.
2.2 目标分子抗癌活性分析
目标分子4a~4p对胃癌SGC7901细胞和肝癌HepG2细胞的抗肿瘤活性测试结果列于表3.可见,目标分子4a~4f,4h~4n 和4p 在供试浓度为10 μmol/L 时对胃癌SGC7901 细胞体外增殖的抑制率为85.56%~98.77%,其抑制效果均优于对照药剂表柔比星(78.38%).当供试浓度下降为1 μmol/L时,目标分子4c,4j,4l和4m对胃癌SGC7901细胞体外增殖的抑制率(86.98%,80.83%,42.73%和43.69%)要优于对照药剂表柔比星(42.43%).进一步的生物活性测试结果(表4)表明,目标分子4c和4j对胃癌SGC7901细胞的半数抑制浓度(IC50)值分别为0.22和0.27 μmol/L,其活性显著优于对照药剂表柔比星(1.23 μmol/L).同时,目标分子4a~4c,4e,4f和4i~4c在供试浓度为10 μmol/L时对肝癌HepG2细胞体外增殖的抑制活性(85.80%~99.94%)显著优于对照药剂表柔比星(81.64%).当供试浓度下降为1 μmol/L 时,除化合物4i 外的其它目标分子均对肝癌HepG2 细胞体外增殖具有一定的抑制活性(>6.30%),其中化合物4l对肝癌HepG2细胞体外增殖的抑制效果(66.69%)最佳,其活性显著优于对照药剂表柔比星(1.36%).由表4还可见,目标分子4l对肝癌HepG2细胞的IC50值达到0.47 μmol/L,其活性显著优于对照药剂表柔比星(2.30 μmol/L).

Table 3 Inhibition rates(%) of title compounds against SGC7901 and HepG2 cells in vitro
由表3可以看出,1,4-戊二烯-3-酮骨架上取代基的位置和类型对目标分子的抗肿瘤活性具有显著影响,通过系统的对比分析总结如下.首先,将香豆素结构引入戊二烯酮1位苯环的邻位总体上有利于提高目标分子对胃癌SGC7901细胞和肝癌HepG2细胞体外增殖的抑制活性.如,在戊二烯酮苯环邻位含有香豆素结构的化合物4c,4j,4l 和4m 在浓度为1 μmol/L 时对胃癌SGC7901 细胞(86.98%,80.83%,42.73%和43.69%)和肝癌HepG2细胞(25.42%,26.92%,66.69%和44.52%)体外增殖的抑制率均显著优于对照药剂表柔比星(42.43%和1.36%).其次,将戊二烯酮5位的苯环替代为六元吡啶杂环能更有利于改善目标分子的抗肿瘤活性.如,含吡啶单元的化合物4a(Ar=Pyrid-2-yl,X=4-O-),4b(Ar=Pyrid-3-yl,X=4-O-)和4m(Ar=Pyrid-2-yl,X=2-O-)在浓度为1 μmol/L 时对胃癌SGC7901 细胞(16.87%,28.78%和43.69%)和肝癌HepG2细胞(11.42%,15.98%和44.52%)体外增殖的抑制率总体要优于目标分子4p(Ar=Ph,X=4-O-)和4d(Ar=Ph,X=2-O-)对胃癌SGC7901细胞(1.03%和22.47%)和肝癌HepG2细胞(12.79%和6.30%)的抑制率.对于Ar位置上为取代苯环的分子,其苯环邻位或对位引入甲氧基将显著增强所得分子的抗肿瘤活性.如,目标分子4c(Ar=2,4-di-OMePh,X=2-O-),4j(Ar=2-OMePh,X=2-O-)和4l(Ar=4-OMePh,X=2-O-)在浓度为1 μmol/L 时对胃癌SGC7901 细胞(86.89%,80.83%和42.43%)和肝癌HepG2 细胞(25.42%,26.92%和66.69%)体外增殖的抑制率显著优于目标分子4d(Ar=Ph,X=2-O-)对胃癌SGC7901细胞(22.47%)和肝癌HepG2细胞(6.30%)的抑制率.
以DMSO 为空白对照,利用光学电子显微镜探究了表柔比星、化合物4c 和4j 分别作用于胃癌SGC7901 细胞24,48 和72 h 后在形态上的改变,结果示于图1.由图1 可见,用DMSO 处理过的SGC7901 细胞轮廓丰满圆润,多呈现为梭形,且细胞的数量随着作用时间的延长而显著增加.用10 μmol/L 表柔比星处理的SGC7901细胞数量显著减少,在处理48 h后细胞轮廓出现了较明显的不规则变化,甚至在72 h后出现破碎和裂解,上述变化在表柔比星浓度降至1 μmol/L时依旧存在.令人欣喜的是,用1 μmol/L目标分子4c和4j仅在处理24 h后就能使SGC7901细胞发生萎缩和失活,这种现象随着作用时间的延长而逐渐明显,且显著不同于表柔比星处理组出现的损伤型细胞变化.上述形态学观察再次证实,含香豆素结构1,4-戊二烯-3-酮衍生物能显著抑制多种肿瘤细胞的体外增殖,可作为新型潜在高效抗肿瘤药物进行深度的开发和研究.

Fig.1 Morphology effects of SGC7901 cells treated with DMSO(0.1%,mass fraction)(A),compounds 4c(B,C) and 4j(D,E),and Epirubicin(F,G) with 24(A1—G1),48(A2—G2) and 72 h(A3—G3)
3 结论
为开发新型高效抗肿瘤药物分子,采用活性基团拼接原理将香豆素单元有机融入1,4-戊二烯-3-酮分子骨架中,设计合成了16个单羰基姜黄素衍生物4a~4p.通过1H NMR,13C NMR和HRMS等手段对目标化合物进行了结构表征,并采用MTT法测定了上述化合物对胃癌SGC7901细胞和肝癌HepG2细胞体外增殖的抑制活性,发现绝大多数目标分子均能显著抑制上述两种肿瘤细胞的增殖.其中,化合物4c 和4j 对SGC7901 细胞的IC50值达到了0.22 和0.27 μmol/L,其活性显著优于对照药剂表柔比星(1.23 μmol/L).同时,化合物4l 对HepG2 细胞的IC50值(0.47 μmol/L)也显著优于表柔比星(2.30 μmol/L).细胞形态学研究结果进一步证实,含香豆素结构1,4-戊二烯-3-酮衍生物能有效抑制肿瘤细胞的增殖,可作为潜在高效抗肿瘤药物候选分子进行深度的开发.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20230337.
