槲皮素锑的合成、表征及生物活性研究*
2023-12-15冯亚莉马杰祎孙帅豪翟广玉
冯亚莉,马杰祎,孙帅豪,从 洋,翟广玉
(郑州工业应用技术学院药学与化学工程学院,河南 郑州 451100)
0 引 言
锑及其化合物的用途广泛。三氧化锑具有阻燃性,是很好的防火材料。沙发,窗帘,地毯常常喷涂三氧化锑阻燃涂料,以避免着火。它还是优良的白色颜料,常用在陶瓷、橡胶、油漆及化工产业。安全火柴头含有三硫化锑,用作引燃剂。含锑合金耐腐蚀、强度高、耐磨性能好,是生产蓄电池极板、化工管道、电缆包皮、制造轴承的理想材料。由于锑及其化合物在环境中普遍存在,环境中锑的污染也日益严重[1]。人体及动物可以经过水、空气、食品、皮肤接触和呼吸等途径接触到环境中的锑[2]。锑是一种有毒的危险物质,不仅影响植物而且还危害动物与人体[3]。锑中毒常表现为胃肠不适,如恶心、呕吐、腹泻;呼吸困难、肺尘病、皮肤斑点(锑斑)、痛风、肾功能衰竭等。锑在环境中的污染,应引起人们的高度重视[4]。
槲皮素(Quercetin,图1)是植物中分布很广的黄酮类化合物,广泛存在于蔬菜、水果、中草药和许多饮料(茶、咖啡、红酒和果汁)中[5]。槲皮素具有广泛的生物活性,能祛痰、止咳、平喘、降低血压、减少毛细血管脆性、降血脂、扩张冠状动脉、增加冠脉血流量等[6];槲皮素是天然的抗氧化剂[7],具有抗炎[8]、抗病毒[9]、降糖[10]和抗癌[11-13]作用。槲皮素具有C6-C3-C6 碳骨架的苯并(γ)- 吡喃酮结构,由两个苯环A 和B 组成,并通过三碳吡喃环C 连接。在槲皮素分子中,B 环存在邻二酚结构,A 环有间二酚结构,C 环有一个烯醇式羟基酮结构,槲皮素的这些特殊结构使其很容易与金属离子形成稳定的配合物。研究表明,槲皮素与某些金属形成配合物后生物活性和药理作用明显增强。故近年来对槲皮素金属配合物的研究逐渐增多[14-15]。
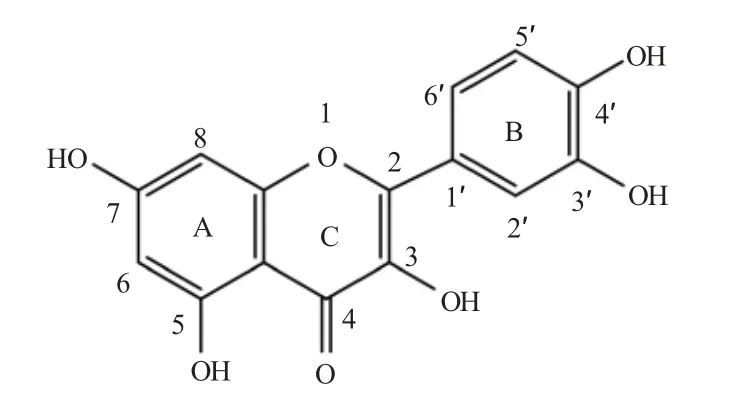
图1 槲皮素的结构Fig. 1 The structure of quercetin
螯合治疗是减缓重金属中毒的首选疗法。螯合剂能与引起中毒的重金属离子牢固地结合成螯合物,从体内排泄出去,达到解毒的目的。槲皮素是一个非常好的重金属离子螯合剂[16],能与许多金属离子螯合成稳定的螯合物。经常食用一些含有槲皮素黄酮类的食物,如苹果、洋葱、茶叶、银杏、荞麦等,可清除体内的自由基,使机体免受自由基的损伤,对降低人体内重金属离子的含量起着重要的作用。
本文介绍了槲皮素锑的合成方法,并对其结构进行了表征,研究了抗自由基的能力。
1 实 验
1.1 药品和仪器
药品:槲皮素,上海阿拉丁公司;三氯化锑,(分析纯),国药集团化学试剂有限公司;DPPH(1,1- 二苯基-2- 三硝基苯肼),上海阿拉丁公司;其它试剂均为分析纯。
仪器:iS10 FT-IR 型红外光谱仪(美国尼高力,KBr 压片);超导核磁共振仪,400 MHz 型(德国Brucker 公司,DMSO-d6,TMS 为内标);UV-2550 型紫外- 可见分光光度计(日本岛津公司);德国耐驰(Netzsch)STA 409 PC/PG 差热分析仪;RE-52AA 型旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 实验过程
参照文献[17] 的方法并改进。取1 mmol(302 mg)槲皮素,加入25 mL 甲醇,搅拌使完全溶解。加入预先溶于25 mL 甲醇中的三氯化锑[1 mmol Sb-Cl3·H2O(230 mg)]溶液,用适量甲醇钠调节pH=8.5。在电热磁力搅拌器上加热,控制在76 ℃,回流反应6 h。用TLC 监控反应进程,待反应完成,过滤,滤液在旋转蒸发仪上蒸干,得棕黄色固体,用甲醇冲洗3次,真空干燥,得深棕黄色固体,收率63%。
槲皮素锑是棕黄色固体粉末,不溶于丙酮、乙酸乙酯等,可溶于甲醇、乙醇、DSMO 等。
1.3 清除DPPH 自由基实验
1×10-4mol/L 的DPPH 溶液的配制:精密称取10 mg DPPH,置于250 mL 容量瓶中,加入少量无水乙醇,待溶解后再用无水乙醇定容至刻度,混匀,避光,置于冰箱保存。供试液的配制:精密取各样品适量,以乙醇为溶剂,分别配制100 mg/L,80 mg/L,60 mg/L,40 mg/L,20 mg/L 的待测溶液。参照文献[18]的方法并改进,精确吸取不同浓度的样品溶液1 mL,分别与3 mL 1×10-4mol/L 的DPPH 溶液混合,避光放置30 min,在517 nm 处测吸光度Ay。以相应溶剂代替样品作为空白对照,吸光度为As,相应样品溶液的吸光度为A0。DPPH 自由基清除活性按下式计算:
Ay-1 mL 样品溶液与3 mL DPPH 溶液混匀后的吸光度值;
As-1 mL 乙醇溶液与3 mL DPPH 溶液混匀后的吸光度值;
A0-1 mL 样品溶液与3 mL 乙醇溶液混匀后的吸光度值。
2 结果与讨论
2.1 紫外光谱分析
若通过氧原子与4- 位羰基划一条线,可将槲皮素结构分成两部分,左侧部分可看成苯甲酰的衍生物,右侧部分可看作肉桂酰的衍生物。槲皮素的紫外光谱可以解析为两部分。在长波区375 nm 吸收带,为肉桂酰基生色团产生,为带Ⅰ,带I 属于π→π*(B 环)电子跃迁;在短波区255 nm 吸收带,由苯甲酰生色团产生,为带Ⅱ,属于n →π*(A 环)电子跃迁。
基于GIS技术,对荣成市资源环境承载力评价,结果显示,荣成市土地资源环境基础性评价为可载,基于水资源系统的综合承载状态判定为临界,基于生态条件与环境质量系统的综合承载状态判定为可载。应继续推进土地资源节约集约利用,提升综合承载力,促进水资源供需平衡。在综合分区规划引导过程中,以区域资源环境承载力评价为基础,合理引导,立足保障,促进科学发展,提高资源环境综合承载力,使人口、资源与环境协调发展,获取最大的社会、经济和生态效益。
比较槲皮素与槲皮素锑的紫外光谱发现,与文献[19]报道一致。带I 从375 nm 移到391 nm,红移了16 nm。带II 从255 nm 移到265 nm,红移了10 nm。槲皮素形成配合物后,特征吸收峰发生了红移,这可能是由于形成配合物后,共轭体系扩大所致[20]。

图2 槲皮素和槲皮素锑的紫外光谱Fig. 2 The UV spectra of quercetin and quercetin-Sb complex
2.2 红外光谱分析
槲皮素分子主要官能团红外吸收峰分别是:羟基υ(-OH)3 408.74 cm-1;υ(C=O)1 663.10 cm-1;苯环骨架振动频率υ(C=C)1 610.89 cm-1,1 521.88 cm-1。

图3 槲皮素的红外光谱Fig. 3 The IR spectrum of quercetin
槲皮素锑配合物主要官能团红外吸收峰分别是:羟基υ(-OH)3 385.65 cm-1;υ(C=O)1 651.57cm-1;苯环骨架振动频率υ(C=C)1 595.53 cm-1,1 512.20cm-1。

图4 槲皮素锑的红外光谱Fig. 4 The IR spectrum of quercetin-Sb
现在把槲皮素和槲皮素锑的主要红外光谱数值分别列于表1。
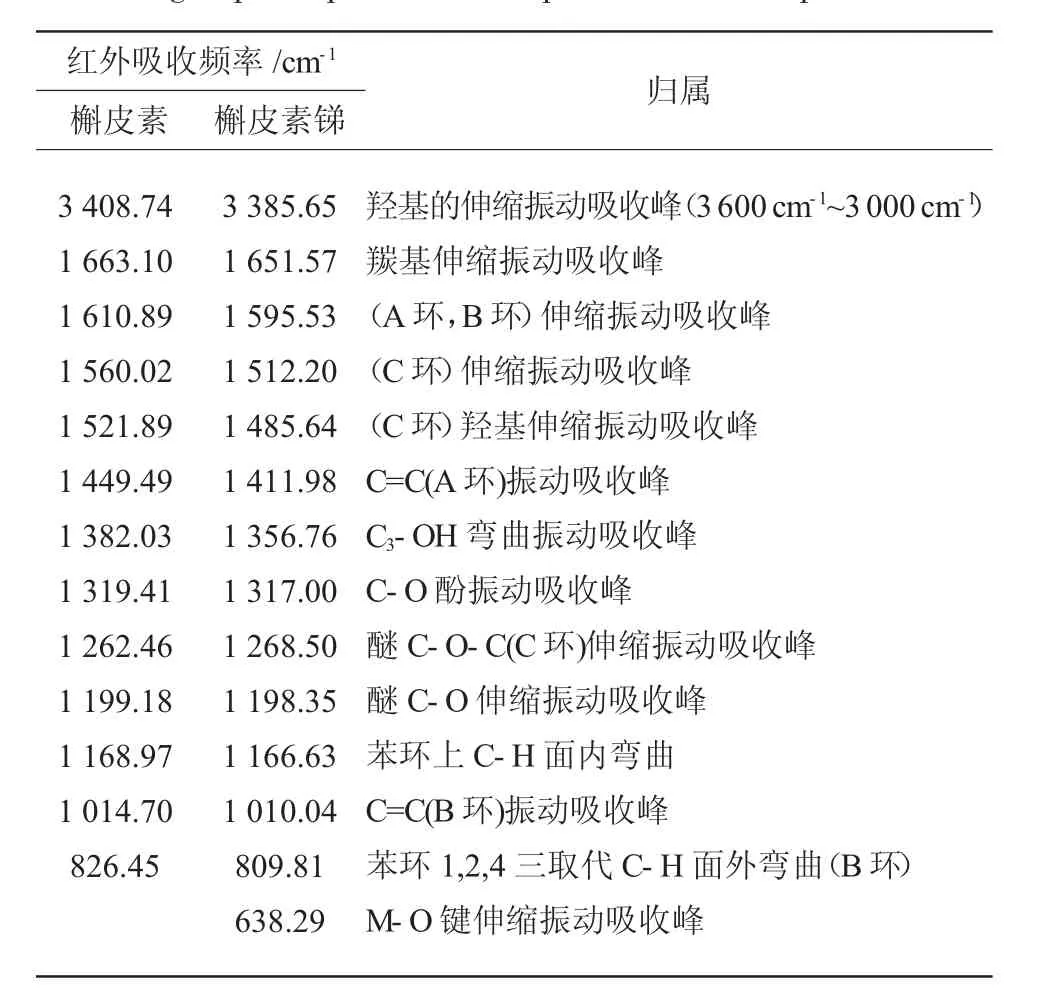
表1 槲皮素和槲皮素锑主要官能团的红外吸收频率[21]Table 1 The IR absorption frequency of principal functional groups of quercetin and quercetin-Sb complex

表2 槲皮素和槲皮素锑的氢谱Table 2 The hydrogen spectrum of quercetin and quercetin-Sb complex
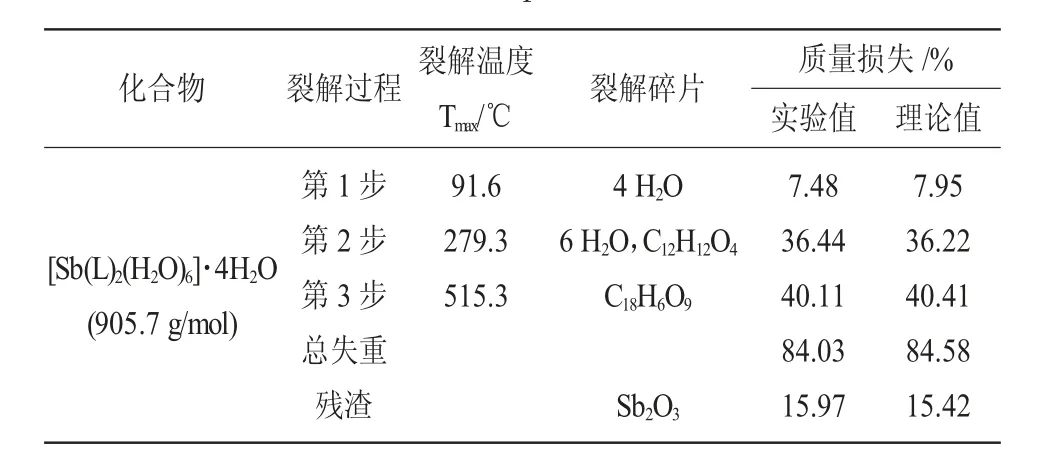
表3 槲皮素锑的热分析Table 3 The thermogravimetric analysis of quercetin-Sb complex
通过表1 的数据比较可以发现:
(1)槲皮素的υ(-OH)3 408.74 cm-1,在配合物中移动到3 385.65 cm-1处,峰变得较宽,说明在配合物中有结晶水的存在。
(2)槲皮素的υ(C=O)出现在1 663.10 cm-1,当形成配合物后该振动频率是1 651.57 cm-1,羰基的吸收峰红移了12 cm-1,这说明配合物在羰基处形成了配位键。
(3)υ(C-O-C)振动频率从1 262.46 cm-1移至1 268.50 cm-1,配合物中此峰向高波数稍有移动,这进一步说明吡喃环中的氧原子没有参与配位。
(4)槲皮素C3-OH 弯曲振动吸收峰在1 382.03 cm-1,配合物红移至1 356.76 cm-1,红移了25.27 cm-1,这说明在C3-OH 处有配位键的生成。
(5)槲皮素中苯环的特征吸收峰分别是:1 610.89 cm-1、1 168.97 cm-1、1 104.70 cm-1。在配合物中苯环的特征吸收峰分别是:1595.53cm-1、1166.63cm-1、1 010.04 cm-1。数值基本上没有发生变化,这说明形成配合物后,对苯环的结构并没有破坏。
(6)υ(Sb-O)伸缩振动峰在638.29 cm-1的出现,说明了金属配位键的形成[22],而槲皮素没有此峰。
2.3 槲皮素锑的氢谱
槲皮素1H-NMR 谱中每个氢原子的归属:有5个亚甲基信号,δH7.66(B 环碳2′上的氢)、δH7.53(B 环碳6′上的氢)、δH6.88(B 环碳5′上的氢)、δH6.39(A 环碳8 上的氢)、δH6.17(A 环碳6 上的氢)。槲皮素羟基的信号分别是,δ-OH12.48(A 环碳5羟基上的氢)、δ-OH10.77(A 环碳7 羟基上的氢)、δ-OH9.58(C 环碳3 羟基上的氢)、δ-OH9.35(B 环碳4′羟基上的氢)、δ-OH9.29(B 环碳3′羟基上的氢)[23]。
槲皮素锑1H-NMR 谱中每个氢原子的归属:有5 个亚甲基信号,δH7.68(B 环碳2′上的氢)、δH7.55(B 环碳6′上的氢)、δH6.67(B 环碳5′上的氢)、δH6.52(A 环碳8 上的氢)、δH6.31(A 环碳6 上的氢)。槲皮素锑羟基的信号分别是,δ-OH12.56(A 环碳5 羟基上的氢)、δ-OH11.03(A 环碳7 羟基上的氢)、δ-OH9.35 (B 环碳4′羟基上的氢)、δ-OH8.30(B 环碳3′羟基上的氢)[23]。
由上述氢谱数据可知,槲皮素锑中3-OH 上的氢消失,而其它4 个羟基(5-OH,7-OH,3'-OH,4'-OH)上的氢依然存在,这说明槲皮素的3 位羟基和4 位羰基上的氧与锑离子配位。这与紫外光谱和红外光谱数据是一致的。
2.4 槲皮素锑的热差分析
通过加热可引起化合物物理化学的变化,伴随放热和吸热以及质量的变化。而通过热重分析,可以了解配合物的稳定性与结构[24-25]。在静态空气气氛,升温速度为10 ℃/min,差热量程为100 V,测定温度范围从室温到710 ℃。
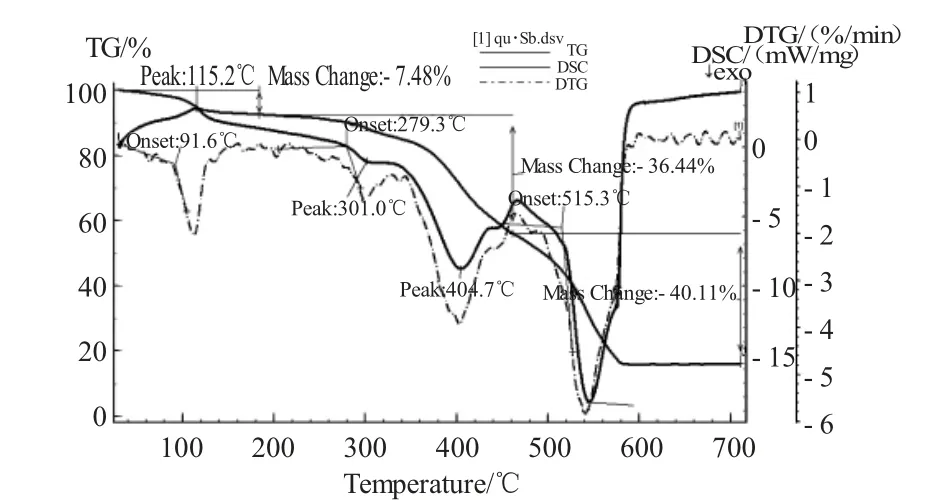
图5 示差热重分析图Fig. 5 The thermogravimetric analysis of quercetin-Sb complex
配合物的DSC 曲线上呈现出吸热和放热峰与热重分析一致。大约在91.6 ℃的吸热峰对应于配合物的脱水过程。在279.3 ℃附近的放热峰对应于槲皮素锑的第一步分解,对应质量损失为36.44%。在515.3 ℃附近的放热峰对应于残余有机物的氧化分解,对应质量损失为40.11%。最后剩余的残渣是氧化锑。对槲皮素锑的热分析显示出2 种不同方式的裂解即脱水和分解。在低于91.6 ℃时,失重率为7.48%,与4 个水分子的量相对应;当加热到115.2 ℃时,槲皮素锑配合物开始分解。
在Sb2O3中Sb 含量=2Sb/ Sb2O3=2×121.7/(121.7×2+16×3)×100%=83.5%。
在槲皮素锑中锑含量(实验值)=(15.97%×83.5%)×100%=13.33%。
在槲皮素锑中锑含量(理论值)=121.7/905.7×100%=13.437%。
通过热差分析知道在槲皮素锑配合物中含有1个Sb 原子,4 个结晶水。通过紫外、红外、氢谱和热差分析可以判断槲皮素锑可能的结构为:
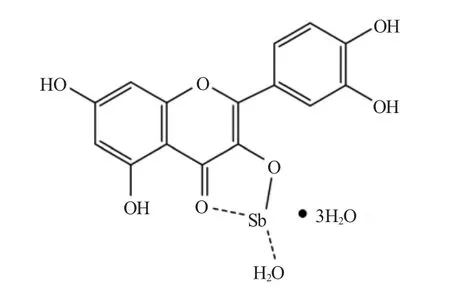
图6 槲皮素锑的结构Fig. 6 The structure of quercetin-Sb complex
2.5 槲皮素锑体外清除DPPH 自由基的作用
DPPH 在有机溶剂中是一种稳定的自由基,其乙醇溶液在517 nm 处有最大吸收,当有自由基清除剂存在时,由于DPPH 自由基的单电子被配对,从而使得在517 nm 处的吸光度减小,因此该法常被用来评价样品的抗氧化能力[15]。从图7 可见,槲皮素和槲皮素锑都随着浓度的增大,对DPPH 自由基的清除率也增大,但是很明显槲皮素与锑离子形成配合物后,其对DPPH 自由基的清除能力是降低的。根据实验结果,进一步说明槲皮素在与锑配位后,其清除DPPH 自由基能力降低,这可能是形成配合物后,羟基的数目减少,使其接受质子的能力降低引起的。

图7 槲皮素和槲皮素锑对DPPH 自由基的清除作用Fig.7 The scavenging effect on DPPH radical of quercetin and quercetin-Sb complex
3 结 论
槲皮素与氯化锑在碱性条件下,生成了槲皮素锑配合物。通过紫外、红外、核磁、热分析等对槲皮素锑进行了结构表征。光谱数据表明了配位的位点:槲皮素的3 位羟基和4 位羰基上的氧与锑离子配位。通过DPPH 法测定了槲皮素锑清除自由基的能力,通过实验显示,槲皮素锑比槲皮素清除自由基的能力要低。
