儿茶素对阪崎肠杆菌的体外抑制作用
2023-12-06龚国利胡乐梅加欣宜
龚国利, 胡乐梅, 加欣宜, 齐 琦
(陕西科技大学 食品科学与工程学院, 陕西 西安 710021)
0 引言
阪崎肠杆菌(Enterobactersakazakii)是一种无芽孢的革兰氏阴性(G-)肠杆菌[1],兼性厌氧,有鞭毛,产黄色素,生长温度范围为6 ℃~45 ℃,在低湿环境更易存活.E.sakazakii属于食源性条件致病菌,广泛存在于环境与食品中,例如,奶粉加工设备、家用吸尘器[2]、奶粉、奶酪制品、香肠、蔬菜[3]、地表水、肥料[4]等.能引起坏死性肠炎、脑膜炎和婴儿败血症等严重的侵袭性疾病[5].Friedemann[6]汇总发现2000~2008年间报道了超百起新生儿E.sakazakii感染病例,其感染总致死率为26.9%,其中脑膜炎、菌血症、坏死性小肠结肠炎的致死率分别为41.9%、10%、19%.目前,食源性疾病日益成为全球公共卫生问题,其常用的防治手段是抗生素,但随之而来的是耐药性问题的日趋严重.J.Parra Flores等[7]分离的E.sakazakii及克罗诺杆菌属均表现出对一种以上抗生素的耐药性.因此,开发新型绿色抑菌剂是目前有待解决的问题,而植物源化合物被认为是天然抗菌剂的有效来源[8].
儿茶素,是一种多酚类化合物,属于类黄酮类,广泛分布于天然植物中,如茶叶等,具有抗癌,抗氧化,抗菌和抗炎等活性[9].欧凯玉等[10]和A.Renzetti等[11]研究发现,绿茶儿茶素主要抑菌途径有:抑制毒力因子、破坏细胞膜和细胞壁、抑制胞内酶、DNA损伤以及铁螯合等.Bhattacharya等[12]发现儿茶素可通过损伤细胞膜来抑制霍乱弧菌N16961.对大肠杆菌和铜绿假单胞菌的研究中表明,表没食子儿茶素没食子酸酯(EGCG)与细胞膜结合产生H2O2导致细胞膜损伤[13,14].研究表明,EGCG能引起大肠杆菌内源性氧化应激增加,细胞膜内部活性氧累积[14].依据GB 1886.211-2016(食品安全国家标准-食品添加剂-茶多酚)规定,儿茶素是食品添加剂茶多酚的有效成分.儿茶素可以应用在鸭肉保鲜中,鸭肉中常见的假单胞菌、李斯特氏菌、大肠杆菌、葡萄球菌以及乳酸菌等都有很好的抑制作用[15].然而目前尚未发现儿茶素对阪崎肠杆菌的抑菌效果及作用机制的相关研究.
本文通过激光共聚焦扫描显微镜(CLSM)和场发射扫描电镜(FEG-SEM)观察儿茶素作用后E.sakazakii细胞膜完整性和细胞形态,并通过测定儿茶素对E.sakazakii的最小抑菌浓度、生长曲线、膜电位、胞内ATP水平、胞内活性氧含量和胞内pH,探究儿茶素对E.sakazakii的抑制作用和可能的机制,为儿茶素作为新型抗菌剂提供可靠的理论依据.
1 材料和方法
1.1 实验材料
1.1.1 菌株
阪崎肠杆菌(Enterobactersakazakii)BNCC 186080,购自中国微生物菌种保藏中心,冻存于-80 ℃冰箱.
1.1.2 实验试剂与仪器
(1)主要试剂:儿茶素(纯度>98%)、DCFH-DA (上海生工生物工程股份有限公司),LB肉汤培养基、琼脂 (北京奥博星生物技术有限公司),磷酸二氢钾、氯化钾、氯化钠、磷酸氢二钠、葡萄糖(天津市天力化学试剂有限公司),ATP检测试剂盒(上海碧云天生物技术有限公司),DiBAC4(3)、cFDA-SE(美国sigma公司),SYTO9/PI试剂盒(赛默飞世尔科技公司).
(2)主要仪器:THZ-98A 恒温振荡培养箱,TGL-20M台式高速离心机(长沙英泰仪器有限公司),Synergy H1多功能酶标仪(美国伯腾仪器有限公司),UV-5200 紫外分光光度计(上海分析仪器有限公司),LSM800 激光共聚焦扫描显微镜(德国卡尔蔡司集团),MLA650 场发射扫描电子显微镜(美国FEI公司).
1.1.3 试验培养基与溶液配方
LB液体培养基:20 g LB肉汤培养基、1 L水、pH自然;LB固体培养基:20 g LB肉汤培养基、20 g琼脂、1 L水、pH自然;PBS缓冲液:0.25 g KCl、10 g NaCl、0.3 g KH2PO4、1.8 g Na2HPO4、1 L水,pH 7.2-7.4.
1.2 实验方法
1.2.1 儿茶素对E.sakazakii的最小抑菌浓度测定
将冻存于-80 ℃的E.sakazakii接种于LB固体培养基,37 ℃培养过夜,挑取1-2个单菌落,接种于LB液体培养基中,37 ℃,180 rpm培养至菌体的对数生长期,得到菌悬液.
采用微量肉汤稀释法测定儿茶素对E.sakazakii的最小抑菌浓度(Minimum inhibition concentration,MIC).取菌悬液与儿茶素溶液各100 μL至96孔微量培养板中混合.儿茶素通过二倍稀释法获得,终浓度分别为0.125 mg/mL、0.25 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL,以终浓度为1 mg/mL的氨苄青霉素钠为阳性对照,PBS处理为阴性对照.37 ℃,180 rpm培养8 h后,用酶标仪测定在600 nm处的菌体密度值.
1.2.2 儿茶素对E.sakazakii生长曲线的影响
按1.2.1中方法得到E.sakazakii菌悬液,将100 μL菌悬液加入到96孔微量培养板中,再加入不同浓度的儿茶素,使其终浓度为2 MIC、MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC.以PBS处理做对照,每小时用多功能酶标仪在600 nm处测定菌体密度值,共监测24 h.
1.2.3 儿茶素对E.sakazakii细胞形态的影响
按1.2.1中方法得到E.sakazakii菌悬液,离心(8 000 rpm,5 min,4 ℃)收集细胞,用PBS溶液洗涤两次,用MIC和2MIC的儿茶素溶液重悬菌体,PBS溶液处理作为对照,于37 ℃,180 rpm培养4 h,洗涤两次后收集菌体沉淀.加入2.5%的戊二醛溶液,4 ℃静置12 h.洗涤两次,分别在30%、50%、70%、80%、90%和100%的乙醇水溶液中静置脱水10 min.离心,用乙酸异戊酯重悬后,-20 ℃冷冻30 min.将样品进行冷冻干燥后固定在载物台上.溅射喷金后,在FEG-SEM下观察.
1.2.4 儿茶素对E.sakazakii细胞膜完整性的影响
按1.2.3中方法得到儿茶素处理后的E.sakazakii菌体沉淀,用PBS溶液重悬,加入3 μL SYTO9/PI混合染料,避光孵育30 min,用PBS溶液洗涤2次菌体后重悬.吸取菌悬液滴于载玻片上,在CLSM下观察.
1.2.5 儿茶素对E.sakazakii细胞膜电位的影响
按1.2.3中方法得到儿茶素处理后的E.sakazakii菌体沉淀,用PBS溶液重悬并加入3 mM DiBAC4(3)膜电位荧光探针,黑暗孵育2 h.分别吸取200 μL加入到96孔微量培养板中,测量荧光强度(激发波长492 nm,发射波长515 nm).
1.2.6 儿茶素对E.sakazakii胞内ROS水平的影响
按1.2.3中方法得到儿茶素处理后的E.sakazakii菌体沉淀,加入10 mM的荧光探针DCFH-DA重悬,避光孵育1 h后,经PBS缓冲液洗涤两次并重悬,将200 μL菌悬液加入黑色96孔微量培养板中,使用多功能酶标仪在激发和发射波长分别485 nm和535 nm时测量荧光强度.
1.2.7 儿茶素对E.sakazakii胞内ATP的影响
按1.2.3中方法得到儿茶素处理后的E.sakazakii菌体沉淀,经PBS缓冲液洗涤两次,用ATP检测试剂盒测定.
1.2.8 儿茶素对E.sakazakiipHin的影响
按1.2.1中方法得到E.sakazakii菌悬液,离心(8 000 rpm,5 min,4 ℃)收集菌体沉淀,用PBS缓冲液清洗两次.在10 mL的磷酸钾缓冲液中重新悬浮细胞颗粒,加入3 mM cFDA-SE分子探针.37 ℃振荡孵育20 min,用PBS缓冲液涤两次,再加入葡萄糖(终浓度10 mM),孵育0.5 h,最后将E.sakazakii细胞洗两次,置于冰上备用.用PBS缓冲溶液配置儿茶素溶液(0、MIC、2 MIC),分别重悬上述所得细胞,在黑暗条件下孵育1 h,在黑色96孔微量培养板中加入200 μL孵育后的溶液,测量荧光强度,激发波长440 nm/490 nm,发射波长520 nm.
2 结果与讨论
2.1 儿茶素对E.sakazakii的最小抑菌浓度
测定MIC来确定儿茶素对E.sakazakii的抑菌活性,其结果如图1所示.由图1可知,儿茶素浓度≥2 mg/mL时,E.sakazakii的生长被明显抑制,比阳性对照组吸光度值更低.表明儿茶素对E.sakazakii的MIC为2 mg/mL.
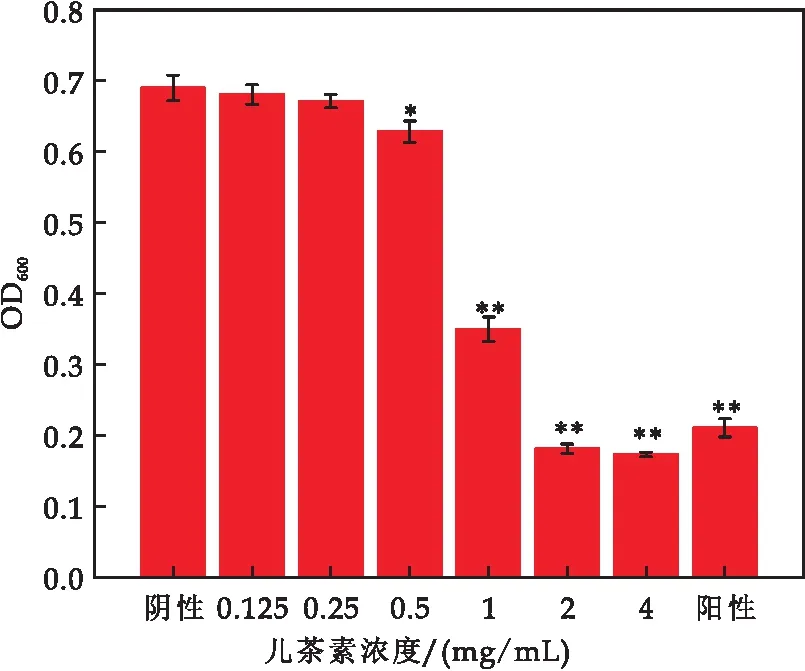
图1 儿茶素对E.sakazakii的最小抑菌浓度
2.2 儿茶素对E.sakazakii的生长曲线
为了准确反映出细菌在24 h内的整体生长情况,测定儿茶素对E.sakazakii的生长曲线,其结果如图2所示.由图可知,当浓度≥1/4 MIC时,相较于对照组在前3 h内激增,E.sakazakii的生长受到抑制;相较于对照组在7 h后的稳定繁殖,当浓度≥1/2 MIC的细菌在3 h后进入平稳期,细菌生长受到明显抑制,菌浓降低了约59.09%(24 h,对照组OD600≈0.88,1/2 MIC处理OD600≈0.36);当浓度≥MIC时,E.sakazakii生长显著抑制,菌浓降低了约87.5%(24 h,对照组OD600≈0.88,MIC处理OD600≈0.11).综上,儿茶素对E.sakazakii的抑制呈浓度依赖性,且可以有效干扰菌体增殖.
2.3 儿茶素对E.sakazakii细胞膜完整性的影响
为了直观观察E.sakazakii的细胞膜是否损伤,采用SYTO9和PI两种荧光染料进行染色观察.观察结果显示,对照组样品在红色荧光通道中荧光稀少(图3 (b)),说明细胞完整性较好,PI染料无法进入细胞.经MIC浓度儿茶素处理后,部分细胞在红色荧光通道中出现红色荧光(图3 (e)),说明部分细胞发生膜损伤,PI得以进入细胞.2 MIC处理组红色荧光进一步增强,叠加通道中部分细胞发出黄色和红色荧光(图3(i)).结果表明,儿茶素通过损伤E.sakazakii细胞膜来达到抑菌效果.
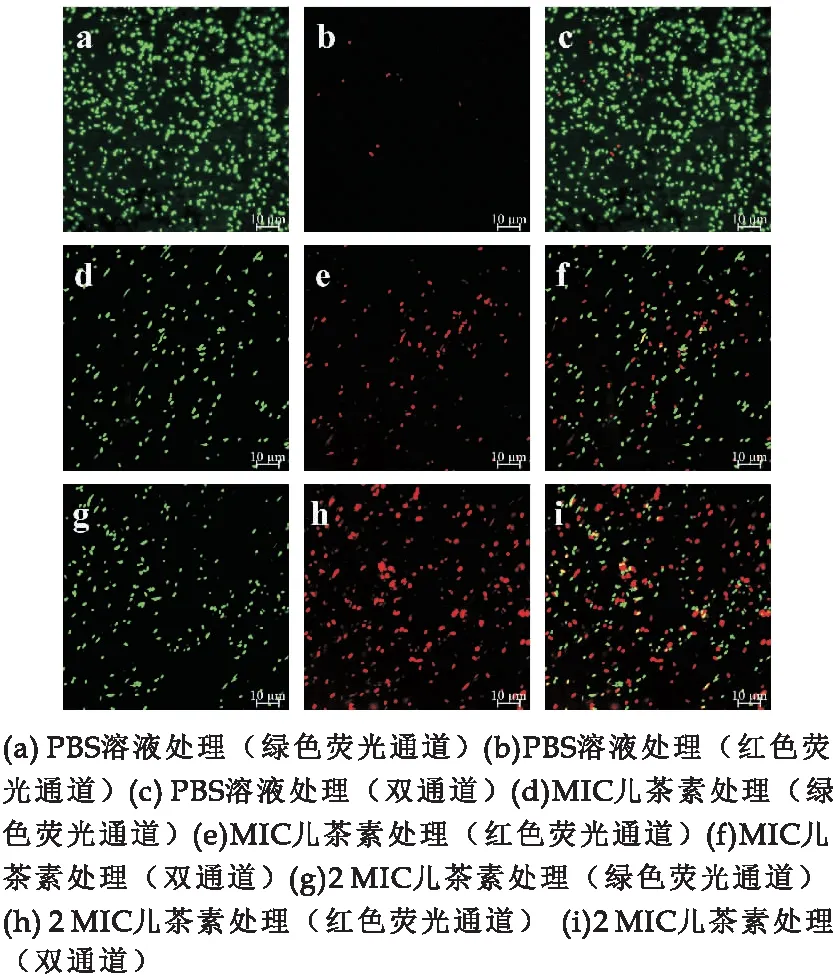
图3 儿茶素对E.sakazakii细胞膜完整性的影响
2.4 儿茶素对E.sakazakii细胞形态的影响
使用FEG-SEM观察E.sakazakii膜表面形态发现,未经处理的对照组细胞表面光滑完整,细胞饱满,细胞膜完整(图4(a));MIC浓度的儿茶素处理后E.sakazakii细胞表面轻微皱缩,细胞膜表面出现损伤(图4(b));2 MIC浓度的儿茶素处理过的细胞产生了粘连,表面凹陷出现孔洞,细胞膜产生破损(图4(c)).以上结果表明,儿茶素可以通过破坏E.sakazakii的细胞膜,来影响菌体的正常增殖.

图4 儿茶素对E.sakazakii的细胞形态影响
2.5 儿茶素对E.sakazakii细胞膜电位的影响
DIBAC4(3) 分子探针能够在细胞内与胞浆中的蛋白质结合,通过其发光强度的改变,来判断细胞膜有无受损.如图5 所示,经儿茶素处理后,E.sakazakii的膜电位明显增强,MIC浓度相较于对照组细胞膜电位提高了24.79%(对照组-21 471,MIC处理组-16 147.5),而当用2 MIC浓度处理后,膜电位提高了51.96%(对照组-21 471,2 MIC处理组-10 315.5).结果表明儿茶素可引起E.sakazakii细胞膜的去极化,最终使得细胞生长繁殖被抑制.
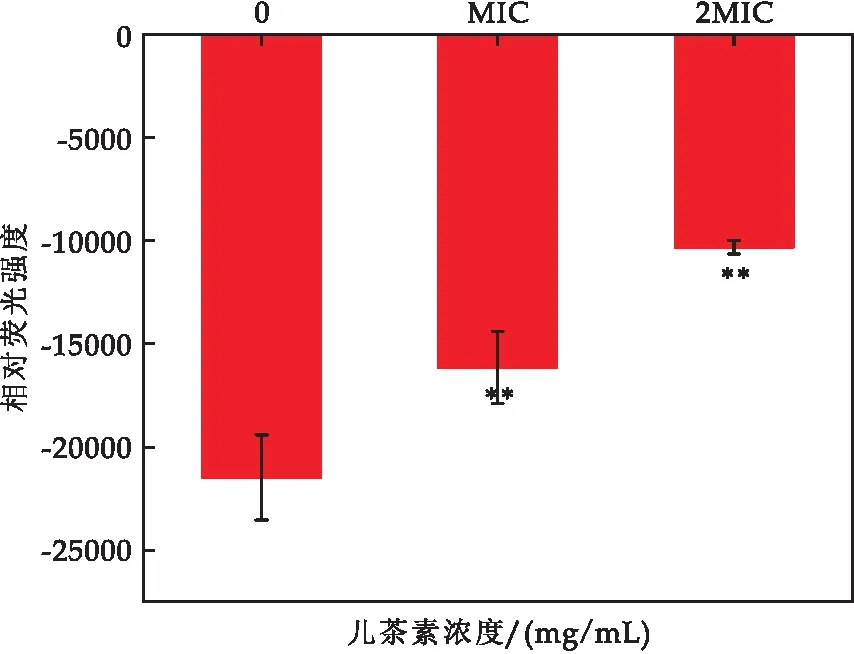
图5 儿茶素对E.sakazakii细胞膜电位的影响
2.6 儿茶素对E.sakazakii胞内ROS水平的影响
ROS水平的激增反映的是细胞的氧化应激,荧光探针DCFH-DA在细胞内可以将ROS代谢产物转化成可检测的DCF.如图6所示,与对照组相比,细胞内的ROS水平通常维持在较低水平,经儿茶素处理后,E.sakazakii胞内ROS过量,细胞的荧光强度显著增加.MIC处理组增加了4.72倍(对照组140.67,MIC处理组804.67),2MIC处理组增加了5.12倍(对照组140.67,2MIC处理组860.33).结果表明儿茶素引起了E.sakazakii中ROS的积累,从而使细胞出现氧化损伤.
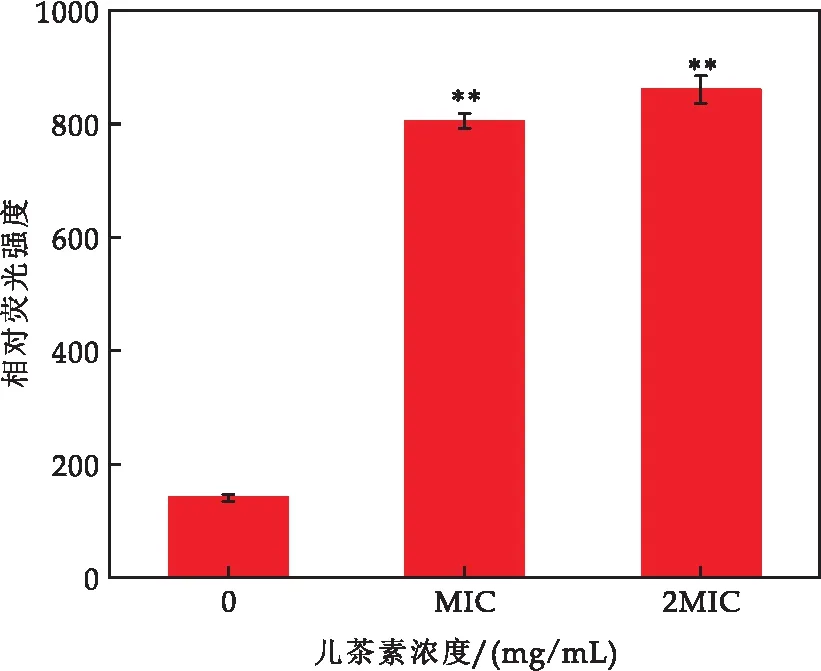
图6 儿茶素对E.sakazakii胞内活性氧的影响
2.7 儿茶素对E.sakazakii 胞内ATP的影响
胞内ATP水平是评估细胞生长的关键性指标.如图7所示,与对照组相比,儿茶素(MIC和2 MIC)处理的E.sakazakii细胞内ATP浓度显著降低(p≤0.01),MIC处理组降低了4.93倍(对照组272.67,MIC处理组46),2 MIC处理组降低了5.29倍(对照组272.67,2 MIC处理组43.33).结果表明,儿茶素处理后E.sakazakii胞内ATP下降,可能是胞内ATP发生泄漏,也可能是代谢紊乱导致细胞ATP合成受阻.
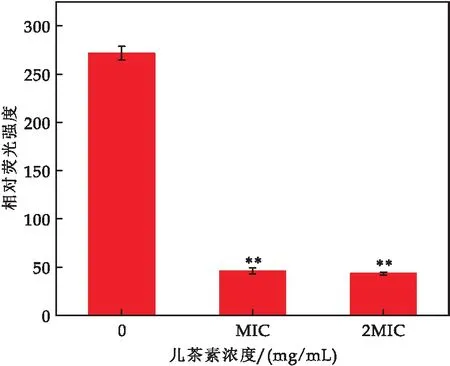
图7 儿茶素对E.sakazakii 胞内ATP的影响
2.8 儿茶素对E.sakazakii pHin的影响
pHin的变化是膜完整性的一个重要指标.cFDA-SE是一种不自发发光的pHin分子探针,当其被内源性的酯酶分解时,就会产生荧光,测量其在490与440 nm处的相对荧光强度比值与pH呈线性关系(pHin的校准曲线:y=0.734 1x+0.245 1,R2=0.990 7).
由图8可知,与对照组相比,儿茶素处理后的菌体相对荧光比值显著下降,MIC处理组降低了45.63%(对照组3.20,MIC处理组1.74),2 MIC处理组降低了48.75%(对照组3.20,2 MIC处理组1.64);儿茶素处理后的E.sakazakiipHin值显著下降,MIC处理组降低了30.26%(对照组5.75,MIC处理组4.01),2 MIC处理组降低了32.35%(对照组5.75,2 MIC处理组3.89).结果表明,经儿茶素处理后的E.sakazakii细胞膜通透性发生变化.
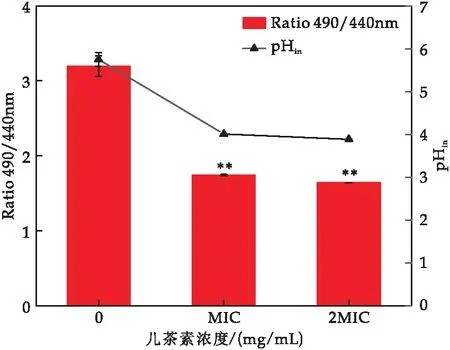
图8 儿茶素对E.sakazakii pHin的影响
3 结论
本研究通过CLSM和FEG-SEM观察细胞形貌,利用膜电位、胞内ATP、pHin以及ROS的测定来探究细胞膜通透性.所得结论如下:
(1)儿茶素对E.sakazakii有良好的抑菌效果,其MIC浓度为2 mg/mL.经CLSM和FEG-SEM观察,直观地发现MIC浓度下E.sakazakii细胞膜出现表面塌陷和变形,通透性发生改变.
(2)细胞膜电位荧光强度增强表明其发生了去极化,说明E.sakazakii细胞膜通透性发生改变,细胞增殖受到了抑制.
(3)经儿茶素处理后,ROS的累积表明细胞发生氧化应激,E.sakazakii细胞膜出现了氧化损伤.
(4)经儿茶素处理后,E.sakazakii的胞内ATP和pHin都有明显的下降,表明儿茶素可能会引起E.sakazakii的细胞膜通透性改变,从而导致胞内成分出现泄漏,或是细胞代谢紊乱,导致ATP合成途径受阻.
本研究结果可为儿茶素的开发和利用提供理论依据.
