基于PI3K/AKT 信号通路探讨益气养阴活血利水方抑制早期糖尿病视网膜病变大鼠微血管周细胞凋亡的作用机制
2023-12-01蒋鹏飞彭清华
钟 缘,蒋鹏飞,赵 盼,谭 诗,彭 俊,彭清华*
1.湖南中医药大学,湖南 长沙410208;2.湖南中医药大学第一附属医院,湖南 长沙410007;3.湖南省中医药防治眼耳鼻咽喉疾病与视功能保护工程技术研究中心,湖南 长沙410208
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病中常见的微血管并发症,是机体持续糖代谢紊乱和微循环障碍在眼部的表现,是20~60 岁劳动人群致盲的首要原因,也是世界范围内重要的致盲眼病[1]。 目前,DR 的治疗方法主要包括视网膜激光治疗、激素治疗、玻璃体内注药及玻璃体切割手术等[2],但这些治疗措施主要应用于晚期增生性DR。 对于早期DR,目前临床上尚无疗效确切的治疗方案。
中医药治疗早期DR 具有独到优势,彭清华教授认为目络阻滞、血水溢出脉外是早期DR 发病的重要病理因素,气阴两虚、目络瘀滞、血水溢出脉外是重要病机,并针对该病机创制了益气养阴活血利水方[3]。 全方由黄芪、黄精、生地黄、墨旱莲、茯苓、蒲黄、蛴螬、葛根、益母草、车前子、甘草组成,共奏益气养阴、活血利水之功。 前期研究表明,益气养阴活血利水方能减轻早期DR 患者的临床症状,能提高视力、减少微血管瘤、减少眼底出血渗出、改善毛细血管通透性、降低血液黏稠度,从而改善微循环[4]。
早期DR 最具特征的组织学改变是视网膜微血管周细胞的选择性丧失[5],周细胞丧失引起血-视网膜屏障(blood-retinal barrier, BRB)受损无法修复,故应重视DR 的早期干预治疗。 早期防治的关键在于减少微血管周细胞的丢失,防止无细胞新生血管的形成,阻止病情进展[6]。 多项研究发现,磷酸肌醇3-激酶蛋白(phosphatidylinositol 3-kiases, PI3K)/丝氨酸/苏氨酸蛋白激酶(phospho-alpha serine/threonine-protein kinase, AKT) 信号通路在维持BRB完整性、抑制视网膜新生血管生成和调控视网膜微血管周细胞凋亡等方面发挥重要作用,与DR 的发生与发展关系密切[7-9]。 本研究拟在前期研究基础上, 进一步以PI3K/AKT 信号通路及其下游凋亡蛋白为切入点,探讨益气养阴活血利水方治疗早期DR的作用机制, 以期为治疗早期DR 找到有效的候选药物。
1 材料与方法
1.1 实验动物
SPF 级SD 雄性大鼠138 只,体质量(200±20) g,购自湖南中医药大学动物实验中心,实验动物质量合格证号:ZS-202106150022。 实验动物购入后饲养于湖南中医药大学SPF 级实验动物中心,实验单位使用许可证号:SYXK(湘)2020-0005。 自由饮食饮水,12 h 昼夜节律。 实验经湖南中医药大学动物实验伦理委员会批准(LL2021061607)。
1.2 主要药物与试剂
益气养阴活血利水方组成:黄芪20 g、生地黄10 g、黄精10 g、墨旱莲10 g、蒲黄10 g(包煎)、蛴螬3 g(磨粉冲服)、葛根10 g、茯苓10 g、益母草10 g、车前子10 g、甘草5 g。 总药量为108 g,为50 kg体质量成人量。 由湖南中医药大学第一附属医院药剂科提供,按传统工艺煎煮一次,并浓缩成85 mL的混悬液,浓度为1.27 g/mL;羟苯磺酸钙胶囊(贵州天安药业股份有限公司,规格0.5 g/粒,国药准字:H20110031,批号:14201658642)。
链脲佐菌素(streptozocin, STZ)(北京索莱宝科技有限公司,批号:301V021);梓檬酸、柠檬酸三钠(上海展云化工有限公司,批号:01B221210、03A221023);伊红、苏木精染液(长沙艾碧维生物科技有限公司,批号:06K230425、11Q230210);蛋白酶抑制剂(中国北 京 金泰宏达公司,批号:583794);Bcl-2 相关X 蛋白(Bcl2-associated X protein, Bax)、胱天蛋白酶-8(cysteine aspartic acid specific protease-8, Caspase-8)、胱天蛋白酶-3(cysteine aspartic acid specific protease-3, Caspase-3)、细胞凋亡死亡激动剂BID 蛋白(apoptotic death agonist BID protein, Bid)、PI3K、AKT 抗体(武汉赛维尔生物科技有限公司,批号:AC220112006、AC210828016、AC220128020、AC210823018、AC2110 15003、AC220122010);mRNA 逆转录试剂盒、miRNA 逆转录试剂盒(北京康为世纪生物科技有限公司,批号:09623、25722);Trizol(美国Thermo 公司,批号:3877101223);琼脂糖(长沙艾碧维生物科技有限公司,批号:02C230423)。
1.3 主要仪器
电子天平(美国双杰,型号:JJ224BC);精密pH计(上海仪电科学仪器股份有限公司,型号:PHS-3C);手术显微镜(苏州六六视觉科技股份有限公司,型号:YZ20T4);超薄切片机(中国浙江金华益迪医疗设备有限公司,型号:YD-315);包埋机(常州市中威电子仪器有限公司,型号:BMJ-A);实时荧光定量PCR仪、LD5-10B 低速离心机、荧光PCR 板(美国Thermo公司,型号:PIKOREAL96、Fresco 17、TSPL0960);紫 外可见分光光度计(上海Spectrum 公司,型号:SP-752);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);恒温水浴箱(河南金博仪器制造有限公司,型号:THH-S2)。
1.4 分组、造模及给药
SPF 级SD 雄性大鼠138 只,适应性饲养7 d 后随机分成6 组,空白组、模型组、羟苯磺酸钙组及益气养阴活血利水方低、中、高剂量组。 每组23 只,并进行编号。 除空白组外,其余各组进行早期DR 模型造模。
参照高玉等[10]早期DR 模型建立方法。 除空白组外,其余各组均以1% STZ 溶液按照60 mg/kg 体质量腹腔注射,72 h 后尾静脉采血测定其空腹血糖值(每次测血糖前禁食过夜),血糖≥16.7 mmol/L提示糖尿病模型造模成功,血糖不达标或死亡大鼠予以剔除。 空白组大鼠腹腔注射相同剂量的柠檬酸钠缓冲液。 造模成功后,维持高血糖状态10 周。 检测大鼠血糖和体质量变化,每周检测1 次。 灌胃4周后再次测量,记录所有大鼠的血糖及体质量。
在模型组、羟苯磺酸钙组及益气养阴活血利水方低、中、高剂量组维持高血糖10 周后,益气养阴活血利水方低、中、高剂量组予以不同浓度益气养阴活血利水方混悬液连续干预4 周,每日灌胃1 次。给药剂量计算方式参照《中医科研设计与统计学》[11]中实验动物给药方法部分,D2=D1×R2/R1 (D1 为50 kg 成人的剂量(108 g),查表得R2为200 g 大鼠对应体表面积(7.040),R1 为50 kg 成人对应体表面积(307.00),计算得到D2 约为12.4 g/(kg·d)。 结合文献及实际给药合理性[12],低剂量组、高剂量组以中剂量组的1/2 倍、2 倍剂量给药, 分别为6.2、24.8 g/(kg·d)。空白组、模型组给予3 mL 蒸馏水灌胃,羟苯磺酸钙组予羟苯磺酸钙150 mg/(kg·d)灌胃治疗,实验过程中出现死亡的大鼠予以剔除并根据要求进行补充。
1.5 取材
药物干预4 周后开始取材,以3%戊巴比妥钠30 mg/kg 腹腔注射后处死大鼠,取带有视神经的大鼠眼球,用4%多聚甲醛固定12 h 以上,于-80 ℃液氮下冷冻储存。
1.6 指标检测
1.6.1 HE 染色观察视网膜组织形态结构 各组取材后,置于多聚甲醛固定,蔗糖脱水后置于石蜡中包埋,将包埋视网膜的石蜡块切成4 μm 的切片,经二甲苯和梯度乙醇常规脱蜡至水,自来水冲洗,经苏木精初染5 min 和伊红复染4 min,中性树胶封片,光学显微镜下观察视网膜组织形态结构。
1.6.2 TUNEL 染色检测视网膜微血管周细胞凋亡取大鼠眼球,将组织进行脱水、透明、浸蜡、包埋,制成石蜡切片,对其进行TUNEL 染色。 根据细胞凋亡检测试剂盒说明书,将切片进行脱蜡、润洗等步骤后,苏木精复染核,梯度乙醇脱水,二甲苯15 min透明,中性树胶封片,置于光学显微镜下观察并采集图像,凋亡细胞的阳性细胞核呈棕褐色,计数每平方毫米微血管周细胞调亡数目。
1.6.3 免疫组织化学法检测视网膜血管Bax、Caspase-8、Caspase-3、Bid、PI3K、AKT 表达 切片经脱腊、复水、通透及抗原修复后行标准的免疫组织化学染色,使用单克隆抗平滑肌肌动蛋白抗体标记周细胞。每张切片随机取2 个视野,应用MIAS 2000型图像分析系统测定Bcl-2、Bax、Caspase-3、Caspase-8、PI3K 及AKT 在视网膜血管周细胞的免疫反应强度(灰度值)。
1.6.4 RT-PCR 检 测 视 网 膜 组 织Bax、Caspase-8、Caspase-3、Bid、PI3K、AKT mRNA 表达 取各组大鼠眼球,剥离视网膜,采用Trizol 法提取总RNA,通过逆转录制备cDNA,聚合酶链反应扩增cDNA。 反应条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s。 Bax、Caspase-8、Caspase-3、Bid、PI3K、AKT 引物序列如下。Bax:正向5'-ACGCATCCACCAAGAAGC-3',反向5'-GCCACACGGAAGAAGACC-3';Caspase-8:正向5'-CACCCGGACCCAGAATACC-3',反向5'-TGTTGCTGGTGAGTGTGCATT-3';Caspase-3:正向5'-TTAATAAAGGTATCCATGGA-3',反向5-TTAGTGATAAAAATAGAGTT-3;Bid:正向5'-TGGTCTCGGTGGTCTTGGTA-3',反向5'-CGTTGTTGGTCGGGGATTTG-3';PI3K:正向5'-AATGGCGACGATTTGCGG-3',反向5-CAGCCATAGGGGAGCATTCG-3';AKT:正向5'-CAGACCCACGACCGCCTC-3',反向5'-GACACAATCTCCGCACCGTAG-3';内参β-actin:正向5'-CCCATCTATGAGGGTTACGC-3',反向5'-TTTAATGTCACGCACGATTTC-3'。 采用琼脂糖凝胶电泳,Bio-Rad 凝胶成像系统进行灰度扫描,分别记录Bax、Caspase-8、Caspase-3、Bid、PI3K、AKT 及相应β-actin 的 光 密 度 值(A),以β-actin 为内参进行半定量,分析Bax、Caspase-8、Caspase-3、Bid、PI3K、AKT mRNA 表达。
1.7 统计学方法
本实验数据采用SPSS 26.0 统计软件进行处理。 符合正态分布的计量资料以“±s”表示,采用t检验;非正态分布的计量数据采用Wilcoxon 秩和检验;计数资料采用χ2检验。 P<0.05 为差异有统计学意义。
2 结果
2.1 益气养阴活血利水方对大鼠体质量的影响
治疗前,与空白组比较,其余各组大鼠体质量均明显降低(P<0.01)。 治疗4 周后,与模型组比较,各用药组大鼠体质量均明显上升(P<0.01);与羟苯磺酸钙组、益气养阴活血利水方低剂量组比较,益气养阴活血利水方中、高剂量组大鼠体质量明显增加(P<0.01);与益气养阴活血利水方中剂量组比较,益气养阴活血利水方高剂量组大鼠体质量明显增加(P<0.01)。 详见表1。
表1 各组大鼠体质量比较(±s,g,n=23)

表1 各组大鼠体质量比较(±s,g,n=23)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与羟苯磺酸钙组比较,△△P<0.01;与益气养阴活血利水方低剂量组比较,□□P<0.01;与益气养阴活血利水方中剂量组比较,■■P<0.01。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组治疗前231.63±10.29 189.65±4.81**186.93±5.45**186.65±7.98**187.34±8.93**187.07±6.79**治疗4 周后309.20±9.58 204.97±6.62**217.05±9.08**##220.03±9.75**##231.62±8.99**##△△□□245.70±9.04**##△△□□■■
2.2 益气养阴活血利水方对大鼠血糖的影响
治疗前,与空白组比较,其余各组大鼠血糖明显升高(P<0.01)。 治疗4 周后,与模型组比较,益气养阴活血利水方中、高剂量组血糖明显降低(P<0.01);与羟苯磺酸钙组比较,益气养阴活血利水方中、高剂量组血糖明显降低(P<0.05);与益气养阴活血利水方低剂量组比较,益气养阴活血利水方高剂量组血糖明显降低(P<0.05)。 详见表2。
表2 各组大鼠血糖比较(±s,mmol/L,n=23)

表2 各组大鼠血糖比较(±s,mmol/L,n=23)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与羟苯磺酸钙组比较,△P<0.05;与益气养阴活血利水方低剂量组比较,□P<0.05。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组治疗前3.25±0.66 26.55±2.01**25.59±3.25**26.23±1.746**25.84±2.05**26.13±1.78**治疗4 周后3.55±0.86 26.03±2.64**26.14±1.69**25.09±1.26**23.85±1.96**##△22.49±2.09**##△□
2.3 益气养阴活血利水方对大鼠视网膜组织结构的影响
空白组大鼠视网膜各层结构清晰,视网膜各层细胞连续,细胞核数量正常;模型组大鼠视网膜各层紊乱变性;羟苯磺酸钙组大鼠视网膜各层结构紊乱;益气养阴活血利水方低、中剂量组大鼠视网膜结构较模型组清晰;益气养阴活血利水方高剂量组大鼠视网膜连续,各层视网膜结构较清晰。 详见图1。
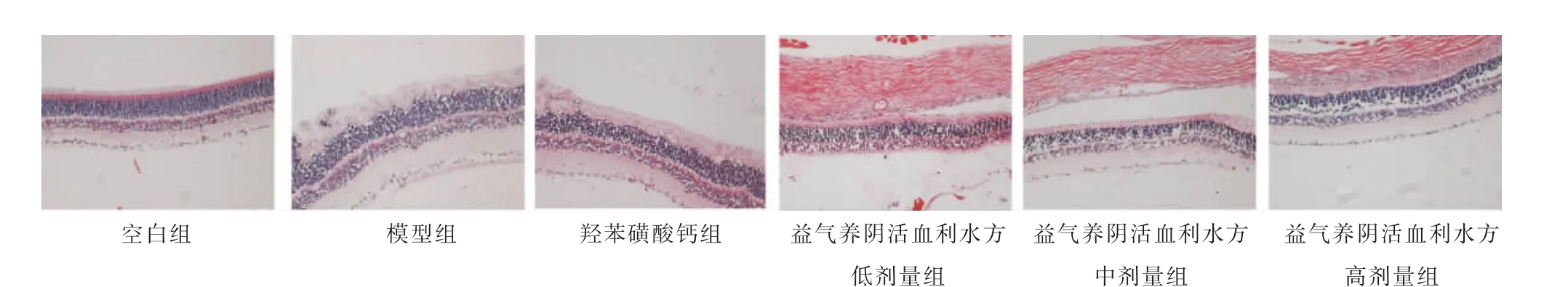
图1 各组大鼠视网膜HE 染色结果(×400)
2.4 益气养阴活血利水方对大鼠视网膜周细胞凋亡的影响
空白组大鼠视网膜微血管未见明显周细胞凋亡;模型组大鼠视网膜可见大量周细胞凋亡,呈棕褐色;羟苯磺酸钙组及益气养阴活血利水方低、中剂量组大鼠视网膜周细胞凋亡数虽高于空白组,但较模型组有减少;益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞凋亡数较模型组明显减少。 详见图2。

图2 各组大鼠视网膜TUNEL 染色结果(×400)
与空白组比较,模型组凋亡细胞数增加(P<0.05);与模型组比较,各用药组凋亡细胞数减少(P<0.05);与羟苯磺酸钙组比较,益气养阴活血利水方低、中、高剂量组凋亡细胞数减少(P<0.05);与益气养阴活血利水方低、中剂量组比较,益气养阴活血利水方高剂量组凋亡细胞数减少(P<0.05)。 详见表3。
表3 各组视网膜周细胞凋亡细胞数比较(±s,n=8)
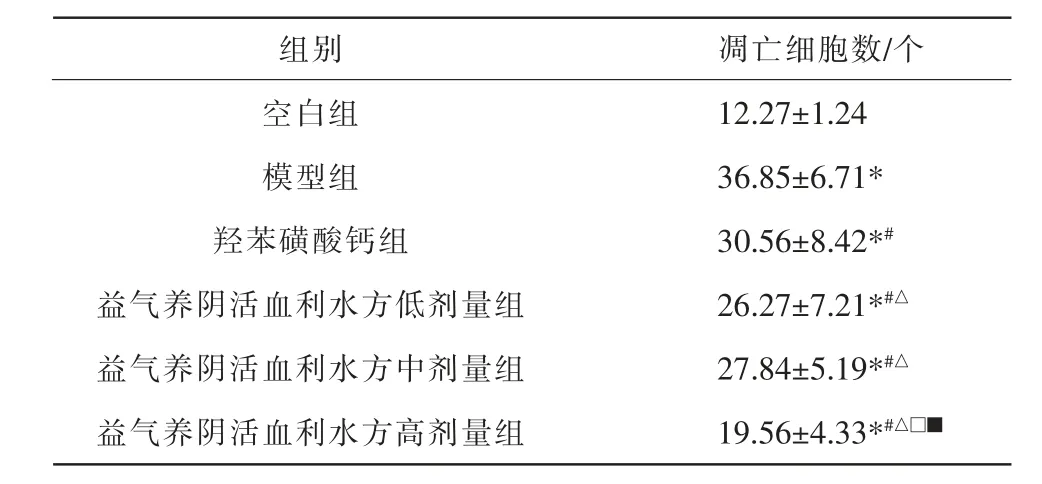
表3 各组视网膜周细胞凋亡细胞数比较(±s,n=8)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与羟苯磺酸钙组比较,△P<0.05;与益气养阴活血利水方低剂量组比较,□P<0.05;与益气养阴活血利水方中剂量组比较,■P<0.05。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组凋亡细胞数/个12.27±1.24 36.85±6.71*30.56±8.42*#26.27±7.21*#△27.84±5.19*#△19.56±4.33*#△□■
2.5 益气养阴活血利水方对大鼠视网膜微血管周细胞中PI3K、AKT 蛋白表达水平的影响
与空白组比较,模型组、羟苯磺酸钙组及益气养阴活血利水方低、中剂量组大鼠视网膜微血管周细胞中PI3K、AKT 蛋白相对表达量明显降低(P<0.05);与模型组相比,益气养阴活血利水方低、中、高剂量组大鼠视网膜微血管周细胞中AKT 蛋白相对表达量升高(P<0.01),益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中PI3K 蛋白相对表达量升高(P<0.01);与益气养阴活血利水方低、中剂量组比较,益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中AKT 蛋白相对表达量明显升高(P<0.05)。详见表4、图3—4。
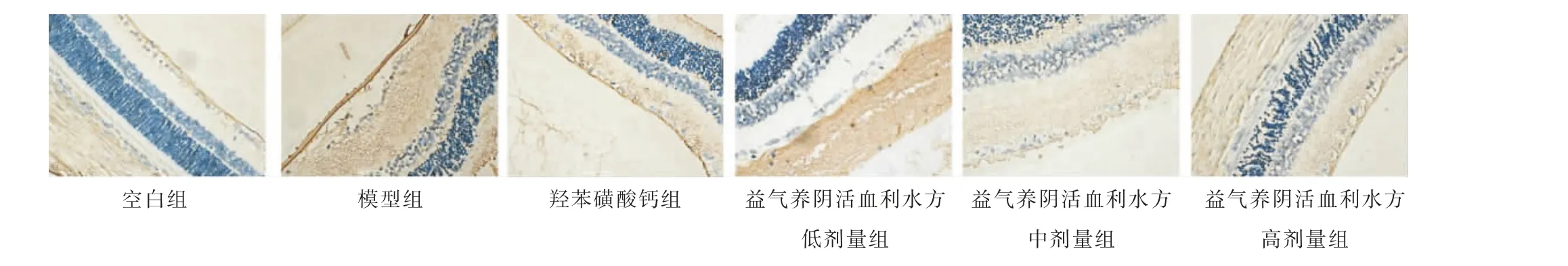
图3 各组大鼠视网膜PI3K 表达情况(免疫组织化学,×400)
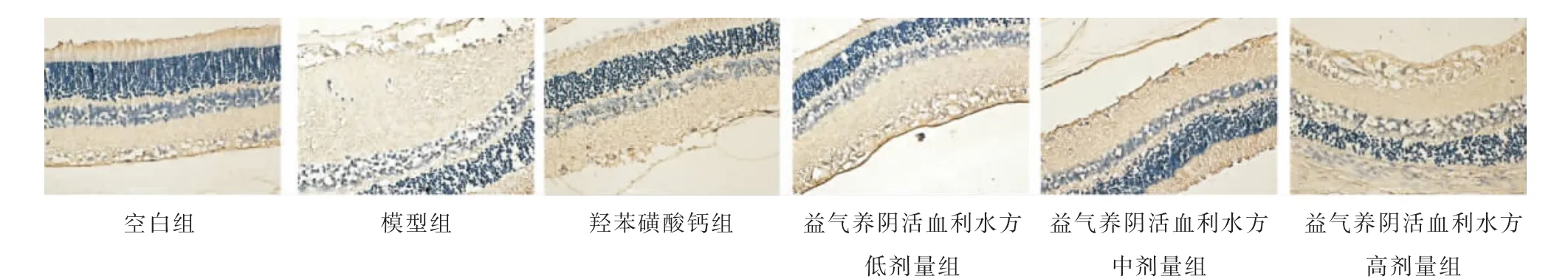
图4 各组大鼠视网膜AKT 表达情况(免疫组织化学,×400)
表4 各组大鼠视网膜微血管周细胞PI3K、AKT 蛋白相对表达量比较(±s,n=6)

表4 各组大鼠视网膜微血管周细胞PI3K、AKT 蛋白相对表达量比较(±s,n=6)
注:与空白组比较,*P<0.05;与模型组比较,##P<0.01;与益气养阴活血利水方低剂量组比较,□P<0.05;与益气养阴活血利水方中剂量组比较,■P<0.05。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组PI3K 0.38±0.03 0.30±0.03*0.31±0.12*0.33±0.03*0.33±0.05*0.35±0.03##AKT 0.44±0.04 0.29±0.04*0.32±0.11*0.36±0.03*##0.36±0.03*##0.40±0.04##□■
2.6 益气养阴活血利水方对大鼠视网膜微血管周细胞PI3K、AKT mRNA 表达水平的影响
与空白组比较,模型组、羟苯磺酸钙组及益气养阴活血利水方低、中剂量组大鼠视网膜微血管周细胞PI3K、AKT mRNA 相对表达量明显降低(P<0.01);与模型组比较,羟苯磺酸钙组大鼠视网膜微血管周细胞AKT mRNA 相对表达量升高(P<0.05),益气养阴活血利水方低、中、高剂量组大鼠视网膜微血管周细胞中PI3K、AKT mRNA 相对表达量明显升高(P<0.01);与益气养阴活血利水方低、中剂量组比较,益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中PI3K、AKT mRNA 相对表达量明显升高(P<0.05)。 详见表5。
表5 各组大鼠视网膜微血管周细胞PI3K、AKT mRNA 相对表达量比较(±s,n=6)

表5 各组大鼠视网膜微血管周细胞PI3K、AKT mRNA 相对表达量比较(±s,n=6)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与益气养阴活血利水方低剂量组比较,□P<0.05;与益气养阴活血利水方中剂量组比较,■P<0.05。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组PI3K 0.54±0.21 0.12±0.03**0.14±0.05**0.29±0.07**##0.31±0.06**##0.42±0.11##□■AKT 1.59±0.46 0.36±0.10**0.55±0.16**#0.68±0.23**##0.64±0.26**##1.25±0.44##□■
2.7 益气养阴活血利水方对大鼠视网膜微血管周细胞Bax、Caspase-8、Caspase-3、Bid 蛋白表达水平的影响
与空白组比较,模型组、羟苯磺酸钙组及益气养阴活血利水方低、中剂量组大鼠视网膜微血管周细胞Bax、Bid 蛋白相对表达量明显升高(P<0.05),各用药组大鼠视网膜微血管周细胞Caspase-8、Caspase-3蛋白相对表达量明显升高(P<0.05);与模型组比较,羟苯磺酸钙组大鼠视网膜周细胞Bid、Caspase-3 蛋白相对表达量降低(P<0.05),益气养阴活血利水方组低、中、高剂量组大鼠视网膜周细胞中Bax、Caspase-8、Caspase-3、Bid 蛋白相对表达量明显降低(P<0.05);与益气养阴活血利水方低剂量组比较,益气养阴活血利水高剂量组大鼠视网膜微血管周细胞Bax、Bid 蛋白相对表达量明显降低(P<0.05);与益气养阴活血利水方中剂量组比较,益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中Caspase-3 蛋白相对表达量明显下降(P<0.05)。 详见表6、图5—8。

图5 各组大鼠视网膜Bax 表达情况(免疫组织化学,×400)

图6 各组大鼠视网膜Caspase-3 表达情况(免疫组织化学,×400)

图7 各组大鼠视网膜Caspase-8 表达情况(免疫组织化学,×400)

图8 各组大鼠视网膜Bid 表达情况(免疫组织化学,×400)
表6 各组大鼠视网膜微血管周细胞Bax、Caspase-8、Caspase-3、Bid 蛋白相对表达量比较(±s,n=6)

表6 各组大鼠视网膜微血管周细胞Bax、Caspase-8、Caspase-3、Bid 蛋白相对表达量比较(±s,n=6)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与益气养阴活血利水方低剂量组比较,□P<0.05;与益气养阴活血利水方中剂量组比较,■P<0.05。
组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组Bax 0.31±0.02 0.42±0.02*0.38±0.06*0.35±0.03*#0.36±0.06*#0.32±0.02#□Caspase-3 0.30±0.02 0.39±0.03*0.35±0.04*#0.35±0.04*#0.37±0.03*#0.33±0.03*#■Caspase-8 0.29±0.03 0.44±0.04*0.38±0.07*0.36±0.03*#0.35±0.07*#0.33±0.04*#Bid 0.28±0.04 0.41±0.04*0.36±0.03*#0.37±0.03*#0.37±0.06*#0.32±0.04#□
2.8 益气养阴活血利水方对大鼠视网膜微血管周细胞Bax、Caspase-8、Caspase-3、Bid mRNA 相对表达水平的影响
与空白组比较,其余各组大鼠视网膜微血管周细胞中Bax、Caspase-8、Caspase-3、Bid mRNA 相对表达量明显升高(P<0.05);与模型组比较,羟苯磺酸钙组大鼠视网膜微血管周细胞Bax、Caspase-8 mR-NA 相对表达量降低(P<0.05),益气养阴活血利水方低、中、高剂量组大鼠视网膜微血管周细胞中Bax、Caspase-8、Caspase-3 mRNA 相对表达量明显降低(P<0.05),益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞Bid mRNA 相对表达量降低(P<0.05);与益气养阴活血利水方低剂量组比较,益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞Bax、Caspase-8、Caspase-3 mRNA 相对表达量明显降低(P<0.05);与益气养阴活血利水方中剂量组比较,益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中Bax、Caspase-3 mRNA 相对表达量明显降低(P<0.05)。 详见表7。
表7 各组大鼠视网膜微血管周细胞Caspase-8、Caspase-3、Bax、Bid mRNA 相对表达量比较(±s,n=6)

表7 各组大鼠视网膜微血管周细胞Caspase-8、Caspase-3、Bax、Bid mRNA 相对表达量比较(±s,n=6)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与益气养阴活血利水方低剂量组比较,□P<0.05;与益气养阴活血利水方中剂量组比较,■P<0.05。
Bid 0.11±0.04 0.73±0.27*0.66±0.24*0.53±0.17*0.52±0.21*0.23±0.08*#组别空白组模型组羟苯磺酸钙组益气养阴活血利水方低剂量组益气养阴活血利水方中剂量组益气养阴活血利水方高剂量组Bax 0.07±0.02 0.92±0.33*0.57±0.24*#0.39±0.12*#0.32±0.15*#0.14±0.07*#□■Caspase-3 0.09±0.02 1.28±0.36*0.94±0.41*0.44±0.20*#0.39±0.16*#0.25±0.07*#□■Caspase-8 0.06±0.02 1.29±0.42*0.87±0.26*#0.54±0.15*#0.43±0.11*#0.35±0.09*#□
3 讨论
随着物质生活水平的提升以及人口老龄化比例的不断升高,糖尿病发病率逐年增加[13],糖尿病人群中DR 患病率达31.8%[14],DR 的致盲率也呈上升趋势[15],早期防治DR 显得尤为重要。研究表明,DR 早期的组织学病理改变之一是视网膜微血管周细胞的消失[5],且周细胞缺失引起的BRB 功能受损是永久性的[16]。 因此,靶向减少微血管周细胞的丢失是治疗早期DR 的关键。 目前对于早期DR 尚无疗效确切的药物。前期临床研究表明,益气养阴活血利水方能有效改善早期DR 患者的临床症状[4]。
DR 属中医学“视瞻昏渺”“云雾移睛”等内障眼病范畴。消渴病久伤阴,气阴亏虚,气虚帅血无力,无力运化水湿,阴虚血行滞涩,脉络不畅,致眼部血络瘀阻或血溢脉外,引起微血管瘤、渗出、出血、水肿等眼底改变。根据早期DR 的病机特点,彭清华教授提出在辨证上须抓住“虚、瘀、水”三要点,以益气养阴活血利水方加减治疗。方中黄芪补脾益气利水,气行则血行,生地黄滋肾养阴,黄精平补气阴,三药合为君药,共奏益气养阴、补脾益肾之功;臣以葛根生津活血,蛴螬活血通络,蒲黄活血止血,墨旱莲滋补肝肾、凉血止血;佐以茯苓健脾利水,益母草活血利水,车前子利水渗湿,甘草调和诸药。 全方共奏益气养阴、活血利水之功[4]。
PI3K/AKT 信号通路是调控胰岛素传导信号的经典途径之一[17],其下游多种靶蛋白参与调节视网膜微血管周细胞的凋亡,现已被证实调控该通路靶基因的表达能在一定程度上预防DR 的进展[18]。PI3K/AKT 信号通路在视网膜微血管周细胞中被激活后,驱动血管内皮生长因子的细胞因子信号,介导内皮细胞增殖、迁移及新生血管生成过程,导致DR进展[19]。 同时,PI3K/AKT 信号激活后可作用于下游靶基因和靶蛋白,调控细胞凋亡[20]。 田丽珍等[21]发现,大黄庶虫广虫丸能够上调PI3K、AKT,降低Caspase-9 的表达,抑制糖尿病大鼠视网膜微血管周细胞的凋亡。CHENG 等[18]证实,DR 小鼠模型中发生了早发性周细胞丢失和细胞凋亡水平增加,并发现地诺前列素可以通过激活PI3K/AKT 信号通路来改善周细胞凋亡,阻止疾病进展。
细胞凋亡主要由外源性和内源性两种途径启动[22],其中执行凋亡的关键元素为Caspase 家族和Bcl-2家族。 Caspase-8 是外源性途径中关键的启动型蛋白酶,而Caspase-3 是最终的凋亡执行因子[23],可被多种因素活化,引起激酶级联反应,促进细胞凋亡。Bcl-2 家族成员则在内源性细胞凋亡途径中发挥重要作用[24],凋亡级联中Bcl-2 蛋白活化,激活下游Caspase 家族蛋白,作用于相应底物,引起细胞凋亡。 Bax和Bid 是Bcl-2 家族促凋亡成员代表,Bax 通过与线粒体上的膜通道结合,促使细胞色素C 的释放而促进凋亡,并可与Bcl-2 形成异二聚体阻断其抗凋亡作用,另一方面,凋亡过程启动后,被激活的Caspase-8 将Bid 切割为活性tBid,进入线粒体后使得细胞色素C 高效释放,细胞色素C 与胞浆中的凋亡酶激活因子结合,活化Caspase-9,进而激活Caspase-3,促使细胞凋亡[25]。
本研究发现,在益气养阴活血利水方干预4 周后,与模型组比较,益气养阴活血利水方中、高剂量组大鼠血糖均降低;益气养阴活血利水方各剂量组大鼠体质量均升高,大鼠视网膜微血管周细胞凋亡数减少;益气养阴活血利水方高剂量组大鼠视网膜微血管周细胞中PI3K、AKT 蛋白和mRNA 表达水平均 升 高,Bax、Caspase-8、Caspase-3 及Bid 蛋 白 和mRNA 表达水平均降低。 说明益气养阴活血利水方能够降低早期DR 大鼠血糖、稳定体质量,上调早期DR 大鼠视网膜微血管中PI3K、AKT 表达,下调Bax、Caspase-8、Caspase-3 及Bid 表达,从而减少周细胞的凋亡,改善视网膜组织结构紊乱。
综上所述,本研究结果表明,益气养阴活血利水方能够减少早期DR 大鼠视网膜微血管周细胞的凋亡,改善视网膜组织结构紊乱,延缓DR 视网膜微血管病变的发生发展,可能是通过激活PI3K/AKT通路,下调Bax、Caspase-8、Caspase-3 及Bid 基因表达水平发挥作用。 DR 的发病机制极为复杂,本研究通过动物实验明确了益气养阴活血利水方对PI3K/AKT 信号通路的部分调控作用,希望能为未来DR的早期防治提供实践依据。
