基于血小板及其衍生物的药物递送系统研究进展*
2023-11-30游训仪朱珂慧刘嘉馨曹晔中国医学科学院北京协和医学院输血研究所四川成都610052
游训仪 朱珂慧 刘嘉馨 曹晔(中国医学科学院北京协和医学院输血研究所,四川 成都, 610052)
目前,纳米药物递送载体如脂质体、聚合物胶束、纳米粒等在临床应用广泛,然而其存在着如靶向性差、血液循环半衰期短、生物利用度低等问题[1]。 因此,为了克服传统纳米载体的缺陷,人们开始研究利用机体自身细胞为载体的新型药物递送系统[2]。 血小板(platelet,PLT)含有多种膜蛋白,如参与免疫逃逸的CD47、抑制补体激活的CD55 和CD59等,能减少免疫系统对药物递送系统的清除,提高其生物相容性和循环半衰期。 同时,血小板较其他自身细胞,具有对肿瘤组织、受损血管及病原体感染等部位的靶向结合特性,能将药物递送至靶部位,提高靶部位药物浓度,增强疗效。基于此,越来越多研究开始探索基于血小板及其衍生物的药物递送系统,以期提高药物递送载体的稳定性和靶向性,提高药物疗效,减少药物的脱靶毒性[3-4]。 本文综述以PLT 及其衍生物作为药物递送载体的研究现状与应用。
1 血小板的形成和生理特点
PLT 作为机体循环系统中的固有成分,是由成熟巨核细胞裂解产生的无核碎片,参与包括止血、血栓形成和肿瘤转移等多种生理病理活动[5]。
PLT 含有多种膜蛋白,如PLM 表面的CD47 可以结合巨噬细胞表面的信号调节蛋白-α(signal regulatory protein-α,SIRP-α),通过引起免疫受体酪氨酸抑制基序中的酪氨酸磷酸化,而后导致下游通路蛋白去磷酸化,最终抑制巨噬细胞吞噬PLT[6-8]。 PLT 能通过能产生分泌免疫调节细胞因子和趋化因子,相关分子和受体在机体抗菌和抗病毒中发挥重要作用[9-12];PLM 表面的CD55 和CD59,是补体系统的一部分,参与机体对病原体的免疫调节[9]。 PLT 可以通过表面受体GPIbα、GPⅡb/Ⅲa、Toll 样受体(Toll-like receptors,TLRs)和C 型凝集素受体(C-type lectin receptors,CLRs)直接与病原体结合[13-14];或通过血管性血友病因子(von Willebrand Factor,vWF)、纤维蛋白原及IgG 等血浆蛋白间接与病原体相互作用[1]。 血小板在多种生理病理情况下会被激活,如受损的血管内皮细胞、剪切应力或糖蛋白(Glycoprotein,GP)Ⅱb/Ⅲa等,活化后PLT 随着伪足形成,胞质内多种颗粒释放大量活性蛋白及细胞因子,或参与机体免疫调节、肿瘤发展及止血凝血等[15-16],或作为PLT 次级激动剂促进PLT 聚集和纤维蛋白交联形成血栓[17]。 PLM 表面GP Ibα 与损伤血管内皮细胞释放的vWF A1 结构域的GPIbα 配体结合,促进PLT 与损伤血管处暴露的胶原蛋白黏附[18]。 活化PLT 表面过表达的CD62p 能结合白细胞P-选择素糖蛋白配体-1(P-selection glycoprotein ligand 1,PSGL-1),形成血小板-白细胞聚集体,促进纤维沉积导致血栓形成[19-21]。 PLT 上CD62p 能与肿瘤表面的CD44 相互作用,GP Ⅱb/Ⅲa 结合肿瘤细胞整合素ανβ3,能增加肿瘤细胞侵袭性[22];PLT 释放的5-羟色胺、血栓烷A2 和血小板活化因子等能收缩肿瘤血管内皮细胞,增加肿瘤血管通透性,使肿瘤细胞更易渗入血管形成循环肿瘤细胞(circulating tumor cells,CTCs),导致肿瘤转移[23]。 CTCs在循环系统中会释放凝血酶诱导PLT 聚集和活化,并通过与活化PLT 表面高表达的CD62p 结合,再加上纤维蛋白沉积,形成微血栓屏障,称为肿瘤细胞诱导的血小板聚集(tumor cell-induced platelet aggregation, TCIPA),能避免自然杀伤细胞和血流高剪切应力对CTCs 的损伤[24-25]。 活化PLT 分泌的血小板外泌体,可以将主要组织相容性复合体Ⅰ类分子转移至TCIPA 表面,帮助CTCs 逃避免疫清除[26]。 同时,活化PLT 会释放血小板细胞外囊泡(platelet extracellular vesicles,PEVs)[27],PEVs 具有和PLT 相似的功能及性质,参与如凝血[28]、血管生成[29]、炎症[30]及肿瘤发生发展[31-32]等过程。PEVs 能促进细胞间和细胞内信号通路,介导靶向炎症和肿瘤部位的药物释放,其天然的纳米级尺寸为跨越生物屏障提供了可能。
PLT 复杂的膜蛋白受体,一方面作为自体蛋白,可以逃逸免疫系统识别清除;另一方面介导PLT 与肿瘤、血栓及病原体感染等部位的相互作用,为基于PLT 的药物递送系统提供了条件。
2 血小板及其膜仿生药物递送系统
按照不同载药方式可以将血小板及其仿生药物递送系统分为以下4 类(图1):1)血小板直接包载药物;2)血小板膜偶联药物;3)血小板膜包裹纳米载体;4)血小板衍生物药物递送系统。
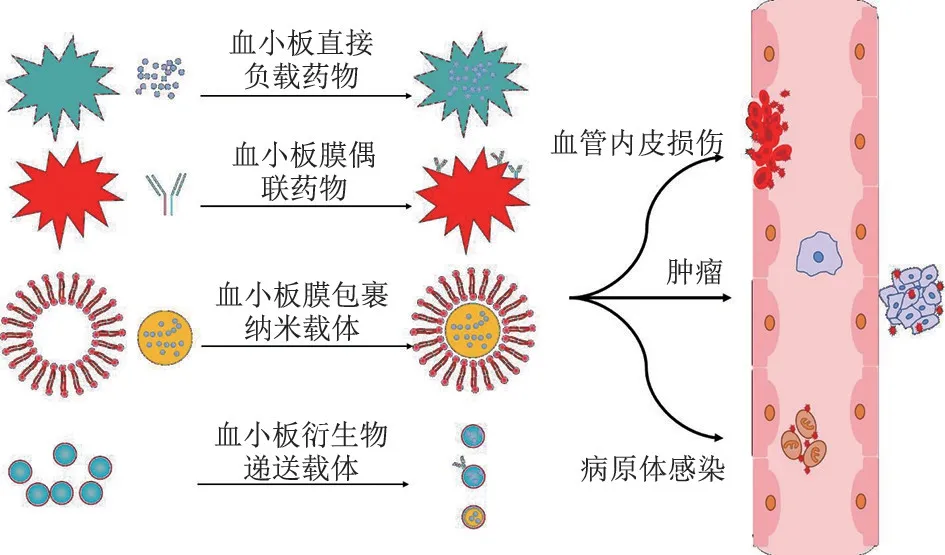
图1 血小板及其衍生物药物递送系统的类型与应用
2.1 血小板直接包载药物 通过共同孵育法、内吞法、电穿孔法和脂质融合法等方法可以将药物直接包载于血小板内。Rao 等[33]通过电穿孔法在PLM 上产生小径孔洞,将金纳米棒(gold nanorods,AuNR)包载于PLT 内,得到的PLT-AuNRs最高负载效率约为0.1pg·PLT-1,在室温下可稳定保存48 h。PLT-AuNRs 同时保留了AuNRs 的良好光热特性和PLT 的长循环半衰期、肿瘤靶向性,通过局部光照可有效的抑制小鼠头颈部鳞癌的生长。 Xu 等[34]采用内吞法,将DOX 溶于PBS后与PLT 混合孵育,通过PLT 上开放的微管系统,将DOX 包载于PLT 内得到DOX-PLT。 当PLT 与DOX 体积比为1 ∶2时载药量为46.3%,包封效率为86.6%。 且DOX-PLT 具有pH酸性敏感性,当pH 为5.5 时,其药物释放速度最快,约84.4%的DOX 在36h 内释放,这表明DOX-PLT 在酸性的肿瘤微环境中,能实现药物的快速释放。 该法所得的DOX-PLT 具有更高的药物负载和包封率,且血小板保留了原有的形态功能。 较游离DOX,DOX-PLT 在淋巴瘤荷瘤小鼠模型中具有更明显的疗效和更低的脱靶毒性,表明PLT 包载药物能大大降低药物脱靶的毒副作用,并通过提高药物的靶部位浓度来提升疗效。
2.2 血小板膜偶联药物 血小板膜偶联药物是通过共价结合或细胞工程手段将药物直接偶联在血小板膜上进行药物递送的方式[35]。 Jing 等[36]通过缀合的方式在血小板膜上偶联RGD 肽得到RGD-PM,然后通过孵育法将黑色素纳米粒(melanin nanoparticles,MNPs)和DOX 共同负载于RGD-PM内。 该纳米递送系统的粒径为(85.92±6.28)nm,有利于肿瘤血管中的高渗透长滞留效应(enhanced permeability and retention effect,EPR),MNPs 和DOX 的负载量分别为(7.6±0.8)wt%和(32.7±1.9)wt%,包封效率分别为(70.6±5.9)wt%和(18.3±0.9)wt%。 通过RGD 肽和PLM 对肿瘤细胞和肿瘤血管的双重靶向能力,大大提高了纳米递送系统对肿瘤的靶向性,同时联合光热化学疗法,显著抑制了多药耐药乳腺癌的生长和转移。
2.3 血小板膜包裹纳米载体 自2011 年首次报道红细胞膜包裹纳米载体取得成功后,许多研究者开发了PLM 包裹纳米载体。 从新鲜血液中分离、纯化获得血小板,后经反复冻融或低渗涨破等方法制备PLM,通过静电吸附、超声或挤出等方法将纳米载体包裹在PLM 内[3]。 Zhao 等[37]采用纳米沉淀法制备负载阿加曲班的聚香草醇-草酸共聚物纳米颗粒,通过挤出的方式将纳米颗粒包裹在血小板膜内,当血小板膜蛋白与纳米颗粒质量比≥1 ∶2时,血小板膜能完全包覆纳米颗粒。 在小鼠劲动脉血栓模型中,利用血小板的血栓归巢特性能靶向血栓部位,通过抗氧化和抗血栓作用显著抑制受损颈动脉中的血栓形成,具有良好治疗效果和生物相容性,且不显示毒性。 Wu 等[38]采用乳化法制备了具有光热效应的聚吡咯(Polypyrrole,PPy)纳米颗粒,采用反复冻融法制备PLM,通过超声挤出的方式将纳米颗粒和DOX 包裹在PLM 内得到PLT-PPy-DOX。 该法不会破坏血小板特异性膜表面蛋白,因此保留了血小板优异的生物相容性和肿瘤靶向性,且体外可在室温下稳定保存15d。 血小板膜包裹纳米载体能同时将PLM 具有生物相容性及靶向性的优势与纳米载体的药物缓释功能、高渗透长滞留效应及增加药物稳定性的优势相结合,构建二者优点兼容的药物递送系统。 然而,该法也面临着如调控纳米载体的性质、选择合适的血小板膜和纳米载体的比例来优化药物递送系统的问题。
2.4 血小板衍生物药物递送载体 目前主要有2 种基于PEVs 的载药方式,一种是将药物预载进PLT 中,通过激活PLT 生成PEVs。 Kailashiya 等[39]先通过共同孵育的方式将DOX 负载进PLT 中,然后加入钙离子诱导PLT 产生包裹DOX 的PMPDox。 PMPDox 粒径大多在129~145 nm 间,在-80℃条件下能稳定保存34 d,DOX 含量为(2.3±0.7)μg·mL-1。 PMPDox 较游离Dox,较游离药物对白血病细胞靶向性更强、毒性更高、脱靶副作用更低。 该法操作简单,可快速获得大量能稳定保存的载药PMPs。 另一种是先将PEVs 分离,然后通过孵育、超声、电穿孔及挤压等方式将药物载入PEVs 中[40-42]。 Rao 等[43]通过反复冻融、离心和超声的方式制备了血小板膜来源的囊泡PLTVs,采用溶剂热法制备了Fe3O4磁性纳米颗粒(magnetic nanoparticles,MNs),并通过挤出的方式将MNs 包载进PLTVs 中获得PLT-MNs。 在人乳腺癌异种移植瘤裸鼠模型中,PLT-MNs 较MNs 有更高的肿瘤富集量和更低的肝脾蓄积量,且能增强肿瘤部位的磁共振成像和光热治疗,具有更优异的肿瘤疗效。 该法制备的PLTMNs 与PLT 有相似的膜蛋白、与MNs 具有相似的光热效应,同时具有肿瘤靶向能力、免疫逃逸能力、良好的水溶性及超顺磁性。 PEVs 在药物递送方面具有天然的优势,然而,PEVs在药物递送中发挥作用的具体有效成分及其生物学效应仍不清楚。
3 血小板及其膜仿生药物递送系统的研究进展
1970 年,Hebden 等[44]在进行大鼠注射长春花碱实验时,猜想PLT 能进行长春花碱等药物的运送,随后人们开始探索PLT 药物递送的应用。 1993 年,Rybak 等[45]首次尝试将超过15 种血小板膜糖蛋白与脂质体结合,制得血小板样脂质体,能使血小板减少模型的大鼠出血时间减少67%。2015 年,Hu 等[3]制备了包裹多西紫杉醇和万古霉素的血小板纳米颗粒,增强了冠状动脉狭窄大鼠和细菌感染小鼠的疗效。 2022 年,LI 等[46]制备了基于血小板外泌体和光热敏感脂质体的纳米颗粒,通过光热效应和化学动力级联协同治疗,显著提高了肿瘤靶向性和疗效。 目前,血小板药物递送系统可以融合其他生物细胞膜,联合光热、光动力疗法等其他手段,应用于肿瘤、心血管疾病等多种疾病的治疗。
3.1 用于肿瘤治疗 受血小板和肿瘤细胞间特异性的相互作用启发,越来越多的研究者利用血小板及其衍生药物递送系统开发了肿瘤治疗方法,能更显著的提高肿瘤疗效、抑制肿瘤复发转移及降低肿瘤治疗副作用[7]。 Li 等[47]制备了包载光热剂的纳米颗粒,并将其负载于血小板膜内得到SPNp,通过光热疗法引起肿瘤血管破裂,激活凝血级联反应,利用血小板的靶向性,招募更多的SPNp 富集在受损血管处,有利于二次光热疗法破坏肿瘤血管,能完全根除肿瘤,有效抑制肿瘤转移。 该法设计了1 种光驱动的自募集策略,证明了血管破坏疗法具有免疫治疗的作用,对血管破坏策略在肿瘤治疗中的应用提供了参考。 同样的,Han 等[48]采用乳化法制备了包裹光热剂吲哚菁绿(indocyanine green,ICG)的PLT-PLGA-ICG,使用连接剂将aPD-1 与PLT 偶联,利用光热疗法使ICG 对肿瘤组织热消融联合aPD-1 的抗肿瘤免疫反应发挥协同抗肿瘤作用。 PLT 对热消融后肿瘤组织和伤口部位的强靶向性,为抑制肿瘤的转移复发的联合治疗策略提供了参考。 Li 等[49]通过乳化法制备了负载化疗药索拉非尼和雷公藤甲素的脂质体,通过超声法将脂质体包裹在PLT-肝癌细胞杂化膜内,该递药系统较其他实验组在肝癌荷瘤小鼠的肿瘤部位富集量最多,能更有效的促进肿瘤凋亡、抑制肿瘤生长,且小鼠体重未出现显著变化。 引入杂化膜能使纳米递送系统具备源细胞的性质和功能,然而可能在一定程度上会阻碍药物的释放,同时,细胞间孵育比例的选择及孵育条件可能会影响细胞活力。
3.2 用于血管内皮损伤和血栓的治疗 基于血小板天然的受损血管靶向性与血栓靶向性,能避免将靶向基团和溶栓药物连接的挑战,较现有的分子靶向溶栓药物或基于红细胞的溶栓疗法更具优势[50-51],已被广泛研究应用于损伤血管和血栓的治疗,以期实现更高的药物靶向递送和更低的脱靶副作用[52-54]。 Wang 等[55]开发了血小板膜包被负载溶栓药物蚓激酶的聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA],在小鼠颈动脉模型中,较游离蚓激酶对血栓有更高的靶向性及更优异的溶栓效果,且对凝血系统副作用更小,降低出血风险。 表明基于血小板的纳米药物递送系统为损伤的血管治疗及抗血栓的治疗提供了一种很有前景的手段,能有效将药物递送至靶部位,并延长其体内循环时间。Song 等[56]制备了血小板膜包裹的负载抗AS 药物雷帕霉素的纳米颗粒(plateletmembrane-coatednanoparticles,PNP),PNP 优先聚集在AS 病变部位,而不在正常动脉中积聚,表明PNP 能有效靶向AS 斑块,能显著延缓小鼠AS 的进展。 血小板膜包裹纳米颗粒不仅能有效靶向AS 斑块部位,还能靶向动脉中易发展成AS 斑块的部位,在AS 的诊断及治疗中有重要作用。 同样的,Wei 等[57]利用血小板与动脉粥样硬化(atherosclerosis,AS)斑块中活化的内皮细胞及胶原蛋白等的相互作用,将纳米载体包载进血小板膜中应用于AS 成像,该仿生纳米系统能有效定位于AS 斑块,提供AS 成像,该法也为各种成像模式提供了参考。 Xu 等[58]采用共同孵育的方式在血小板膜表面偶联了rt-PA 得到PNP-PA,在肺栓塞和脑缺血小鼠模型中,PNP-PA 能广泛靶向血栓实现快速溶栓,显著提高小鼠存活率,降低出血等并发症的发生。 这是首次证明rt-PA 偶联在血小板膜上可以靶向广泛的血栓,实现快速溶栓。 这种基于血小板的递药方式较现有的分子靶向溶栓药物或纳米疗法,能天然识别靶向血栓部位,延长药物半衰期,具有良好的体内药物代谢动力学特性,有可能彻底改变抗血栓药物的传统给药途径。
3.3 用于病原体治疗 病原体表面的蛋白能与PLT 上的受体特异性结合或通过血浆蛋白间接结合,而后引起PLT 活化聚集[1,59],PLT 作为机体重要的免疫调节细胞同时也参与病原体的清除,为血小板药物递送系统应用于抗病原体感染提供了条件,越来越多基于血小板的药物递送系统应用于病原体治疗中[3,60]。 如Hu 等[3]通过融合法将负载万古霉素的PLGA 包裹进血小板膜内,在小鼠全身细菌感染模型中,与单纯NPs 和红细胞膜包覆的RBCNPs 相比,表现出更高的疗效。 受金黄色葡萄球菌与血小板间的相互作用启发[61],Ying等[62]通过共同孵育的方式将万古霉素(Vancomycin,Vanc)直接负载于血小板膜内得到Vanc-PLT,在小鼠耐甲氧西林金黄色葡萄球菌感染模型中,Vanc-PLT 较游离Vanc 和红细胞膜负载的Vanc 有更强的疗效和更低的脱靶毒性。 利用血小板膜与病原体间的特异性相互作用,能实现更精准的病原体治疗,在多药耐药病原体的治疗中发挥重要作用。
4 展望
随着对PLT 理化性质和生理功能的深入研究,基于血小板的药物递送系统的优势日渐显现。 PLT 作为血液循环中的固有成分,容易从血液中获取且具有良好的生物相容性,PLT 活化后收缩形变易于引发药物释放。 同时,PLT 具有如肿瘤靶向性及损伤血管靶向性等优异的靶向功能。 PLT 相关的药物递送系统研究越来越多,PLM 和其他细胞膜融合递药系统的研究也层出不穷,加上近年来利用酶、剪切应力、光、热、磁或超声等刺激触发药物释放与血小板药物递送相结合等取得了很多突破,都为基于PLT 的药物递送系统提供了许多新的策略。
然而,PLT 的保存时间和保存条件相对有限,同种异体来源PLT 可能存在病原体传播等风险。 同时,PLT 在循环中易活化可能会导致药物的提前释放,如何精准有效调控使PLT 在到达靶部位后进行药物释放也是亟待解决的问题之一。 相信在不久的将来,随着基于PLT 等细胞的药物递送系统的不断研发,PLT 药物递送系统也会取得更多的成就,为临床疾病的治疗提供更多选择。
利益冲突:所有作者均声明不存在利益冲突。
