柚皮苷对糖尿病大鼠心肌缺血再灌注损伤的保护作用
2023-11-25张侃迪张俊峰
杨 丽,张侃迪,张俊峰
心血管疾病是全球死亡的主要原因,2017年导致1 700多万人死亡,其中冠心病是常见的死亡原因。在我国,冠心病是人类死亡的主要威胁,与西方国家冠心病发病率相比,我国的发病率较低[1]。然而,由于庞大的人口基数,2016年我国报告的冠心病病例约为2 300万例。糖尿病是一种以血糖、血脂显著升高为特征的糖脂代谢紊乱,心血管疾病并糖尿病病人更容易受到心血管疾病的影响。此外,糖尿病病人的心血管病死亡率明显高于非糖尿病病人,为2~3倍[2]。糖尿病病人心脏结构和功能异常,易受心肌缺血再灌注损伤(ischemia-reperfusion injury,IRI)的影响[3]。在心肌缺血再灌注损伤中,尽管血流再灌注恢复,但缺血心脏损伤不可逆,这种损伤往往引起心肌细胞的坏死和凋亡,线粒体功能障碍,从而导致长期预后不良,甚至死亡[4];有证据表明,糖尿病心脏表现出对心脏保护治疗的抵抗[5],因此,与非糖尿病病人相比,糖尿病可使心肌IRI加重。然而,目前缺乏针对糖尿病病人心肌IRI的有效治疗。柚皮苷(Naringin,Nar)主要是从柚子和橙子中提取的一种天然类黄酮苷[6]。研究发现其能够通过抗氧化、抑制细胞凋亡等机制对心肌缺血再灌注有抑制作用[7]。柚皮苷对心肌IRI的作用可见报道[8-9],而关于柚皮苷对糖尿病心肌缺血再灌注的研究报道较少。本研究旨在研究柚皮苷对糖尿病大鼠心肌IRI氧化应激和凋亡的影响,并探讨其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
雄性SD大鼠24只,体质量200~250 g,购于上海杰思捷实验动物有限公司,生产许可证号:SCXK(沪)2018-0004。饲养于上海市第九人民医院动物房,本研究经本院动物伦理委员会批准。
1.1.2 试剂与仪器
柚皮苷购自上海同田生物技术有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购于上海碧云天生物科技有限公司;原位末端标记测定法(TUNEL)试剂盒和蛋白酶K购自Servicebio公司;二氨基联苯胺(DAB)显色剂购自DAKO。鼠抗B细胞淋巴瘤/白血病2(Bcl-2)、Bax单克隆抗体购自Santa公司;Bcl-2、Bax兔抗鼠二抗购自Santa公司;蛋白酶K购自Roche公司;脱水机(武汉俊杰电子有限公司);病理切片机(上海徕卡仪器有限公司);烤箱(上海福玛实验仪器有限公司);涡旋混合器(Servicebio);显微镜(CIC)。
1.2 方法
1.2.1 糖尿病大鼠模型的构建
糖尿病模型制备方法:SD大鼠禁食12 h,经腹腔注射链脲佐菌素(STZ)60 mg/kg。每日上午抽取禁食12 h的SD大鼠尾静脉血进行血糖检测,直到血糖持续7 d高于16.7 mmol/L,表明糖尿病大鼠模型成功建立。糖尿病鼠自由饮水,单笼普食饲养,饲养2周后制备心肌IRI模型。
1.2.2 大鼠心肌IRI模型
参照文献[7]建立大鼠心肌IRI模型。大鼠腹腔注射1%戊巴比妥钠(30 mg/kg)麻醉。随后在左侧第3肋与第4肋间隙行开胸和心包切开术。在左心耳下方1~2 mm处,用5-0丝线在左冠状动脉前降支下穿线,将缝线两端穿过硅胶管,左前降支(LAD)阻断30 min,再灌注3 h。模型成功的标准:结扎线以下心肌组织发绀,再灌注后心肌局部反应性充血。
1.2.3 动物分组
将24只大鼠随机分为对照组(control组)、糖尿病缺血再灌注损伤组(D-IRI组)、柚皮苷低剂量+糖尿病缺血再灌注损伤组(L-Nar+D-IRI组)、柚皮苷高剂量+糖尿病缺血再灌注损伤组(H-Nar+D-IRI组),每组6只。除control组,其余各组按上述方法制备大鼠糖尿病心肌IRI模型。参照文献[7]方法制备,L-Nar+D-IRI组再灌注结束后应用柚皮苷10 mg/(kg·d)灌胃干预1周;H-Nar+D-IRI组再灌注结束后应用柚皮苷100 mg/(kg·d)灌胃干预1周,control组和D-IRI组使用等量生理盐水。
1.2.4 样本采集
1周后,处死大鼠,取左心室。将大鼠左心室分为5部分,一部分心肌组织用于SOD和MDA的检测;一部分行HE染色;一部分心肌行氯化三苯基四氮唑(TTC)染色,剩余的两部分心肌组织迅速放于液氮中,之后放于-80 ℃冰箱中保存,行心肌TUNEL检测及蛋白质免疫印迹法(Western Blot)检测。
1.2.5 氧化应激指标检测
取一部分左心室心肌组织,应用预冷的生理盐水制成10%的匀浆液,4 ℃离心,取上清液,参照SOD和MDA试剂盒的说明书,对大鼠左心室心肌组织进行检测。
1.2.6 心肌梗死面积计算
将左心室组织,一次切薄片2片,每片厚度是3~4 mm,放入1%TTC中。随后37 ℃恒温箱20 min,使用纯化水充分冲洗。左心室梗死区的颜色呈现灰白色。Image J测量并统计梗死心肌的面积与全部左心室面积的百分比,取平均值。
1.2.7 HE染色观察大鼠心肌组织病理变化
心肌组织经过梯度乙醇脱水,之后应用石蜡包埋,切片(5 μm),最后应用HE染色。
1.2.8 Western Blot检测Bcl-2、Bax
将左心室组织行匀浆、高速离心,测定并且调整蛋白的浓度,103 ℃金属浴5 min,每孔上样20 μL,电泳,转膜,本实验为半干式转膜,25 V转膜30 min。5%牛血清白蛋白(BSA)室温环境下进行封闭1 h。稀释的相应一抗4 ℃孵育过夜。应用TBST洗膜3次,每次5 min。随后稀释过氧化物酶(HRP)标记的二抗,比例为1∶5 000。37 ℃温度下,与膜孵育1 h。加增强型化学发光(ECL)发光液,避光5 min。最后在暗室环境下使用X胶片进行感光、显影、定影。
1.2.9 TUNEL法检测大鼠心肌组织细胞凋亡
取出保存在-80 ℃冰箱中的大鼠心肌组织行TUNEL检测,方法按照TUNEL试剂盒说明书进行。每个标本取8个高倍镜(×400)视野内,计算凋亡细胞数与所有细胞的百分比。设2名观察者,分别进行读片,计算平均值。
1.3 统计学处理
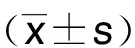
2 结 果
2.1 各组心肌组织中氧化应激指标比较
control组心肌组织SOD值最高,为(142.60±9.29)U/mg;D-IRI组心肌组织SOD最低,为(80.44±4.55)U/mg,低于control组(P<0.05);L-Nar+D-IRI组心肌组织SOD为(92.18±2.65)U/mg,高于D-IRI组(P<0.05);H-Nar+D-IRI心肌组织SOD为(119.80±6.98)U/mg,高于L-Nar+D-IRI组(P<0.05)。control组心肌组织MDA最低,为(3.43±0.57)nmol/mg,D-IRI组心肌组织MDA最高,为(7.88±0.69)nmol/mg,高于control组(P<0.05);L-Nar+D-IRI组心肌组织MDA为(6.72±0.65)nmol/mg,低于D-IRI组(P<0.05);H-Nar+D-IRI组心肌组织MDA为(5.41±0.64)nmol/mg,低于L-Nar+D-IRI组(P<0.05)。详见表1及图1、图2。

图1 各组大鼠心肌组织SOD水平柱状图
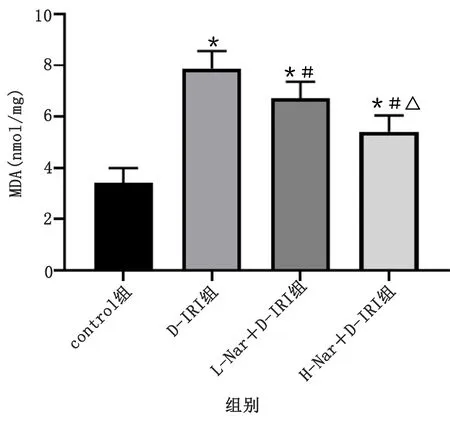
图2 各组大鼠心肌组织MDA水平柱状图

表1 各组大鼠心肌组织SOD、MDA及心肌梗死变化
2.2 各组大鼠心肌梗死面积比较
D-IRI组、L-Nar+D-IRI组及H-Nar+D-IRI组均可见心肌梗死组织,其中D-IRI组梗死面积最大,H-Nar+D-IRI组梗死面积最小,差异有统计学意义(P<0.05)。详见表1及图3、图4。

图3 TTC染色观察各组大鼠心肌组织梗死变化

图4 各组大鼠心肌梗死面积柱状图
2.3 各组大鼠心肌组织的病理变化
control组心肌细胞排列规则,肌丝完整,细胞间隙紧密、均匀。D-IRI组心肌组织水肿明显,排列不规则,肌丝不完整,细胞间隙增大,不均匀。L-Nar+D-IRI组心肌组织水肿,排列尚规则,肌丝尚完整,细胞间隙增大,不均匀,较D-IRI组轻。H-Nar+D-IRI组心肌组织稍水肿,排列规则,肌丝尚完整,细胞间隙增大,尚均匀,较L-Nar+D-IRI组轻。详见图5。

图5 各组大鼠心肌组织损伤情况(HE染色,×200)
2.4 各组大鼠心肌组织Bax、Bcl-2的变化比较
各组大鼠心肌组织均可见Bcl-2和Bax蛋白表达,D-IRI组Bax蛋白表达最高,L-Nar+D-IRI其次,高于H-Nar+D-IRI组,差异有统计学意义(P<0.05)。D-IRI组Bcl-2表达最低,L-Nar+D-IRI其次,H-Nar+D-IRI组Bcl-2表达高于L-Nar+ D-IRI组,差异有统计学意义(P<0.05)。详见表2、图6。

图6 各组大鼠心肌Bax、Bcl-2蛋白表达的变化

表2 各组大鼠心肌组织Bax、Bcl-2的变化比较
2.5 各组大鼠心肌组织细胞凋亡变化
TUNEL染色阳性细胞表现为细胞核被染成棕黄色。control组心肌细胞凋亡率为(7.54±1.43)%,D-IRI组心肌细胞凋亡率为(34.88±4.89)%,高于control组(P<0.05)。L-Nar+D-IRI组心肌细胞凋亡率为(28.55±3.06)%,低于D-IRI组(P<0.05)。H-Nar+D-IRI组心肌细胞凋亡率为(19.34±3.12)%,低于L-Nar+D-IRI组(P<0.05)。详见图7、图8。

图7 TUNEL检测各组大鼠心肌组织细胞凋亡的变化(箭头所指为凋亡细胞,×400)

图8 各组大鼠心肌组织凋亡率比较
3 讨 论
持续高血糖不仅能诱发心血管缺血损伤,而且会加重该损伤。因此,寻找新的干预措施,减少糖尿病状态下心脏IRI具有重要的临床和现实意义。本研究建立糖尿病大鼠心肌IRI手术模型,应用柚皮苷可通过降低氧化应激和细胞凋亡改善糖尿病大鼠心肌IRI。
心肌IRI是多因素共同作用的结果,其中氧化应激是细胞损伤的主导和直接驱动因素之一[10]。在氧化应激过程中,可以观察到自由基和活性氧(ROS)之间的失衡,并对机体造成不利影响。柚皮苷具有抗氧化的作用[11]。应用柚皮苷治疗后降低了糖尿病大鼠心肌IRI氧化应激因子MDA的表达,在心肌IRI中,氧自由基的产生是直接原因。这是因为氧自由基可破坏心肌细胞膜,使心肌细胞的结构发生破坏,从而产生脂质过氧化物。MDA可作为反映氧自由基含量和脂质过氧化的主要指标,SOD是机体抵抗脂质过氧化能力的重要指标。本研究结果显示,柚皮苷治疗可降低糖尿病大鼠IRI心肌组织的MDA水平,提高SOD水平,从而改善心肌损伤。Rajadurai等[12]证明柚皮苷通过增加心肌的抗氧化能力抑制心肌梗死。Li等[13]也报道了类似的结果,发现柚皮苷可以通过磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)通路抑制肿瘤坏死因子-α(TNF-α)诱导的氧化应激。Sun等[14]发现PI3K/AKT信号通路可激活内皮型一氧化氮合酶通路,增强心肌细胞抗IRI的抗氧化能力。以上结果与本研究结果一致。
凋亡,也被称为程序性细胞死亡,是一种活性基因调控的细胞死亡形式。细胞凋亡是引起心肌损伤的重要因素,决定心肌梗死面积,促进心肌重构[15],细胞凋亡可引起心肌收缩功能的降低,从而导致心泵功能下降[16],凋亡是心肌IRI的一个重要因素[17]。心肌恢复血液灌注后可使心肌细胞凋亡加重,因此,降低细胞凋亡可减轻IRI引起的心肌损伤,减少心肌梗死,抑制心肌梗死的发生。研究表明,心肌细胞凋亡是IRI病理生理过程中的关键部分[18]。糖尿病心肌IRI常发生细胞凋亡。Rani等[19]研究表明,柚皮苷通过上调Bcl-2的表达,下调Bax的表达,降低了TUNEL的阳性表达,减轻心肌IRI。本研究结果表明,表明柚皮苷治疗可降低缺血再灌注后糖尿病大鼠心肌组织中Bax的表达,增加Bcl-2的表达,表明柚皮苷治疗对缺血再灌注下糖尿病心肌细胞凋亡有抑制作用,从而对心肌组织发挥保护作用,与上述研究结果一致。
本研究应用糖尿病大鼠心肌IRI模型,柚皮苷通过抗氧化应激和抗凋亡改善糖尿病大鼠心肌梗死面积,从而发挥心肌保护作用,有望为临床应用柚皮苷治疗心肌IRI提供一定的实验基础。
