菠萝不同品种对低温胁迫响应差异的生理代谢机制
2023-11-23刘传和贺涵何秀古陈鑫刘开邵雪花赖多秦健庄庆礼匡石滋肖维强
刘传和 贺涵 何秀古 陈鑫 刘开 邵雪花 赖多 秦健庄庆礼 匡石滋 肖维强
(1. 广东省农业科学院果树研究所 农业农村部南亚热带果树生物学与遗传资源利用重点实验室 广东省热带亚热带果树研究重点实验室,广州 510640;2. 广东省农业科学院,广州 510640)
低温是限制植物生产力和地域分布的主要因素。骤冷或持续低温常造成植物细胞膜结构和功能损伤,破坏植物正常的生长与生理生化代谢过程,显著降低植物存活率[1]。低温胁迫下,植物体中的活性氧含量显著上升,并与质膜上的不饱和脂肪酸反应,产生丙二醛,引起膜脂发生相变,细胞膜透性增大,导致电解质泄漏[2-3];叶绿素合成受阻,光合速率下降[4]。植物体内的可溶性蛋白、可溶性糖、脯氨酸等渗透物质,以及内源激素、抗氧化酶因低温胁迫而发生变化[5-6]。
能否安全越冬是南方果树种植地选择时应着重考虑的问题。果树受低温危害后,轻则造成树干枝叶枯萎、减产,严重时导致树体死亡,给生产造成重大损失[7]。菠萝[Ananas comosus(L.)Merr.]属凤梨科(Bromeliaceae)凤梨属(Ananas)多年生草本果树,是著名的热带水果。冬季的平均温度是限制菠萝种植区域的决定性因素。当温度低至5℃时,菠萝叶片表现出明显的低温伤害症状,脯氨酸和可溶性蛋白含量及细胞膜相对透性均增加[8]。在我国广东、广西、福建等菠萝产区常因低温寒害而造成果实生长发育不良甚至绝收[9]。培育并种植抗寒新品种可有效地减轻或避免寒害对菠萝的不利影响,保障我国菠萝产业健康发展。不同品种菠萝的耐寒性存在明显差异[9],‘金菠萝’和‘无刺卡因’耐寒性较强,‘巴厘’和‘黄金菠萝’耐寒性相对较弱[10]。有关不同品种菠萝对低温胁迫响应差异的机理主要从叶绿素含量、荧光特性,脯氨酸、可溶性蛋白、可溶性糖等方面进行了研究[8,10]。通过转录组、代谢组学技术比较了不同品种菠萝差异表达基因与差异代谢物[11]。
生产中,‘粤甜’菠萝的耐寒性明显好于‘巴厘’等主栽品种。为较好地了解‘粤甜’菠萝的品种特性,扩大‘粤甜’菠萝在生产中的推广应用,本研究比较分析了常温下及低温处理后‘粤甜’‘巴厘’菠萝生理、代谢及部分基因相对表达量等的变化差异,以期了解‘粤甜’菠萝耐寒性状形成的生理代谢机制,为菠萝抗寒新品种的选育及耐寒基因、代谢物挖掘相关研究提供参考。
1 材料与方法
1.1 材料
本试验所用材料为‘粤甜’和‘巴厘’菠萝品种的盆栽植株,每盆种植一棵菠萝苗,盆栽所用土壤取自广东省农业科学院果树研究所内未耕作土壤。2021年,盆栽植株长至约40 cm高时,选择长势一致的2个品种植株各18盆(共36盆)进行试验处理。试验设2个处理,即低温(LT)和常温(NT)。低温和常温处理分别指将盆栽菠萝植株置于5℃和25℃的人工培养箱中(培养箱内不开灯)进行处理,时长为48 h,保持相对湿度70%。每个品种、每个温度处理各9盆(每3盆为1次重复,每个处理重复3次)。处理结束后,每棵选取3片中部叶片,摘取叶片中间部位5 cm长段作为取样部位,同一重复内的3盆植株上取的样混合,用于试验测定。本研究中,试验测定均为3次生物学重复。
1.2 方法
1.2.1 生理指标测定 可溶性蛋白用考马斯亮蓝法检测,可溶性糖采用蒽酮比色法检测,丙二醛采用硫代巴比妥酸法检测,脯氨酸采用茚三酮比色法检测,POD(过氧化物酶)、SOD(超氧化物歧化酶)和CAT(过氧化氢酶)活性分别采用愈创木酚氧化法、氮蓝四唑(NBT)光化还原法和过氧化氢氧化法测定[12]。
1.2.2 基因相对表达量分析 POD、SOD、CAT、ProDH(脯氨酸脱氢酶)基因(单拷贝)相对表达量分析,用诺唯赞公司试剂盒提取RNA,反转录采用反转录试剂PrimeScriptTMRT Master Mix(Perfect Real Time)(TaKaRa公司);TB Green Premix Ex Taq II(Tli RNaseH Plus)(Code No. RR820A)进行RT‑PCR反应,所用引物序列见表1(由上海生工生物工程有限公司合成)。采用2-△Ct方法计算相对表达量,△Ct目的基因=Ct目的基因-CtActin。
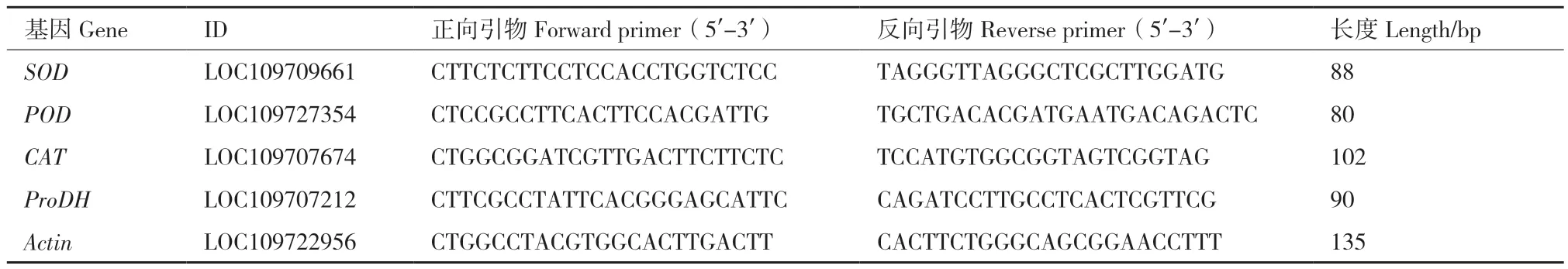
表1 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
1.2.3 内源激素测定 基于LC‑MS/MS平台进行植物激素分析[13-15],绝对定量测定生长素、赤霉素、细胞分裂素、脱落酸、1‑氨基环丙烷羧酸(ACC)、茉莉酸、水杨酸、独角金内酯含量。
1.2.4 代谢物提取与差异分析 样品真空冷冻干燥后研磨至粉末并称取100 mg,溶解于1.2 mL 70%甲醇提取液中,每30 min涡旋一次,每次持续30 s,共涡旋6次,4℃冰箱过夜;离心(转速12 000 r/min,10 min)后,吸取上清,用微孔滤膜(0.22 μm pore size)过滤,保存于进样瓶中,用于UPLC‑MS/MS分析[16]。基于UPLC‑MS/MS检测平台、武汉迈特维尔生物科技有限公司自建数据库以及多元统计分析对代谢组进行分析。按差异倍数、t检验的P值和OPLS‑DA模型变量投影重要度值(variable importance in the projection,VIP)相结合的方法筛选差异代谢物,筛选标准为Fold Change>2或Fold Change<0.5,P‑value<0.05和VIP>1。进行KEGG代谢通路富集分析。
2 结果
2.1 不同品种低温处理后生理指标变化
表2所述为常温及低温处理后‘粤甜’与‘巴厘’菠萝的生理指标。与常温相比,低温处理后‘粤甜’的可溶性蛋白含量显著升高,而‘巴厘’显著降低,相比较‘粤甜’比‘巴厘’高39.47%,差异显著。可溶性糖含量在低温处理后均降低,其中‘巴厘’显著降低,相比较‘粤甜’比‘巴厘’高20.85%,差异显著。低温处理后‘粤甜’‘巴厘’的脯氨酸含量均显著升高,‘粤甜’比‘巴厘’高83.93%,差异显著。低温处理后,‘粤甜’的丙二醛含量显著降低,‘巴厘’显著升高,相比较‘粤甜’比‘巴厘’低70.36%,差异显著。

表2 不同品种低温处理后菠萝叶片生理指标的变化Table 2 Changes in physiological indexes between two different pineapple cultivars after low temperature treatment
低温处理后‘粤甜’的POD酶活性升高,‘巴厘’降低,相比较‘粤甜’比‘巴厘’高1.00倍,差异显著。‘粤甜’‘巴厘’的SOD、CAT酶活性均在低温处理后显著升高,但‘粤甜’的SOD、CAT酶活性均显著高于‘巴厘’。
2.2 不同品种低温处理后基因相对表达量变化
图1所示为常温及低温处理后‘粤甜’‘巴厘’菠萝POD、SOD、CAT与ProDH基因相对表达量变化。与常温相比,低温处理后‘粤甜’的POD基因相对表达量提高了4.65倍,‘巴厘’略降低;‘粤甜’比‘巴厘’高1.55倍,差异显著。
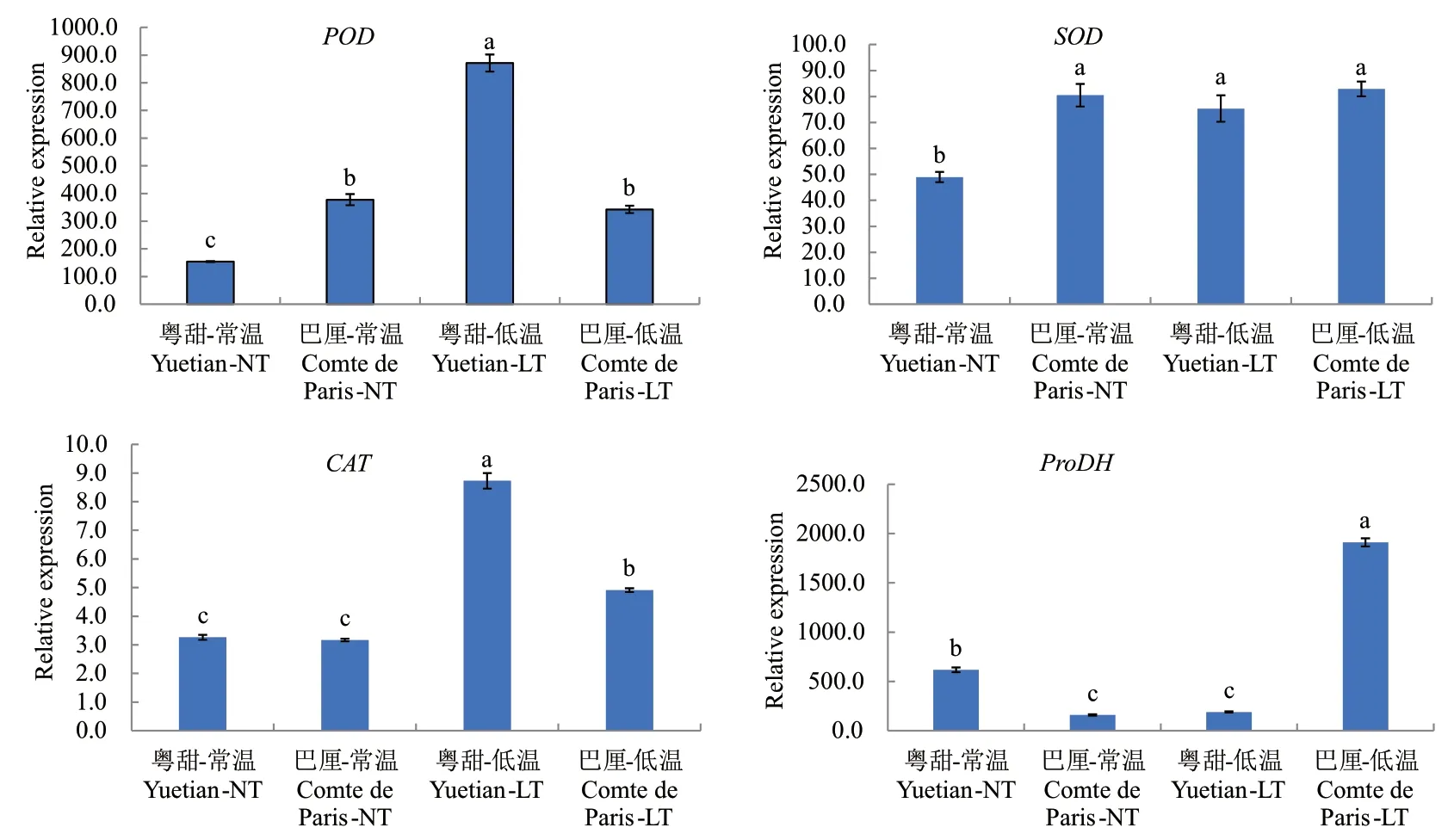
图1 不同品种低温处理后POD、SOD、CAT、ProDH基因相对表达量变化Fig. 1 Changes in the expressions of POD, SOD, CAT and ProDH genes in two different cultivars after low temperature treatment
低温处理后,‘粤甜’‘巴厘’菠萝的SOD、CAT基因相对表达量均升高,‘粤甜’的SOD基因表达比‘巴厘’略低,而CAT基因表达比‘巴厘’高77.73%(差异显著)。低温处理后‘粤甜’的ProDH基因相对表达量降低了69.00%,‘巴厘’提高了11.07倍,‘巴厘’比‘粤甜’高9.09倍,差异显著。
2.3 不同品种低温处理后内源激素含量变化
表3所列为常温及低温处理后‘粤甜’‘巴厘’内源激素含量。低温处理后:‘粤甜’的色胺、L‑色氨酸含量升高,其中色胺显著升高,‘巴厘’的均略降低;‘粤甜’的色胺、L‑色氨酸含量分别比‘巴厘’高7.14倍和83.22%,差异显著;‘粤甜’的吲哚‑3‑乙酸甲酯、吲哚‑3‑甲醛、吲哚‑3‑甲酸及吲哚乙酸-缬氨酸甲酯含量升高,而‘巴厘’的降低;‘粤甜’的吲哚‑3‑乙酸甲酯、吲哚‑3‑甲酸含量均显著高于‘巴厘’;‘粤甜’‘巴厘’的吲哚乙酸-天冬氨酸含量均高于常温,且‘粤甜’显著高于‘巴厘’;‘粤甜’‘巴厘’的GA19含量均降低,但‘粤甜’的GA19含量显著低于‘巴厘’;‘粤甜’的2‑甲硫基顺式玉米素核苷、异戊烯腺嘌呤核苷、双氢玉米素‑7‑糖苷、6‑苄氨基嘌呤含量均升高,‘巴厘’的降低或无明显变化;‘粤甜’的2‑甲硫基顺式玉米素核苷、异戊烯腺嘌呤核苷显著高于‘巴厘’。
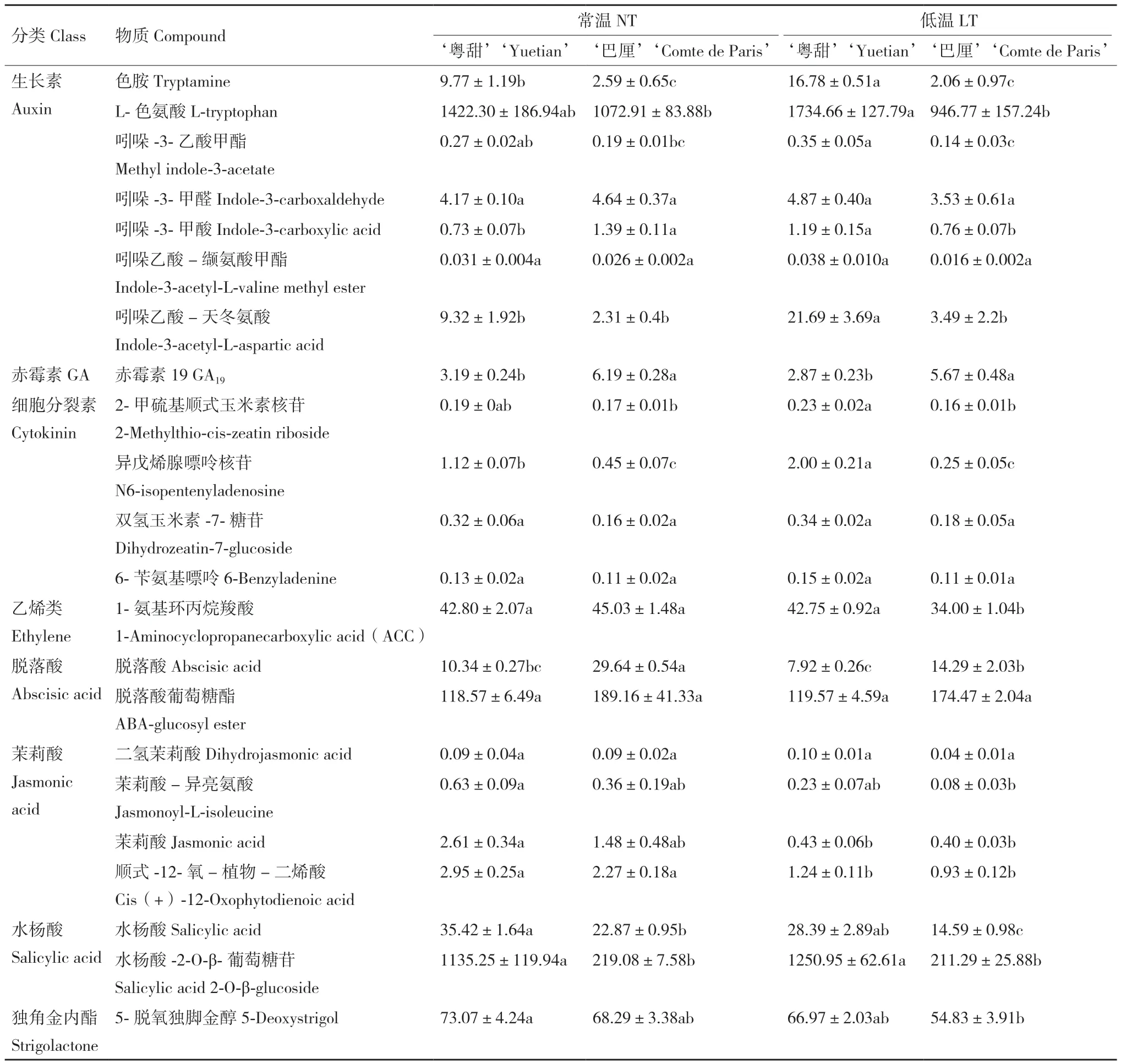
表3 不同品种低温处理后内源激素含量的变化Table 3 Changes of endogenous hormone contents between two different pineapple cultivars after low temperature treatment/(ng·g-1)
低温处理后:‘粤甜’‘巴厘’的ACC含量均降低,相比较,‘粤甜’显著高于‘巴厘’;‘粤甜’‘巴厘’的脱落酸含量均降低,其中‘巴厘’显著降低,‘粤甜’显著低于‘巴厘’;‘粤甜’‘巴厘’的脱落酸葡萄糖酯含量均与常温差异不显著,除顺式‑12‑氧-植物-二烯酸含量显著降低外,低温对‘粤甜’‘巴厘’的茉莉酸类激素含量无显著影响,且‘粤甜’‘巴厘’间无显著差异;‘粤甜’‘巴厘’的水杨酸含量均降低,相比较‘粤甜’显著高于‘巴厘’。‘粤甜’的水杨酸‑2‑O-β-葡萄糖苷含量升高而‘巴厘’的降低,但均不显著,相比较‘粤甜’显著高于‘巴厘’;‘粤甜’‘巴厘’的5‑脱氧独脚金醇含量均降低,但相比较‘粤甜’中的含量高于‘巴厘’。
2.4 不同品种低温处理后的差异代谢物
2.4.1 样品PCA判别分析 PCA结果如图2所示,主成分1解释度为41.5%,主成分2解释度为17.68%,说明该模型可以较好的将样品划分为粤甜-常温、粤甜-低温、巴厘-常温、巴厘-低温共4个组。4个组间离散程度较高,代谢差异明显,且品种间的差异大于温度处理的差异。
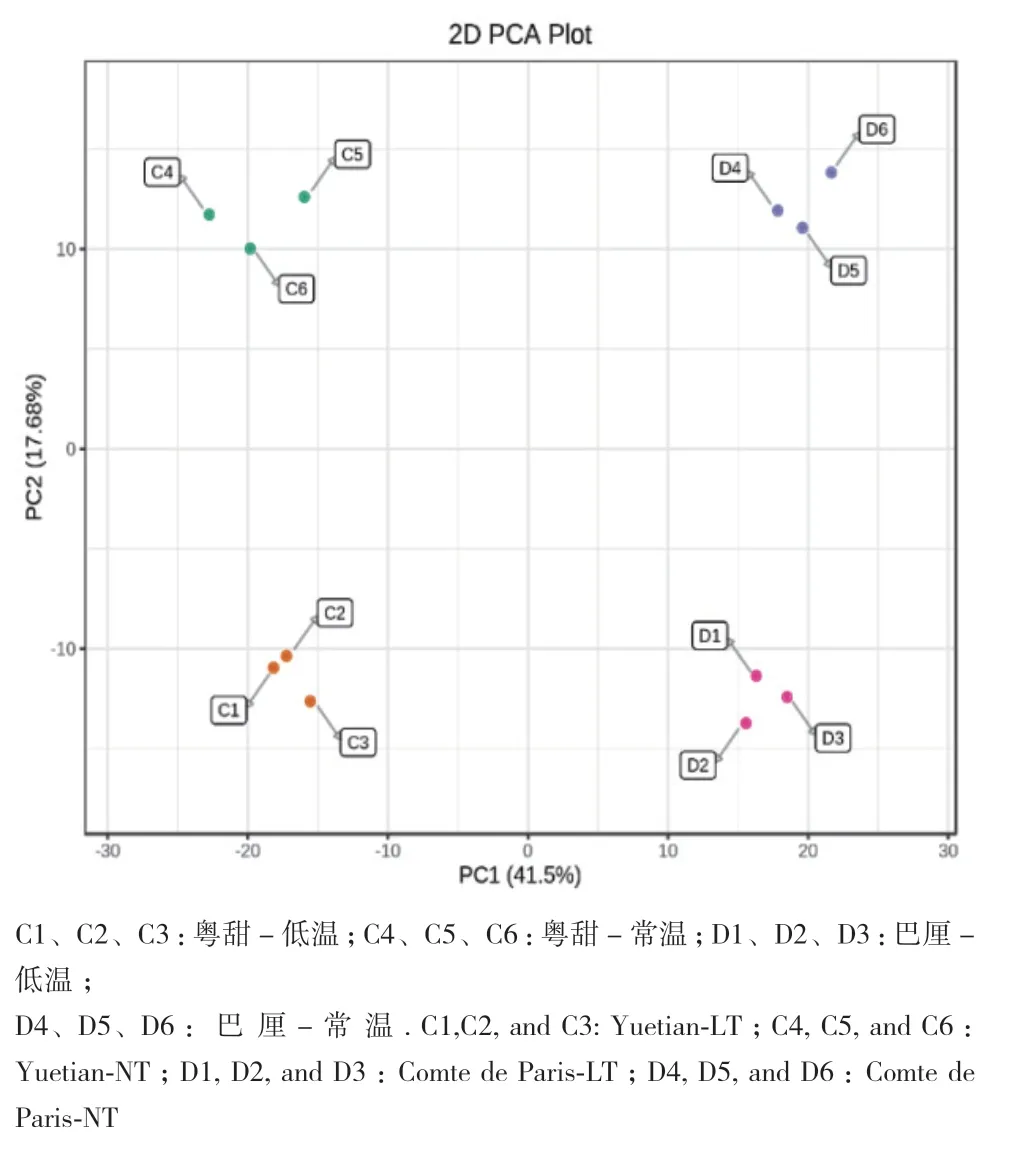
图2 ‘粤甜’‘巴厘’菠萝品种常温及低温处理样品 PCA分析Fig. 2 PCA analysis of the samples of the two cultivars‘Yuetian’ and ‘Comte de Paris’ under normal and low temperatures
2.4.2 ‘粤甜’与‘巴厘’菠萝间差异代谢物组成 常温下,‘粤甜’与‘巴厘’间共检测出差异代谢物226个。包括黄酮122个、氨基酸及其衍生物9个、酚酸类38个、核苷酸及其衍生物7个、木脂素和香豆素8个、生物碱7个、有机酸8个、脂质21个、萜类2个以及其他4个(图3)。其中最多的是黄酮类代谢物。
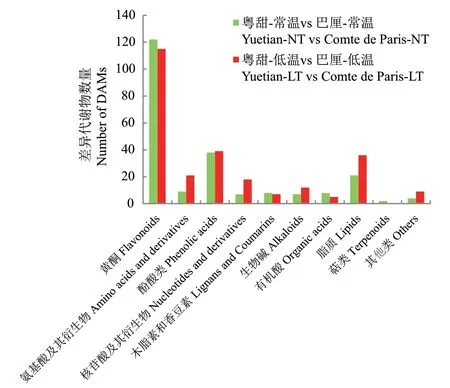
图3 常温及低温处理后‘粤甜’与‘巴厘’菠萝间的差异代谢物组成Fig. 3 Differential metabolite profiling between Yuetian and Comte de Paris under normal and low temperature
低温处理后,‘粤甜’与‘巴厘’菠萝间共检测出差异代谢物262个。包括黄酮115个、氨基酸及其衍生物21个、酚酸类39个、核苷酸及其衍生物18个、木脂素和香豆素7个、生物碱12个、有机酸5个、脂质36个以及其他9个(图3)。其中最多的是黄酮类代谢物。
2.4.3 ‘粤甜’与‘巴厘’菠萝间差异代谢物通路富集 KEGG代谢通路富集分析显示,常温下‘粤甜’与‘巴厘’间差异代谢物显著富集到46条代谢通路中,其中主要富集在次生代谢物生物合成,类黄酮生物合成,黄酮与黄酮醇生物合成,二苯乙烯类、二芳基庚烷类与姜辣素生物合成,以及苯丙烷类生物合成等5条通路中(图4‑A)。低温处理后,‘粤甜’与‘巴厘’间差异代谢物显著富集到56条代谢通路中,其中主要富集在次生代谢物生物合成,类黄酮生物合成,黄酮与黄酮醇生物合成,嘌呤代谢,以及嘧啶代谢等5条通路中(图4‑B)。
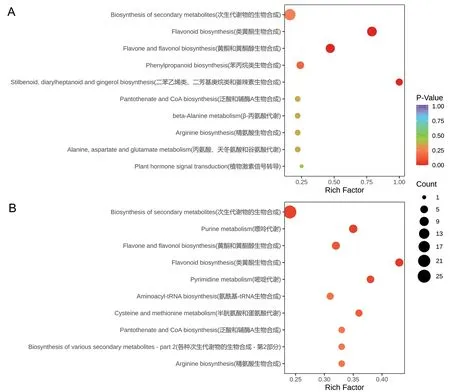
图4 常温(A)及低温处理后(B)‘粤甜’与‘巴厘’间差异代谢物KEGG代谢通路富集Fig. 4 Differential metabolites KEGG pathways enrichment between ‘Yuetian’ and ‘Comte de Paris’ under normal temperature(A)and after low temperature treatment(B)
2.4.4 低温处理后‘粤甜’与‘巴厘’间关键差异代谢物筛选 图5所示为筛选出的110个低温处理诱导的‘粤甜’与‘巴厘’间关键差异代谢物,包括黄酮27个、氨基酸及其衍生物13个、酚酸15个、核苷酸及其衍生物16个、香豆素2个、生物碱7个、有机酸2个及脂质28个。在110个代谢物中,41个在常温下‘粤甜’‘巴厘’间存在显著差异,经低温处理后差异倍数增大;另外69个在常温下差异不显著,经低温处理后差异达到显著水平(相差2倍以上)。而且这些代谢物在‘粤甜’中的含量积累高于‘巴厘’。

图5 低温处理诱导的‘粤甜’与‘巴厘’菠萝间关键差异代谢物Fig. 5 Key DAMs between ‘Yuetian’ and ‘Comte de Paris’ after being induced by low temperature treatment
其中,黄酮类代谢物中的苜蓿素‑7‑O‑芸香糖苷、苜蓿素‑7‑O‑新橙皮糖苷、香叶木苷和3,5,7,3′4′‑五甲氧基黄酮,氨基酸及其衍生物类中的N‑乙酰‑L‑酪氨酸,酚酸类代谢物中的芥子酰葡萄糖醛酸,核苷酸及其衍生物中的2′‑脱氧胞苷‑5′‑单磷酸、黄嘌呤,木脂素和香豆素类代谢物中的伞形酮,生物碱类代谢物中的咖啡酰胆碱,有机酸类代谢物中的3‑脲基丙酸,以及脂质类代谢物中的油酸酰胺(9‑十八碳烯酰胺)、1‑亚油酰甘油酯‑3‑O‑葡萄糖苷,在‘粤甜’与‘巴厘’中的积累差异倍数相对较大。
3 讨论
3.1 低温与植物抗氧化活性
植物的抗逆性是受多种因素影响的复杂的数量性状,不仅表现在形态上,也表现在生理生化过程中。低温胁迫下,植物通过逐渐积累可溶性糖、可溶性蛋白、脯氨酸等物质调节对逆境的适应能力以降低膜脂的过氧化[2-3];丙二醛作为过氧化作用的最终产物,其含量出现上升趋势越早、上升幅度越大,抗寒性越差[6,17]。在本研究中,低温处理后‘粤甜’的可溶性蛋白、可溶性糖、脯氨酸含量均显著高于‘巴厘’,而丙二醛含量显著低于‘巴厘’。‘粤甜’表现出更强的渗透调节能力,在低温胁迫后质膜受损伤程度低,这是其耐寒能力强的生理表现之一。这与在其他菠萝品种上研究认为耐寒性强的品种脯氨酸、可溶性糖、可溶性蛋白含量高于不耐寒品种的结果一致[8,18]。高活性的抗氧化酶系统,高表达的抗氧化酶基因及低表达的ProDH基因,增强了‘粤甜’的抗氧化活性及渗透调节能力,维持了自由基产生与清除的动态平衡,降低了丙二醛积累,从而加快激素信号转导与物质代谢,增强耐寒性[19-20]。
3.2 低温与植物内源激素转导
植物内源激素是抗寒基因的启动因子,诱发抗寒生理反应[21]。内源IAA含量增加、GA信号受抑制均有利于增强抗寒性[4,22-23];ABA作为胁迫激素可诱导植物增强抗寒性,具有较高ABA含量且能较大幅度增加ABA含量是耐低温品种的重要生理特征[21,24]。本研究中与‘巴厘’相比,‘粤甜’的生长素类激素含量较高,赤霉素类激素含量较低且变化幅度较小,脱落酸/赤霉素比值高,可能是其耐寒性强于‘巴厘’的另一原因[25]。
低温降低细胞分裂素的合成,而耐寒品种的ZR含量明显高于不耐寒品种[26];也有研究认为低温对细胞分裂素并无显著影响[27]。在本研究中,除‘粤甜’的异戊烯腺嘌呤核苷显著升高外,低温处理对细胞分裂素类激素无显著影响,但‘粤甜’中的含量高于‘巴厘’。另外,低温处理后,‘粤甜’的茉莉酸类、水杨酸类及独角金内酯激素含量也均高于‘巴厘’。低温胁迫下高含量的茉莉酸、水杨酸及独角金内酯激素能降低过氧化物的积累,增强植物耐寒性。类似的研究结果在蔬菜及粮油作物等上也有报道[6, 28-30]
乙烯能改善逆境对植物的不利影响,番茄抗冷/抗冻能力的增强伴随着乙烯含量增加[31]。低温胁迫下,外源乙烯能提高田间香蕉植株脯氨酸和可溶性蛋白含量及抗氧化酶活性,降低MDA 积累,增强耐寒能力。本研究中,低温处理后,‘粤甜’中ACC含量略微升高,而‘巴厘’中则显著降低,相比较,‘粤甜’中的ACC含量高于‘巴厘’。
3.3 低温与植物生理代谢
本研究通过广靶代谢组分析,筛选出‘粤甜’‘巴厘’间大量差异代谢物,而且低温处理后的差异代谢物更多,表明‘粤甜’‘巴厘’2个品种对低温胁迫的响应存在明显差异,这与在油菜上的研究结果相似[32]。抗逆品种在非胁迫条件下即有较高的相关物质积累[33],本研究中多数差异代谢物在‘粤甜’中的积累高于‘巴厘’,为其后期代谢活动和应对低温环境响应提供了更好物质基础,这可能是‘粤甜’低温适应性强的潜在原因。无论是常温下还是低温处理后,‘粤甜’‘巴厘’间的差异代谢物均是黄酮类、酚酸类、脂质类、氨基酸及其衍生物类代谢物居多,这与前期研究结果相似[11]。
逆境时植物通过合成大量黄酮类物质提高自由基清除和抗氧化活力[34-35],其含量与抗寒强弱相关[36]。在本研究中,低温处理后大量黄酮类代谢物在‘粤甜’中的积累显著高于‘巴厘’,能提高内源性抗氧化物酶活性增强抗氧化活力,降低DNA损伤[37-39]。此外,酚酸类代谢物芥子酰葡萄糖醛酸,核苷酸及其衍生物类代谢物2′‑脱氧胞苷‑5′‑单磷酸、黄嘌呤,木脂素和香豆素类代谢物伞形酮,生物碱类代谢物咖啡酰胆碱,脂质类代谢物油酸酰胺(9‑十八碳烯酰胺)、1‑亚油酰甘油酯‑3‑O‑葡萄糖苷,经低温处理后在‘粤甜’中的含量积累显著高于‘巴厘’,且差异倍数相对较大。这些具有强抗氧化胁迫、清除氧自由基能力代谢物[40-45],与黄酮类代谢物一起为‘粤甜’菠萝的耐寒性状形成发挥了重要作用。
4 结论
低温胁迫下,‘粤甜’比‘巴厘’具有更高含量的可溶性蛋白、可溶性糖、脯氨酸,及更高活性的抗氧化酶系统和高表达的抗氧化酶基因;‘粤甜’的内源生长素、细胞分裂素、茉莉酸、水杨酸及独角金内酯含量高于‘巴厘’,赤霉素、脱落酸含量低于‘巴厘’;黄酮类、酚酸类、脂质类、氨基酸及其衍生物类代谢物在‘粤甜’中的含量积累高于‘巴厘’,这些是‘粤甜’耐寒性比‘巴厘’强的生理代谢基础。
