发根农杆菌介导的甘薯遗传转化体系优化
2023-11-23陶娜李茂兴郭华春
陶娜 李茂兴 郭华春
(1. 云南农业大学农学与生物技术学院薯类作物研究所,昆明 650201;2. 云南省薯类生物育种与良种繁育工程研究中心,昆明 650201)
甘薯(Ipomoea batatas L.)属于双子叶旋花科番薯属,为一年或多年蔓生草本植物,是世界第六大主粮作物[1]。中国是全球最大的甘薯产区,总产量占全球60%以上[2-3]。甘薯的块根和叶片均可食用,营养均衡[4],块根中富含碳水化合物(淀粉、单糖和膳食纤维)和多种功能活性物质(类胡萝卜素、花色苷、抗坏血酸),叶片中富含多种有益脂肪酸(ω-3类脂肪酸)和维生素,能够作为能量和营养来源在人类饮食中发挥重要作用[5-6],在保障区域粮食安全和扩大营养来源上具有较高的价值。甘薯植株生物量较高,生长适应性强,利用现代生物技术开展种质改良与创新,能进一步提高甘薯的应用开发价值。建立遗传转化体系是实现甘薯遗传改造的必要条件之一,目前主要采用基因枪法和根癌农杆菌(Agrobacterium tumefaciens)转化法对其开展转基因操作,但转化再生周期长、成本高,且对基因型具有较强选择性[7-8]。因此,建立更为高效快捷的甘薯转基因体系对甘薯分子育种十分重要。
发根农杆菌(Agrobacterium rhizogenes)为根瘤菌科农杆菌属的革兰氏阴性土壤细菌,能感染大多数双子叶植物和少数单子叶植物以及个别裸子植物[9],其含有Ri质粒,侵染植物后能够从植物外植体组织中快速诱导出大量毛状根[10],其发根原理是将Ri质粒上的T‑DNA通过侵染植物受伤部位的方式整合到植物基因组中进而诱导植物形成毛状根。毛状根是具有多分枝、无向地性、生长速度快、遗传稳定、具有激素自养等特性的不定根[11-12]。不同农杆菌的Ri质粒对不同植物、同一植物不同部位敏感性不同[13],此外侵染时间等对发根农杆菌诱导毛状根也有着重要影响。转基因体系常与基因工程方法,如过表达、基因沉默、基因编辑等技术相结合[14]。Otani等[15]利用发根农杆菌转化甘薯,通过对培养基的筛选,在供试材料10个品种中有5个品种获得了完整植株的再生,较传统育种相对节约时间。
因此,建立一个发根农杆菌介导的高效稳定甘薯遗传转化体系显得尤为重要。本研究对发根农杆菌诱导甘薯毛状根发根条件进行优化分析,以便找到最佳发根诱导条件。在本研究中,以‘泰中6号’‘徐薯22’‘灰薯’‘1610’(品系)、‘YS’(品系)为试验材料,通过筛选外植体和农杆菌菌株、侵染时间等重要因素开展毛状根诱导,建立发根农杆菌介导的甘薯遗传转化体系,为后期开展甘薯特定基因功能鉴定和甘薯遗传改良奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 以甘薯‘泰中6号’‘徐薯22’‘灰薯’‘1610’、‘YS’为试验材料,试验材料组培苗由云南农业大学薯类作物研究所提供。在MS培养基中培养20-25 d后[培养条件:光照时间16 h/d,光照强度100 μmol/(m2·s),培养温度(25±2)℃],分别选取长势良好植株(高度超过10 cm)上的叶片、叶柄和茎段为外植体材料;其中叶片选取完全舒展、嫩绿的叶片,茎段选取茎部节间,切除两端腋芽。
1.1.2 发根农杆菌菌株 Ar.1193、K599、C58C1、ArQual、MSU440(均购自上海唯地生物技术有限公司)。
1.1.3 试剂与相关培养基 卡那霉素(kanamycin,Kan)、链霉素(streptomycin, Strep)、头孢噻肟(cefotaxime sodium, Cef)和MS Base Salts(购自北京酷来搏科技有限公司)、M519(购自PhytoTech LABS),植物表达载体pCAMBIA1301S为本实验室保存,该载体含有35S启动子,NOS 终止子。发根农杆菌的培养采用TY培养基(3 g/L酵母提取物+5 g/L蛋白胨+10 μmol/L氯化钙,pH 7.0),重悬液(M519+30 g/L蔗糖),共培养基(M519+30 g/L蔗糖+7 g/L琼脂+6‑BA 0.1 mg/L+NAA 0.2 mg/L),毛状根诱导培养基(M519+30 g/L蔗糖+6‑BA 0.1 mg/L+NAA 0.2 mg/L+200 mg/L Cef+7 g/L琼脂),重悬液、培养基pH值调到5.8,然后高温(121℃)灭菌20 min备用。
1.2 方法
1.2.1 试验设计及测定指标 研究侵染时间、外植体类型、发根农杆菌菌株对甘薯毛状根诱导率的影响,采用 3×3×5 三因子完全随机试验设计,因子1为侵染时间:15、20、25 min;因子2为外植体类型:叶片、叶柄、茎段;因子3为发根农杆菌菌株:Ar.1193、K599、C58C1、ArQual、MSU440;‘泰中6号’为试验材料,每个处理20-25个外植体,3次重复。研究发根农杆菌菌株与试验材料对甘薯毛状根诱导率的影响,采用5×5双因子设计。毛状根诱导率的计算公式如下:
毛状根诱导率(%)=产生毛状根的外植体数量/外植体总数量×100%。
产生与鉴定转基因毛状根,利用同源重组将目的基因与载体pCAMBIA1301S连接,获得表达载体。表达载体转化发根农杆菌感受态细胞。以野生型菌株侵染的毛状根作为阴性对照,并计算阳性转化率,计算公式如下:
阳性转化率(%)=阳性的毛状根数量/外植体总数量×100%
1.2.2 菌株的选择和活化 选取Ar.1193、K599、C58C1、ArQual、MSU440共5种野生型发根农杆菌菌株进行测试。取保存的发根农杆菌菌液,划平板后挑取单菌落,分别接种至加有不同抗生素的 TY液体培养基中(表1)。在28℃,200 r/min的恒温摇床中培养过夜,4 000 r/min离心10 min收集菌液,弃上清,加入等体积的重悬液,待侵染。

表1 发根农杆菌类型及抗性Table 1 A. rhizogenes strains and their resistances
1.2.3 发根农杆菌侵染液的制备 将‑80℃冰箱保存的菌株在TY(100 mg/L Kan)固体培养基上涂板倒置培养48-72 h后,用灭菌的枪头挑取阳性发根农杆菌单菌落于1 mL TY(100 mg/L Kan)液体培养基中,28℃、200 r/min振荡培养约4 h,吸取100 μL活化的菌液于30 mL TY液体培养基中继续振荡培养,菌液OD600=0.8时,将其活化的菌液4 000 r/min离心15 min后去上清,用MS Base Salts液体培养基(含100 μmol/L 乙酰丁香酮)重悬菌体,即获得侵染液。1.2.4 发根的诱导 取培养25 d左右的‘泰中6号’叶片、叶柄、茎段为外植体,在外植体表面用手术刀划出伤口后分别浸入活化的Ar.1193、K599、C58C1、ArQual、MSU440菌液中摇晃15、20、25 min,然后用无菌滤纸吸干表面的菌液,接种于共培养基上25℃暗培养2-3 d 后,转入毛状根诱导培养基(含200 mg/L Cef)。2-3周后统计诱导出的毛状根数,计算诱导率。以‘泰中 6 号’筛选出适宜的外植体为茎段、适宜的侵染时间为20 min,在此基础上分别取培养25 d左右的‘徐薯22’‘1610’‘灰薯’‘YS’的茎段在表面用手术刀划出伤口后分别浸入以上5种活化的菌液中侵染 20 min,然后按上述方法培养并统计。
1.2.5 表达载体的构建及转基因毛状根的检测 设计HBFD1特异性引物分别通过PCR技术扩增目的基因cDNA,利用同源重组的方法将目的基因与载体pCAMBIA1301S连接,获得表达载体。将35S::HBFD1、空载体表达载体转化感受态细胞,转化方法见上海唯地生物技术公司的感受态使用说明书。通过提取转基因毛状根DNA,目的基因设计引物,通过PCR检测。
1.2.6 发根农杆菌感受态细胞的转化 转化方法见上海唯地生物技术公司的发根农杆菌感受态细胞使用说明书,从平板中挑选单克隆蘸入到1 mL TY液体培养基(100 mg/L Kan+100 mg/L Strep)中,28℃200 r/min摇菌4 h。挑取单克隆进行PCR鉴定获得阳性克隆,摇菌后保存备用。
1.2.7 DNA提取和PCR检测 用CTAB法提取培养的毛状根DNA,用rolB基因检测诱导出来的根是否为毛状根,使用HBFD1基因进行PCR检测确定目的基因是否整合到毛状根中(表2)。
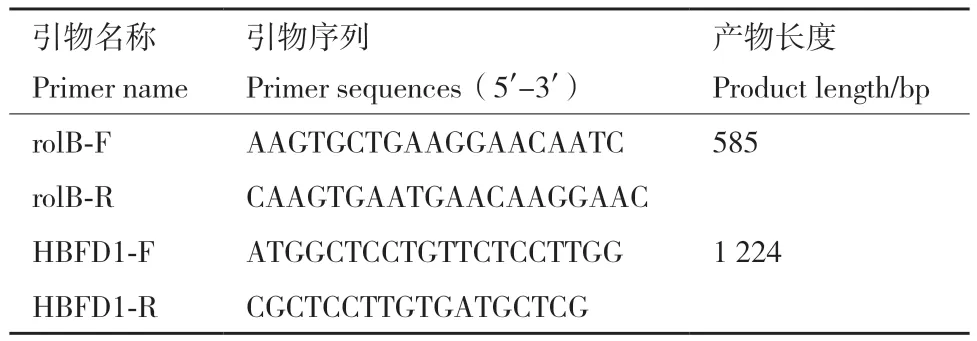
表2 引物列表Table 2 List of primers
1.2.8 数据统计与分析 采用Excel 进行试验的数据记录,采用SPSS分析软件进行单方差分析(ANOVA),采用Photshop2021作图。
2 结果
2.1 不同外植体对甘薯毛状根诱导的影响
不同外植体对植物毛状根的诱导能力存在差异。5种不同类型的发根农杆菌Ar.1193、K599、C58C1、ArQual、MSU440均能诱导甘薯茎段发根且诱导率较高,叶片、叶柄为材料基本诱导不出毛状根,适宜以茎切段为材料来诱导发根的形成(图1)。

图1 不同菌株诱导不同外植体对毛状根的影响Fig. 1 Effects of different explants induced by different strains on hairy roots
2.2 侵染时间对毛状根诱导率的影响
不同侵染时间对甘薯‘泰中6号’毛状根的诱导能力存在差异。15、20、25 min三个不同侵染时间段都可以诱导出毛状根,但侵染20 min时毛状根诱导率相对较高(图2)。
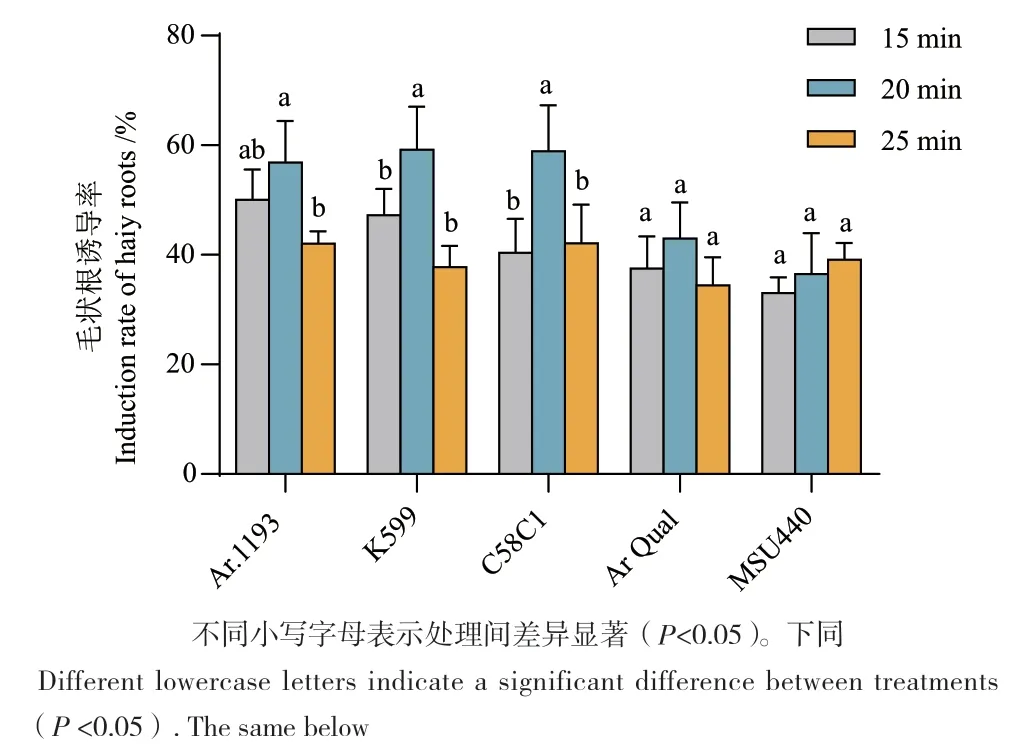
图2 不同菌株和侵染时间对毛状根影响Fig. 2 Effects of different strains and infection times on hairy roots
2.3 不同发根农杆菌对甘薯茎段的诱导培养
5种发根农杆菌菌株均可诱导5种甘薯茎段外植体产生发根,但是每个菌株对每种基因型诱导率间存在差异,侵染10 d左右切口处发出毛状根。侵染18-21 d后发根布满整个培养皿(图3)。

图3 不同菌株对不同甘薯品种(系)毛状根诱导率Fig. 3 Hairy roots induction rates of different sweet potato varieties(lines) by different strains
2.4 不同甘薯品种(系)对发根诱导率影响
5种甘薯茎段都能诱导出毛状根,但是不同基因型甘薯间也存在差异(图4),其中‘徐薯22’‘泰中6号’ ‘1610’诱导率相对较高,‘灰薯’‘YS’诱导率较低。

图4 不同甘薯品种(系)发根诱导率Fig. 4 Hairy root induction rates of different sweet potato varieties(lines)
2.5 发根农杆菌类型和甘薯品种(系)对毛状根诱导的影响
发根农杆菌类型和甘薯品种(系)均显著影响发根诱导率(表3)。‘徐薯22’的发根诱导率最高为79.63%,其适宜菌株为MSU440;‘泰中6号’的发根诱导率最高为59.19%,适宜菌株为K599;‘1610’的发根诱导率为最高为57.16%,适宜菌株为C58C1;‘YS’的发根诱导率最高为25.43%,适宜菌株为K599;‘灰薯’的发根诱导率最高为20.0%,适宜菌株为C58C1。

表3 发根农杆菌类型和甘薯品种(系)对毛状根诱导率Table 3 Type of Agrobacterium rhizogenes and sweet potato varieties(lines)%
不同甘薯品种(系)用5种菌平均发根诱导率为:‘徐薯22’>‘泰中6号’>‘1610’>‘灰薯’>‘YS’。不同发根农杆菌菌株在5个品种中平均发根诱导率为:K599>ArQual>C58C1>MSU440>Ar.1193。
2.6 毛状根、转基因毛状根PCR鉴定结果
以T‑DNA上的rolB基因为检测对象,提取甘薯毛状根和未转化的甘薯根的DNA进行PCR扩增,通过与DNA分子量标记和农杆菌阳性对照的比较,可以确定甘薯毛状根DNA中含有rolB基因的片段,证实了这是由发根农杆菌产生的毛状根(图5)。在优化的毛状根诱导体系上,为进一步验证HBFD1外源基因是否整合到发根农杆菌诱导形成的甘薯毛状根基因组中,另外提取转了质粒的毛状根DNA,并用特异性引物PCR进行检测。提取了84个毛状根,有32个毛状根有目标基因,毛状根转基因率为38.1%,扩增出基因片段符合大小,部分转基因毛状根示意图如图6所示。

图5 甘薯毛状根rolB基因PCR检测图Fig. 5 PCR detection of rolB gene in sweet potato hairyroots

图6 甘薯毛状根HBFD1基因PCR检测图Fig. 6 PCR detection of HBFD1 gene in sweet potato hairyroots
3 讨论
发根农杆菌介导的遗传转化体系具有简便性和高效性,适用于转化周期长、转化难度大的植物,本研究使优化的体系简单易行且发根可靠性强。发根农杆菌介导的遗传转化体系的建立受许多因素的影响,包括菌株类型、外植体类型、植物基因型等[10]。发根农杆菌侵染甘薯茎段之后,在其侵染部位产生大量生长迅速、多分支、没有向地性的发根,在无外源激素的培养基中能正常生长并且不出现退化的情况,从形态学的角度可以鉴定是发根农杆菌诱导产生的毛状根[16]。不足之处为诱导出的毛状根存在一定的假阳性率,所以从分子生物学上用PCR检测是必要的。
外植体类型是毛状根遗传转化过程中的一大重要因素。发根农杆菌对外植体的发根诱导有一定的选择性[17]。本研究中用叶片、叶柄、茎段作为外植体,尽管发根农杆菌类型在诱导毛状根上存在一定的差异,但是不管用哪种菌株只有茎段可以诱导出毛状根,叶片、叶柄都不能诱导毛状根。与之相似,吴飞等[18]在发根农杆菌诱导甘薯发根条件的优化中表明,茎段是最合适的外植体。不同的是吴飞等[18]用叶片、叶柄诱导时可以诱导出少量毛状根,本文中叶片、叶柄诱导不出毛状根,可能与甘薯品种(系)、发根农杆菌类型有关。此外,Huang等[19]以茎段为外植体成功建立了发根农杆菌介导的狗牙根转化体系。
侵染时间对毛状根诱导率有一定的影响[20]。农杆菌侵染过程中,侵染时间影响着发根农杆菌侵染外植体并吸附在外植体上的效率[21]。侵染时间过长或过短都会影响毛状根诱导率,影响转化,适宜的侵染时间有利于发根农杆菌对植物转化,从而提高转化率。本研究中侵染茎段20 min可达最佳诱导效果,为79.63%。庞滨等[22]在非洲菊毛状根转化上,外植体在发根农杆菌液中侵染20 min可达最佳诱导效果,诱导率为86.7%。侵染时间过长或过短都不利于毛状根的转化,而在20 min左右诱导效果最好[23]。
植物基因型是影响农杆菌转化效率的主要因素[24],说明品种(系)的选择是建立发根体系的关键因素,本试验结果也证实了这一点。‘徐薯22’‘泰中6号’‘1610’这3个品种(系)不论用哪种菌株诱导率都比‘YS’‘灰薯’高。这表明不同基因型材料会影响毛状根的诱导,此结论与向润等[25]研究相符,基因型不同诱导率不同。侵染能力会因植物种类的不同而有差别,某一基因型甚至有可能限制住发根农杆菌的侵染能力[23]。
发根农杆菌菌株影响发根,菌株的选择也是转化成功与否的重要因素[26]。发根农杆菌具有广泛的宿主植物细胞,菌株不同,对植物毛状根的诱导能力也不同[27]。‘徐薯22’‘泰中6号’‘1610’‘YS’‘灰薯’最适宜发根农杆菌分别为MSU440、K599、C58C1、K599、C58C1。由此可见,本研究所用方法简单可行,为甘薯毛状根基因功能验证提供一定基础。不同发根农杆菌菌株对不同植物的发根能力也各不相同,边慧慧等[28]分别利用Ar Qual、MSU440、C58C1、K599对番茄进行侵染,最后得到Ar Qual对番茄毛状根诱导率最高可达90.4%,证明不同发根农杆菌对植物的侵染能力各不相同。
已有研究报道了甘薯快速遗传转化的方法,利用发根农杆菌或者根癌农杆菌侵染茎段,无需组培就可以获得转基因甘薯。Zhang等[29]开发了一种高效的发根农杆菌K599介导的方法,避免了组织培养的需要,可以用于快速获得转基因甘薯植株,用于生物技术和研究。Cao等[30]用一种发根农杆菌介导的无需组培快速获得转基因甘薯的高效方法,CBD传递系统。Liu等[31]通过直接注射根癌农杆菌来传递基因,认为发根农杆菌K599转化效率不高,发根农杆菌和根癌农杆菌具体的作用机理、转化效率需要进一步探索。本研究运用组培方法,适用于大规模生产转基因毛状根。后期会借鉴无需组培即可获得转基因甘薯的方法,对此体系进行优化。
4 结论
本研究建立了发根农杆菌介导的甘薯遗传转化体系,不同甘薯品种(系)适宜的发根农杆菌类型不同。以‘ 泰 中 6 号 ’为试验材料筛选出最适宜发根的外植体为茎段,最佳侵染时间是20 min。在此基础上以茎段为外植体,侵染另外4种甘薯品种20 min,其中用MSU440侵染‘徐薯 22’茎段获得毛状诱导率最高为79.63%。。
