基于点扫描的高时空分辨荧光显微成像技术进展*
2023-11-16潘彬雄弓晟张鹏刘子叶皮彭健陈旺黄文强王保举詹求强
潘彬雄 弓晟 张鹏 刘子叶 皮彭健 陈旺 黄文强 王保举† 詹求强‡
1)(华南师范大学,华南先进光电子研究院,广州 510006)
2)(华南师范大学物理学院,广州 510006)
激光点扫描荧光显微镜凭借高分辨率、高灵敏度、高特异性、可光学层切三维成像和动态成像等优势,已成为生命科学研究中广泛应用的重要工具.随着研究者对生命科学研究的逐渐深入,由于受光学衍射极限影响和逐点扫描探测的限制,传统点扫描共聚焦显微镜的时空分辨率已无法完全满足相关研究需求,在实际应用中面临诸多挑战.近二十年来,超分辨荧光显微成像技术取得了重要进展,研究人员发展了多种高空间分辨率、高时间分辨率的点扫描荧光显微成像技术,对于生物成像等具有重要意义.然而,有关该领域最新进展的综述论文较少,系统地讨论、总结基于点扫描的高时空分辨荧光显微成像技术的研究进展,对于其未来研究发展极为重要.本文主要从时间分辨率与空间分辨率两个维度分别介绍了各类点扫描荧光显微成像技术的基本原理及相关进展,并介绍了高时空分辨显微成像技术及应用,最后讨论展望了高时空分辨点扫描荧光显微镜的未来发展趋势和挑战.
1 引言
光学显微镜将人类视野从宏观拓展到了微观领域,为探究物质构成与生命起源发挥了重要作用.1873年,德国科学家Abbe 提出传统光学显微镜的分辨率由波长和物镜数值孔径决定,其理论公式为横向分辨率dminλ0/(2NAobj),轴向分辨率Zmin2λ0/(NAobj)2[1,2].其中,dmin是横向分辨最小距离;Zmin是轴向分辨最小距离;λ0是光波长;NAobj是物镜数值孔径.因此,在可见光波段,传统光学显微镜分辨率,横向约200 nm,轴向约500 nm.
然而,为进一步揭示蛋白分子相互作用,亚细胞器动态变化等机理,光学显微镜分辨率需要由百纳米量级跨越至几十纳米甚至几纳米量级.为实现上述目标,研究者提出多种突破衍射极限的远场光学显微超分辨成像技术,其中代表性技术有:基于单分子定位显微镜(single-molecule localization microscopy,SMLM)的光激活定位显微镜(photoactivated localization microscopy,PALM)[3]和随机光学重构显微镜(stochastic optical reconstruction microscopy,STORM)[4],基于频域扩展的结构光照明显微镜(structured illumination microscopy,SIM)[5],以及基于点扫描成像的受激辐射损耗显微镜(stimulated emission depletion,STED)[6].这些代表性技术在空间分辨率与时间分辨率方面各具优势.例如,单分子定位显微镜(SMLM)核心思想为“闪烁”、“定位”与“重构”[7-9],通过每次激发少量探针以达到高定位精度,横向分辨率最高可达10 nm,但需要大量原始图像进行重构计算,因此时间分辨率通常在分钟量级,难以实现活细胞快速动态成像.SIM 技术采用结构光照明方式,提取目标图像的高频信息,需5—9 张原始图像重构计算出高分辨图像[10,11],其时间分辨率相对较高,但空间分辨率有限,仅比宽场显微镜提高2 倍.相较于上述两类技术,STED 技术的空间分辨率显著高于SIM,一般为20—50 nm[6,12,13],时间分辨率也明显高于SMLM,因此在兼具高时空分辨率方面具有优势(表1).

表1 SMLM,SIM,STED 超分辨技术的关键性能指标对比Table 1.Technical comparison of SMLM,SIM,STED super-resolution microscopy.
为应对当前科学研究需求,研究者对现代显微技术的时空分辨率均提出了更高要求,实现高时空分辨率显微成像技术已成为显微成像领域的重要研究方向.本文主要介绍了多种基于点扫描成像的技术原理及相关进展,从时间分辨率与空间分辨率两个维度分别讨论了各类技术的发展与应用,总结了基于点扫描的高时空分辨显微成像技术进展及应用,最后分析讨论了高时空分辨点扫描荧光显微镜的未来发展趋势和挑战.
2 传统点扫描共聚焦显微成像
早期,传统光学显微成像系统以宽场显微镜为主,即整个样品被同时激发,所产生的荧光信号被相机收集的同时,也包括了未聚焦的背景信号(图1(a)和图1(b)).因此,宽场显微镜的轴向分辨率很差,无法实现清晰的三维成像(图1(e)和图1(f)).共聚焦激光扫描显微镜(confocal laser scanning microscopy,CLSM)通过空间针孔阻挡了离焦光,进而提高了分辨率和对比度,使其具备光学切片的能力,能够实现清晰的三维成像(图1(c)—(f))[14,15].因此,共聚焦激光扫描显微镜凭借具有非接触、非侵入性、操作简便等优势,得到了广泛应用,且已实现了商业化[16,17].

图1 宽场和共聚焦显微成像技术对比(a) 宽场显微镜系统简化图;(b) 宽场显微镜荧光信号采集方式[18];(c) 共聚焦显微镜系统简化图;(d) 共聚焦显微镜荧光信号采集方式[18];(e) 二维切面图对比[18];(f) 三维重构图对比[18]Fig.1.Comparison of wide-field and confocal microscopy:(a) Simplified system schematic of wide-field microscopy;(b) fluorescent signal acquisition of wide-field microscopy[18];(c) simplified system schematic of confocal microscopy;(d) fluorescent signal acquisition of confocal microscopy[18];(e) comparison of two-dimensional section images[18];(f) comparison of three-dimensional reconstruction images[18].
为提高共聚焦显微镜分辨率,1988 年Sheppard[19]提出了在不牺牲信噪比的情况下,获得两倍分辨率提高的点扫描共聚焦成像方式,其原理为使用阵列探测器替代单像素探测器,每个像素都充当一个针孔,用于记录分辨率增强但信号低和偏移的共焦图像,如图2(a)所示.通过将检测到的荧光向照明轴重新分配来校正偏移并恢复信号,如图2(b)所示,从而减少信号损失的情况下提高了分辨率.与反卷积算法结合,横向分辨率可以达到120 nm,该成像系统已有商业化产品,即蔡司的Airyscan 显微镜[20].然而,逐点串行扫描方式会导致时间分辨率相对较差.例如,同样成像视野(512×512 像素),宽场成像单帧时间为20 ms,共聚焦点扫描单像素驻留时间为10 μs,整个成像视野则需2.6 s.
3 高时间分辨率点扫描成像技术
3.1 基于多焦点阵列提高成像速度
为提高共聚焦显微镜成像速度,2010 年Müller 和Enderlein [21]提出了基于面阵探测器(CCD)的单焦点激光扫描共聚焦显微成像技术,并将其命名为图像扫描显微技术(image scanning microscopy,ISM).其将传统的共焦激光扫描显微镜与快速宽场CCD 检测相结合,同时通过上述像素重定位方法和反卷积算法实现分辨率提升.在对荧光珠成像中,传统共聚焦显微镜实现了244 nm 分辨率,而ISM 的分辨率可至150 nm,相比于CLSM 分辨率提高了约1.63 倍(图2(a)—(c)).为解决ISM技术单点扫描成像速度有限的问题,York 等[22]在2012 年提出了多焦点结构光照明显微镜(multifocal structured illumination microscopy,MSIM).该技术原理如图2(d)所示,采用高速数字微反射镜器件(digital micromirror device,DMD)同时实现多焦点结构光的产生和扫描,通过数字像素重定位和反卷积技术进行图像重构,在45.6 μm×45.6 μm的超大视野成像中获得了1 Hz 时间分辨率,并以此实现三维层切成像,其中成像深度可达48 μm,同时具有横向约145 nm、轴向约400 nm 的空间分辨率,如图2(e)和图2(f) 所示.该技术相比单点扫描ISM 技术不仅具有高时间分辨率,还同时具有深层三维成像能力,为活体厚样品的三维成像提供了强有力的工具.为进一步提高MSIM 成像深度,2014年,Ingaramo 等[23]引入近红外脉冲光实现了多光子激发的MSIM 技术,将成像深度提高至100 μm,同时兼顾了高时间分辨率与高空间分辨率的优势.
3.2 基于微透镜阵列提高成像速度
由于多焦点光场的光强严重受限于数字微镜阵列和空间光调制器的反射效率.为生成高效率多焦点光场,有研究者提出利用微透镜阵列产生并行多焦点聚焦光斑.转盘共聚焦显微镜(spinning disk confocal microscopy,SDCM)正是利用此概念,如图3(a)所示,该系统核心器件由两个分别带有微透镜阵列和针孔阵列的转盘组成.当用准直光照射时,每个微透镜都会产生一个聚焦光点,微透镜阵列产生约1000 个焦点对样品进行实时扫描成像[26,27].在相同信噪比下,转盘共聚焦显微镜的成像速度是传统共聚焦显微镜的10—100 倍[28].此外,转盘共聚焦显微镜还具有降低光漂白,细胞光毒性低,可长时程活细胞成像的优势[29-31].转盘共聚焦显微镜虽然借助微透镜阵列提高了成像速度,但其分辨率相较于传统共聚焦显微镜并未改善.
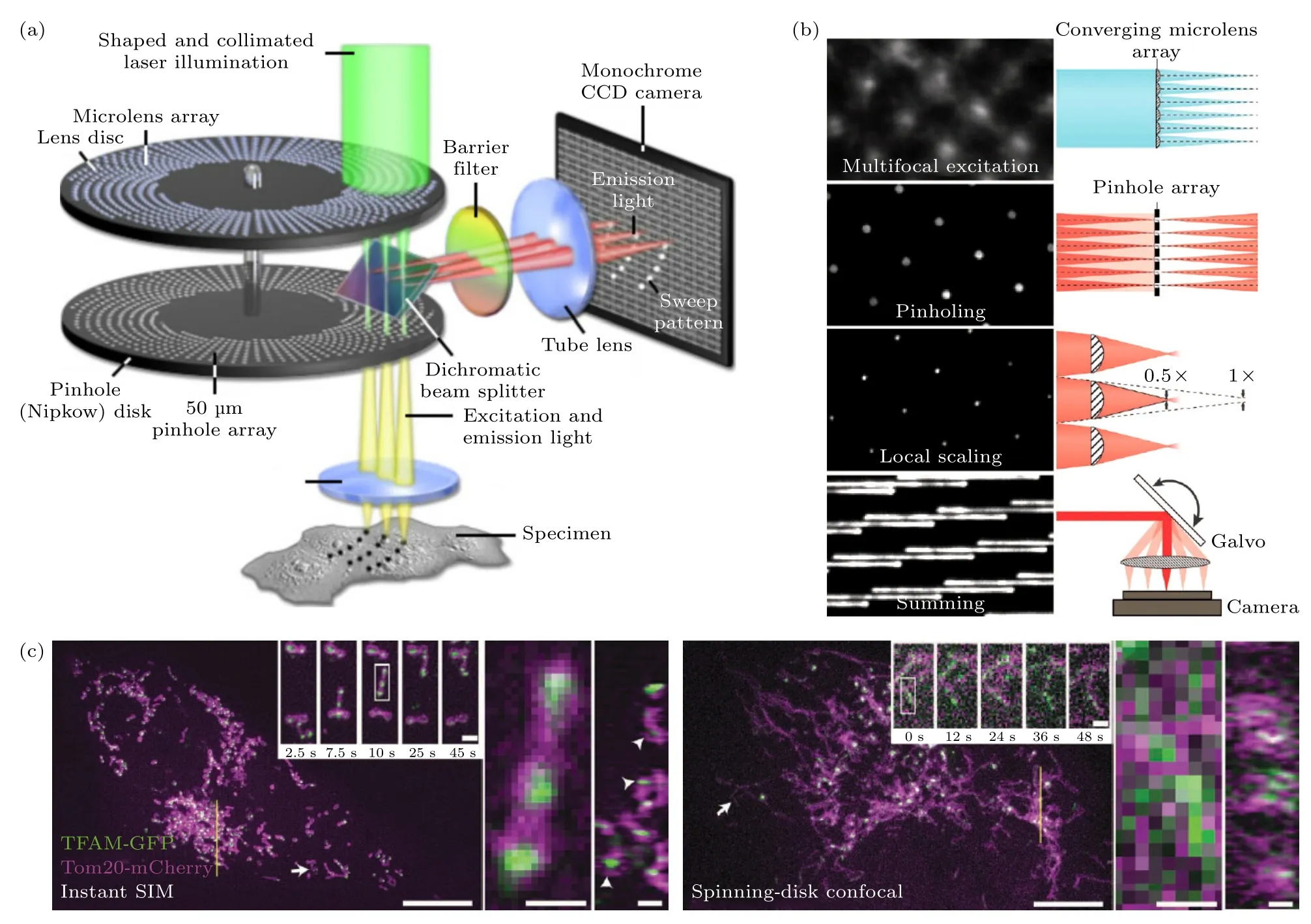
图3 基于微透镜阵列的快速成像技术示意图(a) 转盘共聚焦系统简化图;(b) 实现Instant-SIM 的关键步骤[32];(c) Instant-SIM和转盘共聚焦显微镜的活细胞双色成像对比[32]Fig.3.Schematic diagram of fast imaging technology based on microlens array:(a) Simplified schematic of the spinning disk confocal system;(b) key steps in implementing Instant-SIM[32];(c) dual-color imaging comparison of Instant-SIM and spinning disk confocal microscope on live-cell[32].
为了提高转盘共聚焦显微镜分辨率,同时兼顾其高速成像的优势,York 等[32]在2013 年提出了一种基于微透镜阵列的实时多焦点结构光超分辨技术(instantaneous structured illumination microscope,Instant-SIM),其原理为:首先利用微透镜阵列生成多焦点激发模式,与之相匹配的针孔阵列在共焦面抑制离焦荧光信号,再利用一个共轭且匹配的微透镜阵列局部缩小每个透过针孔的荧光焦点至原来尺寸的1/2,通过硬件实现像素重定位效果,最后再由振镜控制激发点阵扫描整个视场,并将缩小后的荧光点阵反射到CCD 对应的位置,叠加形成实时超分辨图像(图3(b)).Instant-SIM 将MSIM 需要后处理的步骤完全在硬件中实现,使其具备了对活体样品进行高分辨率实时观测的能力.同时,Instant-SIM 的横向和轴向的分辨率分别为145 nm 和350 nm,采集速度高达100 Hz,并在活体肺成纤维细胞中以更高的三维分辨率且10 倍于转盘共聚焦显微镜的成像速度获取双色超分辨图像(图3(c)).Qin 等[25,33]还通过将传统转盘共聚焦显微镜与ISM 的超分辨方法相结合,提出了分辨率更高的CSD-ISM 技术,其显著优势在于可简单实现,如对现有共聚焦旋转盘装置进行光源调制,使旋转盘与照明和成像相机同步,从而很容易地升级到ISM.
4 超高空间分辨率点扫描成像技术
4.1 点扫描超分辨成像技术
研究者提出的上述多种方案提高了成像速度,但依然面临空间分辨率有限的问题.为实现共聚焦超分辨成像(<100 nm),Hell 和Wichmann[6]在1994 年提出了受激辐射损耗显微术(STED).该技术通过缩小有效激发光斑的尺寸来实现衍射极限的突破,其基本原理如图4(a)所示,STED 超分辨成像系统通常由两束激光构成,一束为高斯光,也称作激发光,另一束为“甜甜圈”状的空心光,也称作损耗光,将两束光在空间上精准耦合对齐,仅中间空心位置可发出荧光,实现减小激发光斑的效果,进而获得超分辨成像能力[34,35].STED 分辨率由公式所决定,其中d为横向分辨最小距离,ISTED为损耗光光强;Isat为损耗光的饱和光强,其含义为使荧光强度降低为初始大小1/2 时的损耗光强度.由上述公式可知STED 光强越高,则分辨率越高(图4(a)).因此,理论上STED 分辨率可达无限小[36].例如,有研究者利用NV 色心证实在3.7 GW/cm2的损耗光强下实现了2.4 nm 的分辨率(图4(b))[37].传统染料和荧光蛋白饱和光强较高,其所需损耗光光强通常在MW/cm2—GW/cm2量级,仅能实现40—60 nm 的分辨率.同时,传统商业染料和荧光蛋白无法承受高光强损耗光,极易出现光漂白现象,同时高光强损耗光也会对细胞造成严重光毒性,影响细胞活性[38].因此,在实际应用中STED的损耗光强难以无限提高.
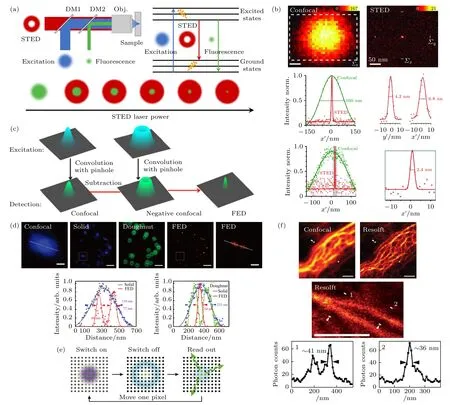
图4 点扫描超分辨成像技术示意图(a) STED 原理图;(b) STED 在NV 色心上实现2.4 nm 分辨率[37];(c) FED 原理图[43];(d) 单颗粒FED 成像[44];(e) RESOLFT 原理图[45];(f)共聚焦显微镜和RESOLFT 的细胞成像对比[46]Fig.4.Schematic diagram of point scanning super-resolution imaging technology:(a) STED schematic;(b) STED achieves 2.4 nm resolution on NV point[37];(c) FED schematic[43];(d) UCNPs-FED single particle imaging[44];(e) RESOLFT schematic[45];(f) cell imaging comparison of confocal microscope and RESOLFT[46].
为了降低损耗光光强,进而减少光漂白和光毒性,研究者提出了基态损耗(ground state depletion,GSD)技术[39],该技术相较STED 大大降低了光功率,可以实现连续光激发与损耗.GSD 技术的损耗光强相比传统STED 功率降低了3 个数量级[40],更适合生物组织细胞成像.同时,为了减少扫描成像过程中的无效照明,研究者探究了许多方法,如MINFIELD 成像技术[41],通过仅对提前确定的亚衍射区域照射来尽可能地减少光损伤;又如Dy-MIN 成像技术[42],使用像素停留时间的一小部分来驱动位于STED 光束的环形波峰上的荧光团进入暗状态.相比传统STED 技术,该成像技术将损耗光强降低了1/20.尽管已提出多种成像技术降低损耗光光强,但是STED 技术仍然面临着损耗光强高、光路难以校准、成像方法复杂等问题.
为解决上述难题,Kuang 等[43]提出荧光差分技术(fluorescence emission difference microscopy,FED) 来降低空心光光强并降低光路复杂性.该技术分别利用实心光斑和空心光斑扫描样品获得两张图像,并将两张图像相减,最终得到差分超分辨图像(图4(c),(d)),其原理公式可表示为PSFFEDPSFsolid-rPSFdoughnut,PSFFED,PSFsolid,PSFdoughnut分别为FED、实心光斑和空心光斑的点扩散函数(point spread function,PSF),r为相减系数[47,48].与STED类似,当产生荧光非线性饱和时,FED 技术的分辨率可进一步提高[49].相比STED 技术,FED 方法具有无荧光染料限制、成像系统简单、后期处理方便的优势.
FED 技术虽具有光强低的优势,但存在分辨率相对较低的问题,一般而言,FED 技术分辨率难以突破100 nm.为追求超高分辨率,进一步降低损耗光强,研究者提出了基于光开关属性的可逆饱和光转移荧光超分辨显微技术(reversible saturable optical fluorescence transitions,RESOLFT)[50,51],RESOLFT 首先使用405 nm 激发光激活衍射受限光斑区域内的蛋白分子,使其发光,再使用一束488 nm 环形光使偏离中心的蛋白分子转化为非发射状态,最后收集荧光信号(图4(e)).与STED 相比,在获得相同分辨率的情况下,该技术所需要的光强可降低8 个数量级.然而,该技术的成像速度取决光开关转换速率.例如,基于绿色荧光蛋白rsEGFP 实现RESOLFT 技术,其成像的激发功率密度仅为1 kW/cm2,实现了约36 nm 的成像分辨率,但该技术的单像素驻留时间却需10—20 ms.为提高RESOLFT 技术成像速度,研究者发展了绿色荧光蛋白rsEGFP2,该蛋白的光转换速率较快,扫描速度提升25—250 倍[52].但是,RESOLFT荧光探针依然存在着成像时间长、光漂白等缺点.为进一步提高成像分辨率与降低光毒性及光漂白等问题,有研究者提出基于最少光子数的纳米尺度定位技术(minimal photon fluxes,MINFLUX)作为一种新兴纳米级超高分辨显微技术[53,54],使用空心光束作为泵浦光,调节光束中心的位置,当荧光强度最小时,荧光分子就被认为在空心光束中心位置.其成像方式实现了1—3 nm 的超高空间分辨率.随后研究者在MINFLUX 的基础上又发展了MINSTED 技术,更是让分辨率突破纳米量级,获得0.23 nm 的定位精度[55].MINFLUX 和MINSTED技术在空间分辨率上有着巨大优势,但耗时很长.
为彻底解决光漂白问题,降低光毒性,实现超长时程的超分辨成像,本课题组提出了上转换超分辨显微技术.上转换荧光纳米探针(upconverting nanoparticles,UCNPs)具有近红外激发、非线性强、光谱丰富可调、无荧光漂白等独特优势,在解决传统STED 面临的激光光强过高、荧光漂白快、无法长时程观测、光毒性大、超快激光系统复杂等方面问题具有很大的潜力.2015年,Wu 等[56]首次实现了近红外光束调控上转换荧光损耗现象,获得了30%的荧光损耗效率,为实现超低功率、无光漂白的上转换超分辨开辟了新思路,提供了重要理论基础.2017年,为实现上转换超分辨显微技术,Zhan 等[57]利用“同种离子间交叉弛豫”构建了高效的荧光损耗机理(图5(a)),实现了96%的极高损耗效率和分辨率为66 nm 的超分辨显微成像(图5(b)),其所需损耗光强相比传统STED 降低了至少2 个数量级,克服了光漂白现象,并首次实现了上转换探针标记的亚细胞结构成像.同年,Liu 等[58]报道了类似的相关现象和上转换超分辨显微技术.为追求更极致的超分辨成像性能,2022年,Guo 等[59]结合上转换发光的多光子非线性泵浦依赖特性,提出了受激辐射诱导激发损耗技术(stimulatedemission induced excitation depletion,STExD),可实现传统STED 所不具有的荧光损耗非线性放大的独特效应,逐级降低高能级荧光损耗所需要的饱和光强,将损耗饱和光强陡降至42 kW/cm2量级,较传统STED 技术下降3 个数量级,并获得了~34 nm 的超分辨成像结果.同年,Pu 等[60]基于上转换“光-物质-能量吸收体”的荧光损耗理论,提出了表面迁移荧光损耗技术(surface-migration emission depletion,SMED),将传统的损耗光引起受激辐射与激发光进行低效率竞争,转变为引导荧光能量向高容量能量吸收体转移(图5(c)),实现了极高效的荧光损耗,损耗效率可达95%,且饱和光强仅为18.3 kW/cm2量级,较传统STED 技术下降3—4 个数量级.同时,仅利用毫瓦级、近红外、连续激光实现了分辨率高达17 nm 的超分辨显微成像(图5(d)).
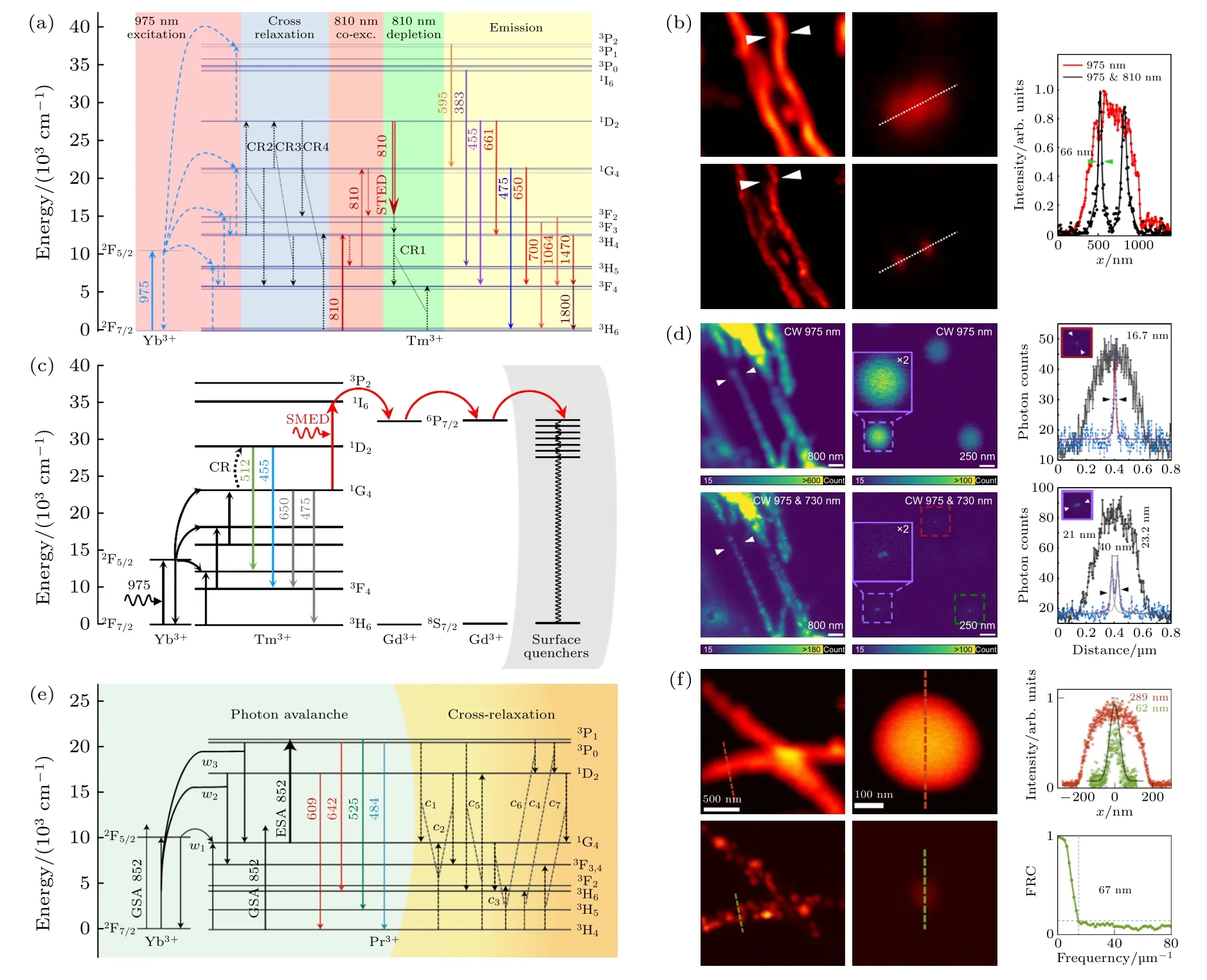
图5 上转换超分辨成像技术示意图(a) 交叉弛豫传能荧光损耗机制[57];(b) 上转换STED 超分辨成像结果[57];(c) 表面迁移荧光损耗机制[60];(d) SMED 超分辨成像结果[60];(e) Yb3+/Pr3+共掺杂纳米颗粒的光子雪崩机制[61];(f) 光子雪崩超分辨成像结果[61]Fig.5.Schematic diagram of up-conversion super-resolution imaging technology:(a) Cross-relaxation energy transfer fluorescence loss mechanism[57];(b) up-conversion STED super-resolution imaging results[57];(c) surface migration fluorescence loss mechanism[60];(d) SMED super-resolution imaging results[60];(e) photon avalanche mechanism of Yb3+/Pr3+ co-doped nanoparticles[61];(f) photon avalanche super-resolution Resolution imaging results[61].
上转换荧光除了可以被低光强激光实现高效荧光损耗外,还有具有超饱和非线性(n< 1)效应与超高阶多光子非线性(n> 1)效应.基于上转换非线性效应也可有效调制激发光斑,进而改变成像点扩散函数实现超分辨显微成像.Wu 等[62]提出了利用单个低功率、波长为808 nm 激光引发掺铒上转换探针产生超饱和非线性激发效应(n=0.59),实现了无光漂白的荧光差分显微技术的超饱和激发上转换超分辨成像,分辨率达到了80 nm.同年,Chen 等[63]将该成像技术应用深层成像,在93 μm厚的组织成像中,实现了50 nm 的分辨率.Huang等[44]构建了激发正交的上转换探针,在低光强、超饱和非线性激发下,实现了铥-蓝光和铒-绿光双通道、无串扰的检测,实现了单次扫描的荧光差分超分辨成像,分辨率高达54 nm 的超分辨成像,同时其成像时间缩短了1/2.为降低饱和荧光差分超分辨成像技术中对空心光束的依赖,仅用简易的高斯光来实现超分辨成像,有研究者提出基于非线性多光子效应提高成像分辨率,其理论为dλ0/(2NAobj),其中dmin是横向分辨最小距离;λ0是光在真空中的波长;NAobj是物镜数值孔径,N为非线性多光子数.然而,传统高阶非线性多光子(N>1)成像技术受限于激发波长与非线性阶数N彼此依赖的倍数关系,在发射波长不变的情况下,多光子激发过程阶数N越高,则需要波长为N倍的高功率脉冲光激发实现,这对于实现超分辨率成像存在理论上的困境.为克服这个难题,本课题组提出基于上转换钕、镱和铥三种掺杂的上转换体系,实现了短波长激发的高阶非线性多光子发光.具体地,利用30 μW,730 nm 连续光激发实现了超衍射极限的高阶非线性四光子(n=4)荧光成像,分辨率达到了161 nm.如同非线性效应可在二维上压缩点扩散函数,同样也可将该思路扩展至三维成像.Denkova 等[64]利用980 nm 激发实现了非线性四光子荧光,获得了三维高分辨成像.基于多光子激发的非线性可直接提高分辨率,是一个重要的、简单的超分辨成像方法,但是长久以来传统上转换非线性阶数并不高,一般多光子n=4—5,进而无法实现100 nm 以内的超分辨成像.近期,Lee 等[65]在铥离子上转换体系中利用近红外1064 nm 激发实现了基于纳米光子雪崩效应,并据此实现了横向~70 nm 的超分辨成像.但该探针荧光辐射波长为800 nm,绝大部分探测器在此波段探测效率较低,不利于成像,此外,该体系雪崩荧光响应时间慢(608 ms),难以应用于生物成像.同一时期,本课题组基于镱和镨两种掺杂离子实现了非线性阶数为26 阶的光子雪崩非线性效应,实现了约62 nm 的超分辨成像(图5(e),(f)),同时基于镱、镨和铥三种离子掺杂上转换体系提出了迁移光子雪崩概念,并结合能量传递及级联激发实现了光子雪崩效应放大,获得了超高46 阶非线性成像,实现了多细胞视野的实用超分辨成像技术.非线性阶数的大幅度提升使多光子成像成为突破衍射极限且分辨率可达60 nm 的超分辨成像技术,同时成像系统具有极为简便、激光光强要求极低的优势[61].
4.2 点扫描三维超分辨成像技术
细胞结构的动态变化并不仅仅局限于二维层面,而是往往发生在三维层面.2000年,Klar 等[66]提出了利用加载了0/π 环形相位的损耗光对荧光进行受激辐射损耗,获得6 倍的轴向分辨率提高,实现了轴向分辨率为110 nm.Harke 等[67]报道的3D-STED 技术可实现xyz三个维度上的超分辨.通过同时引入0—2π 涡旋相位(横向调制)以及0/π环形相位(轴向调制)两束损耗光,对荧光PSF 进行三维受激辐射损耗,如图6(a),(b)所示.3D-STED实现了横向43 nm 和轴向125 nm 的分辨率,如图6(d)所示.为矫正成像像差,实现光束调制的灵活性,耶鲁大学科研团队提出利用两个空间光调制器分别替代0—2π 涡旋相位以及0/π 环形相位板,实现了具有自适应光学(adaptive optics,AO)优化像差能力的AO-3DSTED,获得了更高的成像质量,提高了3DSTED 深度成像的能力[68].为减少空间光调制器的使用,Lenz 等[69]更是通过巧妙的光路设计,仅利用一个SLM 实现了AO-3DSTED,如图6(c)所示.
尽管3D-STED 能实现三维超分辨,但横向和轴向的分辨率通常相差2—3 倍.为解决此难题,2008年,Schmidt 等[70]结合3D-STED 以及4π 显微镜的技术优势,提出了isoSTED,可获得40—45 nm的各项同性分辨率.随后,Chmyrov 等[71]将自适应光学技术加入isoSTED中,实现了AO-isoSTED技术.如图6(e)所示,损耗光的调制采用了单SLM方法,SLM 上分别加载了调制STEDxy的0—2π涡旋相位以及STEDz的离焦相位,图6(e)右上方插图分别展示了STEDxy,STEDz以及STEDtotal双物镜干涉的PSF.由于自适应光学技术的引入,使得AO-isoSTED 技术在实验中从整个30—35 μm厚生物样品内稳定获取了三维各向同性亚50 nm分辨率,并藉此对一系列亚细胞结构进行了精细的三维超分辨成像,如图6(f)所示.此外,Böhm 等[72]基于更低损耗光强的RESOLFT 提出了4Pi-RESOLFT 技术,实现了30—50 nm 的三维超分辨成像.然而,由于RESOLFT 可逆光开关荧光蛋白的转换速率较慢,如对400 μm3体积进行三维成像需要160 min 之久,这极大地限制了RESOLFT 技术在三维动态成像中的应用.
5 超高时空分辨率点扫描成像技术
5.1 智能扫描超分辨成像技术
上述点扫描成像技术在空间分辨率方面展示了优越的性能,可实现20—40 nm 分辨率,可清晰观测亚细胞细微结构.但是,由于点扫描超分辨技术探测体积的缩小,所能探测的荧光光子数相应减少,为保证相同的成像信噪比,一般会增加单像素扫描时间.同时为满足奈奎斯特采样定理,同一视野下超分辨所需像素数更多,最终导致点扫描超分辨技术时间分辨率较差.为进一步提高时间分辨率,有研究者提出了可总结为目标引导的智能扫描超分辨成像技术,其原理为控制扫描振镜跳过视野内没有样品的区域.基于目标引导的智能扫描方式已有多项代表性技术被报道,如Staudt 等[74]在2011 年提出减少荧光“开关”状态切换周期的智能点扫描技术.如图7(a)所示,在决策时间dT内,接收的光子数达到第1 阈值时激光器才会被接通,如果达到第2 阈值且读出时间小于驻留时间,在剩余驻留时间中激光器会被关闭.该方法减少了激发光强,且在保留空间分辨率的同时,提高了成像速度,并且减低了高达8 倍的光漂白现象.另外,Dreier 等[75]于2019 年将智能扫描的概念应用于RESOLFT 显微术.这种智能扫描点扫描的方法将RESOLFT 成像速度提高了6倍,并将体内成像的光剂量降低70%—90%.
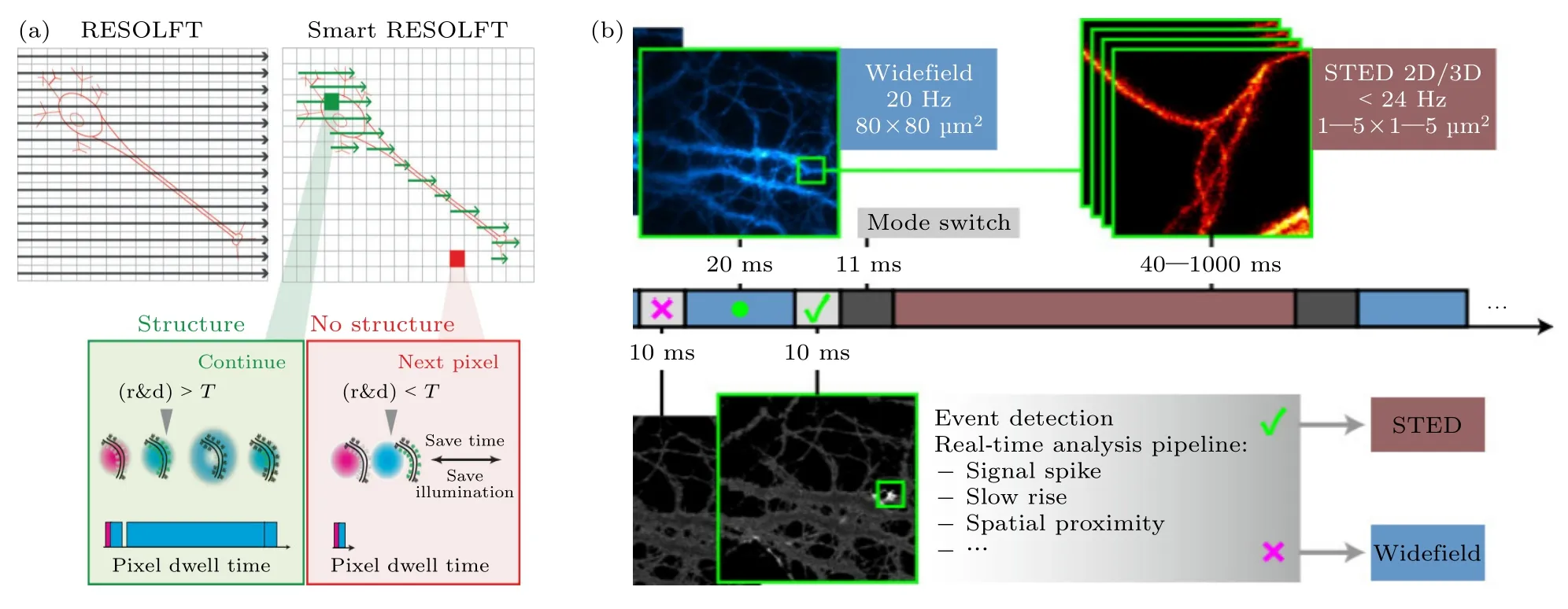
图7 智能扫描超分辨成像技术示意图(a) 智能RESOLFT 扫描机制[75];(b) etSTED 实验方案[76]Fig.7.Schematic diagram of intelligent scanning super-resolution imaging technology:(a) Smart RESOLFT scanning mechanism[75];(b) etSTED experimental scheme[76].
通过目标引导的智能扫描超分辨成像技术,可提供高时间分辨率.同时,由于减少了无效照明,也有效降低了STED/RESOFLT 技术的光漂白问题,使其可实现长时间超时空分辨成像.然而,有些亚细胞结构所发生的动态变化是快速的,可能仅在毫秒至几秒内变化,成像过程中难以捕捉目标区域.为此,有研究者提出了事件触发的智能点扫描超分辨成像技术(event-triggered STED,etSTED)[76],其基本原理如图7(b)所示,先用宽场快速成像对事件进行检测和定位,当检测到事件发生则切换为STED 模式,在事件坐标周围小块区域按照预先设定的参数进行采集.之后继续宽场成像,不断重复这个过程.该技术不仅使细胞整体应力和光损伤最小化,还能够显著提高时间分辨率.与手动采集整个研究样本区域的STED 时间间隔相比,所选感兴趣区域的成像速度快了100—5000 倍.
5.2 并行扫描超分辨成像技术
智能扫描超分辨技术方案依然依赖单点扫描和单点探测的成像方式,时间分辨率提升始终有限.为追求超高时间分辨率,2011年,Bingen 等[77]率先提出了四光束多点并行扫描的STED 技术,该技术将成像速度提升至原来的4倍,同时增大了扫描视场.但该技术方案需要每束激发光与空心光严格耦合实现同步扫描,并依赖多个点探测器,系统搭建较为复杂.为此,Bingen 等[77]提出了一种能更为简单、高效的产生并行空心光的方法,利用两个正交且不相干的交叉驻波相叠加,产生超过10000 个空心光并行扫描的pRESOLFT 技术,其原理如图8(a)所示.与传统RESOLFT 技术一样,“ON”状态聚焦光斑尺寸随激发光强I 与饱和光强Is的比值增大而减小,如图8(b)所示.由于大部分用于RESOLFT 技术的可逆蛋白RSFPs 的“开关”速率相对较慢,在~10 μm 成像视野下,传统点扫描RESOLFT 技术成像时间所需为20—30 min[78,79].相比传统点扫描RESOLFT 技术,利用上万个空心光并行扫描的成像方式,可在 120 μm × 100 μm的超大视野下,以<1 s 的时间分辨率实现~77 nm超分辨活细胞成像,如图8(c)所示.同样地,Bergermann 等[80]也利用上述基本原理,将其扩展至多色并行扫描STED 成像.
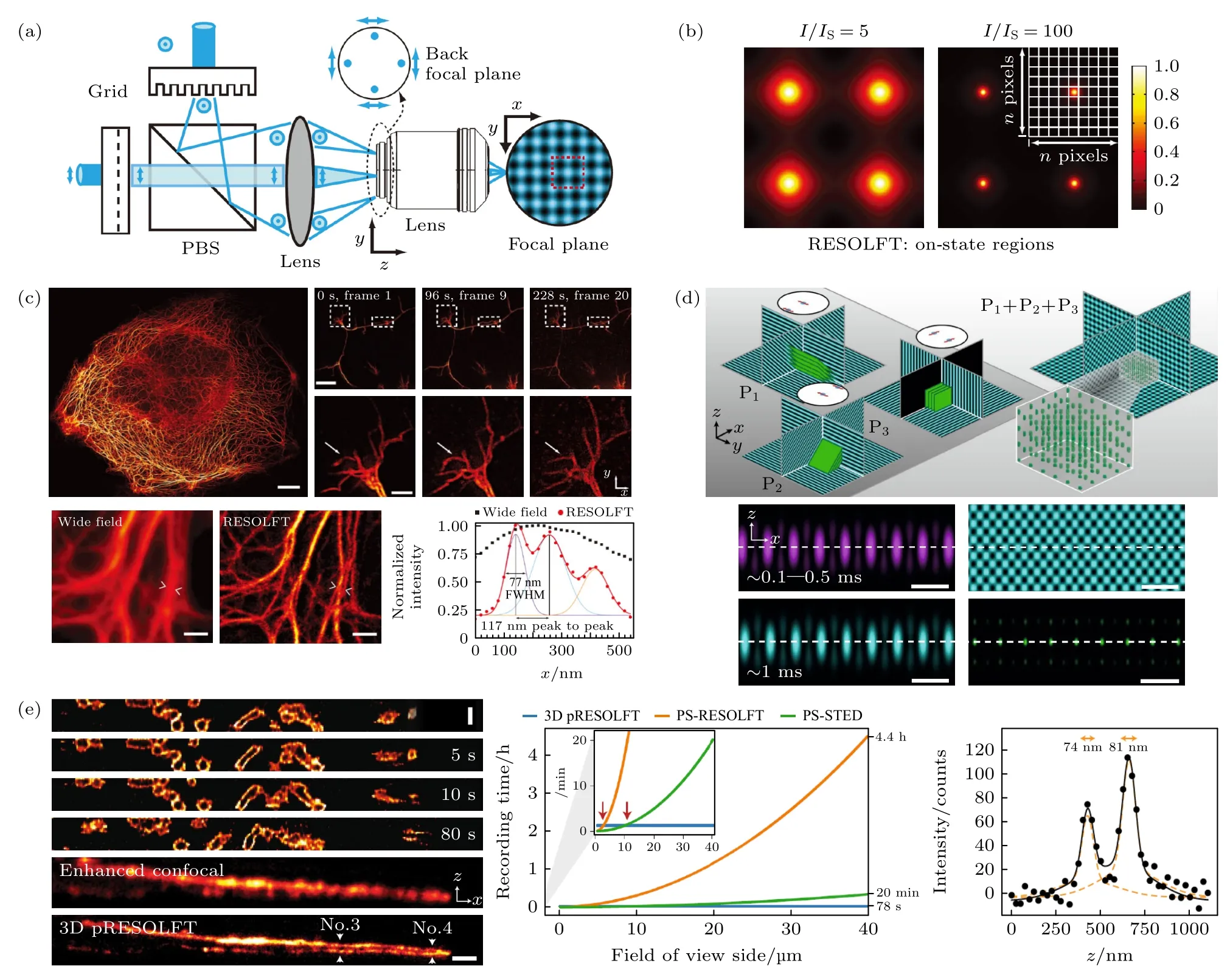
图8 并行扫描超分辨成像技术示意图(a) pRESOLFT 系统简化图[71];(b) pRESOLFT “ON” 状态下不同 I/Is 的二维强度分布图[71];(c) pRESOLFT 纳米显微镜的活细胞成像[71];(d) 3D-pRESOLFT 三种模式的驻波叠加产生蜂窝状照明阵列[81];(e) 3DpRESOLFT 纳米显微镜的活细胞成像[81]Fig.8.Schematic diagram of parallel scanning super-resolution imaging technology:(a) Simplified schematic of pRESOLFT system[71];(b) 2D profiles of the on-state probability distribution for different I/Is [71];(c) live-cell imaging with pRESOLFT nanoscopy[71];(d) three patterns of standing waves are superimposed to create a honeycomb lighting array in 3D-pRESOLFT[81];(e) live-cell imaging with 3D-pRESOLFT nanoscopy[81].
上述并行扫描成像技术,使其在二维上具备了超高时空分辨的性能,为实现各向同性的三维超高时空分辨率成像,Boden 等[81]使用3 种不同的驻波图案的相干叠加来创建一个蜂窝状的三维照明阵列,即3D-pRESOLET 技术,如图8(d)所示.在40 μm×40 μm 成像视野下,3D-pRESOLET 技术可实现1—2 Hz 的时间分辨率,并具有亚80 nm的三维各向同性分辨率.3D-pRESOLET 与单束点扫描成像方案相比,扫描步骤大大减少,将一个体积(40 μm×40 μm×1.6 μm)的记录时间从4.4 h缩短到78 s,如图8(e)所示.
为了直观对比上述相关技术,表2 从空间分辨率、时间分辨率、激光类型及波长、激发光强、光漂白程度、成像深度以及是否需要重构算法等多个方面进行了详细阐述.例如,STED 技术虽提高了空间分辨率,但激发光强都需要数倍的提升,进而导致严重的光漂白,难以在活细胞成像中应用.RESOFLT 技术基于超低激发光强,极大程度地降低了光毒性和光漂白,但时间分辨率相对较差,难以实现快速动态成像.为提高成像速度,以并行扫描成像方式为主的MSIM,pRESOFLT 等技术相继发展,但该类技术的空间分辨率提升有限.isoSTED 带来了各向同性的超高三维空间分辨率,但也同样面临着高激发光强、光漂白严重的问题,同时复杂的光学系统对系统稳定性是极大的挑战.基于上转换纳米探针的UCNP-STED 技术相比传统STED 技术降低激发光强3—4 个数量级,极大程度地降低了光毒性,同时利用近红外光激发,降低了光在样品传播中的散射效应,可提高成像深度,并且连续光的使用,极大地简化了系统复杂性,此外完全无光漂白的独特优势,可使其在超分辨领域有着很大的潜力.MINFLUX 和MINSTED 虽在严格意义上不属于点扫描成像技术,但其创新性地将STED 技术以及单分子定位技术相结合,实现了超高的空间分辨率,使光学显微镜分辨率实现了单纳米尺度的突破,但时间分辨率相当较慢,通常为分钟量级,难以实现快速动态成像.

表2 不同点扫描超分辨成像技术的关键性能指标对比Table 2.Overview of point-scanning super-resolution fluorescence microscopy techniques.
5.3 深度学习助力超高时空分辨率成像
深度学习在图像识别和图像重建等方面具有优越性能,已被应用于点扫描荧光显微成像技术中.深度学习与STED 结合,可以有效克服STED技术中光漂白严重,光毒性高及系统复杂等问题,并获得超高时空分辨率(图9(a)),使STED 技术更有利于应用于活细胞成像.2019年,Wang 等[82]基于生成对抗网络(generative adversarial network,GAN)实现了跨模态超分辨成像技术.如利用20 nm荧光珠的共聚焦图像作为输入数据,通过GAN 网络输出了与STED 图像极为接近的结果,成功分辨间距为130 nm 的两个小球,如图9(b)所示.2020年,Li 等[83]基于GAN 架构,提出了SRGAN方法,使用STED 点扩展函数的先验知识和单元格的结构信息来生成用于网络训练的模拟标记数据对,该方法可以将60 nm 分辨率的STED 图像提高到30 nm 分辨率.同年,Chen 等[84]改良的残差通道注意力网络(residual channel attention networks,RCAN)模型用来对3D 时延图像进行超分辨率的重构或者去噪,使用RCAN 在共聚焦显微镜中实现去噪和分辨率的提高,在STED 显微成像中实现约2.5 倍的横向分辨率增强,如图9(c)所示.2023年,Ebrahimi 等[85]用深度学习对STED图像进行去噪,通过减少像素停留时间来减轻光漂白和光损伤.使用20 个图像数据集,将短像素停留时间的低信噪比STED 图像和长像素停留时间的高信噪比STED 图像作为输入图像对来训练网络.将STED 显微镜的像素停留时间缩短1/40 以上,同时提高了预测精度,保持了去相关分析评估的STED 图像的横向分辨率,如图9(d)所示.深度学习网络模型的建立可以助力于点扫描成像技术中空间分辨率和时间分辨率的提高,使得传统点扫描超分辨成像技术具有超高时空分辨成像性能,更有利于实现亚细胞结构的快速动态成像.
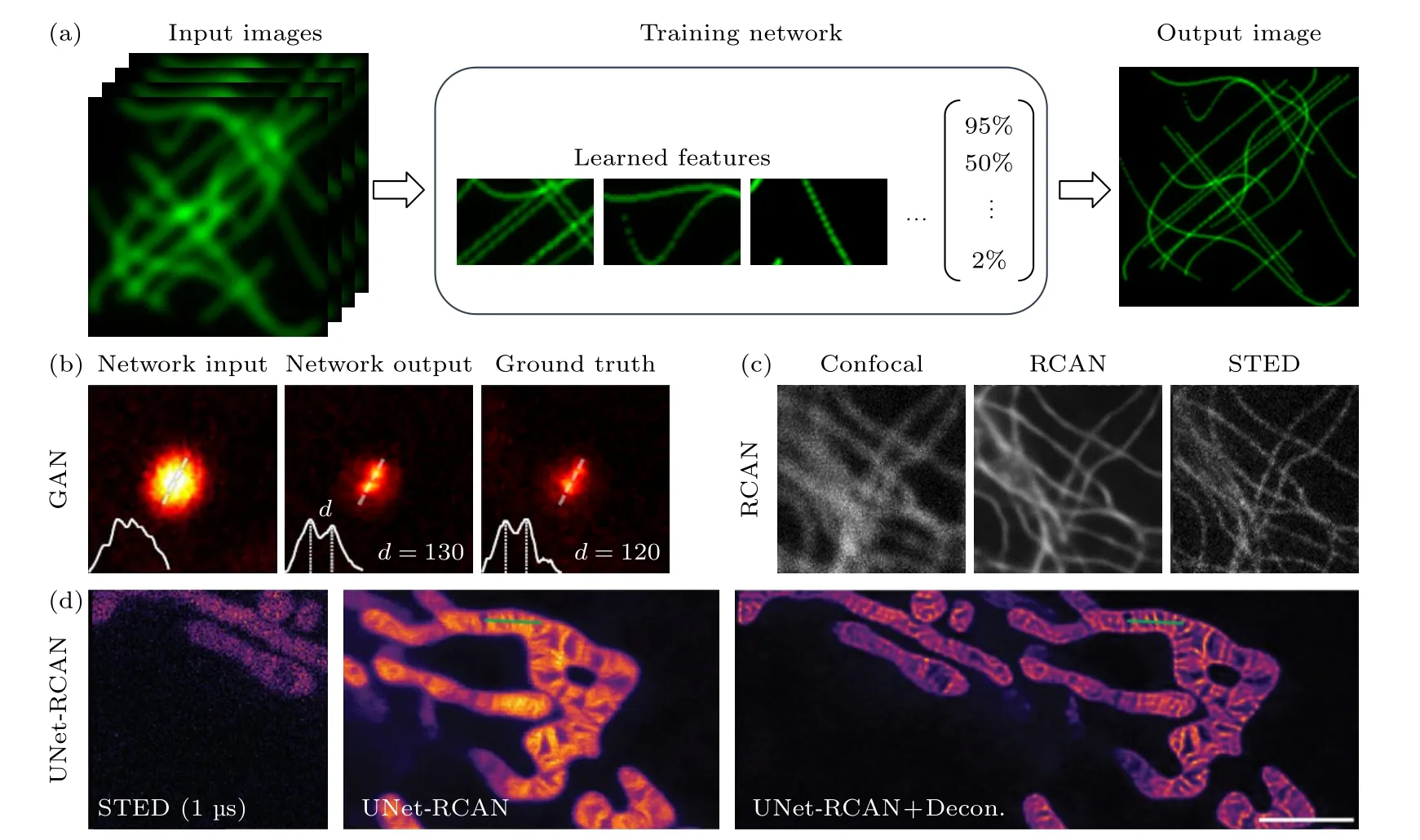
图9 深度学习助力超高时空分辨率成像示意图(a) 深度学习提高图像分辨率;(b) GAN 网络训练结果[82];(c) RCAN 网络训练结果[84];(d) Unet-RCAN 网络训练结果[85]Fig.9.Schematic diagram of deep learning-assisted ultra-high spatial-temporal resolution imaging:(a) Deep learning improves image resolution;(b) GAN network training results[82];(c) RCAN network training results[84];(d) Unet-RCAN network training results[85]
6 总结与展望
本文主要介绍了多种激光点扫描显微成像技术的基本原理和最新研究进展.传统点扫描显微镜具有分辨率高、信噪比高、可光学层切和动态成像等优势,已成为科学研究中的重要工具.但基于点扫描成像技术还有诸多方面需要进一步探究.1) 在空间分辨率方面,传统点扫描显微镜仍未突破衍射极限,无法观察到亚细胞结构及蛋白分子的相互作用.同时传统点扫描显微镜由于采用高能量密度的聚焦光斑进行扫描成像,通常会导致的光漂白和光毒性问题,在长时间活细胞观测的应用中面临着严峻的挑战.2) 在时间分辨率方面,传统点扫描显微镜基于串行光栅扫描成像模式极大地限制了成像速度.尤其针对样品进行大视野(高像素)成像时,点扫描显微镜需要重复数百万次扫描才能遍历整个样品区域,这无疑限制了其在快速获取大量数据或观察快速动态过程的应用.
为解决上述问题,在提高空间分辨率方面,研究人员做出诸多努力,发展了诸如受激辐射损耗显微镜等突破衍射极限的超分辨率点扫描成像技术.在提高时间分辨率方面,研究人员陆续开发出并行扫描的高时间分辨率显微成像技术.目前,所报道的多种点扫描成像技术分别在时间分辨率或者空间分辨率方面各有优势,但如何将二者有机的融合在一起,发展新一代具备超高时空分辨率的点扫描成像技术是未来研究的重要趋势.例如,诸多研究者也在开发并探索新型超分辨技术,如在超高空间分辨率上,利用MINFLUX 技术和MINSTED 技术可实现纳米级分辨率,以及毫秒级蛋白追踪.在超时间分辨率上,泵浦-探测(pump-probe)显微镜结合了超快激光领域的泵浦-探测技术以及显微成像技术,其时间分辨率达到皮秒甚至飞秒量级,在生物和化学领域具有重要意义[86-88],该技术与现有超分辨技术相结合有望发展为兼顾高时空分辨率的成像技术[89].
总之,激光点扫描显微镜在空间分辨率、时间分辨率以及技术融合等方面仍面临着很多挑战,同时也蕴藏着巨大的发展潜力.随着技术的不断创新发展,兼具超高时空分辨率的点扫描荧光显微镜将持续为生命科学等领域的基础研究和技术进步提供重要的工具,为人类对生物体的理解和认识带来新的突破.
