针刺调控脑缺血再灌注损伤大鼠海马区核心基因circHDAC2表达抗神经损伤的研究
2023-11-14谢灿明江姗姗刘晓月李展富汪红娟陈楚淘田浩梅
谢灿明,江姗姗,王 瑶,向 静,刘晓月,唐 红,李展富,汪红娟,陈楚淘,田浩梅
1.湖南中医药大学针灸推拿与康复学院(湖南 长沙 410208);2.安徽中医药大学第二附属医院康复中心(安徽 合肥 230061);3.成都中医药大学针灸推拿学院(四川 成都 610075);4.湖南省妇幼保健院中医科(湖南 长沙 410008)
脑卒中(cerebral apoplexy)是全球第二大死亡原因[1],其中缺血性脑卒中占70%以上,具有极大的危害性[2]。血管复通是治疗缺血性脑卒中的重要手段,但在此过程中可能会加重神经组织损伤和肢体功能障碍,此过程被称为脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI),脑缺血后神经元损伤的程度是决定预后的主要因素,寻找有效降低神经元损伤的方法十分重要。环状RNAs(circRNAs)是一类具有特殊结构的非编码 RNA,其功能多样,充当微小RNAs(miRNAs)的“海绵”是其中之一,circRNAs 竞争性结合并以海绵样方式吸附miRNAs,阻止miRNAs 与其靶信使RNAs(mRNAs)结合,从而调控靶基因的表达,即竞争性内源RNA(ceRNA)机制[3]。 研究[4-6]表明,circRNAs 的表达与神经元发育以及多种神经系统疾病紧密联系,通过高通量测序在大、小鼠大脑中动脉闭塞(MCAO)模型的脑组织中发现了变化的circRNAs 表达谱,并对其中差异表达的circRNAs 宿主基因和mRNAs进行基因本体(GO)数据库功能富集分析,发现其涉及脑形态发生、神经元到神经元突触等多种生物学过程[7-9],提示circRNAs 有望成为CIRI 治疗新靶点。课题组前期研究[10-11]证实,针刺“大椎”“水沟”“百会”穴可通过调整多种蛋白功能与多条信号转导通路抗神经元损伤,从而保护缺血损伤的脑组织。既往研究发现针刺可能通过调节circRNAs 的表达对其他疾病产生影响[12-13],因此本研究以circRNAs 为切入点,探讨针刺对CIRI 大鼠脑组织的保护作用与差异表达核心基因、转录网中mRNAs 功能之间的联系,进而为针刺调控circRNAs抗CIRI后神经损伤提供相关参考。
1 材料和方法
1.1 材料
1.1.1 动物 SPF 级健康雄性SD 大鼠54 只,体质量220~250 g,由湖南中医药大学动物实验中心提供。动物生产合格证号:SCXK(湘)2020-0004。动物使用合格证号:SYXK(湘)2019-0009。饲养条件为SPF 级动物房。室温(25±1)℃,环境湿度40%~60%,每日12 h 光照时间,不限制进食、饮水。本实验方案通过湖南中医药大学实验动物福利和伦理委员会审查(伦理批准号:LL2021081203)。
1.1.2 主要药物与试剂 戊巴比妥钠,德国Merck Kgaa 公司(批号:2203172);2% 2,3,5-三苯基氯化四唑(TTC)溶液,北京雷根生物技术有限公司(批号:DK0005);多聚甲醛,北京白鲨易生物科技有限公司(批号:BL539A);二甲苯,国药集团化学试剂有限公司(批号:10023418);甲苯胺蓝染液,武汉塞维尔生物科技有限公司(批号:G1032);超纯总RNA 提取试剂盒,康为世纪生物科技股份有限公司(批号:CW0581S);第三代全长cDNA 一链合成试剂盒(去基因组)[HiScript Ⅲ1st Strand cDNA Synthesis Kit(+gDNA wiper)]、通用型高特异性染料法定量PCR 检测试剂盒(AceQ Universal SYBR qPCR Master Mix),南京诺唯赞生物科技股份有限公司(批号:R312-01、Q511-02)。
1.1.3 主要仪器 MCAO 栓线,北京西浓科技发展有限公司[规格:(0.32±0.02)mm];恒温水浴锅,上海南阳仪器有限公司(型号:HHS-2);扫描仪,美国Agilent 公司(型号:G2505C);荧光定量 PCR 仪,美国Applied biosystems 公司(型号:ABI 7500);包埋机,武汉俊杰电子有限公司(型号:JB-P5);病理切片机,上海徕卡仪器有限公司(型号:RM2016);无菌毫针,苏州针灸用品有限公司(规格:0.25 mm×13 mm);circRNA芯片及芯片标记试剂盒,美国Arraystar 公司(型号:Human circRNA Array V2)。
1.2 分组与造模 大鼠常规饲养7 d后,采用随机数字表法选取18只大鼠定为假手术组,其余大鼠进行造模,造模成功后的大鼠随机分为模型组和针刺组,每组18 只。造模方法:造模前24 h 大鼠禁食,正常饮水,2%的戊巴比妥钠(3 mL/kg)腹腔麻醉,参照从颈总动脉插入线栓的Longa 线栓法[14]并加以改良制备大鼠右侧MCAO/R模型。造模结束后将大鼠轻放于恒温垫保温,待大鼠麻醉完全苏醒后,参照Longa 评分法[14]进行评定,1~3分的大鼠纳入实验。假手术组大鼠仅用玻璃分针分离颈总动脉、颈内外动脉。
1.3 干预方法 假手术组与模型组大鼠用鞋带捆绑四肢,俯卧位固定于鼠板30 min,每12 h干预1次,共7次。针刺组在假手术组与模型组基础上增加针刺操作,参考《实验针灸学》[15]和大鼠实验图谱[16]针刺“大椎”“水沟”“百会”穴,均匀捻转刺激1 min,频率为90 次/min,15 min后行针1次,共留针30 min。
干预期结束,大鼠完成改良Garcia 评分后,予2%的戊巴比妥钠(3 mL/kg)腹腔麻醉。全脑组织:迅速取大鼠全脑,置于-20 ℃冰箱中冷冻10 min,每组抽取5 只用作TTC 染色;用质量分数为0.9%的氯化钠溶液简单冲洗全脑组织,放入装有4%多聚甲醛的容器中固定24 h 以上,每组抽取5 只用作尼氏染色。海马组织:将取出的全脑组织置于冰盒分离缺血侧海马组织,每组随机抽取3 只用于基因芯片检测,5 只用于实时荧光定量逆转录聚合酶链式反应(RT-qPCR)检测。
1.4 观察指标与检测方法
1.4.1 神经功能损伤情况 采用改良Garcia 评分法[17]在首次针刺前和末次针刺后评估大鼠的运动功能与感觉功能,各项总计18 分,神经功能损伤越严重则得分越低。
1.4.2 TTC 染色法检测大鼠脑梗死面积 将冷冻的全脑组织置于冰上,去除后侧的小脑和低位脑干、前侧的嗅球,将脑组织按冠状位平均切成5 个脑片,每片厚薄均匀,约2 mm,放入玻璃烧杯,再倒入2% TTC 溶液,放入37 ℃水浴箱中,共染10 min,中途翻一次面,染色过程中全程避光;在染色结束后,倒入4%多聚甲醛固定,1 d 后用相机拍照。将图片导入ImageJ 软件进行脑梗死面积的测量,导出数据后利用Swanson公式[18]计算脑梗死面积百分比。
1.4.3 基因芯片技术筛选差异表达基因中的核心circRNAs 及GO 功能富集分析 测定RNA 样品的浓度和纯度后,利用核糖核酸酶R 去除各样品线性RNA 并富集circRNAs,将其扩增并转录为荧光cRNA后进行纯化,标记的cRNA 被杂交到Arraystar 大鼠circRNA 阵列,将装有杂交液的玻片装配到circRNA 表达芯片玻片,经过孵育、清洗与固定后,使用安捷伦提取软件G2505C 进行扫描,利用R 软件limma 包进行数据处理。以差异倍数(FC)>1.25,P<0.05 为筛选标准整理出模型组/假手术组、针刺组/模型组共同差异表达的circRNAs(co-DE circRNAs),再根据P值、FC、GO 条目富集数量筛选出高表达的核心co-DE circRNAs,根据在线数据库(http://www.geneontology.org)对核心co-DE circRNAs 的来源基因进行GO 功能富集分析,应用“微生信”网站将结果进行可视化分析。
1.4.4 尼氏染色法观察缺血侧海马组织神经元受损情况 石蜡切片脱蜡至水,入甲苯胺蓝染液5 min,水冲洗,1%的冰醋酸稍分化,自来水洗终止反应,监测分化程度;自来水洗后,将切片放置于烤箱烤干,二甲苯透明5 min,中性树胶透明封片。在显微镜下观察各组大鼠脑组织切片的染色结果,主要观察海马CA1 区神经元病理形态学,使用CaseViewer 软件查看图像,50 μm标尺下观察海马CA1 区神经元数量。每张切片随机采集3个视野,利用ImageJ软件统计缺血侧海马CA1区尼氏染色阳性细胞数,比较各组大鼠海马CA1 区神经元损伤程度。
1.4.5 RT-qPCR法验证核心 circRNAs表达量 每组随机取5 只大鼠冻存患侧海马组织。取30~50 mg 在液氮中研磨,参照说明书用超纯RNA 提取试剂盒提取RNA、合成cDNA,采用第三代全长cDNA一链合成试剂盒(去基因组)进行cDNA 反转录,以β-肌动蛋白基因(β-actin)为内参,进行RT-qPCR 扩增以检测各组缺血侧海马组织中核心circRNAs 的表达水平。反应条件:95 ℃预变性10 min;40个循环(95 ℃,15 s;60 ℃,60 s)。每个样本检测3 个复孔,按照2-ΔΔCt公式计算出相对表达量结果,核心基因引物由上海康成公司提供。引物序列见表1。

表1 引物序列
1.4.6 核心 circRNAs 的ceRNA 网络构建及mRNA 的GO 功能富集分析 选取经RT-qPCR 验证后与芯片结果一致的circRNAs 进行ceRNA 网络预测,利用基于TargetScan 和 miRanda 的自制靶点预测软件,以SeqMirnaCoverage>0.3、CeMirnaCoverage>0.3、P<0.05 为条件[19],筛选出对应的miRNAs 和mRNAs,构建ceRNA调控网络,使用 Cytoscape 3.8.2 软件对调控网络进行可视化展示,将预测的mRNAs 进行GO 分析,应用“微生信”网站(https://www.bioinformatics.com.cn)将结果进行可视化分析。
1.5 统计学方法 所有数据均采用SPSS 25.0 软件进行统计分析。实验数据用进行统计描述;不符合正态性分布则使用非参数检验,以中位数与四分位间距[M(Q)]表示。组内干预前后比较时,符合正态分布的资料用配对t检验,不符合则采用配对秩和检验。各组间比较时,满足正态性分布的资料使用单因素方差分析,方差齐者用 LSD 法,方差不齐者用Games Howell法。以P<0.05为差异有统计学意义。
2 结果
2.1 对大鼠改良Garcia 神经功能评分的影响 针刺干预前,与假手术组比较,各造模组神经功能评分显著降低(P<0.05),且各造模组间差异无统计学意义(P>0.05)。末次针刺干预后,与假手术组比较,各造模组神经功能评分显著降低(P<0.05);与模型组比较,针刺组评分显著升高(P<0.05);组内干预前后比较,模型组和假手术组神经功能评分差异无统计学意义(P>0.05),针刺组神经功能评分显著升高(P<0.05)。见图1。

图1 各组大鼠改良Garcia神经功能评分比较
2.2 对大鼠脑梗死面积比的影响 TTC 染色后,模型组与针刺组均出现白色梗死灶。与假手术组比较,模型组脑梗死面积比显著升高(P<0.05);与模型组比较,针刺组脑梗死面积比显著降低(P<0.05)。见图2。
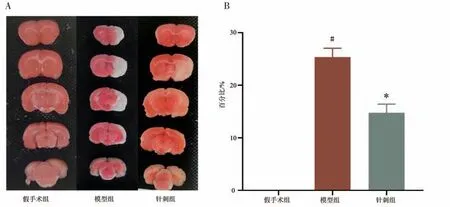
图2 各组大鼠脑梗死面积比较
2.3 基因芯片检测
2.3.1 对大鼠缺血侧海马组织circRNAs 差异表达谱的影响 假手术组、模型组、针刺组各取3 只大鼠海马组织进行基因芯片检测,将差异circRNAs用聚类图展示,结果详见图3。
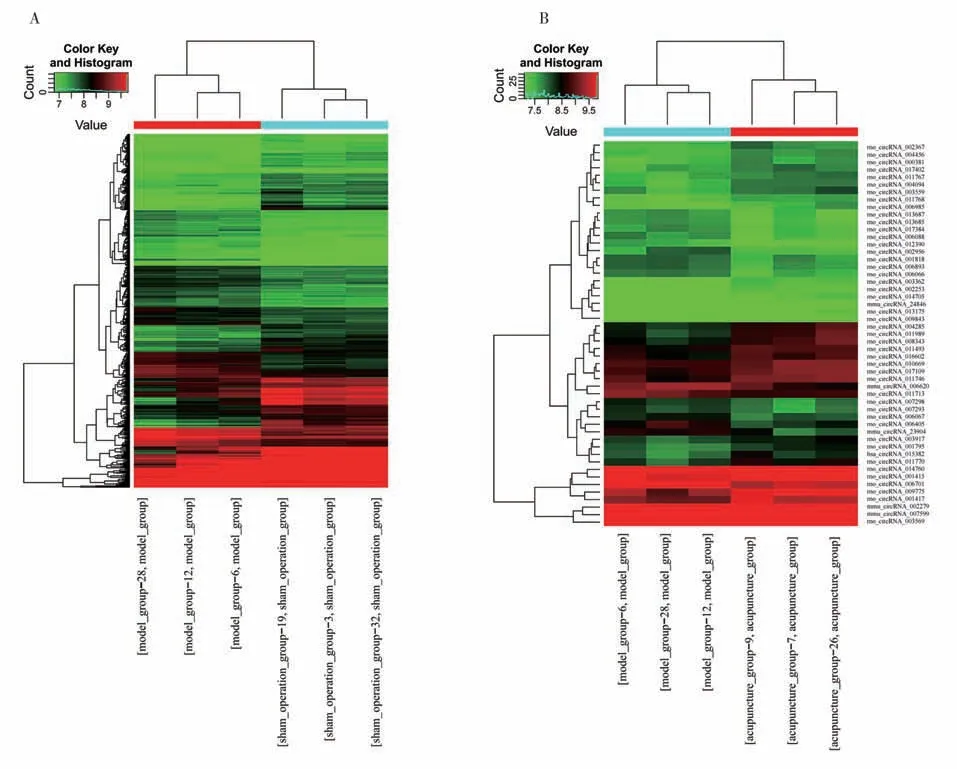
图3 circRNAs差异表达谱
2.3.2 对大鼠缺血侧海马组织circRNAs 差异表达数量的影响 模型组相较假手术组共有603 个差异表达circRNAs,其中288 个上调,315 个下调;针刺组相较模型组共有51个差异表达circRNAs,其中33个上调,18个下调。模型组下调/针刺组上调、模型组上调/针刺组下调的co-DE circRNAs为 23个。见表2。

表2 co-DE circRNAs芯片数据
2.3.3 核心co-DE circRNAs的筛选 以FC>1.25、P<0.05为条件,根据co-DE circRNAs 来源基因富集的GO 条目个数,见图4。筛选出排名前2 的核心基因为组蛋白去乙酰化酶2(HDAC2)和神经营养受体酪氨酸激酶2(NTRK2),其中芯片结果显示HDAC2为针刺干预后上调基因,NTRK2为针刺干预后下调基因,二者对应的circRNA 分别为rno_circ_009775和rno_circ_006893,根据来源基因,分别将其命名为circHDAC2和circNTRK2。

图4 co-DE circRNAs 来源基因富集的 GO 条目计数
2.3.4 大鼠缺血侧海马组织circHDAC2、circNTRK2来源基因的GO 功能富集分析 GO 富集分析由生物过程(BP)、细胞成分(CC)和分子功能(MF)组成,可初步探讨基因产物在生物体中的潜在功能。选取每个模块富集分数前10 的条目进行绘图,可见circHDAC2、circNTRK2来源基因在BP 富集于神经元的产生、神经系统发育、神经元分化等;在CC 富集于细胞质、细胞内膜结合细胞器、高尔基体等;在MF 富集于神经营养因子结合、蛋白质结合、激酶结合等。见图5。

图5 circHDAC2、circNTRK2来源基因的GO分析
2.4 大鼠缺血侧海马组织CA1区神经元尼氏染色 假手术组CA1 区神经细胞结构完整,排列整齐,细胞核多呈圆形,核仁清晰,细胞质深染,尼氏体数量多;与假手术组比较,模型组CA1 区神经细胞形态多呈空泡状,核仁不明显,尼氏体数量减少;与模型组比较,针刺组细胞结构较为完整,核仁较清晰,胞浆明显,尼氏体数量增加,海马CA1 区神经元损伤减轻。与假手术组比较,模型组缺血侧海马 CA1区神经元尼氏染色阳性细胞数降低(P<0.05);与模型组比较,针刺组神经元尼氏染色阳性细胞数升高(P<0.05)。见图6 A、图6 B。
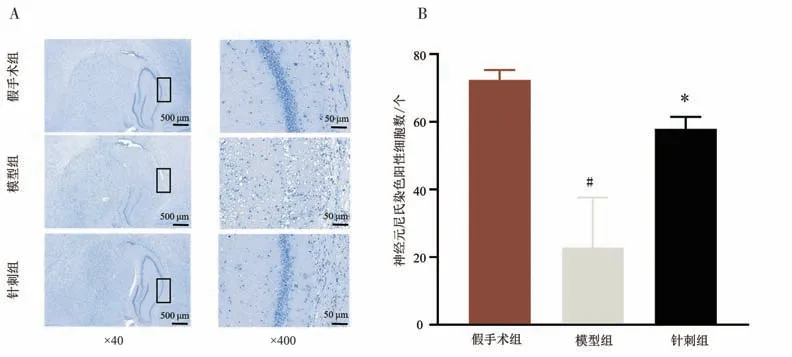
图6 各组大鼠缺血侧海马组织CA1区神经元尼氏染色情况比较
2.5 对大鼠缺血侧海马组织circHDAC2、circNTRK2表达量的影响 与假手术组比较,模型组大鼠缺血侧海马组织circHDAC2、circNTRK2表达量均显著下调,差异有统计学意义(P<0.05);与模型组比较,针刺组circHDAC2、circNTRK2表达量均显著上调,差异有统计学意义(P<0.05)。其中circHDAC2表达趋势与芯片结果一致,circNTRK2表达趋势与芯片结果相反,根据显著性结果及表达趋势,选择circHDAC2进行下一步研究分析。见图7。
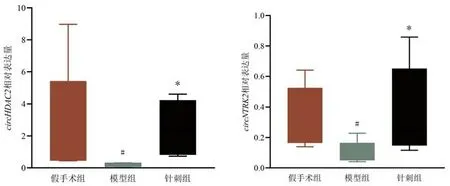
图7 各组大鼠缺血侧海马组织circHDAC2、circNTRK2表达量比较
2.6circHDAC2调控网络的构建及mRNAs的GO分析2.6.1circHDAC2调控网络的构建 基于TargetScan 和miRanda 的自制 miRNA 靶点预测软件,以SeqMirnaCoverage>0.3、CeMirnaCoverage>0.3、P<0.05 为条件筛选circHDAC2对应的miRNAs 和mRNAs,构建ceRNA 调控网络,结果显示有12 个miRNAs,31 个mRNAs。见图8。

图8 circHDAC2相关ceRNA调控网络可视化结果
2.6.2circHDAC2调控网络中的mRNAs 的GO 分析
将预测出的ceRNA 调控网络中的mRNAs 进行GO 分析,可见其在BP 富集于神经元的产生、神经元分化的调控、轴突引导、神经系统发育、神经元死亡的调节等,在CC 富集于神经元细胞体、突触、细胞质等,在MF 富集于微管结合、神经递质跨膜转运蛋白活性、丝裂原活化蛋白激酶结合等。见图9。

图9 调控网络中mRNAs的GO分析结果
3 讨论
CIRI归属于中医学“中风”范畴。一般认为本病多因气血亏虚,心、肝、肾三脏失调,复因劳逸失度、内伤积损、情志不遂、饮酒饱食或外邪侵袭等触发,进而导致机体阴阳失调,气血逆乱。其病位在脑,与心、肝、脾、肾相关。“脑髓损伤,神机失用”是中风发病之病机关键,“督脉痹阻”是其发病之经络学基础[20],因此脑部疾病的诊治常以督脉循经选穴为主。现代研究[21-22]也证实,针刺督脉穴位对于中风的疗效优于普通针灸选穴。本研究选取的大椎、水沟、百会均为督脉要穴。大椎为督脉入脑之枢纽要穴,刺之可通督醒脑,活血行气;水沟为督脉和手足阳明经的交会穴,可醒神开窍、熄风止痉;百会位于头顶正中,为百脉聚会处,可生精补髓,调理五脏六腑之功能。三穴相配,共奏补益脑髓、通督醒神之功。课题组前期研究[23-24]已证实针刺对CIRI 疗效确切,其机制可能与抑制细胞凋亡及调控多种类miRNAs 的表达相关。本研究结果显示,造模后,大鼠神经功能评分均显著降低,TTC 染色出现白色梗死灶,且脑梗死面积比升高,提示造模成功。针刺后,针刺组大鼠神经功能评分显著升高,脑梗死面积比下降,说明针刺可改善CIRI大鼠神经功能损伤,减少脑梗死面积,进而实现对脑的保护作用。
circRNAs是通过特殊的剪切方式将RNA的3'和 5'端通过共价键相连而形成的一种非编码RNA,具有高度丰富性、高稳定性和保守性[25]。circRNAs 在哺乳动物的神经元组织中高度富集,涉及神经细胞凋亡、增殖、分化以及脑缺血后神经细胞损伤[26]。目前,尽管针刺调控circRNAs 的表达抗 CIRI 鲜有研究报道,但针刺调控其他非编码RNA的表达从而发挥治疗作用已有相关文献报道。例如张亚敏等[27]采用电针“百会”“足三里”穴治疗大鼠CIRI,结果显示电针可以降低脑组织及血清miR-29的表达,提高miR-320表达水平,减轻 CIRI后脑损伤。课题组前期研究[28]亦证实,CIRI 大鼠海马组织miRNAs表达谱在针刺后可发生改变,并且针刺可下调miR-106b-5p、上调miR-34c-5p,提示针刺改善CIRI 大鼠神经功能、减少脑梗死面积可能与针刺调控miRNAs 的差异表达以及激发其功能有关。本研究通过基因芯片技术识别出针刺后的CIRI大鼠海马组织中差异表达的circRNAs,并筛选出高表达的核心co-DE circRNAs 为circHDAC2 和circNTRK2。其中芯片结果显示,HDAC2为针刺干预后上调基因,NTRK2为针刺干预后下调基因。二者GO 功能富集分析涉及神经元的产生、神经系统发育、神经元分化,可见核心基因GO 分析结果与神经元密切相关。海马对机体氧含量的变化最敏感,CIRI后海马最先受到损伤,而海马CA1区神经元最为敏感[29],因此本实验对海马CA1 区域的神经细胞进行计数。本实验结果显示,模型组缺血侧海马组织CA1 区神经元尼氏染色阳性细胞数降低,而在针刺后显著升高,证实针刺可减轻缺血侧海马组织神经元损伤。核心基因circHDAC2、circNTRK2的GO 功能富集分析结果与针刺所显示的效应一致。
进一步对核心基因circHDAC2、circNTRK2进行验证发现,与假手术组比较,模型组大鼠缺血侧海马组织circHDAC2、circNTRK2表达量均显著下调;针刺后二者表达量均显著上调,其中circHDAC2表达趋势与芯片结果一致,circNTRK2表达趋势与芯片结果相反,提示circHDAC2可能是针刺抗CIRI 的高表达关键靶点。且文献[30]研究也显示,组蛋白去乙酰化酶(HDAC)是调节细胞内蛋白乙酰化的一种重要酶,可减轻脑缺血后神经元损伤,对中风具有神经保护作用。本研究中circHDAC2定量分析、GO 功能富集分析、尼氏染色的结果恰也提示circHDAC2可能是针刺抗CIRI 后神经损伤的关键靶点。
circRNAs 最主要的生物学功能是“海绵作用”。研究[31]显示,circTLK1可充当miR-335-3p的“海绵”进而调节靶基因TIPARP的表达,进而促进缺血性脑卒中神经元损伤。本实验针对高表达关键靶点circHDAC2构建调控网络,结果显示调控网络有12 个miRNAs、31 个mRNAs。对这些mRNAs 进行GO 分析,发现其富集于神经元的产生、神经元分化的调控、轴突引导、神经系统发育等BP,神经元细胞体、突触、细胞质等CC,微管结合、神经递质跨膜转运蛋白活性、丝裂原活化蛋白激酶结合等MF。以上富集分析结果与神经损伤联系紧密,故推测circHDAC2抗CIRI 后神经损伤可能与调控网络中的mRNAs 相关,但具体是何种mRNA 还需要进一步验证。
综上所述,针刺“大椎”“水沟”“百会”能显著改善CIRI 大鼠神经功能评分与脑梗死面积比,减轻缺血侧海马组织神经元损伤,其机制可能与针刺调控缺血侧海马组织circHDAC2表达以及激发调控网络中mRNAs神经元的产生、神经元分化、神经元细胞体功能等有关。本实验未涉及调控网络中的miRNAs、mRNAs以及神经元损伤相关蛋白的验证,以上机制还需进一步深入研究。
