猕猴桃多胺氧化酶基因家族的鉴定及表达分析
2023-11-14谢羽恬张新业苏彦苹张泽银褚卓栋孙艳香
谢羽恬,张新业,2,3,苏彦苹,3,吴 双,张泽银,褚卓栋,3,冯 雪,3,孙艳香,3
(1.廊坊师范学院生命科学学院,河北 廊坊 065000;2.河北省动物多样性重点实验室,河北 廊坊 065000;3.廊坊市资源植物与应用生物技术研发重点实验室,河北 廊坊 065000)
多胺(PA)是一类含有2 个或以上氨基的低分子质量脂肪族胺类化合物,广泛分布于生物体内[1],其能够参与植物生长发育的整个过程,且与逆境胁迫响应密切相关[2]。根据氨基数目的不同,可将PA分为二元胺[如腐胺(Put)]、三元胺[如亚精胺(Spd)]、四元胺[如精胺(Spm)]等[3]。
植物细胞内的PA 浓度可以通过生物合成、降解代谢及跨膜运输等途径进行精准调控,对于维持植物正常的生长发育至关重要[4-5]。PA 主要通过二胺氧化酶(DAO,EC 1.4.3.6)及多胺氧化酶(PAO,EC 1.5.3.11)进行氧化分解[6]。DAO 内含有Cu2+,又称铜胺氧化酶(CuAO),能够催化Put降解产生4-氨基丁醛、H2O2和氨,其在拟南芥中亦可催化Spd的降解代谢[7]。PAO以FAD作为辅因子[1],一方面能够通过末端分解代谢催化Spd、Spm 生成1,3-二氨基丙烷(DAP)、H2O2及4-氨基丁醛或N-(3-氨基丙基)-4-氨基丁醛,另一方面又可通过反向转化途径将Spm、Spd 分别转化为Spd、Put,并生成3-氨基丙醛和H2O2[8-9]。
PAO 编码基因通常以基因家族的形式存在于植物基因组中。到目前,拟南芥(Arabidopsis thaliana)[10]、水稻(Oryza sativa)[11]、甜橙(Citrus sinensis)[12]、番茄(Solanum lycopersicum)[13]、苹果(Malus pumila)[14]、茶树(Camellia sinensis)[15]、小麦(Triticum aestivum)[9]、桃(Prunus persica)[16]、荔枝(Litchi chinensis)[17]、玉米(Zea mays)[18]、辣椒(Capsicum annuum)[19]等物种内的PAO 基因家族已被鉴定,成员数目多为4~10 个,但不同物种间个数存在差异。如桃、拟南芥、水稻、荔枝中PAO 基因的数目分别为4、5、7、10 个,而小麦中则鉴定到30 个PAO 基因。研究表明,PAO 通过参与PA 的末端分解代谢或反向转化途径来调节植物生命活动[17]。棉花GhPAO 能将Spm 转化为Spd,在拟南芥中过表达GhPAO能够提高H2O2、水杨酸、植保素含量及黄萎病抗性,而沉默GhPAO可降低棉花黄萎病抗性[20]。拟南芥AtPAO5 催化PA 的反向转化,其功能缺失后,可以提高拟南芥抗盐性[21],在水稻中则存在相反的机制,过表达OsPAO3能够增加水稻胚芽鞘中的PA 含量,降低H2O2的过度积累及Na+浓度,从而提高水稻萌发期的抗盐性[22]。甜橙CsPAO4 能够催化Spd、Spm 降解产生DAP 及H2O2,并促进盐胁迫条件下烟草种子萌发[23]。在桃果实成熟过程中,PpePAO1表达水平显著升高,过表达该基因可使烟草的Spd、Spm 含量显著降低,推测其可能参与PA的末端分解代谢[16]。
猕猴桃隶属猕猴桃科猕猴桃属,是多年生雌雄异株落叶藤本植物,其果实富含维生素、矿物质及其他营养成分,因此有“水果之王”的美誉。猕猴桃果实皮薄多汁,采后具有典型的呼吸跃变,因此在贮藏期间易软化,不耐储存,严重影响其贮藏、货架寿命及商品价值。研究表明,内源较高的PA 含量或外施PA 有利于延长猕猴桃的采后保鲜期[24]。PAO 是PA 降解代谢的关键酶,对维持植物内源PA平衡具有重要作用。因此,挖掘、鉴定PAO 家族成员对于猕猴桃鲜果的采后贮藏、保鲜及运输具有重要意义。截至目前,中华猕猴桃(Actinidia chinensis)Hongyang[25]、Red5[26]及毛花猕猴桃(Actinidia erianth)White[27]的基因组数据已经公布,为PAO家族成员的鉴定工作奠定了基础。本研究拟利用已公布的猕猴桃基因组序列及廊坊师范学院资源植物与应用生物技术研发团队前期获得的软枣猕猴桃(Actinidia arguta)转录组数据,对猕猴桃PAO 家族成员进行鉴定、分析,并探究它们在猕猴桃果实发育及采后贮藏过程中的表达情况。
1 材料和方法
1.1 试验材料及转录组数据获得
从廊坊师范学院软枣猕猴桃种质资源圃内选择生长健壮、长势相似、无病虫害的软枣猕猴桃龙成2 号植株,于花后135 d 摘取大小均匀、无机械损伤及病虫害的果实,并在采收当天运回实验室,室温下分别放置0、3、6、9 d,果实去皮,将果肉切成小块,液氮速冻后,埋于足量干冰内寄送至北京诺禾致源科技股份有限公司,将各样本的RNA 混合后基于Pacbio平台进行三代全长转录组测序。
1.2 猕猴桃PAO家族成员的鉴定及特征分析
中华猕猴桃、毛花猕猴桃蛋白质序列下载自猕猴桃基因组数据库(http://kiwifruitgenome.org/home)[28]。以AtPAO[10]及OsPAO[11]蛋白质序列作为查询序列,分别对中华猕猴桃、毛花猕猴桃蛋白质序列及软枣猕猴桃全长转录组数据进行BLAST 比对(E-value:1×10-5),比对结果去除冗余,并利用SMART 数据库(https://smart.embl.de/)及CD-Search工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行分析,剔除结构不完整的序列,从而获得中华猕猴桃、毛花猕猴桃、软枣猕猴桃PAO 家族成员。利用在线工具Compute pI/Mw(https://web.expasy.org/compute_pi/)分析猕猴桃PAO 蛋白的分子质量、理论等电点。从猕猴桃基因组数据库中提取中华猕猴桃及毛花猕猴桃PAO 的基因及CDS 序列,利用在线工具GSDS 2.0(http://gsds.gao-lab.org/)绘制基因结构图。分别利用SignalP-4.1(https://services.healthtech.dtu.dk/service.php?SignalP-4.1)[29]和TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)[30]预测信号肽和跨膜区。利用WoLF PSORT(https://wolfpsort.hgc.jp/)对猕猴桃PAO蛋白进行亚细胞定位预测。
1.3 猕猴桃PAO家族成员的系统进化分析
利用MEGA 6 软件[31]中内置的ClustalW 程序对来自猕猴桃、拟南芥[10]、水稻[11]、甜橙[12]、棉花[20]、玉米[32]、大麦(Hordeum vulgare)[33]的PAO 进行氨基酸序列比对,使用TBtools[34]软件中的Simple MSA Trimmer 程序修剪比对结果,最后基于Neighbor-Joining 法构建系统发育进化树,校验参数Bootstrap重复1 000次。
1.4 猕猴桃PAO家族成员结构分析
利用在线程序MEME(http://meme-suite.org/tools/meme)对蛋白质进行保守基序分析,并将鉴定到的保守基序在Pfam 数据库(https://www.ebi.ac.uk/interpro/)中注释,利用在线程序CD-Search 获取蛋白质保守结构域信息,利用TBtools基于系统进化树对保守基序、保守结构域进行可视化。
1.5 猕猴桃PAO基因共线性分析
利用TBtools软件中的One Step MCScanX 程序,基于中华猕猴桃、毛花猕猴桃的基因组及gff3 注释文件,对猕猴桃PAO 基因进行共线性分析。利用TBtools 软件中的Simple Ka/Ks Calculator 程序计算共线性基因对的同义替换率(Synonymous substitutions rates,Ks)、非同义替换率(Nonsynonymous substitution rates,Ka)以及Ka/Ks 值,并以此分析猕猴桃PAO基因进化过程中的选择压力[35-36]。
1.6 猕猴桃PAO基因表达分析
从猕猴桃基因组数据库网站获取中华猕猴桃转录组数据,分析AcPAO基因在授粉后20、120、127 d 和盛花后147、168、175、224、231 d 果实中的表达情况及其对不同储藏温度的响应情况[37-39]。
利用RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(天根公司)提取龙成2 号茎、叶及不同储藏时间(采摘后室温放置0、3、6、9 d)果实的总RNA,经浓度及纯度测定后,利用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)反转录试剂盒合成cDNA,以软枣猕猴桃Actin基因[40](表1)作为内参,利用荧光定量PCR 技术分析软枣猕猴桃AaPAO基因(表1)的组织表达模式及其在不同储藏时间的表达情况。反应体系为20.0 μL,包含cDNA 模板1.0 μL,上、下游引物各0.5 μL,2×SYBR Green qPCR Mix(艾德莱公司)10.0 μL,ddH2O 8.0 μL。反应程序:95 ℃2 min;95 ℃15 s,63 ℃20 s,72 ℃25 s,40 个循环。试验设置3 次生物学重复,利用2-ΔΔCt法计算基因相对表达量。
表1 引物信息Tab.1 Primers information
2 结果与分析
2.1 猕猴桃PAO家族成员的鉴定及特征分析
利用BLAST 检索,从中华猕猴桃、毛花猕猴桃及软枣猕猴桃中各鉴定到4、4、5 个PAO 基因,分别命名为AcPAO1—4、AePAO1—4、AaPAO1—5(表2)。AcPAO1—4分别位于中华猕猴桃0、5、11、19 号染色体上,基因长度分别为7 985、7 418、7 766、9 837 bp。AePAO1—4分别位于毛花猕猴桃12、15、20、21 号染色体上,基因长度分别为7 562、8 088、1 722、7 448 bp。除AePAO3只含有1 个内含子外,其余的AcPAO及AePAO成员均含有9 个内含子(图1)。AcPAO、AePAO、AaPAO分别编码490~496、420~496、475~496个氨基酸。AcPAO、AePAO、AaPAO 的分子质量分别为54.33~55.85、45.74~55.92、52.67~55.92 ku,等电点(pI)分别为5.34~5.74、5.39~5.77、5.29~5.79。SignalP-4.1、TMHMM-2.0 预测结果表明,AcPAO、AePAO、AaPAO 序列中均不含有信号肽和跨膜区。WoLF PSORT 预测结果表明,AcPAO、AaPAO 主要定位在过氧化物酶体,而AePAO 在内质网、液泡、细胞质、过氧化物酶体中均有分布。
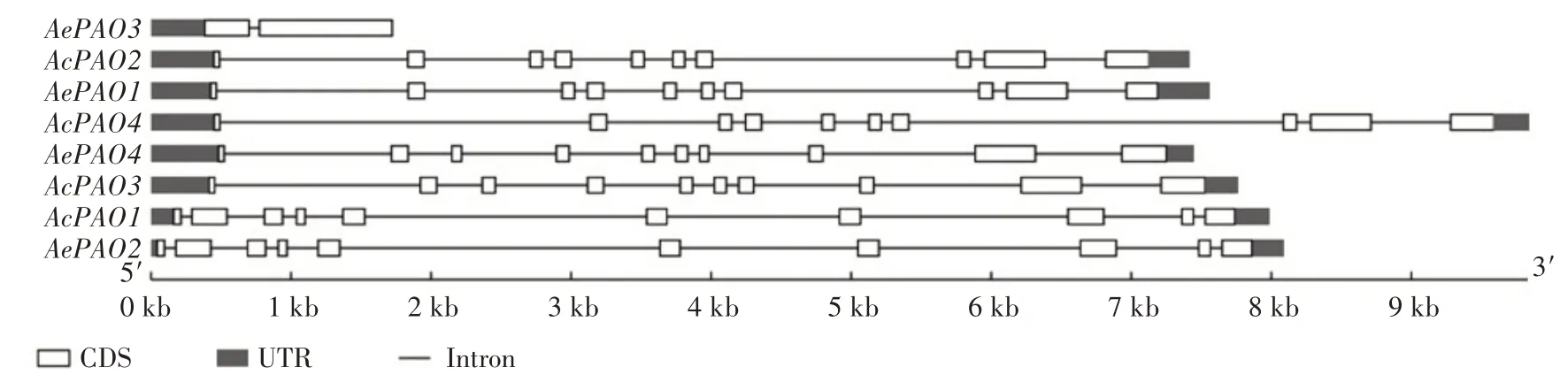
图1 AcPAO、AePAO基因结构Fig.1 Gene structures of AcPAO and AePAO

表2 猕猴桃PAO基因家族成员基本信息Tab.2 The information of PAO gene family in kiwifruit
2.2 猕猴桃PAO家族成员的系统进化分析
为了解猕猴桃PAO 家族成员的系统进化关系,利用MEGA 6 构建了来自拟南芥(AtPAO1—5)、水稻(OsPAO1—7)、玉米(MPAO)、大麦(BPAO1—2)、甜橙(CsPAO4)、棉花(GhPAO)及猕猴桃9个物种共30个PAO 蛋白的系统发育进化树。如图2 所示,AePAO3 与CsPAO4、AcPAO2 与AePAO1、AaPAO2与 AaPAO3、AcPAO4 与 AaPAO1、AcPAO3 与AaPAO4、AcPAO1 与AePAO2 亲缘关系最近,首先聚为一支;30 个PAO 蛋白可以划分为3 个类群,类群Ⅰ内成员数目最少,包含OsPAO1、AtPAO5、AePAO3、CsPAO4,类群Ⅱ内成员数目最多,包括3个AcPAO、2个AePAO、4个AaPAO、3个AtPAO、3个OsPAO,类群Ⅲ包含AcPAO1、AePAO2、AaPAO5、GhPAO、AtPAO1、MPAO及3个OsPAO、2个BPAO。
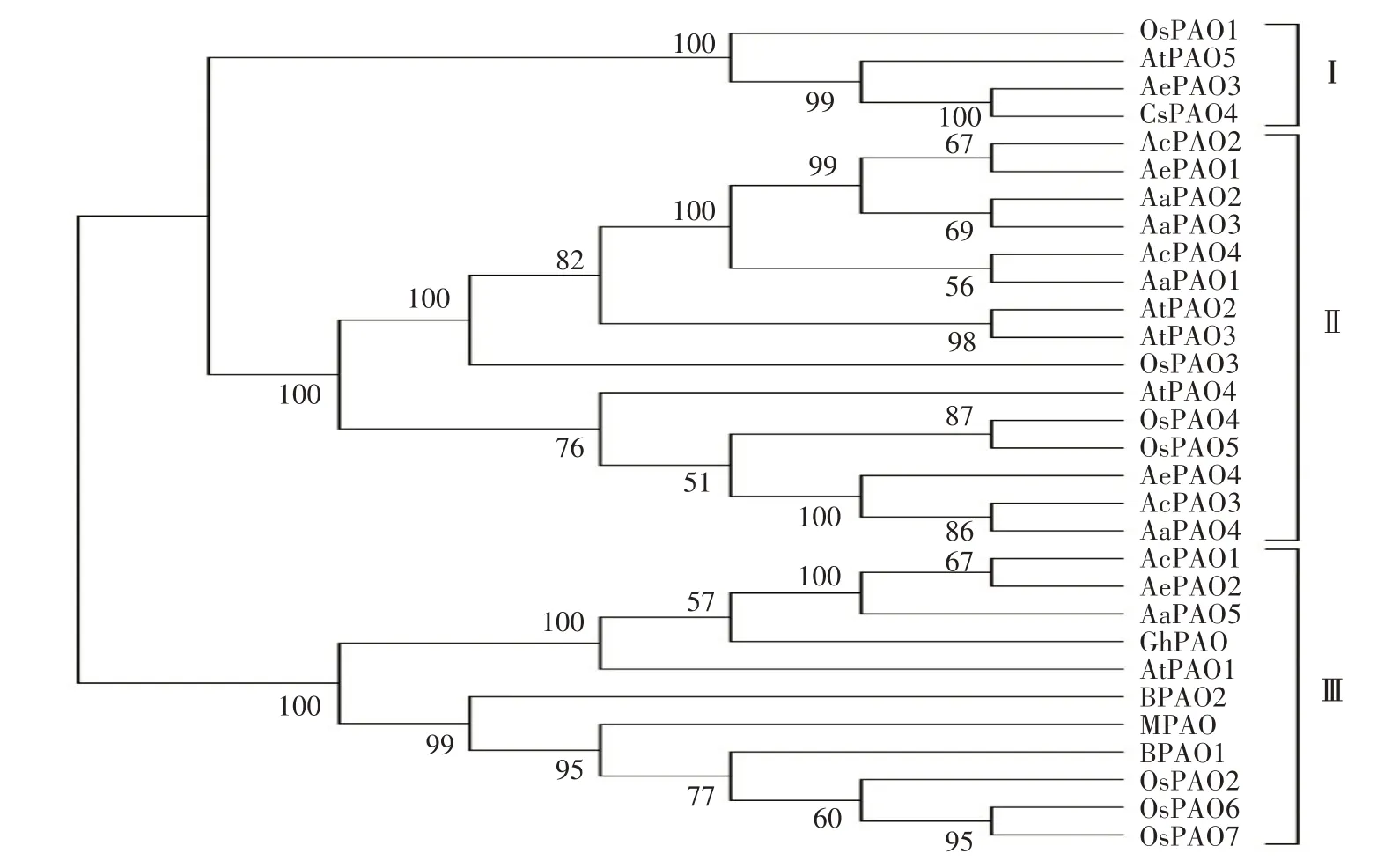
图2 猕猴桃及其他物种PAO蛋白的系统进化分析Fig.2 The phylogenetic tree of PAO proteins derived from kiwifruit and other species
2.3 猕猴桃PAO家族成员结构分析
为了进一步阐明猕猴桃PAO 家族成员的蛋白质结构,利用TBtools 基于系统进化树,对猕猴桃PAO 蛋白的保守基序及结构域进行可视化。如图3所示,利用MEME 程序在猕猴桃PAO 蛋白中检测到6种保守基序(motif1—6);除AePAO3 只含有motif1、4、6 三种保守基序外,其余成员则含有全部的6 个motif;利用CD-Search 程序在猕猴桃PAO 蛋白中鉴定到3 种保守结构域(PLN02568、PLN02268、PLN02676),三者均被注释为多胺氧化酶。如图4 所示,基于猕猴桃PAO 的多序列比对结果,对家族成员共有的保守基序进行了展示,motif1长度为50 aa,motif4 长度为41 aa,motif6 长度为38 aa,motif1、4 在Pfam 数据库中均被注释为含黄素的胺氧化还原酶;此外,AcPAO2—4、AePAO4、AaPAO1—4 的C 端均含有过氧化物酶体引导信号(PTS)保守基序(S/A/C)(K/R/H)(L/M)[12],与其亚细胞定位预测结果相一致(表2)。

图3 猕猴桃PAO蛋白的系统进化(A)、保守基序(B)、保守结构域(C)分析Fig.3 Phylogenetic tree(A),motifs(B)and conserved domains(C)analysis of kiwifruit PAO proteins

图4 猕猴桃PAO蛋白多序列比对Fig.4 Multiple sequence alignment of kiwifruit PAO proteins
2.4 猕猴桃PAO基因共线性分析
在AcPAO、AePAO间共检测到4 对共线性基因,分别是AcPAO1/AePAO2、AcPAO2/AePAO1、AcPAO3/AePAO4、AcPAO4/AePAO1,且AcPAO2、AcPAO4与AePAO1均存在共线性关系。为了阐明选择压力在猕猴桃PAO 基因家族进化过程中的作用,对共线性基因对的Ka、Ks及Ka/Ks值进行计算,4对共线性基因间的Ka/Ks值均小于1,表明它们在进化过程中经历了较强的纯化选择(表3)。
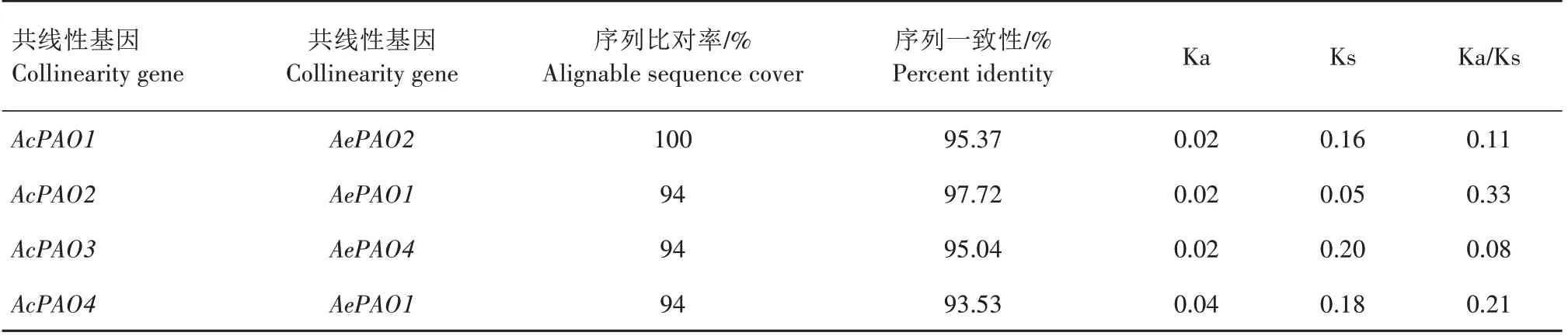
表3 猕猴桃PAO共线性基因间Ka/Ks分析Tab.3 Ka/Ks values of collinearity gene pairs in kiwifruint PAO gene family
2.5 猕猴桃PAO基因表达分析
基于转录组数据对AcPAO进行表达分析。图5A所示的是中华猕猴桃品种Hongyang 果实生长发育过程中AcPAO的表达变化情况。AcPAO1在3 个时间点基本无表达,AcPAO2在授粉后20 d 的表达量最高,分别是授粉后120、127 d 表达量的7.77、6.24倍,AcPAO4与AcPAO2表达趋势相似,而AcPAO3的表达量随发育进程呈先降低后升高的趋势。图5B所示的是AcPAO在中华猕猴桃品种Hort16A 果实不同成熟期的表达变化情况。AcPAO1在5 个时间点基本无表达,AcPAO2表达量变化不明显,AcPAO3的表达量呈现先升高后降低趋势,AcPAO4在盛花后147、168、175 d 的表达量较高,在224、231 d 表达量较低。图5C 所示的是Hort16A 果实在0、3、8、10、12、14、16 ℃及室温(RT)下储藏2 d 后AcPAO的表达情况。AcPAO1基本无表达,AcPAO2、AcPAO4在不同温度下的表达量差异较小,AcPAO3在0、3、8 ℃条件下表达量较高,在12、14、16 ℃及室温条件下表达量较低,呈先升高后降低趋势,说明AcPAO3对储藏温度的变化有一定响应。
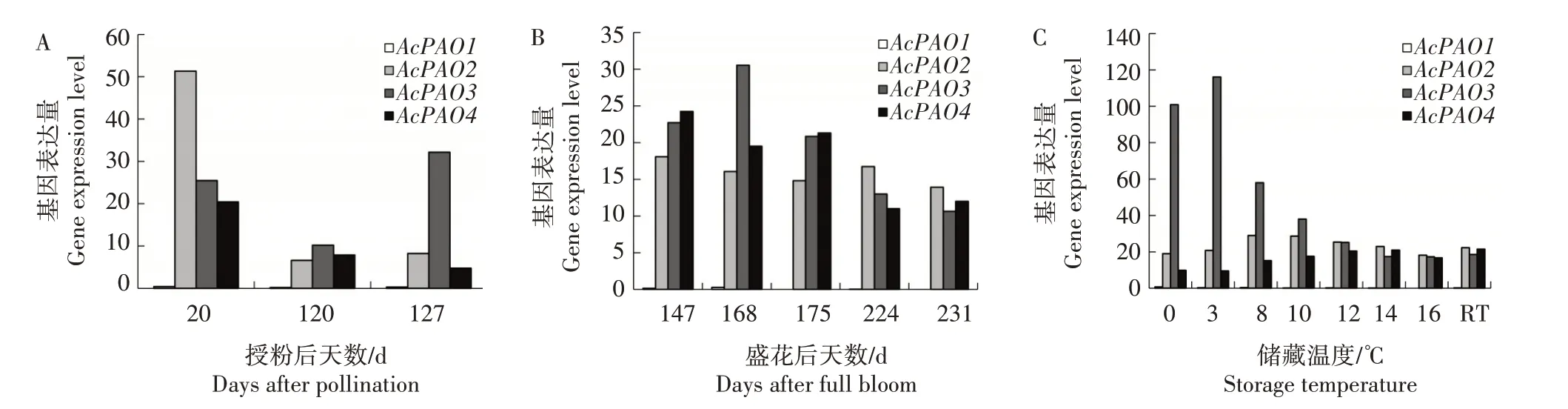
图5 基于转录组数据的AcPAO表达分析Fig.5 Expression analysis of AcPAO based on transcriptome data
利用荧光定量PCR 技术分析了AaPAO在软枣猕猴桃不同组织及储藏阶段的表达情况。AaPAO1、AaPAO3、AaPAO4、AaPAO5在茎、叶、果实中均有表达,AaPAO1、AaPAO4、AaPAO5在茎中表达量最高,果实中表达量最低,AaPAO3则在叶中表达量最高(图6A)。AaPAO1、AaPAO3、AaPAO5的表达量在储藏过程中呈现先升高后降低的趋势,AaPAO4的表达量则逐渐降低(图6B)。
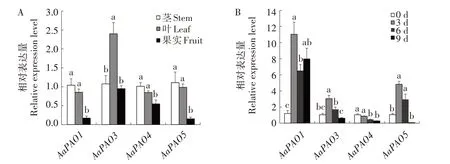
图6 AaPAO在不同组织(A)及不同储藏时间(B)的表达分析Fig.6 Expression analysis of AaPAO across different tissues(A)and storage time(B)
3 结论与讨论
植物体内PA 的动态平衡主要依赖合成及分解代谢来维持,在植物生长发育及响应逆境胁迫过程中具有重要作用[1],PAO 能够催化PA 的末端分解代谢及反向转化途径[19],PAO 通常由成员数目较少的小基因家族编码[12]。到目前为止,越来越多的植物PAO 基因被克隆、鉴定,但未见关于猕猴桃PAO 基因全基因组鉴定、结构特征、表达分析的系统报道。本研究从基因组水平鉴定了猕猴桃PAO 基因,分析其编码蛋白质的理化性质、系统进化关系、蛋白质结构及其在猕猴桃果实生长发育、储藏过程中的表达情况。
经鉴定,中华猕猴桃、毛花猕猴桃、软枣猕猴桃中分别存在4、4、5 个PAO 基因,与拟南芥[10]、水稻[11]、桃[16]中PAO 基因数目相近,表明猕猴桃PAO亦为小基因家族。系统进化分析将来自拟南芥、水稻、玉米、大麦、甜橙、棉花及猕猴桃的30 个PAO 蛋白划分为3 个类群,13 个猕猴桃PAO 蛋白在3 个类群内均有分布,AePAO3 属于类群Ⅰ,AcPAO2—4、AaPAO1—4、AePAO1、AePAO4 属于类群Ⅱ,AcPAO1、AePAO2、AaPAO5 归属于类群Ⅲ,同一类群内多数成员的亚细胞定位、motif及保守结构域分析结果亦具有相似的规律特征,如AcPAO2—4、AaPAO1—4 及AePAO4 均定位于过氧化物酶体,都含有保守结构域PLN02268 及motif1—6;AcPAO1、AePAO2、AaPAO5 定位于液泡,含有保守结构域PLN02676 及6 种motif,这与在番茄[41]、苹果[14]、荔枝[17]中的研究结果一致。共线性分析表明,AcPAO、AePAO间存在4对共线性基因,且Ka/Ks值均小于1,说明在进化过程中受到了纯化选择,且高度保守,具有相似的功能[42-44]。
李会等[41]和GHOLIZADEH 等[9]根据多物种间系统进化分析,分别对番茄SlPAO、小麦TaPAO 蛋白的功能进行推测,指出SlPAO1 及TaPAO7、10、11 作用于PA的末端分解代谢,SlPAO2—8及TaPAO2—5、8、9 则可能催化PA 的反向转化途径。前人研究结果表明,AtPAO2、3[10]、OsPAO3—5[11,45]能够催化PA的反向转化途径。根据系统进化关系,AcPAO2—4、AaPAO1—4、AePAO1、AePAO4 与它们属于同一类群。因此,它们之间可能具有相似的功能。甜橙CsPAO4[12,23]虽然催化PA 的末端分解,却与催化反向转化的AtPAO5[46]、OsPAO1[47]归于一类,与本研究结果一致。此外,类群Ⅲ中的AtPAO1[5]、GhPAO[20]及OsPAO7[48]也是分别催化反向转化和末端分解代谢。因此,本研究后续的重要任务是对猕猴桃PAO蛋白开展功能研究,并探究其作用机制。
近年来,越来越多的研究表明,PA 在肉质果成熟、衰老及品质调节方面具有重要作用[49]。收获前及采后施用PA 能够有效延迟芒果(Mangifera indica)、桃、欧洲李(Prunus domestica)、苹果果实的成熟并延长货架期[50]。草莓FaPAO5能够催化Spm、Spd 降解,并负向调控果实成熟[51]。桃PpePAO1基因被沉默后,Spd 含量显著升高,延缓果实软化,而其在番茄中过表达后,Spd、Spm含量降低,促进果实软化[52]。本研究利用转录组数据及荧光定量PCR技术对猕猴桃果实发育及储藏过程中PAO 基因的表达变化进行了分析。AcPAO1在中华猕猴桃果实中基本无表达,可能在果实发育、成熟、储藏过程中作用不大。AcPAO2、AcPAO4在授粉后20 d 的表达量最高,随后降低,与桃PpPAO4的表达变化趋势一致,而AcPAO3则与PpPAO2、PpPAO3[53]的情况相似,表达量随生长发育进程呈先降低后升高的趋势,但在果实成熟、软化过程中,AcPAO3的表达量呈现先升高后降低趋势,并对不同储藏温度存在一定响应。AaPAO基因在被测组织中均有表达,但在不同组织间的表达量存在差异,除AaPAO4表达量随储藏时间延长逐渐降低外,其余3 个成员的表达量在储藏过程中呈现先升高后降低的趋势。
本研究首次从3 个猕猴桃物种的基因组/转录组数据中对PAO 基因家族进行了鉴定,初步确定了13个猕猴桃PAO基因。它们在结构上较为保守,均含有PAO 蛋白保守结构域。表达分析结果表明,它们当中的某些成员在猕猴桃果实成熟及储藏软化过程中具有一定作用。这些试验结果可为后续猕猴桃PAO基因的功能研究提供参考。
