火龙果茎多糖对调节小鼠细胞免疫功能的研究及毒性评价
2023-11-11梁秋杨白新鹏李国胜常会敏朱恒伟桥振栓黄桂花
梁秋杨,白新鹏,*,李国胜,常会敏,朱恒伟,桥振栓,黄桂花
1. 海南大学食品科学与工程学院/热带多糖资源利用教育部工程研究中心,海南海口 570228;2. 海口植之素生物资源研究所有限公司,海南海口 570000;3. 海南北纬十八度食品科学有限公司,海南东方 572633
火龙果(Hylocereus undatus)属仙人掌科多年生攀援植物,是一种营养丰富的热带经济水果,在我国台湾、广西、广东、海南以及福建等省(区)有较大规模种植面积[1]。火龙果根茎生长茂盛,为了保证果实品质,需要不断修剪枝条,加上果实采摘后产生的大量根茎,这些果茎如果仅作为废弃物处理,不但提高了火龙果生产加工成本,还导致环境污染[2]。因此,为提升火龙果的经济附加值,减少资源浪费,对火龙果茎进行开发利用具有重要意义。
火龙果茎多糖(pitaya stem polysaccharide,PSP)作为天然活性多糖的一种,是火龙果茎的重要活性成分之一,具有抗氧化、调节肠道等生物功能,能够提高机体免疫力[3]。目前火龙果茎多糖的研究方向较多集中于提取、纯化以及抗氧化活性检测。李国胜等[4]比较了3种多糖提取方法,其中亚临界水提取得率为20.53%,远高于热水提取和超声辅助提取的得率,这一结果和马若影[5]用亚临界与微波辅助和超声微波协同提取比较得出的结论相似,说明亚临界水提取要比其他提取方法更高效;王超雪[6]利用超滤膜截留[7]和分子筛凝胶柱层析[8]纯化得到不同分子量的多糖成分,这些多糖组分浓度变化对其抗氧化活性影响较大。此外,有研究指出,利用火龙果茎多糖的生物活性应用于美容护肤上开发出的产品,具有一定的独特效果。唐雅园等[9]在制备护手霜时发现,添加火龙果茎多糖的护手霜,其DPPH自由基清除能力随着添加量的提高而显著增强,与未添加样品相比,护手霜的保湿率提高了20%以上,且添加多糖不会改变护手霜的稳定性,这是由多糖流变学性质所决定的。
除以上研究外,对于火龙果茎多糖在机体免疫调节方面的研究尚未报道。植物多糖具有显著的免疫活性,能促使机体免疫器官正常生长,提升淋巴细胞增殖能力,通过调节红细胞免疫,影响蛋白质和抗体产生,从而影响机体免疫信息[10-12]。据研究表明,孙加燕等[13]研究发现玛咖多糖浓度在0.1~10.0 mg/L范围内能促进大鼠上皮细胞增殖,在10.0 mg/L浓度时能促进上皮细胞迁移,这一结果和CHEN等[14]研究得出的玛咖多糖具备调节机体免疫功能的观点基本一致。YIN等[15]从海藻中提取的多糖具有调节机体肠道菌群和免疫应答等活性功能,刘红萍等[16]研究发现,高剂量白芷多糖处理可增强免疫低下小鼠的先天免疫功能,也可以促进小鼠脾淋巴细胞增殖。
基于以上研究基础,本研究以Balb/c小鼠为实验动物,对火龙果茎多糖样品进行毒性评价,探究火龙果茎多糖对体外小鼠淋巴细胞增殖效应,及其对环磷酰胺诱导的免疫低下小鼠细胞免疫调节活性的影响,旨在明确火龙果茎多糖是否具有免疫调节活性,为火龙果茎多糖开发为功能产品提供一定参考依据。
1 材料与方法
1.1 材料
新鲜火龙果茎由海南省东方市北纬十八度果业有限公司提供。
实验动物:Balb/c小鼠,雌性,55只,每只18~20 g。小鼠SPF环境饲养,正常供食供水(动物实验过程获得海南大学和海南医学院动物伦理委员会的批准)。
RPMI-1640培养液:RPMI-1640(Gibco),NaHCO3;HEPES,丙酮酸钠110,青霉素钠,硫酸链霉素,2-ME,胎牛血清(FBS)10%;磷酸盐缓冲生理盐水(PBS);红细胞裂解液:NH4Cl,KHCO3,EDTA(pH 7.6);环磷酰胺(cytoxan,CTX),江苏盛迪医药有限公司;刀豆球蛋白A(concanavalin A, ConA)(Sigma);脂多糖(lipopolysaccharide, LPS)(Sigma);CCK-8检测试剂盒(美仑生物)。
1.2 方法
1.2.1 体外小鼠淋巴细胞增殖效应检测 (1)火龙果茎多糖制备与配制。多糖制备:清洗干净的新鲜火龙果茎剖切去刺去芯,切成小块取200 g,在2.0 MPa,120 s的条件下进行汽爆,汽爆后使用纱布分离固体残渣,8000 r/min离心15 min,除掉沉淀,通过旋蒸浓缩上清液至1/4,按4倍体积加入95%乙醇于4 ℃低温醇沉,醇沉后6000 r/min离心10 min,取沉淀冻干,得到粗多糖PSP-1,得率为2.18%,PSP-1中总糖含量为44.64%,按马若影[5]的多糖纯化方法,利用大孔树脂对PSP-1进行脱色除蛋白得到纯化多糖PSP-2,PSP-2在PSP-1组分中约占1/5。
多糖配制:称取33.8 mg PSP-1加至676 μL二甲基亚砜(DMSO)中配成浓度为50 mg/mL的溶液,称取6.9 mg PSP-2加至690 μL DMSO中配成浓度为10 mg/mL的溶液,二者均无法完全溶解,静置有棕黄色沉淀物质,通过涡旋和冰浴超声助溶后可以成为混悬状态,由于无法确定未溶物的质量,故后续实验先混悬再吸取使用。在含10%胎牛血清的RPMI-1640培养液中将PSP-1多糖DMSO溶液配制成浓度为200 μg/mL,PSP-2多糖DMSO溶液配制成浓度为40 μg/mL,再用含10%胎牛血清的RPMI-1640培养液将待测样品稀释至所需样品液浓度。
因PSP-2在PSP-1组分中约占1/5,故设置PSP-1体外剂量为PSP-2的5倍,则最终PSP-1的培养浓度为50、5、0.5、0.05、0.005、0.0005、0.000 05 μg/mL;PSP-2的培养浓度为10、1、0.1、0.01、0.001、0.0001、0.000 01 μg/mL。显微镜下观察均未出现明显不溶物颗粒。
(2)小鼠淋巴细胞的制备。脱脊椎处死5只Balb/c小鼠,无菌环境下取脾脏进行破碎,过膜,于4 ℃,1200 r/min离心5 min,离心沉淀加入红细胞裂解液约1 mL,混匀,静置30 s;加入PBS,终止红裂,离心,循环2次;洗涤2次剩余细胞,用含10%胎牛血清的RPMI-1640 培养液将细胞悬至5 mL,对细胞样品进行活细胞计数,调节细胞浓度为4×106个/mL。
(3)淋巴细胞增殖活性检测。①对淋巴细胞毒性浓度排除。在96孔培养板中每孔加入100 μL各组细胞样品悬液,50 μL培养液,50 μL各浓度待测多糖培养液,总体积200 μL。每个样品设4个复孔,另设4孔加培养液作为正常对照组,2孔无细胞等体积培养液作为本底空白对照。细胞于含5% CO2的37 ℃培养箱中培养48 h,培养结束前12 h每孔加入10 μL CCK-8溶液。测定时将标记的细胞样品用全波长酶标仪在450 nm处读取OD值,以正常对照组细胞生存率为100%,空白对照组作为本底扣除,即0%,计算待测样品组细胞生存比率。②对T、B淋巴细胞增殖活性效应的评价。在96孔培养板中每孔加入100 μL各组细胞样品悬液,50 μL有丝分裂原(ConA终浓度1 μg/mL或LPS终浓度2 μg/mL),50 μL各浓度待测多糖培养液,总体积200 μL。每个样品设4个复孔,设4孔仅加有丝分裂原不加待测多糖培养液作为细胞增殖的阳性对照,另设4孔不加有丝分裂原作为细胞增殖的阴性对照。细胞于含5% CO2的37 ℃培养箱中培养48 h,培养结束前12 h每孔加入10 μL CCK-8溶液。测定时将标记的细胞样品用全波长酶标仪在450 nm处读取OD值,以仅加有丝分裂原的阳性对照组细胞的增殖率为100%,阴性对照组作为未增殖本底扣除,即0%,计算待测样品组细胞增殖比率。
1.2.2 体内小鼠细胞免疫调控活性检测 (1)实验小鼠分组。准备50只Balb/c小鼠,其中,空白(正常)对照组10只,免疫低下模型对照组10只,火龙果茎多糖低剂量组(125 mg/kg)10只,火龙果茎多糖中剂量组(250 mg/kg)10只,火龙果茎多糖高剂量组(500 mg/kg)10只。
(2)实验小鼠模型。小鼠随机分为5组,每组10只,提前1周经胃给予小鼠多糖,以注射等体积生理盐水为空白对照组,其余组在第1、4、7天腹腔注射环磷酰胺75 mg/kg。
(3)多糖样品的配制与干预。用纯水溶解火龙果茎多糖受试样品,配制成所需干预浓度如下,分别对应样品干预的低(125 mg/kg)、中(250 mg/kg)、高浓度(500 mg/kg)。低剂量组:125 mg/kg×0.1 kg/mL= 12.5 mg/mL;中剂量组:250 mg/kg×0.1 kg/mL= 25 mg/mL;高剂量组:500 mg/kg×0.1 kg/mL= 50 mg/mL。
CTX造模前,各浓度组干预1周,每组每天灌胃0.1 mL/10 g。第1次CTX发作后,继续干预10 d,第10天处死各组实验小鼠,评估干预效果。期间,空白对照组和模型对照组按相同方法灌胃纯水。
(4)体重观测。自实验小鼠分组开始,每天监测每只实验小鼠的体重变化,并记录。
(5)脾指数。在多糖干预终点,脱脊椎处死小鼠,无菌取脾脏,并对脏器质量称重,计算每只小鼠的脾指数。脾指数=脾脏质量/体重,单位为mg/g。
(6)全脾免疫细胞计数。在多糖样品的干预终点,参照1.2.1-(2),计算每只小鼠的全脾免疫细胞的总数。
(7)T、B淋巴细胞增殖能力检测。将细胞样品的细胞浓度调至4×106个/mL。每个样品设12个复孔,另设12孔不加有丝分裂原作为细胞增殖的空白对照。参照1.2.1-(3)检测T、B淋巴细胞在火龙果茎多糖作用后的淋巴细胞增殖比率。
(8)血细胞计数。在体内实验终点,取各组小鼠全血,柠檬酸钠抗凝处理。经适当稀释后,用血细胞分析仪检测全血中白细胞、淋巴细胞、中间细胞、粒细胞、红细胞以及血小板等成分的数量。以每升血液中的血细胞数量表示。
1.3 数据处理
所有实验结果均以均值±SD表示,数据均符合正态分布,采用单因素方差分析。
2 结果与分析
2.1 体外小鼠淋巴细胞增殖效应
2.1.1 对淋巴细胞毒性浓度排除 脾脏淋巴细胞在无诱导条件下无增殖能力,可在无诱导培养条件下通过活细胞检测评价火龙果茎多糖是否对淋巴细胞具有毒性效应,或者可能的毒性浓度范围。结果如图1,火龙果茎多糖样品在测试浓度范围内对活细胞均未表现出明显的细胞毒性效应,即在该浓度范围内火龙果茎多糖对脾脏淋巴细胞存活率均无抑制作用。PSP-1在0.5 μg/mL条件下具有一定增殖促进作用,但其他浓度条件下细胞存活率的变化不明显;PSP-2在浓度范围内均呈明显的促进增殖作用,并具有浓度依赖关系。这说明火龙果茎多糖,尤其是PSP-2可能具有诱导淋巴细胞增殖的效应。

图1 火龙果茎多糖对淋巴细胞的毒性效应Fig. 1 Toxic effects of pitaya stem polysaccharides on lymphocytes
2.1.2 对T淋巴细胞增殖活性的影响 检测淋巴细胞增殖能力是评价免疫功能最重要的指标,有丝分裂原ConA主要诱导T淋巴细胞增殖。结果如图2,在有丝分裂原ConA(1 μg/mL)诱导的条件下,火龙果茎多糖在无毒性浓度范围内对T淋巴细胞均表现出显著的增殖促进效应,并呈现一定的浓度依赖关系,PSP-1和PSP-2多糖浓度分别为50、10 μg/mL时的增殖效果最好,PSP-1为PSP-2的5倍浓度的条件下,增殖促进作用与PSP-2相当。这说明纯化后的火龙果茎多糖PSP-2可能是PSP-1促进免疫功能的主要效应成分。
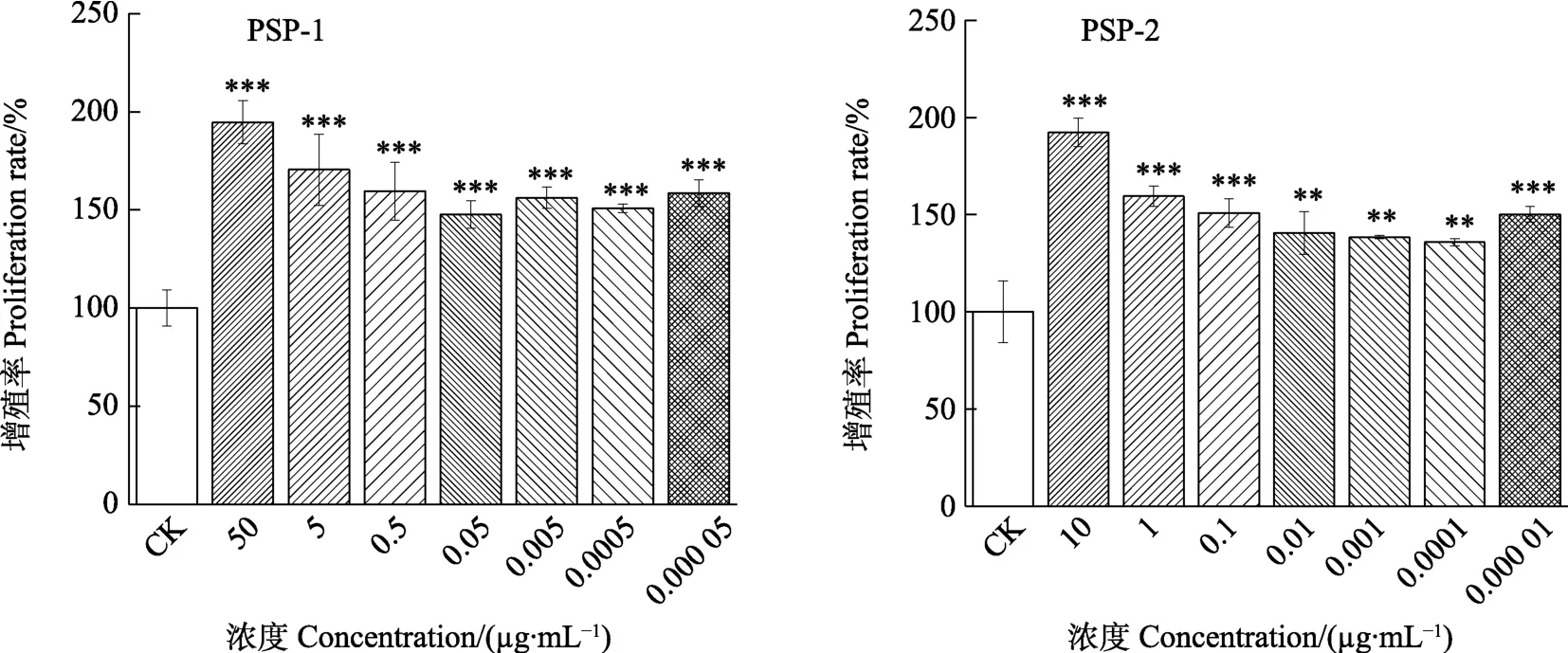
图2 火龙果茎多糖对T淋巴细胞增殖效应的影响Fig. 2 Effects of pitaya stem polysaccharides on the proliferative effect of T lymphocytes
2.1.3 对B淋巴细胞增殖活性的影响 有丝分裂原LPS主要诱导B淋巴细胞增殖。结果如图3,在有丝分裂原LPS(2 μg/mL)诱导的条件下,火龙果茎多糖在无毒性浓度范围内,PSP-1与PSP-2均未对B淋巴细胞表现出增殖促进效应。结合在无诱导条件下和ConA诱导条件下火龙果茎多糖对淋巴细胞的效应,可见火龙果茎多糖促进淋巴细胞增殖主要作用于T淋巴细胞增殖,且表现出非有丝分裂原诱导依赖的特征,而PSP-2可能为其中的主要效应成分。
2.2 体内小鼠细胞免疫调控活性
2.2.1 体重观测 结果如图4,在为期10 d的体重观测期内,各组实验小鼠在各体重监测点中均未表现出组间差异,体重基本维持在18~20 g之间。这说明环磷酰胺与火龙果茎多糖对实验小鼠体重均无明显影响。
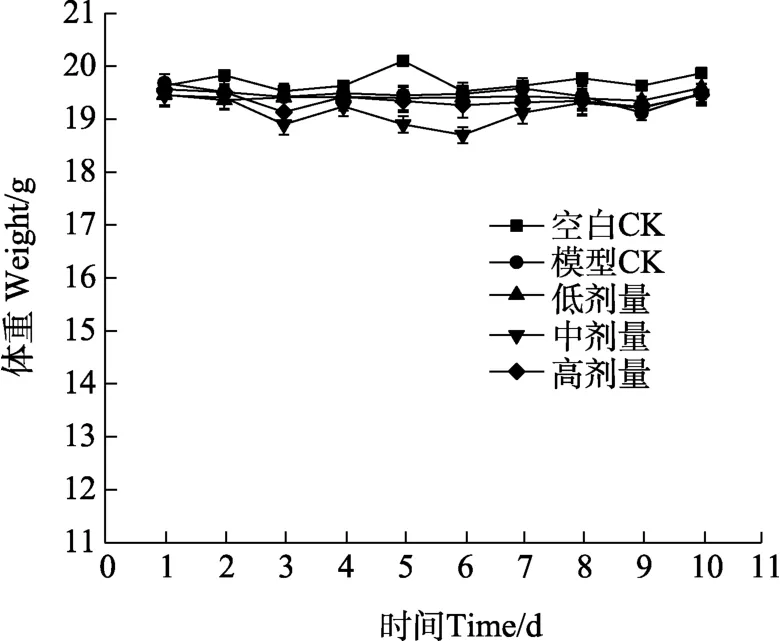
图4 小鼠体重监测结果Fig. 4 Mouse weight monitoring results
2.2.2 脾指数 结果如图5,经环磷酰胺所致的免疫低下小鼠脾指数与正常小鼠相比,其脾指数降低幅度较大,表明环磷酰胺建模可用于多糖的免疫效应评价。火龙果茎多糖模型CK、低剂量组和中剂量组的脾指数比高剂量组略低,但三组均与空白CK呈极显著差异。
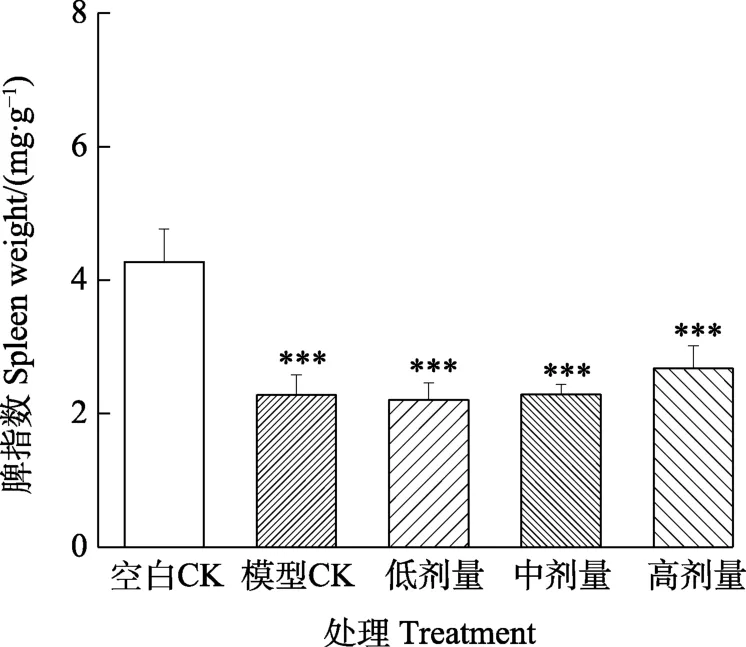
图5 小鼠脾指数Fig. 5 Mouse spleen weight index
2.2.3 全脾免疫细胞计数 对裂解后的全脾细胞进行计数,结果如图6,与正常组(空白CK)相比,模型CK、低剂量和中剂量的细胞数显著降低,而高剂量处理的全脾细胞数比这三组明显提升,且具有显著性差异。这表明经胃给予火龙果茎多糖的模型小鼠具有一定的恢复或增强免疫的效应。
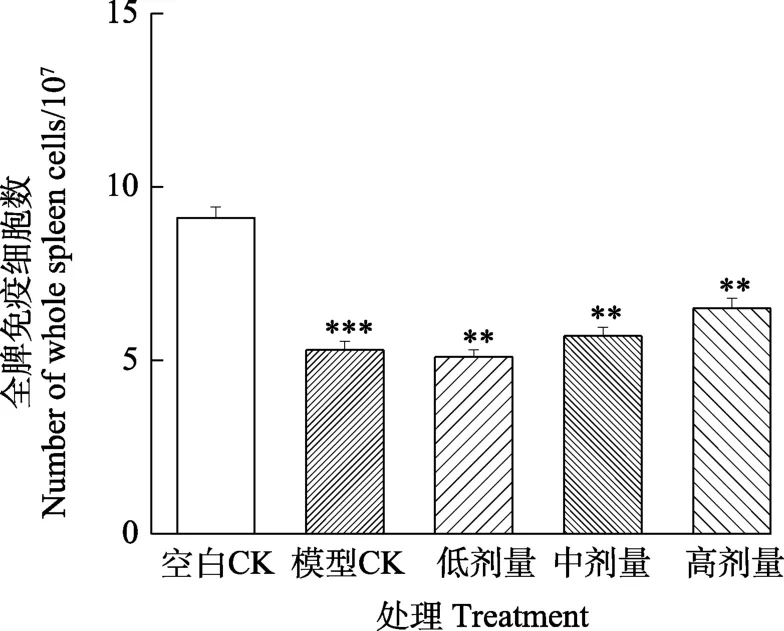
图6 小鼠脾脏免疫细胞计数Fig. 6 Mouse spleen immune cell counts
2.2.4 对T、B淋巴细胞增殖能力评价 小鼠体内淋巴细胞增殖结果如图7,火龙果茎多糖在体内促进淋巴细胞增殖效应评价中,出现了跟体外增殖实验一样的结果。结果表明,经ConA诱导的各模型处理组T淋巴细胞增殖能力明显减弱,由LPS诱导的各模型处理组B淋巴细胞也出现相同结果,但经胃给与火龙果茎多糖的小鼠T淋巴细胞增殖能力与模型CK组相比有明显的促进效应,但给予相同剂量多糖的小鼠B淋巴细胞无明显效应。这种结果的一致性进一步说明,T淋巴细胞可能是火龙果茎多糖促进机体免疫的主要靶细胞。

图7 小鼠淋巴细胞增殖率Fig. 7 Mouse lymphocyte proliferation rate
2.2.5 血细胞计数 结果如图8,环磷酰胺诱导的免疫低下小鼠模型其外周血细胞比例并未发生有规律的改变,这可能是由于环磷酰胺对骨髓抑制与造血代偿效应的相互作用造成的。其中,虽然外周淋巴细胞可能由于造血代偿导致模型处理组淋巴细胞的比例增加,而火龙果茎多糖高剂量处理组能够进一步提高其细胞比例,这与全脾免疫细胞数增加的研究结果一致,这也从另一方面表明火龙果茎多糖,特别是高剂量具有一定的免疫增强效应。
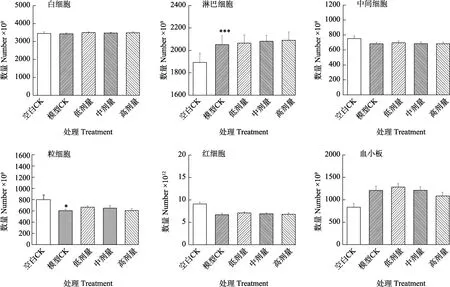
图8 小鼠血细胞计数Fig. 8 Mouse blood cell count
3 讨论
生物体通过在漫长的种系发展过程和进化历程中产生的适应型免疫应答来保证体内环境的相对平衡,这种防御机制中主要利用T、B淋巴细胞产生的不同抗体来实现免疫作用,而脾脏作为人体最主要的免疫器官,可以产生大量淋巴细胞来实现免疫作用,而免疫细胞的活跃度以及免疫器官的发育也能够反映机体免疫程度,细胞繁殖能力以及脾脏指数越高,则表示人体免疫力也越高[17-18]。
多糖是火龙果茎的重要活性物质,作为一种来源安全、天然的植物多糖,具备多种生理功能,具有较高的开发利用价值。目前关于火龙果茎多糖免疫功能的研究尚未报道,但发现多种植物多糖均具有显著的免疫活性,如茶叶多糖[19]在处理免疫低下小鼠后能显著提高小鼠脾脏和胸腺指数,也可降低脾细胞肿瘤坏死因子-α和白细胞介素-6的含量。岩藻多糖[20]可以通过增加免疫球蛋白和细胞因子的分泌,减少炎症因子的产生,从而提高免疫低下小鼠的免疫功能,并能有效缓解环磷酰胺造成的免疫器官损伤。荔枝多糖[21]可诱导脾脏细胞增殖、平衡脾脏淋巴细胞亚群比例、提高胸腺和脾脏指数等系统免疫应答。白术多糖[22]同样对淋巴细胞、脾脏细胞的增殖具有显著的提升效果。因此,本研究将火龙果茎多糖应用于免疫低下小鼠模型对其体内免疫调节活性进行研究,旨在明确火龙果茎多糖是否具有免疫调节功能,为火龙果茎多糖的功能性利用提供依据。
研究结果显示:①火龙果茎多糖PSP-1和PSP-2对原代脾脏淋巴细胞均无毒性效应。②火龙果茎多糖PSP-2在没有有丝分裂原诱导的条件下,其检测浓度范围均具有诱导淋巴细胞的增殖效应,且在0.01~10 μg/ml浓度范围内具有明显的量效关系。③有丝分裂原诱导的淋巴细胞增殖结果表明,火龙果茎多糖在LPS诱导条件下无显著的促进增殖效应,而能促进ConA诱导的淋巴细胞增殖,并具备一定的浓度依赖关系,说明火龙果茎多糖的主要效应细胞为T淋巴细胞。并且在PSP-1与5倍浓度PSP-2的效应比较中,2种多糖表现出相近的效应与量效关系,说明PSP-2可能是主要促进T淋巴细胞增殖的活性组成部分。④通过环磷酰胺诱导的免疫低下小鼠模型评价火龙果茎多糖对增进免疫功能的可能效应。结果表明,火龙果茎多糖能一定程度缓解环磷酰胺对脾脏免疫细胞数量的抑制作用,对全脾免疫细胞数量与脾指数的效应一致,且高剂量的作用更为显著。
综上所述,火龙果茎多糖在小鼠体内外的实验中均表现出对ConA诱导的T淋巴细胞增殖反应的特异性促进作用,说明T淋巴细胞可能是火龙果茎多糖促进免疫作用的主要效应细胞。而相对细胞数量与细胞增殖能力的效应,高剂量对脾指数的提升效果不显著,表明火龙果茎多糖促进免疫主要是通过增加淋巴细胞的功能实现的。
