水包油型灵芝多糖纳米乳佐剂的制备及乳化方法探究
2023-11-10王楚文李玉林石盼盼左蕾闫生辉王云龙
王楚文,李玉林,石盼盼,左蕾,闫生辉,王云龙,*
(1. 郑州大学生命科学学院,河南 郑州 450000;2. 河南省生物工程技术研究中心,河南 郑州 450000;3. 郑州职业技术学院生命健康学院,河南 郑州 450000)
非洲猪瘟对猪的致病性以病程短、高热和出血性病变为主要特征,具有极强的传染性和较高的病死率。自2018年传入我国以来,给养猪业带来沉重打击,是重点防范的一类动物疾病[1]。针对该疾病目前已开展多种疫苗研究,其中,亚单位疫苗具有比传统疫苗安全性高、可操作性强、能够规模化生产等优势,成为非瘟疫苗研制的主要方向之一[2]。然而,优选的抗原片段因缺乏致病成分,难以激活天然免疫,因此需要使用佐剂协同疫苗诱导强烈、持久的免疫反应[3]。灵芝多糖是灵芝中含量最丰富的成分之一,具有多种生物活性,可促进巨噬细胞增殖,以及T淋巴细胞、B淋巴细胞、自然杀伤细胞和其他免疫细胞的活化,促进脾细胞增殖并产生细胞因子和抗体[4]。因此,可利用灵芝多糖提高疫苗免疫效果。本研究采用纳米技术制备灵芝多糖纳米乳佐剂并对其进行初步应用和品质评价,旨在开发一种安全有效的佐剂提高疫苗质量,并为研发安全、高效且易于使用的疫苗佐剂提供参考和方法借鉴。
1 材料与方法
1.1 主要试剂与设备
非洲猪瘟病毒重组抗原P72溶液由河南省生物技术研究中心提供;医用白油52号购自美国埃克森美孚化工商务有限公司;Span-80、Tween-80、PEG-400购自西格玛奥德里奇(上海)贸易有限公司;灵芝多糖购自杨凌慈缘生物技术有限公司;ISA201 VG、ISA61 VG、ISA15 VG购自赛彼科(上海)特殊化学品有限公司。剪切乳化机购自弗鲁克流体机械制造有限公司;马尔文激光粒度仪购自英国马尔文公司;超声细胞破碎仪(超声探头16#)购自宁波新芝生物科技股份有限公司;电子天平购自奥豪斯仪器有限公司;高速离心机购自湖南湘仪仪器有限公司。
1.2 组方筛选
1.2.1 纳米乳组分的确定
综合考虑组分原料的安全性等因素,选择进口医用白油Marcol-52为制备纳米乳的油相,常用的非离子表面活性剂Span-80、Tween-80为制备纳米乳的表面活性剂,PEG-400为助表面活性剂。
1.2.2 表面活性剂复配比例筛选
采用复合表面活性剂,以进口医用白油Marcol-52为油相,PEG-400为助表面活性剂,固定Km=2∶1,绘制伪三元相图,筛选出Span-80、Tween-80最佳复配比例。
1.2.3 Km值筛选
将表面活性剂与助表面活性剂按照质量比3∶1、2∶1、1∶1、1∶2、1∶3混合均匀,绘制伪三元相图,筛选出最佳Km值。
1.2.4 水滴定法绘制伪三元相图[5]
将油相与复配后的表面活性剂按质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1准确称量并置于平底玻璃烧杯中。在室温条件下,边搅拌边缓慢滴加水相至溶液澄清,然后根据最终加入的水相质量,计算乳液体系各组分在临界点的质量百分比,使用Origin 2021软件绘制纳米乳相应的伪三元相图。
1.2.5 水包油型灵芝多糖纳米乳组方确定及制备
选取伪三元相图纳米乳区的中央附近点作为纳米乳处方。从“1.2.3”筛选的伪三元相图中央选取5个点作为乳液候选配方,检测各组乳液体系粒径、聚合物分散指数(PDI)、黏度和离心稳定性。
1.3 乳化方法筛选
1.3.1 免疫制剂制备
将ASFV-P72抗原溶液与佐剂ISA201 VG、ISA61 VG、ISA15 VG混合,按照说明书制备疫苗候选物备用。
将200 g灵芝多糖溶于抗原缓冲液中配制20%的灵芝多糖溶液,与ASFV-P72抗原原液混合制备含1%、2%、4%、8%、10%灵芝多糖的抗原溶液,分别与“1.2.5”中制备的GLP-NE佐剂混合,用于乳化方法探究。
1.3.2 不同乳化方法GLP-P72疫苗候选物的制备
将稀释后的非洲猪瘟病毒P72抗原溶液分别在剪切搅拌转数为300、500、1 000、1 500、2 000 r/min及超声功率为100、200、300、400、500 W(超声/停止时间为3 s/3 s)条件下缓缓加入到GLP-NE佐剂中至完全乳化。
1.3.3 不同乳化时间GLP-P72疫苗候选物的制备
将稀释后的非洲猪瘟病毒P72抗原溶液在步骤1.3.2筛选的乳化设备参数条件下缓缓加入到GLP-NE佐剂中乳化,分别在不同时间取样检测。
1.3.4 离心稳定性
吸取样品10 mL装入15 mL透明离心管中,放入离心机中,10 000 r/min,(4±2)℃、(23±2)℃离心20 min,观察免疫制剂是否出现分层、破乳、浑浊及沉淀析出等现象。
1.3.5 贮藏稳定性
吸取样品10 mL密封于西林瓶中,分别贮藏于(4±2)℃、(37±2)℃条件下,每隔7 d观察免疫制剂是否出现分层、破乳、浑浊及沉淀析出等现象。
1.4 GLP-P72纳米乳疫苗候选物检验
1.4.1 GLP-P72纳米乳疫苗候选物结构鉴定
使用红色油溶性染料苏丹红Ⅲ和蓝色水溶性染料亚甲基兰在纳米乳中扩散快慢来判断,如果蓝色的扩散速度大于红色,则纳米乳为水包油(O/W)型,反之为油包水(W/O)型。
1.4.2 GLP-P72纳米乳疫苗候选物微观形态及粒径分布
取GLP-P72纳米乳蒸馏水稀释100倍,透射电镜下观察纳米乳的微观形态;使用激光粒度仪检测纳米乳液滴粒径分布,通过图像分析系统显示出粒径分布图。
1.4.3 黏度检测
纳米乳取样后用口径1.2 mm的1 mL吸管吸取油乳剂1 mL,室温下以垂直自然流出0.4 mL所需时间表示油乳剂的黏度。
1.4.4 组织病理学检查
为了进一步研究GLP-NE佐剂的生物安全性,通过HE染色对小鼠的重要器官(心、肝、脾、肺、肾)进行病理学检查。
1.4.5 动物免疫及检测
将制备免疫制剂以肌肉注射方式免疫6~8周的雌性昆明鼠,空白组为100 μL PBS,每组5只,每只每次注射100 μL(抗原含量50 μg),免疫2次间隔14 d,分别在初次免疫后第0、7、14、21、28、35、42、49天尾静脉取血,间接ELISA法检测血清抗体效价。
1.5 数据分析及图形绘制
使用Graphpad Prism 8.0软件对各组数据进行统计学分析和曲线图绘制。
2 结果与分析
2.1 组方筛选
2.1.1 表面活性剂复配比例筛选
由图1可知,固定Km为2∶1,Tween-80与Span-80质量比为3∶1所制备的纳米乳液乳区面积最大。
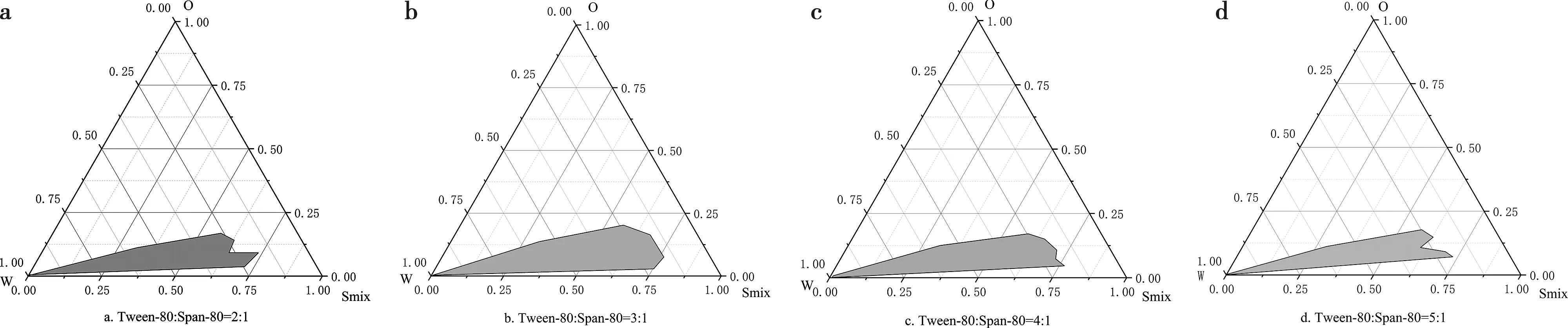
a. Tween-80∶Span-80=2∶1;b. Tween-80∶Span-80=3∶1;c. Tween-80∶Span-80=4∶1;d. Tween-80∶Span-80=5∶1。
2.1.2 Km值筛选
由图2可知,微乳区大小顺序为:Km(2∶1)>Km(3∶1)>Km(1∶1)>Km(1∶2)>Km(1∶3),因此,确定Km值为2∶1。
2.1.3 组方确定
从形成纳米乳区域最大的Km=2∶1(Tween-80∶Span-80=3∶1)的伪三元相图(图2b)中央选取5个点(NE1~NE5)的各组分比例作为乳液候选配方(表1),检测各组纳米乳液的混合表面活性剂(Smix)含量、油相(O)含量、水相(W)含量、粒径、PDI值、黏度和离心稳定性。根据最佳黏度、粒径、PDI值和离心稳定性最终确定灵芝多糖纳米乳的组方:混合表面活性剂(Tween-80、Span-80、PEG-400质量比3∶1∶2)32%、油(Marcol-52)12%、水相(PBS)53%~55%、灵芝多糖1%~3%(均为质量分数)。

a. Km=3∶1;b. Km=2∶1;c. Km=1∶1;d. Km=1∶2;e. Km=1∶3。
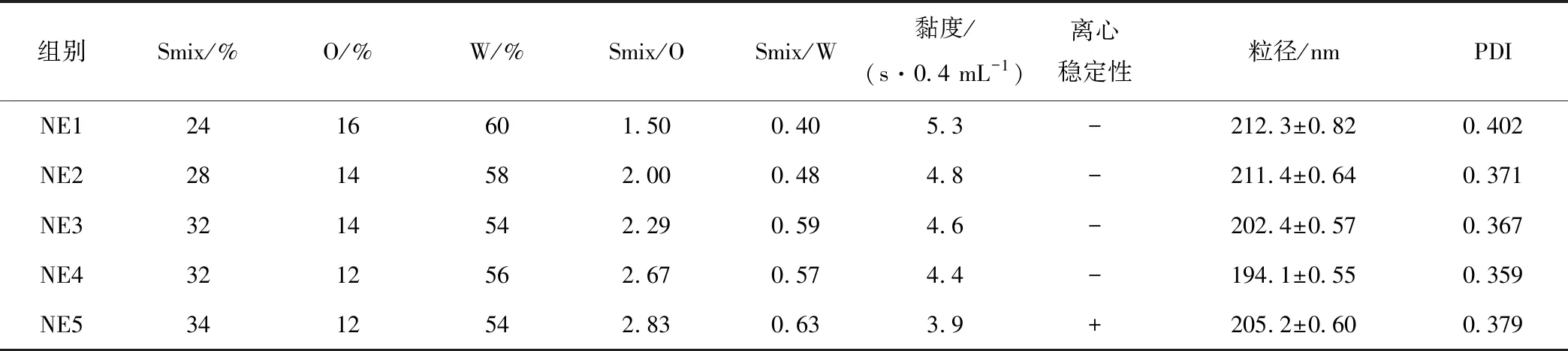
表1 各组乳液配方参数
2.2 GLP-NE佐剂乳化方法探究
2.2.1 不同乳化方法对乳液粒径和PDI值的影响
完全乳化后的纳米乳在不同乳化方法下的参数变化,如图3。纳米乳液粒径在1 500 r/min以内随着剪切搅拌转数(图3a)的增加而降低,当转数达到1 500 r/min时PDI值最低,此时乳液粒径为(173.3±0.33)nm。超声功率(图3b)在400 W时纳米乳粒径为(75.86±0.85)nm,PDI值为0.392;功率在300 W时PDI值为0.282,粒径(96.21±0.54)nm。因此,以均一程度为判定标准,分别确定该佐剂在2种乳化方法下的最佳剪切转速和超声功率为1 500 r/min和300 W。

a. 不同剪切搅拌转速对样品参数的影响(内插图为不同搅拌转速下乳液粒径大小);b. 不同超声功率对样品参数的影响(内插图为不同超声功率下乳液粒径大小)。
2.2.2 不同乳化时间对乳液粒径、黏度和PDI值的影响
2种乳化方法下不同乳化时间的纳米粒径、黏度及PDI值见图4。剪切搅拌乳化20 min时粒径和PDI值在达到最低,分别为(169.4±0.28)nm和0.251后趋于稳定(图4a)。超声乳化30 min时粒径和PDI值均达到最低分别为(96.11±0.46)nm和0.274(图4b)。超声乳化法较剪切搅拌乳化法降低疫苗粒径更为显著,但还需要结合稳定性试验来验证乳液参数的可靠性。
2.2.3 不同乳化方法对纳米乳离心稳定性的影响
分别以1 500 r/min、20 min和300 W、30 min制备的样品在低温、常温条件下4 000 r/min离心20 min后均未出现破乳分层现象,见表2。剪切组疫苗在2种离心试验后的黏度、粒径和PDI参数数值均变化不大,超声组疫苗常温离心后参数变化波动,剪切搅拌法制备的纳米乳稳定性在离心试验中优于超声乳化法。

表2 不同乳化方法疫苗离心稳定性试验
2.2.4 不同乳化方法对纳米乳贮藏稳定性的影响
不同方法制备的纳米乳贮藏稳定性如图5所示。在(4±2)℃环境下静置时,剪切组粒径、PDI无显著变化;超声组在第42天检测时出现分层、破乳现象,且粒径、PDI值在储存期间变化显著。在(37±2)℃环境下静置时,剪切组在第14天后出现分层,而超声组在7 d后出现分层现象。在离心和静置试验中,剪切乳化法制备纳米乳稳定性优于超声组。因此,结合纳米乳液均一度、离心稳定性和贮藏稳定性,确定GLP-NE佐剂乳化方法为1 500 r/min剪切搅拌20 min。
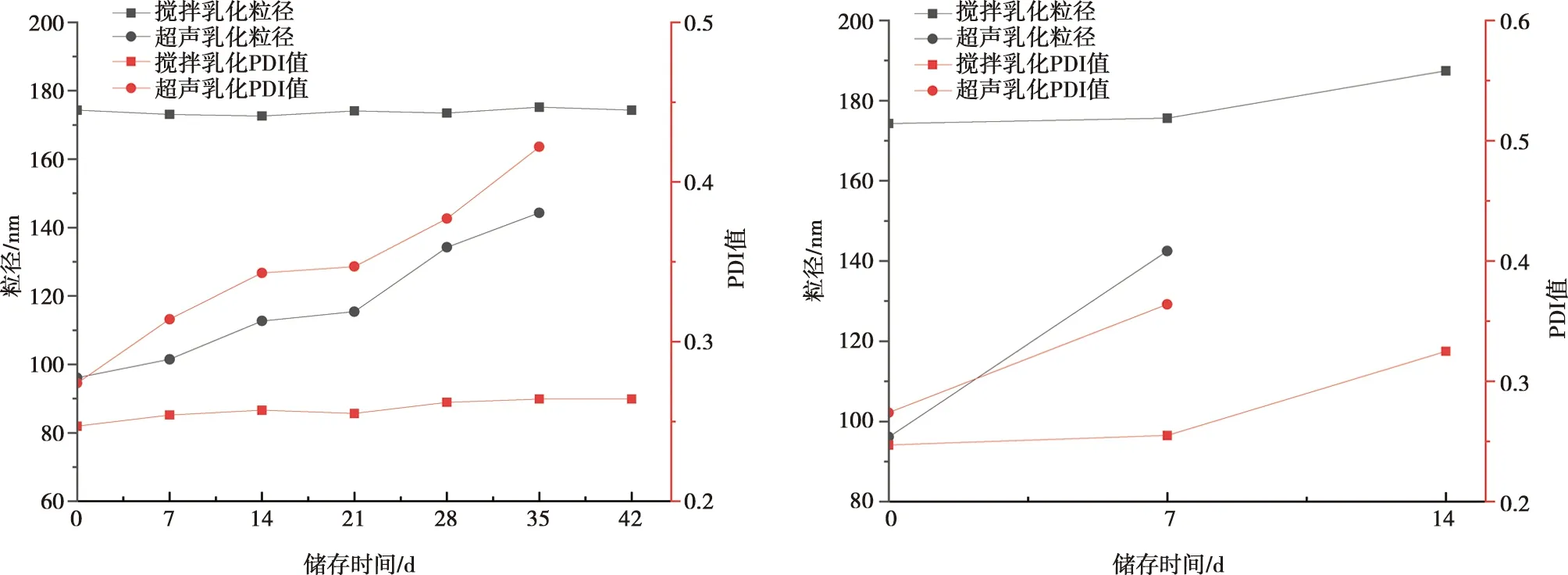
a. (4±2)℃条件下静置对2组样品参数的影响;b. (37±2)℃条件下静置对2组样品参数的影响。
2.2.5 不同佐剂疫苗样品稳定性比较
以剪切搅拌方法制备的不同浓度GLP-P72纳米乳液与ISA201 VG、ISA61 VG、ISA15 VG稳定性比较观察免疫制剂样品分层情况,见表3。从表中可知,在各组稳定性试验结果中,空白NE佐剂稳定性与ISA61 VG佐剂相当,可在(4±2)℃环境下贮藏42 d以上。
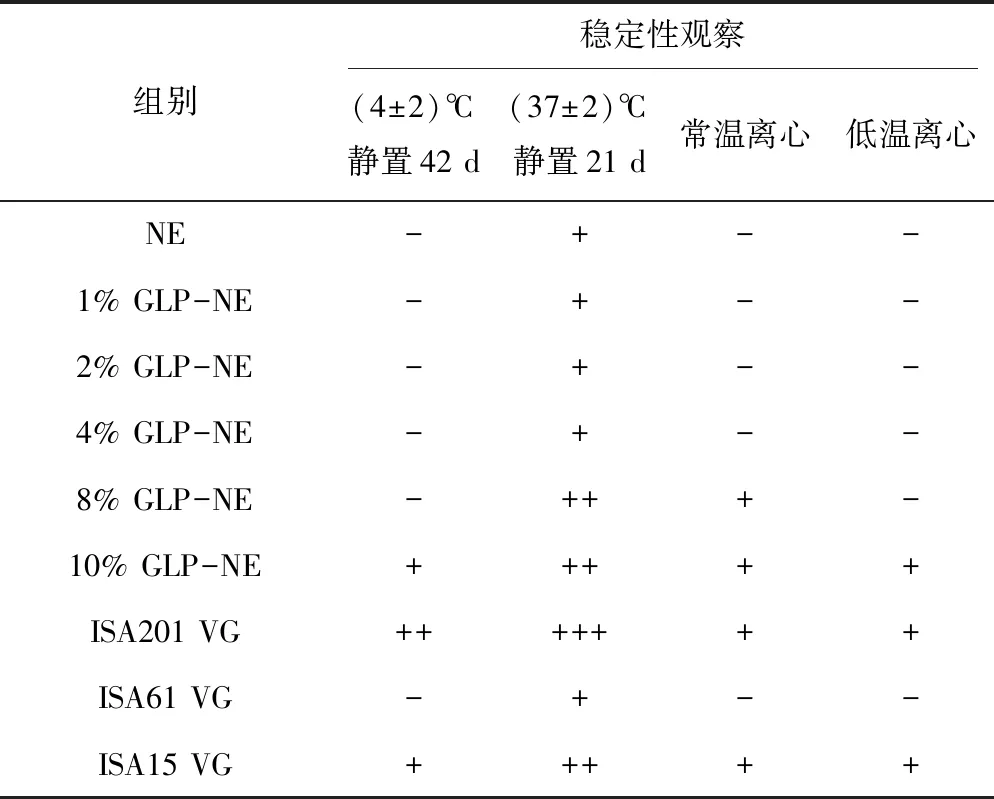
表3 不同油乳佐剂疫苗样品稳定性试验
2.3 GLP-P72纳米乳疫苗候选物检验
2.3.1 GLP-P72纳米乳疫苗候选物物理性状检验
如图6所示,蓝色染料(亚甲基蓝)在乳液中扩散程度高于红色染料(苏丹红),说明该佐剂为水包油(O/W)型佐剂(图6a)。经检测后GLP-P72纳米乳液滴粒径为(167.4±0.1)nm,PDI值为0.253(图6b)。GLP-P72纳米乳液滴呈球形,大小较为均匀(图6c)。0.4 mL的GLP-P72纳米乳流出时间为4.2 s,黏度为4.2 s/0.4 mL。
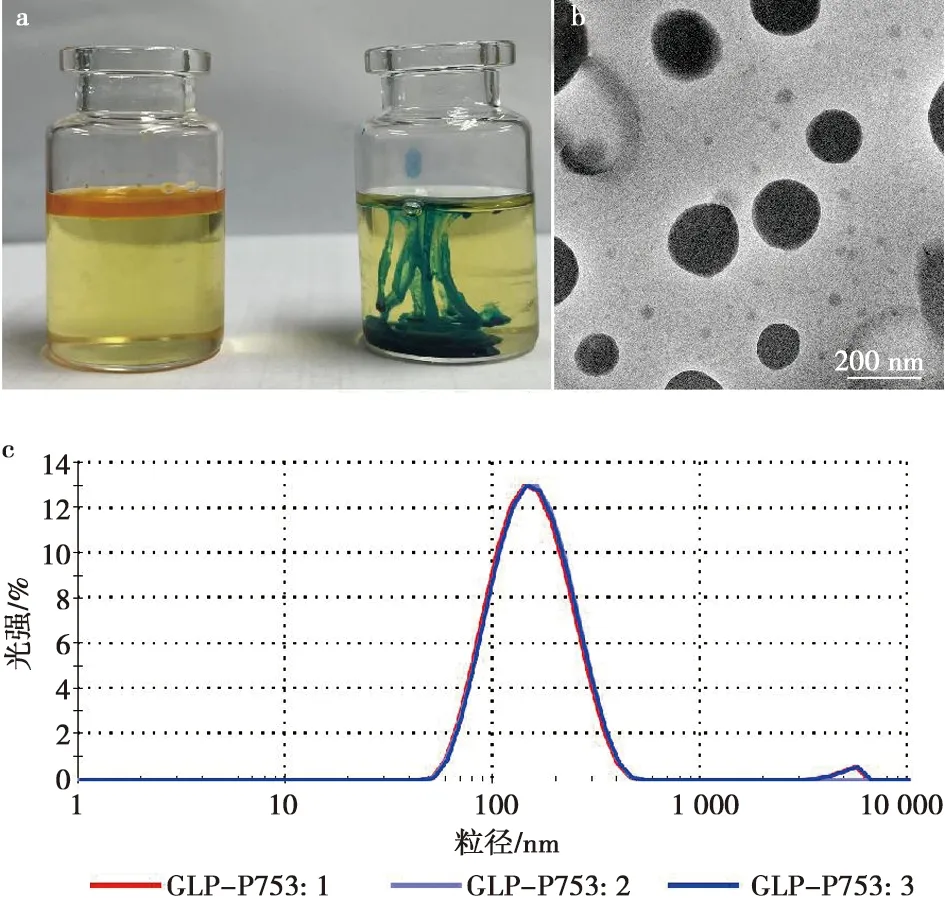
a.纳米乳结构鉴别;b. 纳米乳微观形态;c. 纳米乳液粒径分布。
2.3.2 组织病理学检查
通过HE染色对小鼠的重要器官(心、肝、脾、肺、肾)进行病理学观察,结果如图7所示,各组组织器官中均没有发现明显的病理变化。
2.3.3 动物免疫及检测
由于ISA201 VG和ISA15 VG佐剂制备的候选疫苗在14 d内破乳分层,因此这2种佐剂不满足两次免疫使用条件。经免疫后,小鼠产生IgG特异性抗体的水平如图8所示,灵芝多糖浓度为1%~3%的GLP-NE佐剂组小鼠血清的P72特异性IgG抗体效价在第35天达到顶峰,抗体效价约为1∶128 000,显著高于ISA61 VG佐剂组和无佐剂组。

ns表示P> 0.05;***P<0.001。
3 讨论
疫苗佐剂研发过程中,多数研究者以油乳液为载体,引入不同活性成分提高佐剂效应,从而增强疫苗的免疫效果[6]。本研究选用Marcol-52,利用表面活性剂(Tween-80和Span-80)与助表面活性剂(PEG-400)复配制备纳米乳液,该方法可最大限度地降低界面张力,增加界面膜的流动性和柔韧性,阻止油滴的聚集,有利于形成粒径和PDI值更小、界面膜更稳定的纳米乳[7]。为深入研究纳米乳液参数与稳定性之间的关系,本研究还探究了超声乳化法和剪切搅拌乳化法对纳米乳液稳定性的影响,超声乳化法对降低纳米乳中分散相尺寸的效果较剪切搅拌乳化法更为显著,这是由于超声对分散相的直接作用力大于剪切搅拌。然而,超声乳化的作用力均匀程度低于剪切搅拌[9],使得分散相液滴均一程度低于后者,导致稳定性差,其参数变化表现为PDI值随着超声时间先下降后上升。动物试验结果表明,GLP-NE组小鼠的抗原特异性IgG滴度显著高于NE组,说明GLPs具有较强的体液免疫佐剂活性。Liu等[8]使用大豆磷脂、吐温-80和胆固醇将灵芝多糖包封于脂质体载体中,从而增强药物对脾淋巴细胞增殖活性的刺激作用,与本研究结果相符,说明灵芝多糖可作为免疫调节剂引入纳米乳载体中制备复合型佐剂。本研究采用纳米乳佐剂作为载体,以灵芝多糖作为免疫调节剂,制备了水包油型灵芝多糖纳米乳佐剂,具有较好的稳定性和免疫效果,后续还需采用其他病毒抗原进一步验证佐剂效果,为研发安全、高效且易于使用的疫苗佐剂提供数据支撑。
