重组贻贝黏蛋白的体外抗氧化及抗炎活性评价
2023-11-09张娅王蓉侯增淼曾亮乔保坤黄文涛杨鹭
张娅,王蓉,侯增淼,曾亮,乔保坤,黄文涛,杨鹭
(西安德诺海思医疗科技有限公司,陕西 西安 710000)
皮肤伤口愈合过程涉及炎症后反应、细胞增殖、迁移及创面重塑等阶段,它们通过细胞、细胞外基质,炎性介质及各种生长因子交互影响构成一个复杂有序的创面愈合关系网[1];其中,炎症期被广泛接受为伤口愈合过程中的第一阶段,即在创面修复过程中需要细胞因子和生长因子来启动这个过程,并在整个过程中引导和维持愈合。肿瘤坏死因子(TNF-α)或γ-干扰素(IFN-γ)是炎症反应产生的重要介质,可激活转录因子NF-κB,进而触发大量继发性炎症因子,阻抑伤口愈合进程[2]。许多研究报道,TNF-α或/和IFN-γ刺激是一种成熟的促炎细胞因子诱导模型[3-4],且这种刺激会诱导白细胞介素6(IL-6)和白细胞介素8(IL-8)等细胞因子以及趋化因子(MDC)释放。另有研究表明,TNF-α、IL-6、IL-8、MDC和黏附因子等的表达与慢性炎症密切关联,在介导慢性炎症疾病的细胞损伤和发病机制中发挥重要作用[5-6]。此外,创面微环境中的许多细胞(包括成纤维细胞、内皮细胞、中性粒细胞和巨噬细胞)在皮肤伤口愈合的过程中会产生大量的活性氧如超氧阴离子(·O2-)和羟自由基(·OH)等引发氧化应激反应,而氧化应激在创面愈合的炎症阶段平衡失调,进一步导致皮肤组织损害,不利于创面修复[7]。
贻贝黏蛋白(Mussel adhesive protein,MAP),也称作贻贝足丝蛋白,是一种从海洋贻贝中提取的新型生物材料,具有较高的生物相容性、可形成具有抗氧化能力的纳米级网状微观支架,从而抑制炎症[8]。目前,MAP已在一些细胞或组织黏附、伤口闭合和细胞-细胞毒性实验中被成功地证明为潜在的生物黏合剂,因而作为重要的原材料服务于日化行业和医疗器械等领域[9-10];然而,由于贻贝原料难以获得足够的数量,它们的应用受到了极大的限制。重组贻贝黏蛋白(rMAP)是利用基因工程技术,以微生物为宿主菌经发酵纯化等工艺所获,具有与天然贻贝黏蛋白相同的黏附性、生物相容性及和生物可降解性,且生产不受原料来源所限,可实现大规模生产,已成为医学和组织工程应用中很有前途的生物黏附材料,因此,采用基因重组技术制备贻贝黏蛋白是未来发展必然趋势。本公司参照Dong等[11]所报道,以大肠杆菌为宿主菌,选取天然I型贻贝黏蛋白和V型贻贝黏蛋白部分序列,制备成“I型-V型-I型”融合重组贻贝黏蛋白。这类重组贻贝黏蛋白相较于天然贻贝黏蛋白采用基因工程技术表达,其优势在于,发酵生产周期短,蛋白表达量高,便于工业化大规模生产,可作为优良的生物医学材料广泛应用于医疗器械和化妆品领域[12-13]。
近年来,Ahn等[8]利用贻贝黏蛋白fp-151和玻璃蛋白融合,研究了其在巨噬细胞和角质细胞中的抗炎作用,结果显示其具有有效的抗炎活性,可作为治疗皮肤炎症的有效成分。然而,关于重组贻贝黏蛋白对各种皮肤伤口的治疗潜力尚不清楚。因此,本研究探讨了本公司制备生产的重组贻贝黏蛋白的体外抗氧化能力,并采用IFN-γ诱导的人皮肤成纤维细胞(HFF-1)炎症模型评价了其抗炎作用,从而为重组贻贝黏蛋白在生物医学、日化行业等的应用提供新思路。
1 材料与方法
1.1 试验材料
重组贻贝黏蛋白,由天然I型贻贝黏蛋白的特征十肽(AKPSYPPTYK)与天然V型贻贝黏蛋白Mfp-5的氨基酸序列(GenBank: AAS00463.1)融合组成,以pET28a为载体,以大肠杆菌BL21为宿主菌,经发酵、纯化及冻干等工艺获得重组贻贝黏蛋白纯品,电泳结果见图1。

图1 重组贻贝黏蛋白的SDS-PAGE分析
1.2 试验细胞
人皮肤成纤维细胞(HFF-1,深圳豪地华拓生物科技有限公司,批号:HTX2251)。
1.3 试验分组
利用已知的抗氧化剂谷胱甘肽(GSH)作为对照,评价其抗氧化能力。试验分组如下:(1)对照;(2)实验组:0.1,0.4,0.8,1.2,1.6,2.0 mg/mL的重组贻贝黏蛋白或GSH。此外,采用IFN-γ诱导的人皮肤成纤维细胞(HFF-1)炎症模型评价其抗炎作用。试验分组如下:1)对照;2)诱导组:10 ng/mL IFN-γ;3)实验组:10 ng/mL IFN-γ+ 30 μg/mL 重组贻贝黏蛋白。
1.4 1,1-二苯基-2-三硝基苯肼自由基(·DPPH)清除能力
参考张婧琦等[14]的方法,分别取重组贻贝黏蛋白溶液和GSH 1.0 mL,与2.5 mL 1×10-4mol/L DPPH乙醇溶液混合,在室温下放置l h,离心,取上清液,测520 nm吸光度,样品溶液由蒸馏水代替作为对照。
DPPH清除率=[(A控制-A样品)/A控制]×100%
(1)
1.5 还原力
参考吴禹践等[15]的方法,均匀混合1%的铁氰化钾和PBS(pH值6.6)缓冲溶液2.5 mL,并加入供试液1 mL,50 ℃水浴20 min,迅速冷却后加入10%的三氯乙酸溶液2.5 mL。然后。离心取上清2.5 mL,依次加入蒸馏水2.5 mL和0.02%的三氯化铁溶液0.5 mL,静置10 min,在700 nm处测得吸光值。
1.6 ·O2-清除能力
依据魏梦涛等[16]的方法,依次取Tris-HCl(pH值8.2)2.35 mL,蒸馏水2 mL,4.5 mmol/L邻苯三酚盐酸溶液0.15 mL,再加入4.5 mmol/L邻苯三酚盐酸溶液立即混合,分别测定初始时和1 min后吸光值ΔA1,波长条件为325 nm。以上述相同步骤加入不同浓度的重组贻贝黏蛋白和GSH溶液20 μL,分别测定在初始时和1 min后吸光值ΔA2。
清除率=[(ΔA1/Δt-ΔA2/Δt)/(ΔA1/Δt)]×100%
(2)
1.7 ·OH清除能力
参考王英特等[17]的方法,分别将0.5 mL重组贻贝黏蛋白及GSH溶液,l mL 0.3 mmol/L的甲基紫溶液,1.0 mL 3 mmol/L H2O2溶液充分混合,然后继续加入1.5 mL 2 mmol/L FeSO4溶液,快速摇匀后立即用pH值4.6的醋酸缓冲溶液将上述溶液定容至25 mL,混匀,避光静置30 min后,在波长578 nm处测定吸光度,根据以下方程进行清除率的计算:
清除率=(A1-A0)/(A2-A0)×100%
(3)
注:式中,A1-加入样品溶液后的吸光度;A0-未加入样品溶液的吸光度;A2-未加入Fenton试剂及样品溶液的吸光度。
1.8 MTT法检测细胞增殖
取处于对数生长期的 HFF-1细胞,用胰酶消化,制成细胞悬液,计数并调整细胞为 1.5×104个/mL,接种至 96 孔板,每孔100 μL(1 500 个),放入CO2培养箱中培养,次日贴壁, 弃去原培养基,按重组贻贝黏蛋白 50,40,30,20,10 μg/mL质量浓度分组加样,继续培养24 h;然后分别加入 50 μL 噻唑蓝(MTT)溶液,孵育 2 h后,吸除上清,每孔加异丙醇100 μL,摇匀使其充分反应,测定570 nm吸光度,按公式计算样品对细胞的增殖率。细胞增殖率=(A加样组/A对照组)×100%。
1.9 炎性细胞因子检测
将收集的不同时间段(24,48 h和72 h)HFF-1细胞培养上清液以1 500 g,6 min离心去掉细胞残渣备用。然后,使用酶联免疫吸附法(ELISA)检测细胞上清中的 TNF-α、IL-6、IL-8和MDC含量。
1.10 RNA提取和实时荧光定量PCR分析
在NCBI上搜索炎症因子相关序列,结合Primer Premier 5.0软件设计炎症基因特异性引物(表1)。在培养的不同时间点(24,48 h和72 h)去除细胞培养液,用PBS缓冲液清洗3次,加入1 mL的Trizol,将细胞收集于1.5 mL的无RNA酶的离心管中,按 Total RNA 提取试剂盒说明书提取RNA,再使用逆转录试剂盒说明反转录合成cDNA备用。最后,使用SYBR Green RT-PCR试剂盒检测相关炎症因子的表达。反应体系按照TaKaRa公司(TransGen) SYBR预混Ex TaqTM Kit的说明进行配置。每个样品设置3个平行样品,用β-actin作为内参,用2-ΔΔCt法计算相对表达量。

表1 引物序列
1.11 数据处理
采用SPSS 17.0软件用单因素方差分析(ANOVA)和邓肯多重比较检验对数据进行分析统计,所有值至少重复三次,数据以平均值±标准误差表示,P≤0.05被认为差异显著。最后,利用软件Origin 2018和PhotoshopCS6进行绘图。
2 结果与分析
2.1 清除·DPPH能力
不同浓度重组贻贝黏蛋白对·DPPH的清除能力如图2所示。在0~0.4 mg/mL范围内,重组贻贝黏蛋白和GSH所具有的·DPPH清除能力均具有显著的量效关系,即随重组贻贝黏蛋白浓度的升高,·DPPH清除能力越强。此外,同浓度下的重组贻贝黏蛋白对·DPPH的清除率要低于对照品GSH的。

图2 不同浓度重组贻贝黏蛋白对·DPPH的清除能力
2.2 总还原力
如图3所示,同样浓度下,重组贻贝黏蛋白与对照品GSH的还原力比较接近,但对照品GSH的还原力要强于类贻贝黏蛋白的还原力。当重组贻贝黏蛋白质量浓度>1.2 mg/mL时,随着该浓度的增大,重组贻贝黏蛋白的还原力不再显著增强。
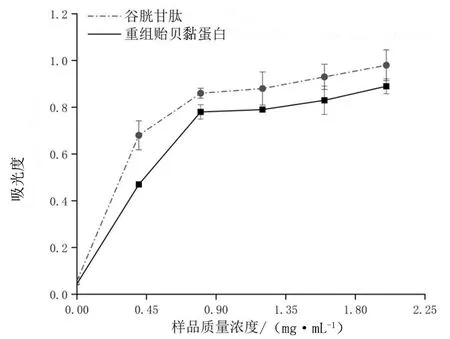
图3 不同质量浓度重组贻贝黏蛋白的还原力
2.3 清除·O2-能力
从图4可以看出,重组贻贝黏蛋白对·O2-的清除率要低于对照品GSH的,且重组贻贝黏蛋白对·O2-的清除作用低,几乎不起作用。

图4 不同质量浓度重组贻贝黏蛋白对O2-·的清除能力
2.4 清除·OH能力
如图5所示,随重组贻贝黏蛋白和对照组GSH浓度的升高,对·OH的清除作用也随之增大;但对照组GSH的清除作用明显强于同浓度的重组贻贝黏蛋白,其中,当对照组GSH为2.0 mg/mL时,同浓度重组贻贝黏蛋白清除·OH的能力也达到峰值,分别为75.44%和45.02%。
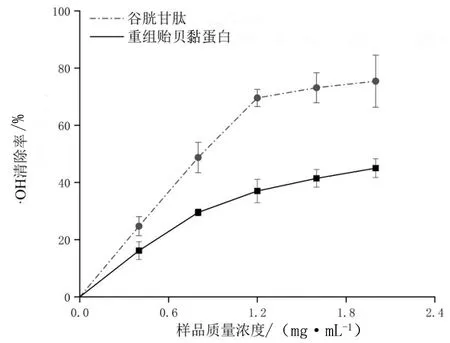
图5 不同浓度重组贻贝黏蛋白对·OH的清除能力
2.5 不同浓度重组贻贝黏蛋白对HFF-1细胞增殖的影响
由表2可以看出,不同质量浓度的重组贻贝黏蛋白(10~0 μg/mL)处理24 h后对HFF-1细胞无显著影响,而在处理48 h时,仅30 μg/mL 重组贻贝黏蛋白显著促进细胞增殖。不同的是,处理72 h后,20,30,40 μg/mL和50 μg/mL 重组贻贝黏蛋白均显著促进细胞增殖,且呈先升高后降低的趋势,即在30 μg/mL浓度处理下细胞增殖速率最大。

表2 不同浓度重组贻贝黏蛋白处理对HFF-1细胞增殖的影响
2.6 不同浓度IFN-γ刺激对HFF-1细胞产生TNF-α的影响
由表3可以看出,IFN-γ1 ng/mL组TNF-α的含量有升高趋势 ,但在各个时间点TNF-α的含量与对照组相比差异无统计学意义(P≥0.05);随 IFN-γ浓度增大、共培养时间的延长,TNF-α产生随之显著增加,即IFN-γ质量浓度为5 ng/mL时 24 h和48 h以及10 ng/mL时24,48 h和72 h。因此,后续我们选用10 ng/mL的IFN-γ。

表3 不同浓度IFN-γ处理下HFF-1细胞上清液中TNF-α含量
2.7 不同处理对HFF-1细胞IL-6、IL-8和MDC蛋白水平的影响
与对照相比,IFN-γ(10 ng/mL )处理24 h,培养的HFF-1细胞的上清液中IL-6的含量显著增加,且随着处理时间的延长,细胞毒性因子IL-6含量进一步升高(图6a)。与单独IFN-γ处理相比,30 μg/mL重组贻贝黏蛋白的加入并不影响IFN-γ处理24 h的细胞上清液中的IL-6含量,而使IFN-γ单独处理48 h和72 h的细胞上清液中的IL-6含量较同期单独IFN-γ处理分别显著降低约13%和38%。由此可见,重组贻贝黏蛋白的加入主要影响IFN-γ处理中期和后期的细胞上清液中的IL-6含量。
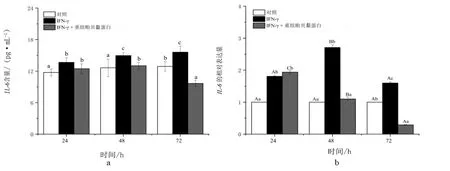

图6 不同处理对HFF-1细胞中炎症基因表达的影响
由图6c可知,10 ng/mL IFN-γ处理可显著诱导细胞上清液中IL-8的产生,且随着处理时间的延长,该参数也逐渐增大。与单独IFN-γ处理相比,IFN-γ+ 30 μg/mL 重组贻贝黏蛋白复合处理反而使细胞上清液中IL-8含量减少。
从图6e可以看出,与IFN-γ(10 ng/mL )单独处理24,48 h和72 h时,HFF-1细胞上清液中MDC含量较对照分别显著升高约15%,21%和30%。不同的是,IFN-γ+30 μg/mL 重组贻贝黏蛋白复合处理使IFN-γ单独处理48 h和72 h的细胞上清液中的MDC含量较同期单独IFN-γ处理分别显著降低约17%和29%,但不影响IFN-γ单独处理24 h的HFF-1细胞上清液中的MDC变化。
2.8 不同处理对HFF-1细胞中IL-6、IL-8和MDC mRNA水平的影响
由图6b可知,10 ng/mL IFN-γ处理24,48 h和72 h时,IL-6表达明显上调,分别较同期对照增大约81%,171%和60%。与同期IFN-γ单独处理相比,10 ng/mL IFN-γ+ 30 μg/mL 重组贻贝黏蛋白复合处理下该参数在24 h均没有明显变化,而30 μg/mL 重组贻贝黏蛋白的加入诱导该基因在IFN-γ处理的第48 h和72 h显著下调。
图6d显示了不同处理下HFF-1细胞中IL-8表达的变化。单独IFN-γ处理显著促进细胞中IL-8的表达,在24,48 h和72 h较同期对照分别上调约62%,109%和125%。与同期IFN-γ单独处理相比,30 μg/mL 重组贻贝黏蛋白的加入诱导该基因在IFN-γ处理的第24,48 h和72 h均显著下调。
如图6f所示,MDC的表达在IFN-γ单独处理24 h和48 h时均较同期对照显著上调,但处理72 h时该基因的表达与对照无显著性差异。与同期IFN-γ单独处理相比,30 μg/mL 重组贻贝黏蛋白的加入诱导该基因在IFN-γ处理的第24,48 h和72 h均显著下调,较IFN-γ单独处理相比分别下降约56%,41%和66%。
3 讨论
贾贵华和任雪峰[18]的研究证明:样品的还原力和抗氧化活性具有直接的关系效应。对于创面而言,·DPPH、·O2-和·OH等会导致修复细胞的迁移、增殖能力下降,细胞外基质合成障碍[19]。氧化应激失衡也已被证明可以延缓皮肤伤口的愈合[20-21]。本研究结果显示,在一定浓度范围内,随重组贻贝黏蛋白浓度的升高,总还原力、清除·DPPH以及·OH能力越强。这可能是因为重组贻贝黏蛋白在结构上具有不寻常的氨基酸3,4-二羟基苯丙氨酸(DOPA),这类基团在创面可形成具有抗氧化能力的微观支架。此外,同浓度下的重组贻贝黏蛋白对·DPPH和·OH自由基的清除率要低于对照品GSH。相似,张艳萍等[22]的研究也表明, MAP酶解物的抗氧化效应与样品浓度呈显著正相关关系,即浓度越高,则抗氧化效果越强,且同样的浓度条件下,对照GSH对自由基的清除作用均强于MAP酶解物。不同的是,重组贻贝黏蛋白对·O2-的清除作用低,几乎不起作用,说明重组贻贝黏蛋白主要对·DPPH和·OH的清除起作用。以上结果表明,重组贻贝黏蛋白具有良好的清除活性氧的能力,可延缓因活性氧过量诱发的皮肤辐射损伤、炎症等自由基伤害,促进皮肤伤口愈合。
创面愈合是多种细胞、细胞因子和生长因子相互作用的过程,其改变会导致愈合过程的延迟[13]。有研究报道,MAP具有促进细胞贴壁,促进创面愈合等特性[8]。Liu等[23]的研究也证实,MAP能显著抑制UVB诱导的细胞死亡和凋亡。但是,针对重组贻贝黏蛋白的相关报道鲜少。本研究发现,适宜浓度重组贻贝黏蛋白可显著促进细胞增殖(表2),推断重组贻贝黏蛋白具有良好的促进伤口愈合能力。TNF-α被认为是伤口愈合过程中的促炎症细胞因子,参与启动早期伤口愈合反应[24]。IFN-γ是Th1细胞因子,也可产生炎症前反应[25]。本研究中,HFF-1细胞在IFN-γ的刺激下,产生的TNF-α增多,且该效应与IFN-γ刺激浓度及作用时间呈显著正相关,提示IFN-γ可能通过上调TNF-α表达,使TNF-α含量增加,进而诱发炎症反应,延缓创面愈合过程。IL-6、IL-8和IL-1β属于Th2细胞因子,它们能产生更多的炎症反应,而MDC是Th2细胞产生的一种趋化因子[26]。本研究采用重组贻贝黏蛋白处理经IFN-γ刺激的HFF-1细胞,动态观察炎症细胞因子IL-6、IL-8和MDC在蛋白水平和mRNA水平的变化。结果发现,适宜浓度的重组贻贝黏蛋白可在蛋白水平或mRNA水平抑制IFN-γ刺激的中期和后期的HFF-1细胞中IL-6和MDC的表达,而在处理早期(24 h)就可显著抑制IL-8的表达,且随处理时间的延长,抑制效果越好。相似,Jung-Mo Ahn等[8]将fp-151和玻连蛋白VT组成融合蛋白fp-151-VT在大肠杆菌中进行表达后也发现fp-151-VT可以抑制UVB刺激角质细胞中IL-1β、IL-6和TNF-α的释放。与本研究结果一致,Lee等[27]在TNF-α/IFN-γ-刺激前用抗炎药物黄芩黄酮II处理HaCaT细胞,也证实其在蛋白水平和mRNA均显著抑制MDC的表达。上述体外细胞实验证实,重组贻贝黏蛋白可通过下调炎症因子的表达,抑制炎症反应,在组织修复中发挥积极作用。
4 结论
综上所述,IFN-γ刺激致炎有时间和剂量依赖性,而重组贻贝黏蛋白可通过抑制IFN-γ诱导的IL-6、IL-8和MDC表达发挥抗炎作用。此外,重组贻贝黏蛋白具有较强的还原力,可通过清除·DPPH和·OH等自由基抑制因炎症反应引起的氧化应激损伤,促进伤口愈合。这些结果为以重组贻贝黏蛋白为原料开发新型抗氧化及抗炎医疗器械,进一步应用到日化行业治疗皮肤伤口提供了一定的实验依据。
