肥胖/超重对哮喘发作期患儿Th1/Th2和Th17/Treg细胞因子的影响
2023-11-07丁肖媛戴劲盛焦荣红马素丽朱海峰吴梦雅车艳然
丁肖媛 戴劲盛 焦荣红 马素丽 朱海峰 吴梦雅 车艳然 张 蕾
(1.上海市浦东新区人民医院儿科,上海 201299;2.上海市浦东新区人民医院检验科,上海 201299)
支气管哮喘是儿童常见的慢性呼吸道疾病。近20年来,我国儿童哮喘患病率呈明显上升趋势,2010年全国14岁以下城市儿童的哮喘患病率为3.02%[1]。与此同时,儿童肥胖人群数量也在不断增长,流行病学统计结果显示,2000年,我国7~18岁男、女性肥胖检出率分别为4.94%~8.41%、2.25%~4.85%[2-3]。肥胖患儿不仅存在代谢紊乱,同时也伴随着慢性炎症,会导致一系列的合并症。有研究结果显示,超重是肥胖和哮喘的高危因素,而肥胖和哮喘之间存在着复杂的交互机制[4],肥胖儿童哮喘的严重程度显著高于正常体重的哮喘患儿[5-6]。2014年,肥胖型哮喘作为新的哮喘表型被全球哮喘防治创议(Global Initiative for Asthma,GINA)提出[7]。2020年,GINA指出,肥胖可能是哮喘发病的危险因素[8]。与过敏性哮喘不同的是,肥胖型哮喘可能由的辅助性T细胞(T helper cell,Th)2机制介导的[9]。为此,本研究拟探讨肥胖/超重合并哮喘患儿在哮喘急性发作期血清瘦素、白细胞介素(interleukin,IL)6、外周血Th1炎症因子[肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)]、Th2炎症因子(IL-10、IL-13)、Th17细胞炎症因子(IL-17F)和调节性T细胞(regulatory T-cell,Treg)炎症因子(IL-35)水平的变化,并分析其与体重指数(body mass index,BMI)的关系,探讨超重/肥胖合并哮喘的发病机制。
1 材料和方法
1.1 研究对象
选取2020年1月—2021年12月上海市浦东新区人民医院哮喘发作期患儿112例,符合《儿童支气管哮喘诊断与防治指南(2016年版)》中的诊断标准[10]。收集所有患儿的年龄、性别、身高和体重数据,年龄精确到月,身高精确到1 cm,体重精确到0.1 kg,计算BMI。根据《中国0~18岁儿童、青少年体块指数的生长曲线》中不同年龄、性别的BMI标准[11],将哮喘患儿分为哮喘组[56例,其中男40例、女16例,年龄(4.39±1.57)岁,BMI为(16.16±0.71)kg/m2]和肥胖/超重合并哮喘组[56例,其中男36例、女20例,年龄(4.46±1.77)岁,BMI为(19.70±2.33)kg/m2]。同时选取符合超重、肥胖诊断标准[11]的非哮喘患儿56例(肥胖/超重组),其中男41例、女15例,年龄(4.13±1.59)岁,BMI为(19.35±2.20)kg/m2。3组之间年龄、性别差异均无统计学意义(P>0.05),BMI差异有统计学意义(P<0.001)。本研究经上海市浦东新区人民医院伦理委员会批准(prylz2020-101),所有患儿监护人均签署知情同意书。
1.2 方法
采集所有患儿空腹静脉血3 mL,室温下静置30 min,以1 500×g离心5 min,分离血清,-80 ℃保存待测。采用酶联免疫吸附试验检测血清瘦素、IL-6、TNF-α、IL-10、IL-13、IL-17F和IL-35水平,试剂盒均购自美国CUSABIO公司(货号分别为CSB-E04649h、CSB-E04638h、CSB-E04740h、CSB-E04593h、CSB-E04601h、CSB-E15916h、CSB-E13126h)。检测仪器为Microlab STAR全自动酶免分析仪(瑞士Hamilton公司)。
1.3 统计学方法
采用SPSS 23.0软件进行统计分析。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Kruskal Wallis检验,两两比较采用Mann WhitneyU检验,采用Bonferroni法控制假阳性。计数资料以例或率表示,组间比较采用χ2检验或Fisher精确检验。采用Spearman相关分析评估各项指标之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 哮喘组、肥胖/超重合并哮喘组和肥胖/超重组各项指标比较
哮喘组、肥胖/超重合并哮喘组和肥胖/超重组之间血清IL-6、IL-10、IL-13和瘦素水平比较,差异均有统计学意义(P<0.05)。肥胖/超重合并哮喘组血清TNF-α水平高于哮喘组(P<0.05)。肥胖/超重组血清IL-17F水平高于哮喘组和肥胖/超重合并哮喘组(P<0.05)。哮喘组血清IL-35水平高于肥胖/超重合并哮喘组和肥胖/超重组(P<0.05)。见表1。
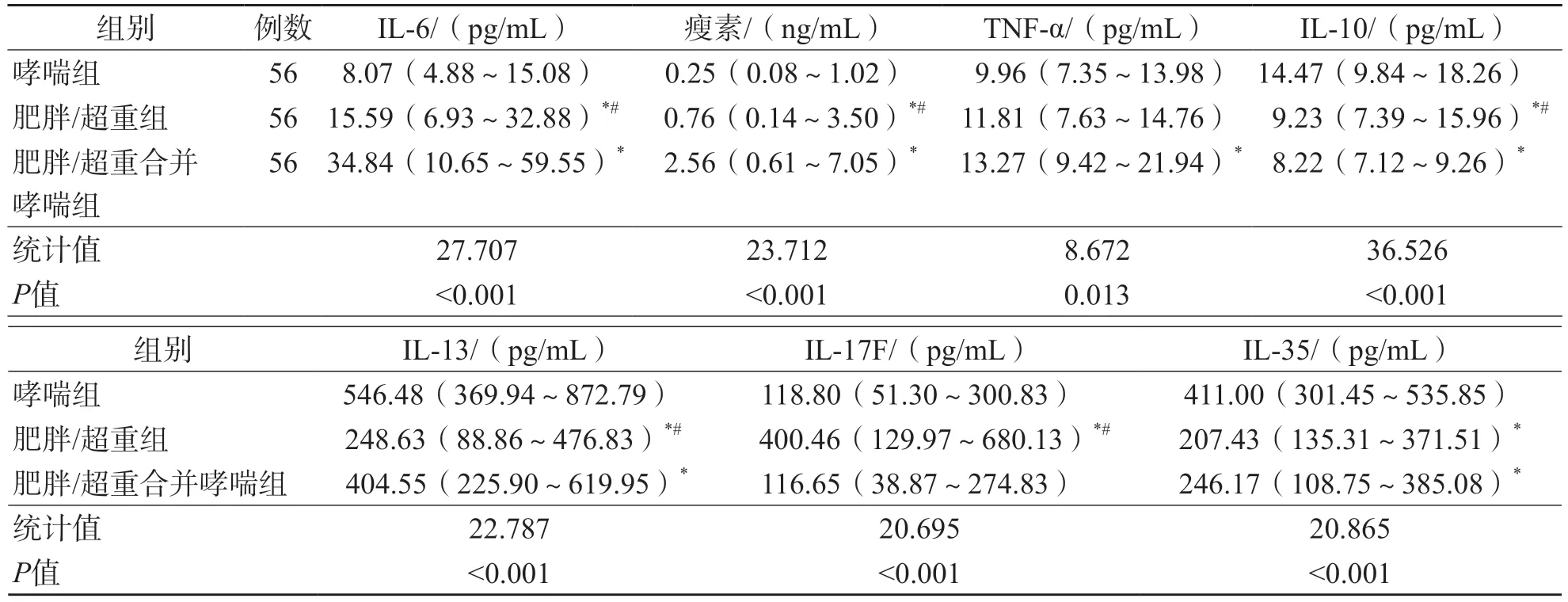
表1 3组之间血清IL-6、TNF-α、IL-10、IL-13、IL-17F、IL-35和瘦素水平比较
2.2 各组BMI与各项指标之间的相关性
将肥胖/超重合并哮喘患儿和肥胖/超重非哮喘患儿进一步分为超重合并哮喘组、肥胖合并哮喘组、超重组和肥胖组。Spearman相关分析结果显示,超重合并哮喘组、肥胖合并哮喘组、超重组和肥胖组BMI与IL-6呈正相关(r值分别为0.515、0.510、0.515、0.432,P<0.05)。超重合并哮喘组、肥胖合并哮喘组和肥胖组BMI与瘦素呈正相关(r值分别为0.488、0.578、0.546,P<0.05),与IL-35呈负相关(r值分别为-0.491、-0.517、-0.524,P<0.05)。见表2。

表2 各组BMI与IL-6、TNF-α、IL-10、IL-13、IL-17F、IL-35和瘦素的相关性
3 讨论
哮喘是一类由包括嗜酸性粒细胞、中性粒细胞、T淋巴细胞、肥大细胞等在内的多种炎症细胞和气道平滑肌细胞、上皮细胞等气道结构细胞,以及细胞组分参与的慢性气道炎症性疾病。有研究结果显示,哮喘患儿IL-4、IL-5和IL-13水平均高于喘息性支气管炎患儿(P<0.01),基于IL-4、IL-5和IL-13构建的风险评分模型鉴别重症哮喘的敏感性为90.24%[12]。Th1/Th2失衡(表现为IL-4、IL-5、IL-13高表达,IL-2、γ-干扰素(interferon gamma,IFN-γ)低表达,以Th2占优)介导了过敏性哮喘的发作。Th17/Treg失衡是哮喘发病的另一机制,Th17分化过多,产生IL-6和IL-17,造成中性粒细胞的炎性浸润,在临床上表现为喘息症状严重,且激素疗效不佳的哮喘表型[13-14]。中性粒细胞是哮喘患者气道中IL-6的主要来源[15]。有学者认为肥胖型哮喘可能不是由Th2介导的,更有可能是Th1型或中性粒细胞炎症表型[16]。
IL-6是一种促炎细胞因子,包括T细胞、髓系细胞和内皮细胞在内的多种细胞均可分泌[17]。动物实验结果显示,外界压力会诱导小鼠棕色脂肪细胞分泌IL-6,导致棕色脂肪细胞无法正常调节葡萄糖等物质的代谢和脂肪分解,最终造成肥胖,并引起相关并发症[18]。有研究结果显示,肥胖儿童Th1呈高表达,可分泌更多的IL-6、IFN-γ和TNF-α[19-20]。肥胖可促进Th1的细胞因子IFN-γ升高,减少Treg的分化,BMI与Treg呈负相关(r=-0.404 4,P=0.035 5)[21]。本研究结果显示,肥胖/超重合并哮喘组、肥胖/超重组和哮喘组IL-6和TNF-α水平依次降低(P<0.05);Spearman相关分析结果显示,超重合并哮喘患儿、肥胖合并哮喘患儿、超重患儿和肥胖患儿BMI与IL-6呈正相关(r值分别为0.515、0.510、0.515、0.432,P<0.05)。提示在超重/肥胖合并哮喘患儿中,IL-6和TNF-α可能参与了哮喘急性期的发病,肥胖型哮喘存在Th1介导的炎症因子水平升高。
瘦素可刺激脂肪细胞分泌IL-6、TNF-α、IL-12等促炎症因子[22-23],刺激外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分泌IL-6和TNF-α[24]。有研究结果显示,哮喘患者瘦素水平显著高于健康对照者(P<0.05),且哮喘发作期患儿瘦素水平显著高于无症状期哮喘患儿(P=0.025)[25]。提示瘦素可能参与了肥胖型哮喘的发病。本研究结果显示,肥胖/超重合并哮喘组、肥胖/超重组、哮喘组瘦素水平依次降低(P<0.05),且超重合并哮喘组、肥胖合并哮喘组和肥胖组BMI与瘦素呈正相关(r值分别为0.488、0.578、0.546,P<0.05)。由于本研究未纳入健康对照儿童和哮喘稳定期的儿童,因此无法验证瘦素参与哮喘的机制。有研究结果显示,瘦素可促进Th1的分化和活化,同时抑制Th2分泌IL-4、IL-5和IL-10,激活Th17的前炎症因子[26-28]。本研究结果显示,肥胖/超重合并哮喘组IL-10和IL-13水平均低于哮喘组(P<0.05),提示肥胖/超重患儿的哮喘可能不是由Th2介导的。
动物实验结果显示,敲除TNF-α受体的肥胖小鼠能耐受气道高反应的固有免疫反应,且IL-17表达降低[29]。BANTULÀ等[30]针对成人的研究结果显示,瘦素可刺激脂肪细胞释放炎症因子,激活M1巨噬细胞内的核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding domainlike receptor protein 3,NLRP3),导致脂肪细胞内的IL-1β升高,进而激活3型先天淋巴细胞(innate lymphoid cell type-3,ILC3),同时产生IL-17。本研究结果显示,肥胖/超重合并哮喘组和哮喘组之间IL-17F水平差异无统计学意义(P>0.05),与文献[30]不一致。原因可能为:1)研究对象不同,本研究为儿童,文献[30]为成人;2)本研究检测的是IL-17F,未检测IL-17A(又称IL-17)。
IL-12细胞因子家族包括IL-12、IL-23、IL-27和IL-35,其中IL-35是最新的家族成员,具有促进Treg增殖的作用。MA等[31]的研究结果显示,哮喘患儿IL-35 mRNA和蛋白表达均下调,血清IL-35水平与血清IL-4水平呈负相关(r=-0.352,P=0.032 7),与IFN-γ水平呈正相关(r=356.9,P=0.022 0)。LI等[32]的研究结果显示,在类风湿关节炎患者中,超重者血清IL-35水平明显低于消瘦者(P<0.05)。目前尚未见肥胖型哮喘患儿IL-35水平的研究。本研究结果显示,肥胖/超重合并哮喘组和肥胖/超重组的IL-35水平均低于哮喘组(P<0.05),且超重合并哮喘患儿、肥胖合并哮喘患儿和肥胖患儿BMI与IL-35呈负相关(r值分别为-0.491、-0.517、-0.524,P<0.05),肥胖合并哮喘患儿和肥胖患儿BMI与IL-35的r值更高,提示肥胖可能参与了IL-35表达的下调。由于本研究未纳入健康对照组,缺乏健康儿童与肥胖儿童IL-35水平的比较,未来需进一步验证。
综上所述,肥胖/超重会引起Th1/Th2失衡,哮喘患儿在发作期以Th2介导为主,肥胖/超重合并哮喘患儿则以Th1介导为主。
