含铜废水处理与废弃热能利用的契合
——2023年高考山东化学卷电化学试题情境溯源与解析
2023-11-04李玉玺
□李玉玺
电镀行业产生的电镀废水中含有大量铜离子,目前处理含铜废水的常用方法有化学沉淀法、离子交换法、吸附法、膜过滤法、电化学等。然而,这些方法往往存在着二次污染、成本高、耗能大及运行困难等缺点。学者提出了一种基于电化学系统技术的热再生氨电池,在利用低温废热资源产电的同时去除铜离子。该技术在含铜电镀废水的处理及资源回收方面具有独特的优势和良好的应用前景。
山东省2023年普通高中学业水平等级考试化学卷第11题,就以这类热再生氨电池创设真实情境,考查考生对陌生电化学装置的分析与推测能力,基于电极反应类型确定电极名称的逻辑推理能力、基于实际需求确定隔膜种类的论证能力、基于情境书写总反应式的必备知识,评价考生应用原电池基本模型解决实际问题的能力与学科素养发展水平。本文通过查阅文献资料对该试题的命题情境进行溯源,剖析热再生氨电池的构造和工作原理,并对试题进行深度解析。
一、试题原题
2023年山东卷第11题:利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示(图1),甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
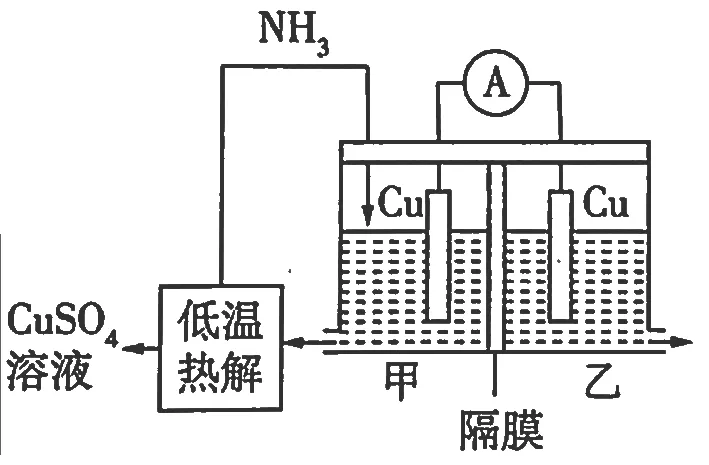
图1
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为:Cu2++4NH3=[Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
二、命题情境溯源
中文期刊中关于热再生氨电池的最早报道,是2015年《浙江电力》中一篇名为《可再生氨电池助推废弃热能利用》的文章。该报道称,有研究者将低品位废弃热能转化为电能的一种有效的新技术使用到可逆转的氨电池中。该文章对于热再生氨电池的应用价值进行了简单介绍。
近年来,重庆大学工程热物理研究所、重庆大学低品位能源利用技术及系统教育部重点实验室的研究人员致力于热再生氨电池的研究。该研究团队自2018年至今,发表与热再生氨电池相关的科研论文十余篇。其中,卢志强等的《不同负载下热再生氨电池产电及Cu2+去除特性》一文,与上述试题的相关性最强。相关研究表明,电池负载不但影响电化学反应速率和产电性能,而且会对Cu2+去除效果产生影响。随着负载的降低,电流强度逐渐增大,电池的产电量会逐渐提升。此外,氨渗透现象(阳极室中氨的浓度过大时通过交换膜进入阴极室)的存在极大地影响了Cu2+的去除效果。电池负载较小时,可以降低阴极氨渗透量,减弱副反应的发生,Cu2+去除率较高。
热再生氨电池可分为电池产电部分和热再生部分(图2)。图中右侧为电池产电部分,阳极(即电池负极)上,氨与金属电极发生配位反应,如式(1)所示。电子通过外电路传输到阴极(即电池正极),与阴极电解液中的金属离子在阴极表面发生电沉积反应,如式(2)所示。在电池内部,SO42-通过阴离子交换膜(AEM)由阴极室进入阳极室。图中左侧为热再生部分,通过利用低温废热(≤130℃)将产电反应完成后的阳极电解液加热,将[Cu(NH3)4]2+分解成Cu2+和氨气,反应如式(3)所示。氨气循环至阳极室,继续参与放电。铜离子溶液可循环至阴极室,也可经处理作为电镀液使用。
该研究团队发现,热再生氨电池放电时还伴随着大量的副反应发生,这主要是由于氨通过交换膜渗透至阴极室导致的,因此他们研究了不同氨渗透量下阴极发生的反应。实验表明,当阴极液中不存在氨时,阴极上仅发生Cu2+还原成铜单质的沉积反应。随着阴极液中氨浓度增加,Cu2+的沉积反应受到抑制,当氨浓度增加到0.2mol·L-1时,阴极出现副反应。这是由于氨与Cu2+发生配合反应生成了[Cu(NH3)4]2+,[Cu(NH3)4]2+在阴极被还原成[Cu(NH3)2]+,并进而被还原成铜单质。随着氨浓度增加到0.4mol·L-1,[Cu(NH3)2]+生成量增加,使得Cu2+的沉积反应进一步被抑制。
三、试题解析
【分析】解答电化学试题的突破口是快速判断电极种类,关键点是正确书写电极反应式。甲、乙两室均预加相同的CuSO4电镀废液,向甲室中加入足量氨水时电池开始工作。甲室Cu电极的氨腐蚀反应不属于高中化学必备知识。考生可认为甲室中的Cu2+与NH3通过配位反应形成[Cu(NH3)4]2+,减小了Cu2+的浓度。此时甲、乙两室中因Cu2+的浓度差而产生电势差,Cu2+浓度较小的甲室中电极电势较低,该侧电极为负极,电极反应为Cu-2e-+4NH3=[Cu(NH3)4]2+。Cu2+浓度较大的乙室中电极电势较高,该侧电极为正极,电极反应为Cu2++2e-=Cu。
【详解】
A.由分析可知,甲室中Cu电极为负极,故A选项错误;
B.电池工作时阳离子向正极移动,阴离子向负极移动。若隔膜为阳离子膜,甲室中的[Cu(NH3)4]2+扩散至乙室,会影响乙室的电极反应。应使用阴离子膜,使溶液中的SO42-通过隔膜进入甲室。甲室中SO42-增大,与[Cu(NH3)4]2+继续经过低温废热分解,实现CuSO4电镀废液的浓缩再生,故B选项错误;
C.由分析可知,甲室中负极反应为Cu-2e-+4NH3=[Cu(NH3)4]2+,乙室中正极反应为Cu2++2e-=Cu,两式相加可得电池总反应为:Cu2++4NH3=[Cu(NH3)4]2+,故C选项正确;
D.NH3扩散到乙室会与C u2+反应生成[Cu(NH3)4]2+,Cu2+因浓度降低而氧化性减弱,因此会对电池电动势产生影响,故D选项正确。
考生在解答此题的过程中,需要应用电化学模型对装置进行分析。这样既发展考生证据推理与模型认知核心素养,同时使考生感受到化学知识在解决能源、环境等社会热点问题过程中的实用价值,能够促进他们科学态度与社会责任核心素养的发展。
