芍药苷抗急性坏死性胰腺炎相关性肾损伤的作用与机制研究
2023-11-02王鹏邵俊伟左腾郭闻一张利龙邱振东王卫星
王鹏,邵俊伟,左腾,郭闻一,张利龙,邱振东,王卫星
(武汉大学人民医院 1.普通外科 2.胃肠外Ⅱ科,湖北 武汉 430060)
急性坏死性胰腺炎(acute necrotizing pancreatitis,ANP)是一种严重的消化系统疾病,其起病急骤、临床症状严重,且极易导致胰腺外脏器功能损伤,其发病机制尚未完全清楚,临床治疗也缺乏有效的治疗方案[1-3]。肾脏是ANP胰外脏器损伤的常见靶器官,当ANP发生时,肾功能损伤易发生在ANP的早期,ANP伴有肾功能损伤的患者病死率约为71.2%[4]。因此对于ANP相关肾功能损伤的治疗十分必要,是目前ANP胰外脏器损伤研究的重点[5-7]。目前中医药联合西医治疗是胰腺炎研究的热点,芍药苷(paeoniflorin)是传统中药材芍药的有效提取物,具有多种药理作用,如抗炎、抗肿瘤、镇痛以及免疫调节等多种功能[8-10]。其可以抑制脂多糖诱导的脓毒症大鼠的全身炎症反应并提高其存活率,但是在ANP相关肾损伤中芍药苷是否能够发挥其药理作用,如能发挥其作用,其具体机制如何尚未见报道。因此,本研究通过建立ANP相关肾损伤大鼠模型,应用芍药苷对其进行干预,观察其干预效果,然后探讨其发挥作用的可能机制。
1 材料与方法
1.1 主要材料与试剂
芍药苷(C23O28H11;分子量:480.45;纯度≥95%)购于南京建成生物公司,TNF-α、IL-1β、IL-6的ELISA试剂盒购于华美生物。兔抗-NF-κBp65(1∶200;ab16502)、内参GAPDH(1∶2 500;ab8245)和抗-caspase3(1∶100;ab2302)抗体购自Abcam公司。兔抗p38(1∶1 000;8690)和抗磷酸化p38(p-p38)(2∶1 000;4511)抗体购自Cell Signaling Technologies.(美国加利福尼亚州赫拉克勒斯)。TUNEL检测试剂盒购于罗氏公司。
1.2 实验动物
武汉大学实验动物中心提供128只SD大鼠(体质量180~200 g)。将大鼠置于特定的无病原体条件下,进行12 h的光暗循环,并自由饮水。大鼠术前禁食。动物福利遵守赫尔辛基宣言。本研究由武汉大学动物伦理委员会批准[批号:WDRM动(福)第20221005B]。
1.3 动物分组与处理
将40只大鼠随机分为5组,每组8只,分别为假手术组、ANP模型组(ANP组)、ANP模型+芍药苷处理组(芍药苷组),后者按芍药苷剂量(50、100、150 mg/kg)分为3组。实验前一晚大鼠禁食但可自由饮水。ANP模型采用胆胰管逆行注射5%的牛磺胆酸钠(1 mg/kg)建立,假手术组仅做开腹后翻动小肠处理。3个芍药苷组在ANP模型建立后通过股静脉连续注射2次芍药苷(中间间隔30 min),假手术组与ANP组以相同的方式注射生理盐水。各组大鼠在建模后12 h异氟烷气体麻醉后处死并取材检测相关指标,分析安全有效的芍药苷剂量。随后将72只SD大鼠随机分为3组,每组24只,分别为假手术组、ANP组、芍药苷组,处理方法同前,芍药苷剂量按前一部分实验结果选择。分别在造模后3、6、12 h,每组各取8只大鼠麻醉后处死,下腔静脉采血,血液标本静止30 min后离心分离血清,取大鼠胰头组织以及肾组织取材后固定及-80 ℃冻存。
1.4 指标检测
1.4.1 血清指标检测 采用全自动生化分析仪(奥林巴斯2700,日本)检测血清中淀粉酶(AMY)、脂肪酶(LIPA)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)水平。
1.4.2 病理学分析 大鼠胰腺组织及肾组织经多聚甲醛固定后,石蜡包埋、切片、HE染色,通过光镜观察。根据Schimidt等[11]所提出的胰腺损伤病理评分对胰腺组织进行病理评分,根据Paller等[12]所提出的肾脏病理损伤评分对肾组织进行病理评分。
1.4.3 ELISA法检测血清中TNF-α、IL-1β以及IL-6的表达 取血清后低温离心,取上清,按ELISA试剂盒说明准备标准品、洗涤工作液、生物素标记抗体工作液的配置、辣过氧化物酶标记亲和素工作液,并将上述试剂放置室温下平衡1 h,加样,37 ℃恒温孵育2 h,然后洗板加入辣根过氧化物酶标记亲和素工作液37 ℃恒温孵育1 h,洗板,加入底物,终止反应,应用酶标仪测定光密度值。
1.4.4 免疫组化检测肾脏组织NF-κB以及caspase-3的表达 肾脏组织的石蜡切片常规脱蜡、水化、抗原修复、去除内源性过氧化物酶、封闭、一抗4 ℃过夜、采用免疫组化试剂盒进行后续显影(DAB显色)、苏木精染色,脱水、封片,在光镜下观察细胞核内黄染为阳性表达,光镜下拍照,采用Image Pro-Plus 6.0软件进行统计分析[13]。
1.4.5 TUNEL细胞凋亡实验 将肾组织石蜡包埋后切割成3 μm的切片。脱蜡、水化并在室温下与蛋白酶K(武汉古德生物科技有限公司)孵育15 min。剩余步骤根据推荐的原位细胞死亡检测试剂盒POD(Roche Diagnostics)提供的方案进行。DAB染色后用苏木精染色细胞核。TUNEL结果用Olympus BX53显微镜观察。TUNEL阳性结果为细胞核棕色染色[14]。
1.4.6 Western blot分析 使用RIPA均浆裂解大鼠肾脏组织并提取总蛋白,BCA法检测蛋白浓度。凝胶电泳分离蛋白质,并通过Bio-Rad转膜系统将蛋白转到PVDF膜,封闭2 h后清洗充分后,加入p38(抗体浓度1∶1 000)、p-p38(抗体浓度1∶1 000)以及GAPDH抗体(抗体浓度1∶2 500)4 ℃孵育过夜。第二天加入荧光二抗,常温孵育1 h后,充分清洗后,应用奥德赛红外成像系统采集并转化为灰度图,Quality One 软件系统分析灰度。
1.5 统计学处理
计数数据采用均数±标准差(±s)表示,通过SPSS 19.0统计学软件采用单因素方差分析进行统计学处理,组间比较采用Tukey多重比较,P<0.05为差异具有统计学意义。
2 结 果
2.1 不同剂量芍药苷对ANP大鼠AMY、LIPA水平及肝功能的影响
不同剂量的芍药苷均能明显降低ANP大鼠血清AMY、LIPA水平(均P<0.05),并呈一定程度的剂量依赖趋势,但150 mg/kg芍药苷组的ALT、AST高于50、100 mg/kg芍药苷组,且相较100 mg/kg组,未明显降低AMY及LIPA水平(表1),故选择100 mg/kg芍药苷用于后续实验。
表1 各组大鼠血清AMY、LIPA、ALT、AST水平(±s)Table 1 Serum levels of AMY,LIPA,ALT,and AST in each group of rats (±s)
注:1)与假手术组比较,P<0. 05;2)与ANP组比较,P<0. 05;3)与50 mg/kg芍药苷组比较,P<0.05Notes:1) P<0.05 vs.sham surgery group; 2) P<0.05 vs.ANP group; 3) P<0.05 vs.50 mg/kg paeoniflorin group
组别假手术组ANP组芍药苷组(mg/kg)50 100 150 AMY(U/L)1 755.7±214.0 8 287.5±1 394.51)LIPA(U/L)4 417.9±553.1 14 599.5±1 741.51)ALT(U/L)40.1±4.8 183.5±54.61)AST(U/L)127.9±37.2 618.8±165.71)480.3±70.41)357.6±51.71),2),3)514.0±65.61)7 244.1±793.21),2)6 333.1±683.91),2),3)5 244.3±445.81),2),3)14 190.3±803.11)12 675.0±735.21),2),3)11 362.8±905.01),2),3)158.6±24.81)114.1±9.41),2),3)275.2±84.51),2),3)
2.2 芍药苷对ANP大鼠胰腺与肾脏病理学的影响
与假手术组比较,ANP组与芍药苷组胰腺组织均出现明显的病理学改变,后者胰腺间质水肿较ANP组减轻,出血减少,胰腺病理学评分在各个时间均低于ANP组(均P<0.05)(图1)。与假手术组比较,ANP组与芍药苷组均观察到肾脏组织病变,表现为不同程度的肾皮质刷状缘丢失、细胞坏死、小管上皮细胞脱落、管型形成和肾小管扩张,且随着时间的延长肾脏病理评分逐步升高,但芍药苷组肾脏病理学评分在各个时间点均低于ANP组(均P<0.05)(图2)。

图1 大鼠胰腺组织病理检测 A:造模后各时间点胰腺病理学评分;B:造模后12 h各组胰腺组织HE染色(×200)Figure 1 Pathological examination of rat pancreatic tissues A: Pancreatic histopathological scores at various time points after modeling; B: HE Staining of pancreatic tissues in different groups at 12 h post-modeling (×200)

图2 大鼠肾脏组织病理检测 A:造模后各时间点肾脏病理学评分;B:造模后12 h各组肾脏组织HE染色(×200)Figure 2 Pathological examination of rat kidney Tissues A: Renal histopathological scores at various time points after modeling; B: HE staining of renal tissues in different groups at 12 h post-modeling (×200)
2.3 各组血清AMY、LIPA、BUN及Cr水平
在造模后各时间点分析,ANP组与芍药苷组的AMY均在造模后6 h达最高值,而两组的LIPA、BUN以及Cr水平最高值均在造模后12 h出现,但芍药苷组的各项指标在各时间点均明显低于ANP组(均P<0.05)(图3)。
2.4 各组TNF-α、IL-1β及IL-6水平
ELISA结果显示,ANP组与芍药苷组血清TNF-α、IL-1β、IL-6水平在造模后均随时间延长而逐渐升高,但芍药苷组的以上指标水平在各时间点均明显低于ANP组(均P<0.05)(图4)。
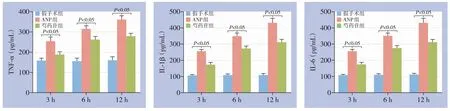
图4 各组血清TNF-α、IL-1β、IL-6水平比较Figure 4 Comparison of serum TNF-α,IL-1β,and IL-6 levels among groups
2.5 各组肾脏组织中NF-κB以及caspase-3的表达及细胞凋亡情况
在各组大鼠造模后12 h的肾脏组织标本中,免疫组化结果显示,ANP组与芍药苷组NF-κB与caspase-3的表达均明显升高,但芍药苷组两者的升高程度均明显低于ANP组(均P<0.05);TUNEL染色结果显示,ANP组与芍药苷组的细胞凋亡均明显增加,但后者的细胞凋亡明显少于前者(均P<0.05)(图5)。

图5 肾脏组织中NF-κB与caspase-3表达情况及细胞凋亡情况Figure 5 Expression of NF-κB and caspase-3 in renal tissues and assessment of cell apoptosis
2.6 各组肾脏组织中p-38与p-38的表达
通过Western blot检测各组造模后12 h肾脏组织p38与p-p38的表达,结果显示,ANP组与芍药苷组p-p38/p38比例均明显升高,但后者的升高程度明显低于前者(均P<0.05),ANP组约为80%,芍药苷组约为60%(图6)。
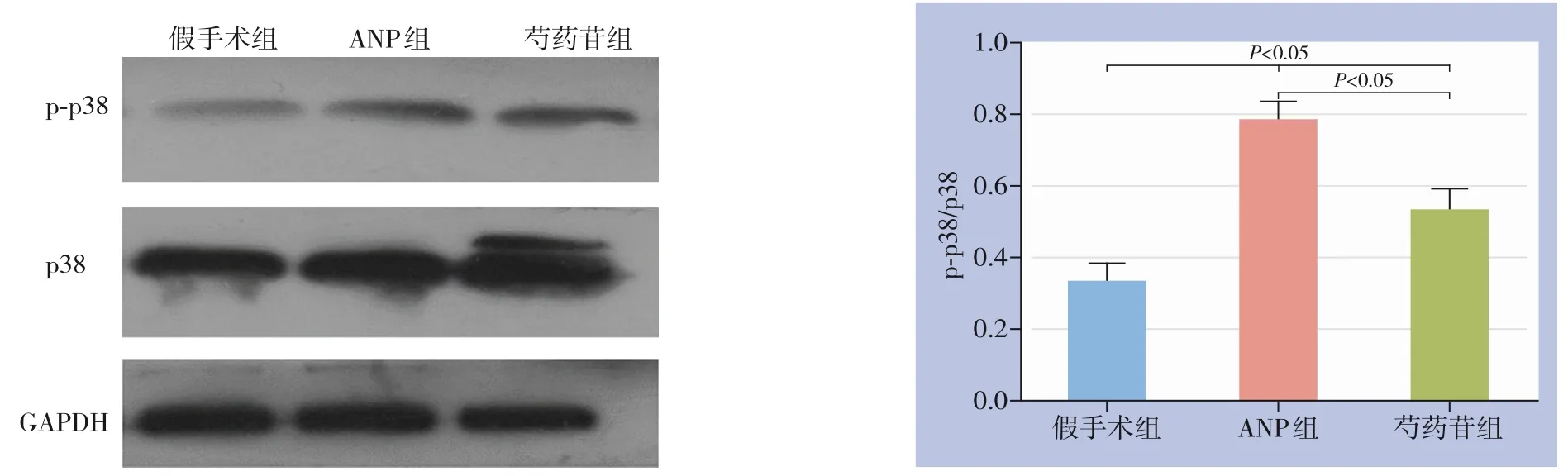
图6 各组肾脏组织p38与p-p38检测及p-p38/p38比例比较Figure 6 Detection of p38 and p-p38 in renal tissues and comparison of the p-p38/p38 ratio in each group
3 讨 论
急性胰腺炎(acute pancreatitis,AP)是消化系统中常见疾病,属于自限性疾病的一种,但是当治疗方法不当或其他原因导致治疗延迟时可导致ANP的发生[15]。ANP的病因主要为炎症因子所致的级联瀑布反应、氧化应激所致的细胞凋亡、肠道菌群失调等多种病理生理机制[16]。其中炎症因子所致的级联瀑布反应可导致全身炎性反应综合征,导致胰腺外脏器的损伤[17],肾脏作为常见的靶器官,极易受到炎症因子的影响,从而导致肾脏功能障碍,进而引发多器官功能衰竭,导致病情危重加重患者死亡[6,18-20]。目前早期液体复苏、镇痛、营养支持以及后期炎症及感染性并发症的控制是治疗ANP的重要靶点,因此寻求一种新的抗炎药物对于ANP及相关胰腺外并发症具有重要的意义[21-24]。
芍药苷作为传统中药芍药的有效提取物,其药理作用广泛,近年来其在抗肿瘤以及抗炎等方面的药理作用不断被发掘[25-26]。芍药苷在肝脏纤维化疾病、结直肠恶性肿瘤、自身免疫性肝病、溃疡性结肠炎以及慢性疼痛中均有一定的功效,而芍药苷在ANP相关肾损伤中的作用如何、其具体作用机制尚无明确定论,在本研究中通过构建ANP+肾损伤大鼠模型,可以观察到芍药苷具有减轻ANP的炎症反应,具体表现为降低胰腺病理评分,且对肝功影响较小,降低机体炎症指标如TNF-α、IL-1β以及IL-6水平。胰腺本位器官的功能保护对于ANP的治疗十分重要,在早期如能及时保护胰腺功能,逆转炎性反应对于患者的预后具有重要意义,但ANP之所以病情危重在于其疾病进展速度快且极易引发胰外脏器损伤,特别是肾功能损伤。本研究结果显示,芍药苷可减轻肾皮质水肿,减少肾小管管型,具有保护肾功能的作用。ANP后肾损伤的一个重要机制是肾脏的急性缺血导致的肾皮质细胞的凋亡,通过TUNEL凋亡实验观察到应用芍药苷治疗后肾脏皮质细胞TUNEL阳性细胞较ANP组明显降低,而芍药苷组NF-κB的表达低于ANP组(此指标反映机体氧化应激水平),因此芍药苷的保护机制可能为通过抑制氧化应激所致的细胞凋亡,从而达到保护肾功能的作用。通过免疫组化检测凋亡指标caspase-3的表达情况观察到,应用芍药苷治疗后,肾脏组织中caspase-3的表达情况较ANP组明显降低。因此,结合caspase-3的表达以及TUNEL实验的结果,芍药苷可能通过抑制细胞凋亡起到保护肾功能的作用。
除细胞凋亡原因外,炎症所致的应激反应对于细胞凋亡具有协同作用,炎症指标TNF-α、IL-1β以及IL-6可以通过激活NF-κB的前体I-κB,使得I-κB磷酸化形成NF-κB-I-κB复合体,从而导致炎症的发生进展,而p38信号通路,当被特定的炎性细胞因子、病原体或细胞应激刺激时,p38被激活磷酸化后并转移到细胞核中。p-p38可以激活I-κB并诱导NF-κB信号转导途径[27-28]。本研究表明ANP组中NF-κB的表达明显高于假手术组,应用芍药苷治疗后NF-κB的水平下降,而通过Western blot 技术分析p38的磷酸化情况,可以观察到ANP组磷酸化水平最高,而应用芍药苷干预后肾脏组织的p38磷酸化水平明显低于ANP组。
综上,芍药苷能够改善ANP所致的急性肾损伤,其可能的机制与通过抑制P38MAPK信号通路所介导的炎症反应及减轻组织细胞凋亡相关。本研究仅在动物实验及组织水平验证了芍药苷对于ANP相关肾损伤的保护作用,后续仍需在细胞水平进行进一步验证。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:王鹏、王卫星负责实验设计及具体实验统筹及操作;邵俊伟负责动物实验部分指导;左腾、郭闻一负责动物实验部分操作;张利龙负责生化实验部分操作及统计数值;邱振东负责生化实验部分操作。
