KCl部分替代NaCl协同强化高温对干腌羊火腿品质的影响
2023-10-31洪文龙戴照琪章建浩
洪文龙,吕 周,戴照琪,章建浩,罗 辑
(1.江苏农林职业技术学院茶与食品科技学院,江苏 句容 212400;2.南京农业大学食品科技学院,江苏 南京 210095;3.安徽师范大学生命科学学院,安徽 芜湖 241000)
传统中式腌腊肉制品风味独特,但生产周期较长且盐分含量高,因此有必要研发一种新型加工工艺来提高生产效率,改善产品质量。近年来,强化高温成熟技术作为一种新型的发酵成熟工艺,因既能缩短加工时间,又能改善产品风味而受到国内外学者关注[1-2]。章建浩等[3]采用强化高温成熟技术加工金华火腿,通过与传统金华火腿的风味品质进行对比后发现,80 d高温成熟发酵的产品风味品质最佳。
人体摄入过量的钠盐会加重肾脏负担,增加高血压和心血管疾病死亡率[4]。因此,开发出既能保证产品风味品质又能满足消费者健康需求的加工技术,是未来肉制品加工的趋势。KCl被认为是NaCl的合适替代品。Nachtigall等[5]使用一定比例的KCl、Ca-Cl2部分替代NaCl 加工咸肉,发现使用KCl 复合盐加工而成的产品品质好于CaCl2替代的产品。吴海舟等[6]对比了部分KCl 盐替代和100%食盐加工对中式培根理化指标以及感官品质的影响,发现KCl含量低于40%时,不会影响产品的感官特性。相对于干腌猪肉制品,国内对干腌羊肉制品的研究较少。王晶[7]通过分析干腌新疆羊火腿生产过程中理化指标和蛋白质水解变化,发现作为风味物质前体物的游离氨基酸占成品非蛋白氮含量的70%以上。Teixeira 等[8]分别对腌制绵的羊腿和山羊腿的理化性质和感官品质进行对比分析后发现,腌制山羊腿和绵羊腿产品均具有高蛋白低脂肪的特点,且腌制羊腿的硫代巴比妥酸反应物(TBARS)值都低于2 mg MDA/kg,证明绵羊腿和山羊腿都非常适合用来生产腌制羊腿。
本研究使用25%KCl 部分替代NaCl 协同强化高温成熟工艺加工内蒙古羊后腿,制成干腌羊火腿。通过分析加工过程中水分含量、水分活度、盐分含量、亚硝酸盐含量以及颜色的变化,研究盐替代协同强化高温工艺对干腌羊火腿理化指标的影响;再利用气相色谱-质谱联用(GC-MS)分析方法研究KCl部分替代NaCl 对干腌羊火腿风味品质的影响,以期探索盐替代协同强化高温工艺对干腌羊腿的加工效果,为低盐干腌羊腿加工提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
试验原料为8~12月龄的内蒙古白山羊去皮后腿((2±0.5)kg),购自包头市草原百盈农牧业发展有限公司。随机选取4根羊腿用作原料指标分析,其余40根后腿随机分为2组(每组20根),用于生产干腌羊火腿。
KCl(食品级),江苏科伦多食品配料有限公司;NaCl,江苏中盐集团有限公司;亚铁氰化钾、乙酸锌、冰醋酸、盐酸萘乙二胺、亚硝酸钠、盐酸、硼酸钠等试验所用试剂均为分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
IKA T25高速匀浆机,德国IKA有限公司;GYW-1水分治度测试仪,深圳冠亚技术科技有限公司;UV-2600 紫外分光光度计,日本Shimadzu 仪器(苏州)有限公司;Agilent7890A-MSD 5975C 气相色谱-质谱联用仪,美国Agilent科技公司;75 μm CAR/PDMS SPME萃取针头,美国Supelco有限公司;BSC-250恒温恒湿箱,上海博迅实业有限公司;DW-45W158冰箱,河南冰熊电器股份有限公司;CR-400色差仪,柯尼卡美能达控股公司。
1.2 方法
1.2.1 工艺流程
原料解冻→修腿胚→干法腌制→清洗→低温风干→中温发酵→强化高温成熟
1.2.2 操作要点
1.2.2.1 解冻
将冷冻保藏的原料放置在4 ℃、相对湿度70%的室内解冻48 h。
1.2.2.2 修腿胚
去除细毛,修割羊腿表面和边缘,使每条羊腿呈琵琶形状。
1.2.2.3 干法腌制
盐的添加量为羊腿质量的3.2%;火腿采用两种配方:100%NaCl为对照组(CK);25%KCl+75%NaCl为钾盐替代组(YTD)。火腿在(4±1)℃、相对湿度70%±2%条件下堆放腌制7 d,期间分两次擦盐,第1次用总盐量的30%堆放腌制24 h,之后用总盐量的70%腌制6 d。
1.2.2.4 清洗
将干腌后的羊腿在(10±1)℃下浸入水中10 h,并用竹刷清洗。
1.2.2.5 风干、发酵、成熟
将洗净后的羊腿悬挂在发酵房内,设置温湿度控制程序,每天查看羊腿状态和环境温湿度,强化高温成熟后,将火腿于室温下放置10 d制成最终产品。具体参数见表1。
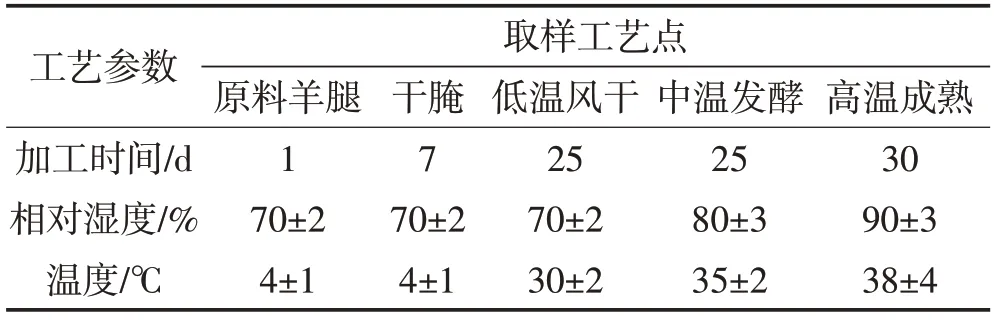
表1 干腌羊火腿加工工艺参数Table 1 Processing parameters of dry-cured lamb ham
1.2.3 取样
加工过程设定5 个取样点,分别为原料(工艺点1)、干腌结束(工艺点2)、低温风干(工艺点3)、中温发酵(工艺点4)和高温成熟(工艺点5),每个工艺点随机选取4条羊腿股二头肌(50 g),真空包装后置于-40 ℃冰箱中冷冻。
1.2.4 测定项目与方法
1.2.4.1 水分含量
参照GB 5009.3—2016[9],采用直接干燥法进行测定,计算产品的水分含量。
1.2.4.2 水分活度
参照GB 5009.238—2016[10],采用水分活度仪扩散法进行测定,计算产品的水分活度。
1.2.4.3 盐分含量
参照GB 5009.44—2016[11],采用佛尔哈德法进行测定,计算产品中Cl-含量。
1.2.4.4 亚硝酸盐含量
参照GB 5009.33—2016[12],采用分光光度计法在540 nm处测定吸光度,绘制标准曲线后进行计算。
1.2.4.5 色泽
参照Wang 等[13]的方法,使用全自动色差仪于样品3个不同部位测量产品表面L*、a*、b*值。测试时确保色差仪垂直紧扣肉表面且不漏光。饱和度(C)计算公式如下:
1.2.5 挥发性风味物质分析
根据王勇勤等[14]的方法进行测定,采用固相微萃取(SPME)结合GC-MS 方法测定顶空风味化合物。使用DB5MS 毛细管柱(60 m×0.32 mm×1.8 μm)分离挥发性物质,He 为载气气体,流速为1 mL/min。将(5.0±0.3)g的样品装入20 mL顶空样品瓶中,用硅橡胶垫密封后置于40 ℃水浴中。平衡后,将75 μm聚二甲基硅氧烷(CAR/PDMS)固相萃取头纤维插入瓶中,在30 ℃条件下吸附风味化合物30 min。然后,纤维上的化合物在气相色谱仪注入端口220 ℃无分离模式解吸5 min。升温程序:GC 色谱柱箱的温度在35 ℃启动,持续3 min,然后以5 ℃/min升温到80 ℃,8 ℃/min升温到150 ℃,随后以10 ℃/min 升温到220 ℃,并保持10 min。质谱条件:采用电子轰击电离源模式,检测器电压为350 V,电子能量为70 eV,离子源温度为200 ℃,扫描范围为30~450m/z,扫描速率为6.34次/s。将挥发性风味物质与NISTDEMO和WILEY数据库的质谱进行比较,鉴定出相似指数在800 以上的化合物,并采用峰面积归一化法计算挥发性化合物的相对含量。
1.2.6 数据处理
试验数据采用SPSS 18.0统计软件进行单因素方差分析,各处理组数据之间利用邓肯多重范围检验进行显著性分析(P<0.05 表示差异显著),使用Origin 8.5软件绘制图形。所有试验数据均重复3次,结果以表示。
2 结果与分析
2.1 干腌羊火腿加工过程水分含量与水分活度的变化
由图1A 可知,KCl 替代组和对照组产品加工过程水分含量均呈下降趋势,且两组产品水分含量最终无显著差异。对照组的水分含量由原料的75.65%下降到36.9%,KCl 替代组的水分含量下降至37.7%,略高于对照组,可能是由于腌制过程中K+相对于Na+更易于在肌肉中扩散,KCl 混合盐渗透更快,减慢了肌肉中的水分流失[15]。由图1B可见,在加工初期,盐分未完全渗透进原料,羊腿中自由水流失缓慢,使得羊腿具有较高的水分活度,随着腌制时间的延长,盐分逐渐进入肌肉,增加了产品渗透压,加速水分流失,而在风干成熟阶段肉品加速脱水,导致水分活度快速降低。水分活度的迅速下降使得两组产品最终水分活度无显著差异,对照组和KCl替代组产品水分活度分别为0.836 和0.834。说明25%KCl 盐替代对羊火腿加工过程的水分变化无显著影响。
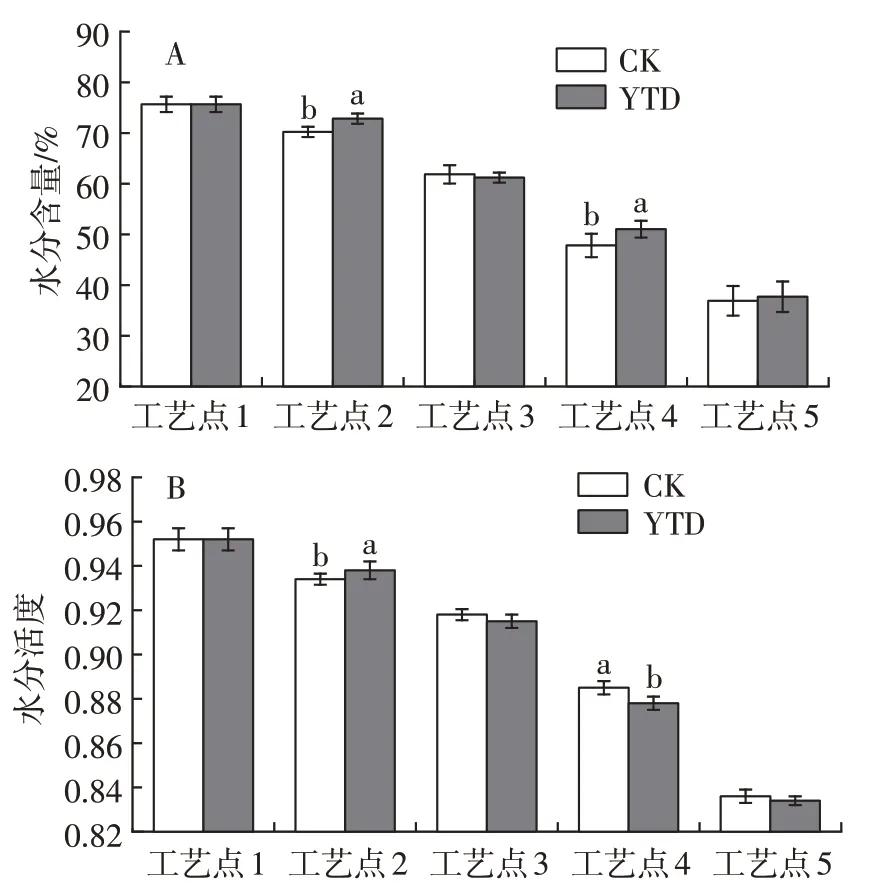
图1 干腌羊火腿加工过程中水分含量(A)和水分活度(B)的变化Fig.1 Changes of the moisture contents(A)and water activity(B)in dry-cured lamb ham during processing
2.2 干腌羊火腿加工过程盐分含量的变化
由图2 可知,整个加工过程中,羊火腿盐分含量随加工时间的推移持续上升。对照组成品火腿的盐分含量为5.35%,KCl 替代组成品火腿的盐含量为5.10%,显著低于对照组(P<0.05)。由于本试验分析方法参照国家标准,以产品Cl-含量计算盐分,相对NaCl 来说,KCl 具有较高的相对分子质量,使得相同质量的两种盐中替代组Cl-含量更低。干腌过程中替代组盐分含量上升速度更快,可能是由于Na+的电荷密度(0.043 单位电荷/分子量)高于K+的电荷密度(0.026单位电荷/分子量),因此K+更易于在肌肉中扩散[16]。同时,由于盐分扩散的协同作用,扩散速度更快的KCl 能加速NaCl 的渗透,缩短火腿的腌制时间[17]。在随后的风干阶段,随着盐分渗透到羊腿肌肉中心,分布更加均匀,使得盐分含量逐渐增加;而在发酵成熟期,羊腿中水分含量较少,且环境湿度增加,不利于水分流失,减缓了盐分上升速度。
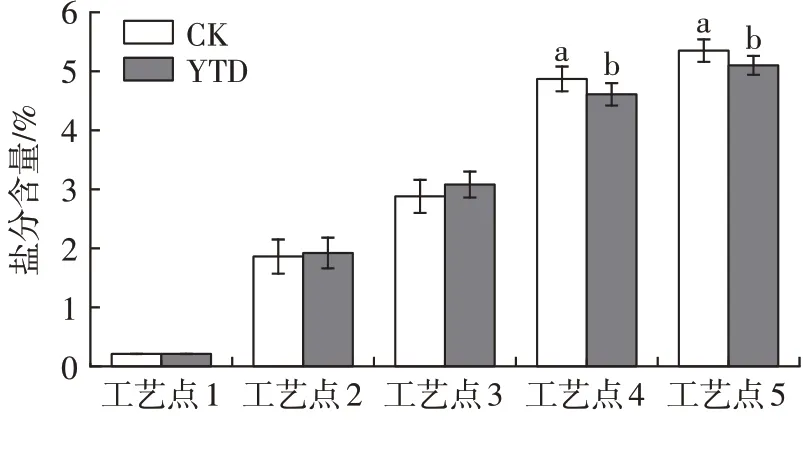
图2 干腌羊火腿加工过程中盐分含量的变化Fig.2 Changes of salt contents in dry-cured lamb ham during processing
2.3 干腌羊火腿加工过程亚硝酸盐的变化
由图3可以发现,加工过程中两组羊火腿亚硝酸盐含量变化趋势一致,均为先快速上升再迅速下降,这与金华火腿及意大利帕尔马火腿加工过程中亚硝酸盐含量的变化相似[18-19]。腌制结束后,亚硝酸盐含量迅速上升,在低温风干阶段达到最大值。本试验加工过程未添加亚硝酸盐,推测在腌制及风干过程中亚硝酸盐的快速上升可能来自腌制用盐,而后期亚硝酸盐的下降与肉品中存在降低亚硝酸盐的微生物以及加工后期亚硝酸盐的降解有关[18]。亚硝酸盐降解生成的NO与羊腿中肌红蛋白反应起显色作用,导致中温发酵和高温成熟阶段产品中亚硝酸盐含量快速下降。替代组产品的亚硝酸盐含量(以NaNO2含量计)显著低于对照组(P<0.05),这与K+更易在肌肉中扩散有关。KCl在肌肉中的扩散带动了NaCl的扩散,使25%KCl替代组产品盐分含量增加速度更快,可更好地抑制微生物的作用,加速亚硝酸盐含量的下降。
图3 干腌羊火腿加工过程中亚硝酸盐含量的变化Fig.3 Changes of nitrite contents in dry-cured lamb ham during processing
2.4 干腌羊火腿加工过程色泽的变化
在干腌羊火腿加工过程中,水分含量的降低,肌肉蛋白和脂肪的氧化降解都会改变肉品颜色。如图4A 所示,在加工过程中,L*值整体呈下降趋势,说明随着加工时间的延长,干腌羊火腿的颜色逐渐变暗,但KCl 替代组和对照组最终产品无显著性差异。由图4B 可见,在干腌过程中,由于水分的快速流失,盐分渗透加速蛋白质水解,使得两组产品颜色变暗,a*值快速下降,随后从低温风干阶段到高温成熟过程,两组产品a*值快速上升,可能是由于亚硝酸盐分解生成的NO 与肌红蛋白反应,提高了产品的a*值[20]。已有研究表明,无硝火腿中红色的产生与Zn-原卟啉Ⅸ(ZnPP)密切相关,ZnPP 含量会随着盐分的增加而上升,且加工后期微生物的生长也能促进ZnPP的形成,从而改善肉色[21]。由图4C可见,两组产品在加工过程中b*值均呈上升趋势,可能与脂肪氧化后生成的黄色有机物质相关[4],强化高温期b*值上升速度加快,这与脂肪的氧化加剧和肌红蛋白氧化相关[22]。C值代表着产品色泽的鲜艳程度。由图4D可见,C值呈现先下降后上升的趋势,说明干腌羊火腿在发酵成熟阶段色泽逐渐变得鲜艳。KCl替代组和对照组最终产品之间的L*、a*、b*和C值均无显著差异,说明25%KCl 替代NaCl 对干腌羊火腿颜色无不良影响,这与Wu 等[23]的研究结果一致。
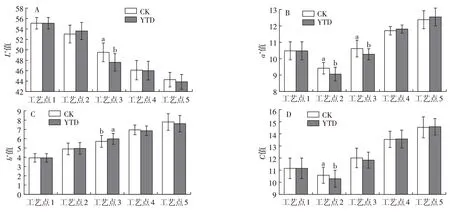
图4 干腌羊火腿加工过程中色泽的变化Fig.4 Changes of the color in dry-cured lamb ham during processing
2.5 干腌羊火腿挥发性风味物质分析
研究发现,腌腊肉制品中挥发性风味物质主要来自于加工过程中蛋白质与脂肪的降解氧化[24]。氨基酸作为一些特征风味物质前体,能够为肉制品提供鲜味[25],同时一些支链氨基酸在高温成熟阶段还能参与美拉德反应和斯特雷克(Strecker)降解反应生成支链醛类、酮类、醇类、酸类等风味物质[23]。利用GC-MS分析后发现,原料羊腿中含有26种挥发性物质,经过加工后,对照组成品中检测到51 种挥发性物质,KCl 替代成品中检测到61 种挥发性物质。图5 为干腌羊腿加工过程中各挥发性风味物质相对含量的变化。
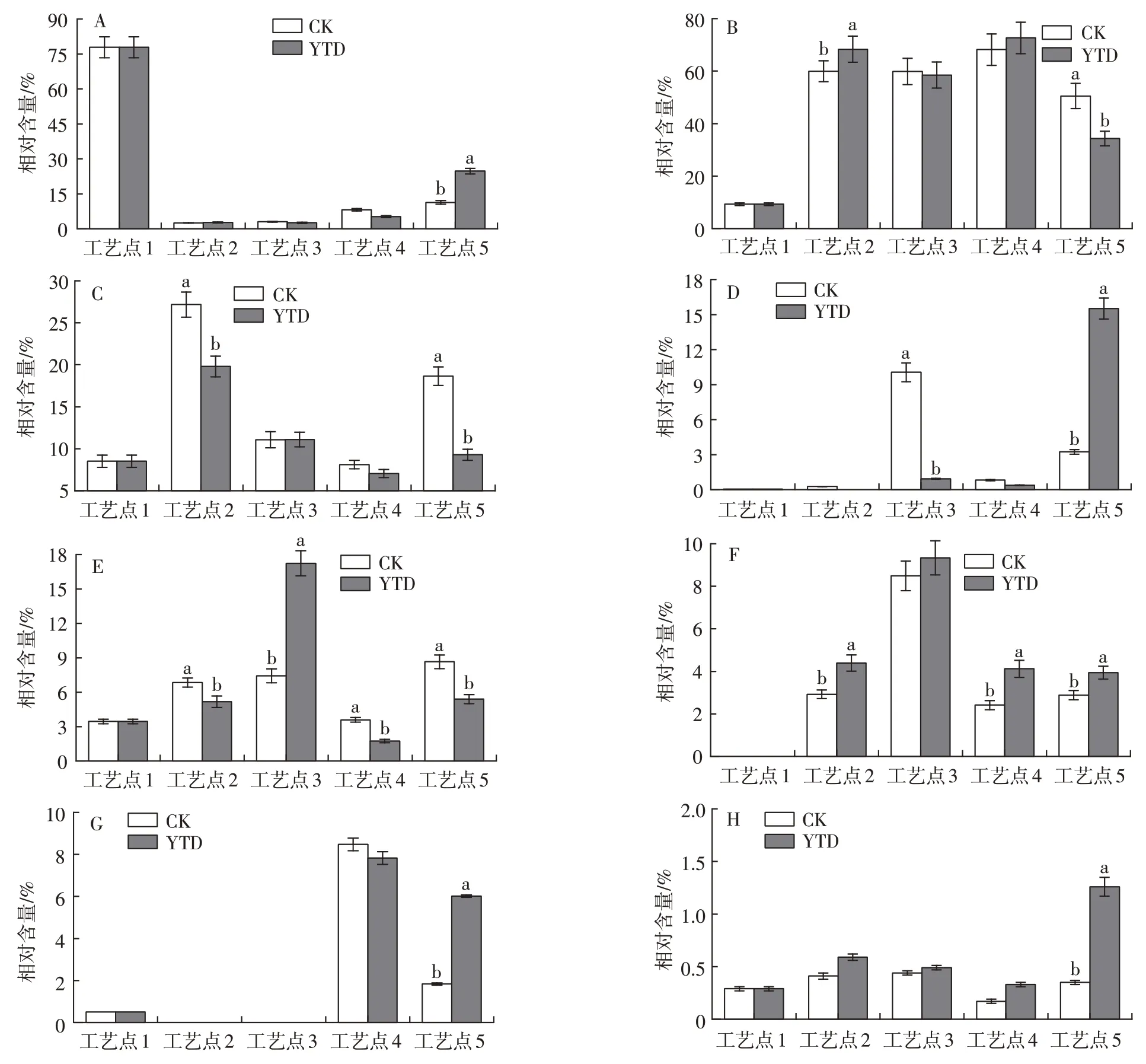
图5 干腌羊火腿加工过程中各种挥发性风味物质相对含量的变化Fig.5 Changes of relative contents of volatile compounds during processing
2.5.1 芳香烃和环烃类
由图5A 和表2 可见,干腌结束后两组产品中芳香烃和环烃类化合物总相对含量均迅速下降,随后缓慢上升,最终KCl 替代组成品的总相对含量显著高于对照组(P<0.05)。萜烯类物质是最具代表性的挥发性风味物质之一,在羊火腿风味中起着重要作用。原料中含有较高含量的萜烯类物质,包括桧烯、D-柠檬烯、α-蒎烯和β-蒎烯。这可能是因为羊腿原料来自内蒙古,主要饲养方式为牧草饮食,使得萜烯类物质在动物的肌肉中积累。柠檬烯是植物油中不皂化部分,动物进食后积累在肌肉组织中,能赋予产品新鲜的水果风味[1]。β-蒎烯有树脂的气味,而石竹烯为木材的气味,它们在肉类中的含量受到牧草饮食的影响,是动物受到良好饲养的标志[26]。吡嗪、哌啶、2-戊基呋喃、噻吩等也都能改善产品的香气。
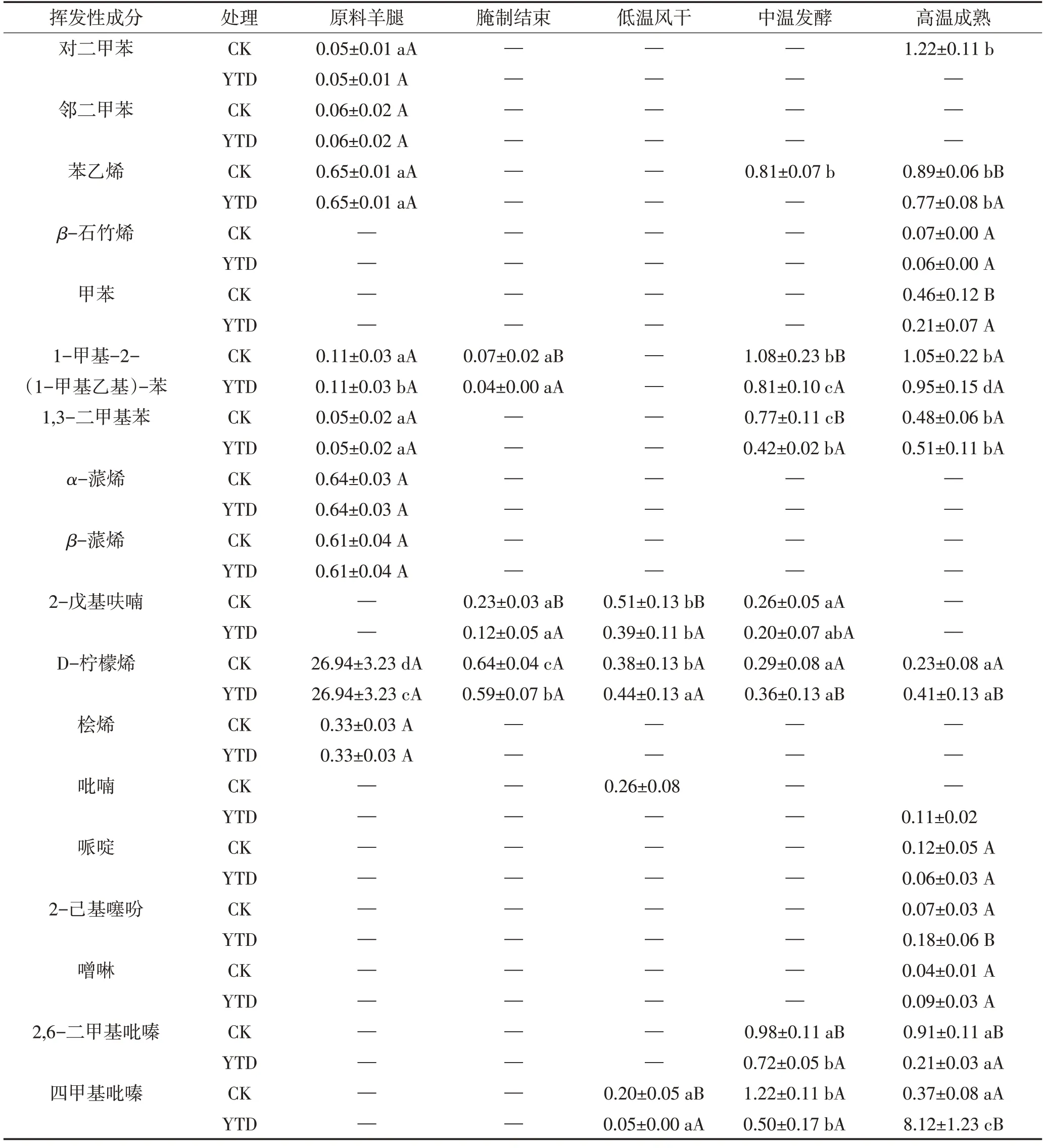
表2 干腌羊火腿加工过程中芳香烃和环烃类物质相对含量的变化Table 2 Changes of the relative contents of aromatic and cyclic hydrocarbons in dry-cured lamb ham during processing 单位:%
2.5.2 醛类
醛类因其较低的感知阈值,对干腌肉制品的整体风味有显著贡献[27]。两组干腌火腿加工过程中醛类化合物总相对含量均显著增加(P<0.05)。由图5B 和表3 可见,在中温发酵时期,KCl 替代组和对照组的醛类化合物总相对含量无显著差异,而强化高温后,两组醛类化合物总相对含量均显著降低(P<0.05),可能是由于醛与其他挥发性或非挥发性化合物发生反应。
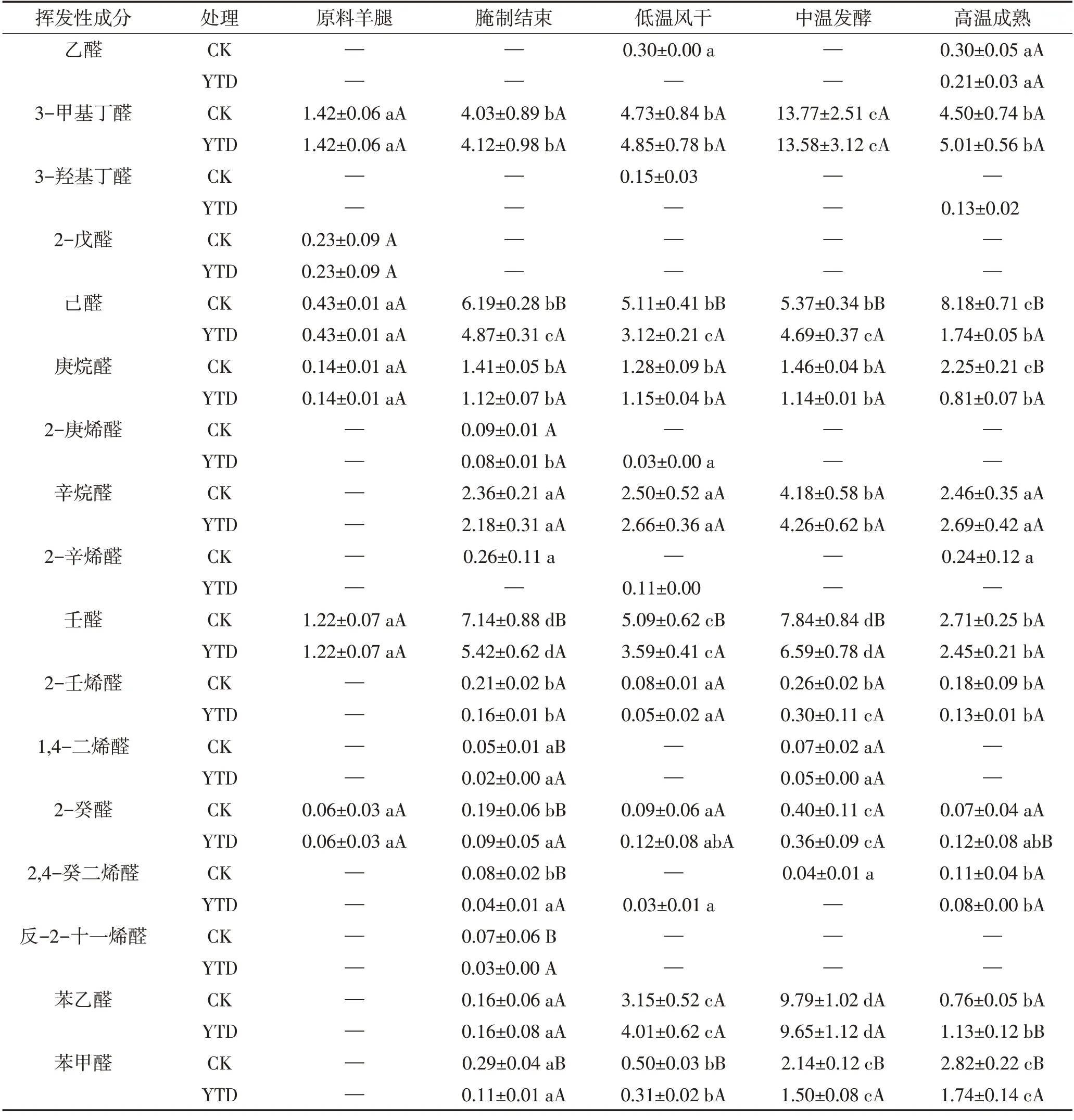
表3 干腌羊火腿加工过程中醛类物质相对含量的变化Table 3 Changes of aldehydes relative contents in dry-cured lamb ham during processing 单位:%
火腿加工过程中产生的3-甲基丁醛、苯甲醛和苯乙醛主要与参与美拉德反应和Strecker 降解的支链氨基酸有关,这些醛类化合物对干腌羊火腿的风味有很大影响[1]。3-甲基丁醛来源于亮氨酸,在发酵成熟时期显著增加,强化高温成熟后显著下降,这是由于本试验强化高温的温度可以增强美拉德反应和Strecker 降解[3]。KCl 替代组和对照组中3-甲基丁醛的相对含量在加工过程中无显著差异。苯乙醛作为苯丙氨酸通过Strecker 降解得到的产物[27],在生产过程中其相对含量也是先增加后减少。己醛是干腌羊火腿成品中含量最丰富的直链脂肪醛,它来源于n-6脂肪酸,如亚油酸和花生四烯酸的氧化[28]。
2.5.3 醇类
由图5C和表4可以看出,两组干腌火腿的醇类化合物总相对含量在腌制后先减少后增加,强化高温结束时,对照组产品中醇类化合物总相对含量显著高于KCl替代组(P<0.05)。羊火腿加工过程中产生了香味阈值相对较低的3-甲基丁醇和2-甲基丁醇,它们可通过3-甲基丁醛和2-甲基丁醛的还原产生,也可能来自于亮氨酸和异亮氨酸参与的Strecker反应[29]。两组火腿产品之间的3-甲基丁醇的相对含量无显著差异,但KCl替代组产品中2-甲基丁醇的相对含量显著低于对照组(P<0.05);1-丁醇和2-丁醇的产生可能与丁醛的降解有关;在两组成品火腿中,由不饱和脂肪降解产生的低气味阈值的1-辛烯-3-醇含量无显著差异,这表明25%KCl的替代可能不会增强脂肪分解。
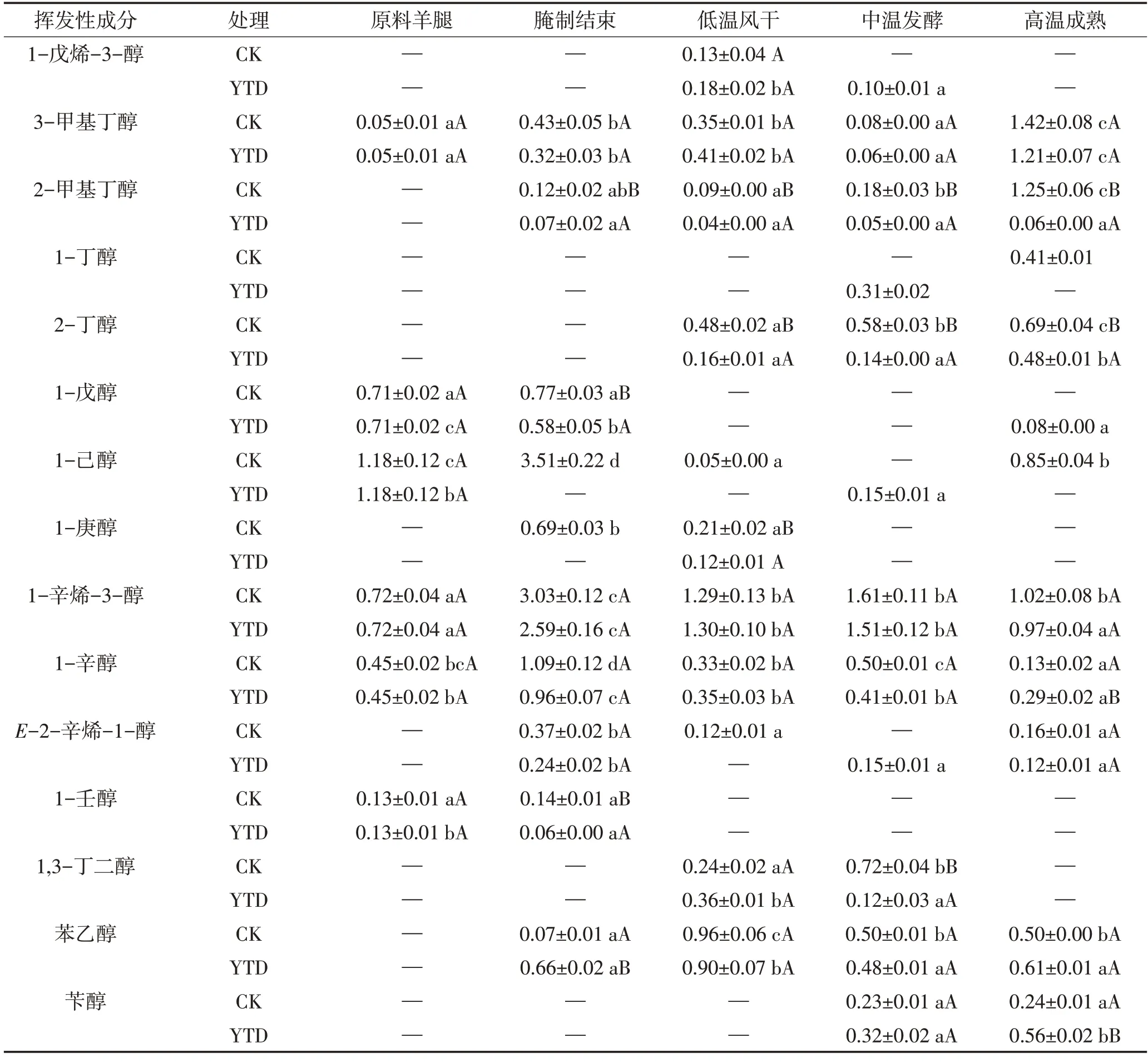
表4 干腌羊火腿加工过程中醇类物质相对含量的变化Table 4 Changes of alcohols relative contents in dry-cured lamb ham during processing 单位:%
2.5.4 烷烃和烯烃类
由图5D和表5可见,对照组中烷烃和烯烃类物质的相对含量从干腌结束至低温风干阶段迅速上升随后快速下降,KCl替代组最终产品中烷烃和烯烃类化合物总相对含量显著高于对照组(P<0.05)。由于烷烃和烯烃类化合物具有相对较高的气味阈值,对产品的气味贡献不大。直链脂肪烃主要来源于脂肪氧化,在高温成熟结束后,直链脂肪烃含量在两组间无显著差异,如己烷和庚烯,这与1-辛烯-3-醇的检测结果一致。
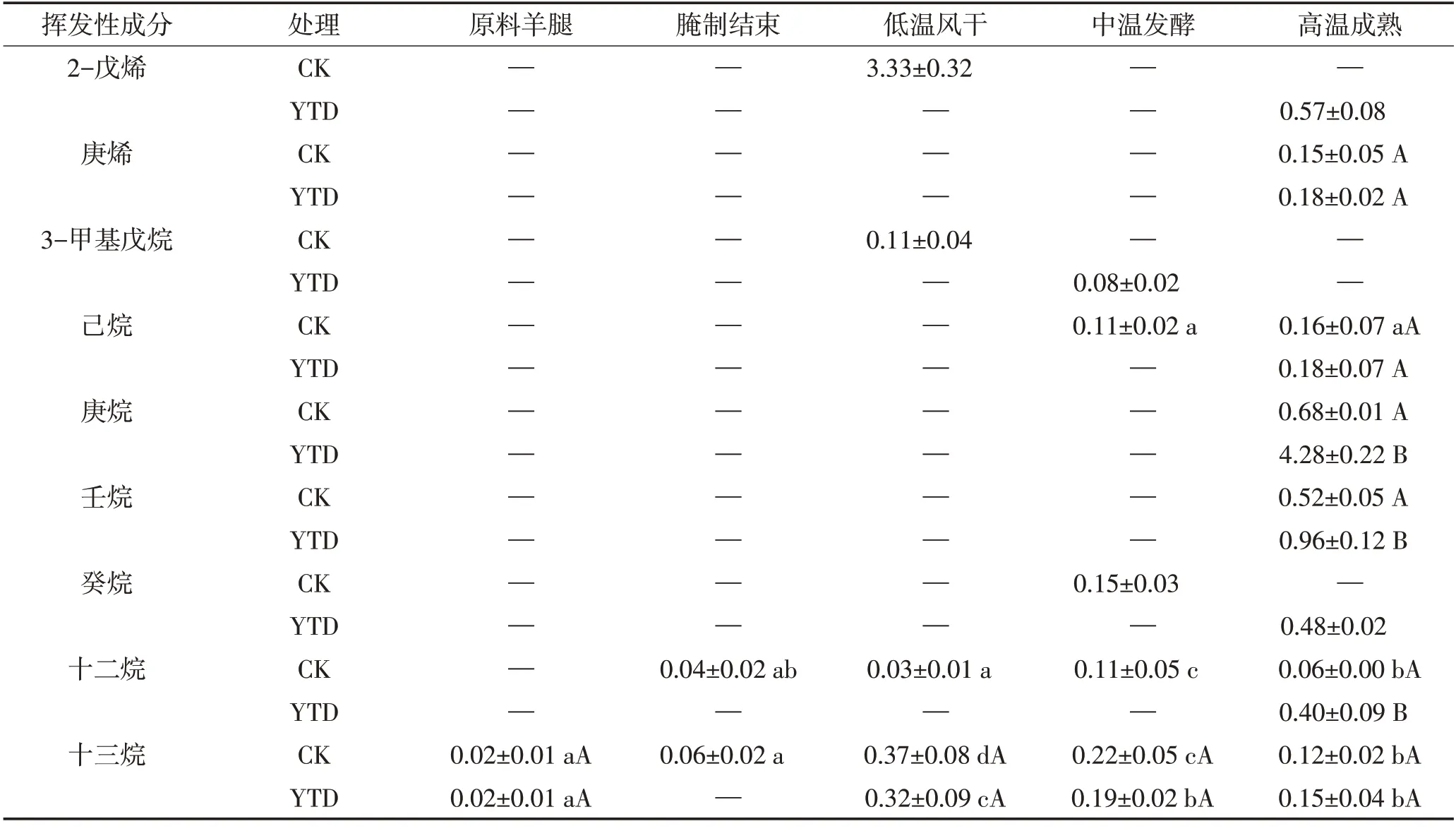
表5 干腌羊火腿加工过程中烷烃和烯烃类物质相对含量的变化Table 5 Changes of alkanes and alkenes relative contents in dry-cured lamb ham during processing 单位:%
2.5.5 酮类
由图5E和表6可见,KCl替代组的羊火腿酮类化合物总相对含量在风干结束时达到最大值,随后迅速降低;而对照组的酮类化合物总相对含量在成熟结束后达到最高值。对照组成品中相对含量最高的酮类化合物是2,3-辛二酮,盐替代组中2-庚酮和2-壬酮的相对含量较高;在干腌阶段,2-酮类的相对含量略有增加,使产品具有黄油味,直链2-酮的生成与肉制品表面霉菌的β-氧化能力有关[30]。在两组最终产物中发现了通过美拉德反应形成的3-辛烯-2-酮,说明强化高温成熟工艺可促进美拉德反应,提升干腌羊火腿的风味品质。

表6 干腌羊火腿加工过程中酮类物质相对含量的变化Table 6 Changes of ketones relative contents in dry-cured lamb ham during processing 单位:%
2.5.6 酯类
酯类风味物质具有果香味,且阈值很低,对干腌肉制品的整体风味有重要影响。肉制品中的酯类物质可通过微生物调控生成,也可由酸与醇之间的酯化反应产生[31]。如表7所示,两个处理组中的支链短链酯是发酵肉制品的特征风味物质。本试验中,KCl替代组的酯类化合物总相对含量从干腌结束至强化高温结束一直高于对照组(图5F),因为高Na+浓度可抑制微生物生长,从而降低干腌肉制品中酯酶的活性[22]。相对低温风干阶段,最终产品的酯类化合物总相对含量显著减少(P<0.05),可能是由于强化高温成熟加速了产品中酯类物质挥发,且原料羊腿脂肪含量较低,表面皮层薄,也使得加工后期酯类物质损失。
2.5.7 酸类
如表8所示,两组加工过程只检测到4种酸类物质。乙酸存在于中温发酵期,火腿中乙酸可能来自碳水化合物的微生物代谢或高温成熟温度阶段的美拉德反应[32]。支链羧酸由微生物或者通过美拉德反应氧化醛而产生,对产品的风味有重要影响。本研究中,成品火腿中主要的酸类化合物具有奶酪香气,阈值较低的3-甲基丁酸在最终产品中产生,这与3-甲基丁醛在羊火腿加工过程中发生氧化相关[27]。辛酸的形成主要源于脂类的水解。
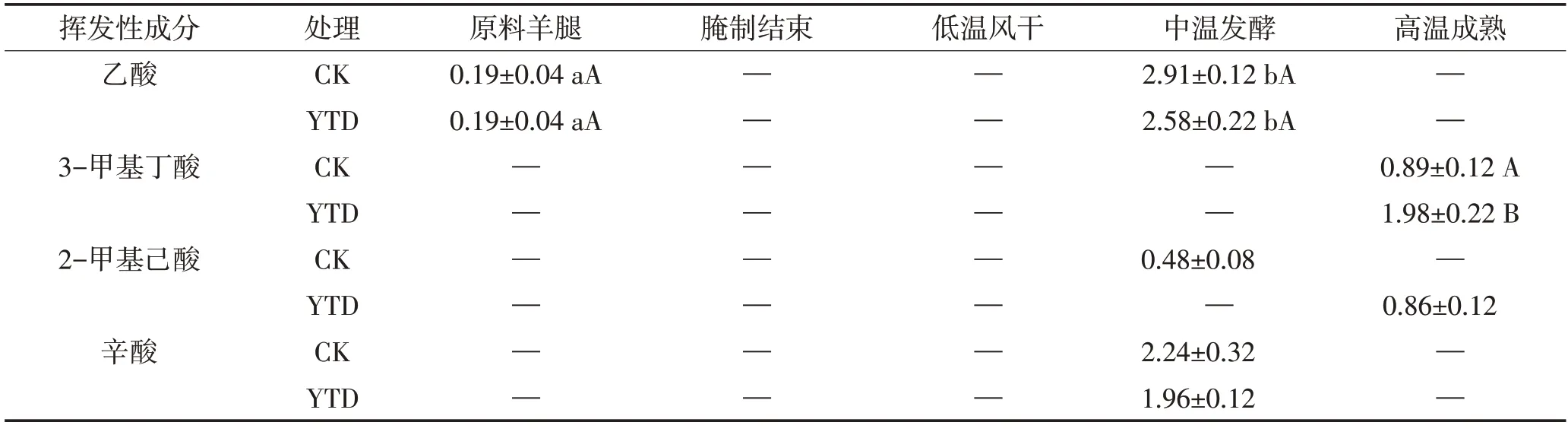
表8 干腌羊火腿加工过程中酸类物质相对含量的变化Table 8 Changes of acids relative contents in dry-cured lamb ham during processing 单位:%
2.5.8 含硫和含氯化合物
由表9 可以看出,作为肉制品中的气味活性成分,2-甲基二硫化物在两组中均被检测出,其赋予产品大蒜和洋葱的味道,这可能与含有硫甲基的氨基酸通过Strecker 降解进行分解代谢相关[1]。由于其阈值很低,因此相对含量较低的硫化合物对火腿的整体风味可能有更好的贡献,使其相对含量更低的替代组在风味上表现更佳。羊火腿中挥发性含氯化合物1,3-二氯苯可能来自包装材料或农药残留[33]。

表9 干腌羊火腿加工中硫和氯化物相对含量的变化Table 9 Changes of sulfur and chloride compounds relative contents in dry-cured lamb ham during processing 单位:%
3 结论
本研究结果表明,相对于100% NaCl 加工的产品,25% KCl 替代NaCl 协同强化高温成熟技术对产品的水分含量、水分活度、盐分含量、亚硝酸盐含量及色泽无不良影响,加工过程中两组羊火腿的理化指标变化趋势基本一致。通过GC-MS 分析发现,25%KCl 替代NaCl 增加了Strecke 醛的含量,如3-甲基丁醛,它对火腿的整体风味有重要影响。同时KCl替代NaCl 也促进了产品中3-甲基丁酸的生成,抑制硫化物的形成。说明KCl 替代NaCl 协同强化高温成熟工艺能改善产品的理化性质和风味品质,且降低了产品中的Na+含量,是一种健康可行的干腌肉制品加工方法。
