香根草根系分泌物对阿特拉津胁迫的响应及对土壤中阿特拉津残留的去除
2023-10-30张发明王秋玲杨树春荣渝虹孙仕仙
张发明,王秋玲,杨树春,李 良,荣渝虹,孙仕仙,郑 毅,3②
(1.云南农业大学植物保护学院,云南 昆明 650201;2.西南林业大学湿地学院/国家高原湿地研究中心,云南 昆明 650233;3.云南开放大学云南乡村振兴教育学院,云南 昆明 650223;4.云南省动物疫病预防控制中心,云南 昆明 650201;5.西南林业大学园林园艺学院,云南 昆明 650233)
阿特拉津是一种三氮苯类除草剂,主要用于控制一年生阔叶杂草,如玉米、高粱和甘蔗等作物田间的杂草[1]。阿特拉津全球年使用量为7万~9万t[2],中国近年来年消费量为1万~1.5万t[3]。据报道,50%~90%的农药施用后直接到达非靶标植物或进入环境中,对土壤、水体和非靶标生物造成污染[4-5]。欧洲中部和波兰土壤中阿特拉津及其转化产物的最高检出浓度分别为0.124和1.64 mg·kg-1[6-7],我国农田土壤中阿特拉津最高残留量达2.48 mg·kg-1[8]。阿特拉津在自然条件下降解缓慢,半衰期为10~5 824 d[9]。阿特拉津在土壤中累积会造成作物死苗和减产[10]。而且,阿特拉津具有内分泌干扰物和致癌物性质,经食物链传递对人类健康构成严重威胁[11-14]。开展阿特拉津污染土壤修复研究具有重要现实意义。
植物修复具有环境友好、成本低、操作简便和无二次污染等优点[15-16],是当今有机污染修复领域关注的焦点和未来发展的趋势[5,17]。根系分泌物是有机污染物修复过程中的关键物质。在植物修复过程中,植物通过向根际释放根系分泌物,与根际微生物进行物质交换和信息传递,加速土壤中污染物去除[18-19]。大量研究证明,在有植物的土壤中污染物降解效果更好[20-21],根系分泌物营造的根际微环境是有机污染物快速消减的重要原因[22]。例如,有机酸和氨基酸对土壤中结合态苯醚甲环唑和吡虫啉有明显的活化作用[23],苏丹草根系分泌物改变了土壤中细菌和真菌种群数量与群落结构,促进有机氯农药的降解[24],黑麦草根系分泌物促进了多环芳烃降解菌的生长,使土壤中的芘含量显著下降[22]。此外,研究表明小麦和狼尾草根系分泌物可以促进土壤中阿特拉津的解吸[25-26]。苜蓿根系分泌物组成和含量在阿特拉津胁迫下明显改变,而且苜蓿根系分泌物能够促进溶液中阿特拉津的去除[27]。
香根草(Chrysopogonzizanioides)是一种分布广、生长迅速、生物量大、根系发达、对污染物耐受性强的多年生禾本科植物[28-29],已广泛用于受污染水体和土壤环境的修复。例如,香根草可以吸收和有效去除环境中的重金属(铅、砷、镉)、农药(扑草净、硫丹)和抗生素(磺胺)等污染物[30-32],具有广阔的运用前景。另外,香根草能够促进旱地土壤和淹水土壤中阿特拉津的去除和降解[28,31]。近年来有学者通过水培试验研究了四环素胁迫下的香根草根系分泌物[33],笔者前期研究也采用水培方法对扑草净胁迫下的香根草根系分泌物进行了鉴定[34]。有研究表明,不同的生长环境通常会导致根系分泌物组分的差异,土培方式获得的根系分泌物最接近真实情况[35]。但土培环境中,阿特拉津胁迫下的香根草根系分泌物特征尚不清楚,根系分泌物对阿特拉津的去除效果也有待研究。因此,该试验旨在鉴定香根草根系分泌物,并明确香根草根系分泌物对土壤中阿特拉津的去除效果。
1 材料与方法
1.1 试验材料
阿特拉津标准品购自Dr.Ehrenstorfer GmbH(上海)公司。阿特拉津原药(w=97%)购自美伦生物技术有限公司(大连)。试验用土采自云南农业大学后山农场,属于红壤。土壤在室内风干后过2 mm孔径筛,除去石头和植物残体等杂物,经气相色浓度谱质谱联用法(GC-MS)检测[36],该土壤阿特拉津背景值为0。香根草分蘖苗购自江西省红壤研究所,幼苗移栽到苗床缓苗1个月以适应水土。
1.2 试验设计
1.2.1香根草分泌物鉴定试验
试验设2个处理,即2 mg·kg-1阿特拉津 + 种植香根草(ATP)、0 mg·kg-1阿特拉津 + 种植香根草(CKP)。每个处理重复3次。ATP组中阿特拉津浓度设置以环境浓度和推荐浓度(3~6 mg·kg-1)为依据[8,37]。阿特拉津在试验开始前一次性加入土壤,添加方法如下:称取适量w=97%的阿特拉津原药,充分溶解于装有丙酮的1 L三角瓶中,向三角瓶中加入适量土壤,置于振荡器中振荡30 min(25 ℃、180 r·min-1),取出置于通风橱中,直至丙酮完全挥发,得到阿特拉津掺合浓度为200.00 mg·kg-1的土壤,将此土壤与适量无阿特拉津土壤均匀混合并逐级稀释,得到阿特拉津掺合浓度为2.00 mg·kg-1的土壤。
试验在云南农业大学后山温室大棚内进行,昼夜周期为14 h∶10 h,试验期间平均温度为(23.08 ± 7.36)℃。移栽当天,从苗床选取表型一致的香根草分蘖苗,剪去部分茎叶至地上部高度为25.00 cm。先后用自来水和去离子水清洗根系,去除附着在表面的土壤。取125 g香根草苗(5~6株,表型基本一致)放入0.038 mm孔径尼龙网袋(长和高分别为14和15 cm),袋内填入500.00 g土壤(以干土计),将装有土壤和香根草的尼龙网袋放入花盆(底径、高度和口径分别为17、22.5 和 22 cm),填入2 000.00 g土壤(以干土计)。ATP处理填装2.00 mg·kg-1的阿特拉津掺合土壤,CKP处理填装无阿特拉津土壤,尼龙网袋内外填装土壤一致。及时浇水,浇水量为田间持水量的90%。试验期间定期补充水分,使盆内土壤水分保持在田间持水量的60%左右。培养第60天收集香根草根系分泌物用于分泌物特征鉴定。
根系分泌物收集参考LIAO等[38]的方法。试验第60天取出根袋,抖落附着在根系上的土壤,用自来水和超纯水冲洗根系。将洗净的根系浸没于超纯水配制的400 mL 0.5 mmol·L-1氯化钙溶液中,用锡纸包裹瓶身避光,置于阳光下连续培养4 h。收集液过0.45 μm孔径微孔滤膜,超纯水定容至400 mL,4 ℃储存。
1.2.2香根草分泌物降解土壤阿特拉津试验
试验设3个阿特拉津浓度水平:10、50和100 mg·kg-1。每个阿特拉津浓度水平设4个香根草根系分泌物添加水平(10、20、50和100 mg·kg-1)和1个对照(添加等量超纯水),香根草根系分泌物添加量参考LIAO等[38]的试验,每个处理重复3次。
取土壤中培养60 d的香根草,用超纯水按照上述方法收集根系分泌物,并用旋转蒸发仪在40 ℃下对根系分泌物收集液进行浓缩,得到质量浓度为270 mg·L-1的香根草根系分泌物,保存于-20 ℃冰箱中。
培养条件及采样时间:每个处理称取100 g老化(-20 ℃储藏1个月)的阿特拉津污染土壤,装入棕色玻璃瓶(底径、高度和口径分别为6.5、12.5和5 cm)。向玻璃瓶中添加香根草根系分泌物,调节土壤湿度至田间持水量的60%,30 ℃连续培养32 d。试验期间用称重法定期补充水分,使土壤湿度维持在田间持水量的60%。第4、8、16和32天破坏性采集土壤样品,测定阿特拉津浓度、土壤pH值和微生物生物量碳(MBC)含量。
1.3 测定指标和方法
1.3.1根系分泌物鉴定
香根草根系分泌物提取:提取方法参考张建聪等[39]的报道。取50 mL二氯甲烷加入装有根系分泌物的玻璃瓶,剧烈摇晃30 s,收集下层有机相。50 mL二氯甲烷重复提取上层水相,合并2次提取所得有机相,用旋转蒸发仪40 ℃浓缩至近干,分别用3和2 mL二氯甲烷润洗旋蒸瓶,润洗液全部转移至5 mL玻璃瓶,氮气下吹干,HPLC级二氯甲烷复溶,涡旋10 s混匀,待GC-MS测定。
GC-MS条件:GC-MS参数设置参考罗丽芬等[40]的方法。以氦气作为载气,恒流模式,流速为1 mL·min-1;不分流模式进样,进样量1 μL;升温程序:初始柱温60 ℃(保持1 min),10 ℃·min-1上升至 325 ℃(保持10 min);进样口温度250 ℃;传输线温度为280 ℃;离子源和四极杆温度分别为230和150 ℃;电子能量为70 eV。
1.3.2土壤微生物生物量碳含量测定
土壤微生物生物量碳含量用氯仿熏蒸法测定[41]。称取5 g培养32 d的鲜土,装入50 mL离心管,用去乙醇氯仿真空下熏蒸24 h,同时做不熏蒸对照。熏蒸完毕加入20 mL 0.5 mol·L-1硫酸钾溶液,25 ℃下以180 r·min-1振荡30 min,以相对离心力(RFC)3 080离心5 min,上清液过0.45 μm微孔滤膜。滤液中有机碳含量用TOC分析仪测定。土壤微生物生物量碳含量以熏蒸和不熏蒸样本的碳含量之差除以转化系数0.45计算。
1.3.3土壤阿特拉津浓度测定
土壤阿特拉津浓度按照ZHANG等[31]的方法测定。
1.4 数据分析
分泌物数据采用MSD ChemStation F.01.03.2357软件进行处理。以质谱数据库NIST14作为检索依据,对香根草根系分泌物测定所得色谱图进行检索与核对分析,以匹配度≥90%作为筛选标准,确定香根草分泌物中化合物的组分。化合物相对含量和相对含量变化值分别根据下式计算:
(1)
(2)
式(1)~(2)中,Ra为某类化合物相对含量;An为某类化合物总峰面积;AN为所有化合物总峰面积;ΔRa为某类化合物相对含量的变化值;TAA为阿特拉津胁迫处理香根草根系分泌物中某类化合物总峰面积;KAC为无阿特拉津处理香根草根系分泌物中某类化合物总峰面积。
用Excel 2021和SPSS 19.0软件进行数据处理、单因素方差分析和t检验,用Duncan检验评估显著性水平为0.05时处理间的差异显著性。图表用Excel 2021和Origin 2021绘制。
2 结果与分析
2.1 香根草根系分泌物鉴定结果
香根草根系分泌物GC-MS扫描色谱图见图1,图中基线无明显漂移,且分泌物特征峰明显,峰形对称,响应值高,说明检测结果可靠。

图1 香根草根系分泌物GC-MS扫描总离子流色谱图(TIC)
通过NIST谱库检索比对,在CKP处理的香根草根系分泌物中鉴定出15类88种化合物,在ATP处理的香根草根系分泌物中鉴定出15类83种化合物(附表1)。

表1 香根草根系分泌物中化合物种类及数量
2.2 阿特拉津胁迫下香根草根系分泌物数量的变化
如表1所示,CKP处理根系分泌物中化合物类别按数量由多到少排序依次为烷、烯、酯、酸、腈、酮、酰胺、醇和酚,其中占比前3位的烷(32.95%)、烯(19.32%)和酯(12.50%)占化合物总数的64.77%;ATP处理根系分泌物中化合物类别按数量由多到少排序依次为烷、烯、酯、醇、酰胺、酸、腈、酮和酚,其中烷、烯和酯占化合物总数的61.45%。与对照相比,阿特拉津胁迫下香根草根系分泌物类别整体上变化不大,但烷类化合物占比减少8.85百分点,烯类和醇类化合物占比分别增加4.78和3.82百分点。说明阿特拉津胁迫可能抑制烷类化合物的分泌,促进烯类和醇类化合物的分泌。
2.3 阿特拉津胁迫下香根草根系分泌物相对含量的变化
CKP和ATP处理香根草根系分泌物中化合物相对含量按类别排名前3位的依次为酰胺、腈和烯,这3类化合物相对含量占所有化合物含量的80%以上(表2)。此外,阿特拉津处理组中酰胺类和醇类化合物相对含量占所有化合物相对含量的比例显著大于对照组,而腈类和酮类化合物相对含量占所有化合物相对含量的比例显著小于对照组。从化合物相对含量变化的角度分析,阿特拉津胁迫增加了醇类和酚类化合物的相对含量,分别比对照增加123.45%和5.19%。相反,阿特拉津胁迫降低了腈、酮、酸、烷、烯、酯、胺和酰胺类化合物的相对含量(图2)。说明阿特拉津胁迫可能会提高香根草中醇类和酚类化合物的分泌量,但降低其他类化合物的分泌量。

表2 香根草根系分泌物相对含量

图2 阿特拉津胁迫下香根草根系分泌物的变化
2.4 香根草根系分泌物对土壤中阿特拉津的去除
由图3可见,不同阿特拉津污染水平下,10、20、50和100 mg·kg-1香根草根系分泌物添加处理均显著提高了土壤中阿特拉津的去除率(P<0.05)。10、50、100 mg·kg-1阿特拉津污染水平处理组分别比对照提高9.18%~15.57%、5.51%~11.72%和9.43%~16.99%。当分泌物添加量不超过50 mg·kg-1时,土壤中阿特拉津去除率整体上随分泌物添加量增加而提高。当分泌物添加量超过50 mg·kg-1时,第32天土壤中阿特拉津去除率低于其他分泌物添加水平,但显著大于对照(P<0.05)。

同一幅图中同组直方柱上方英文小写字母不同代表同一时间不同分泌物添加水平间去除率差异显著(P<0.05)。
2.5 香根草根系分泌物对土壤pH值和微生物生物量碳含量的影响
在10、50 和100 mg·kg-13个阿特拉津污染浓度下,土壤pH值整体随根系分泌物添加量增加而提高(图4),分别比对照提高0.68%、1.53%和1.50%,其中100 mg·kg-1处理与对照差异达显著水平(P<0.05)。另外,土壤pH值随阿特拉津浓度增加而显著增加(P<0.05)。试验结果说明添加香根草根系分泌物和阿特拉津能够提高土壤pH值。
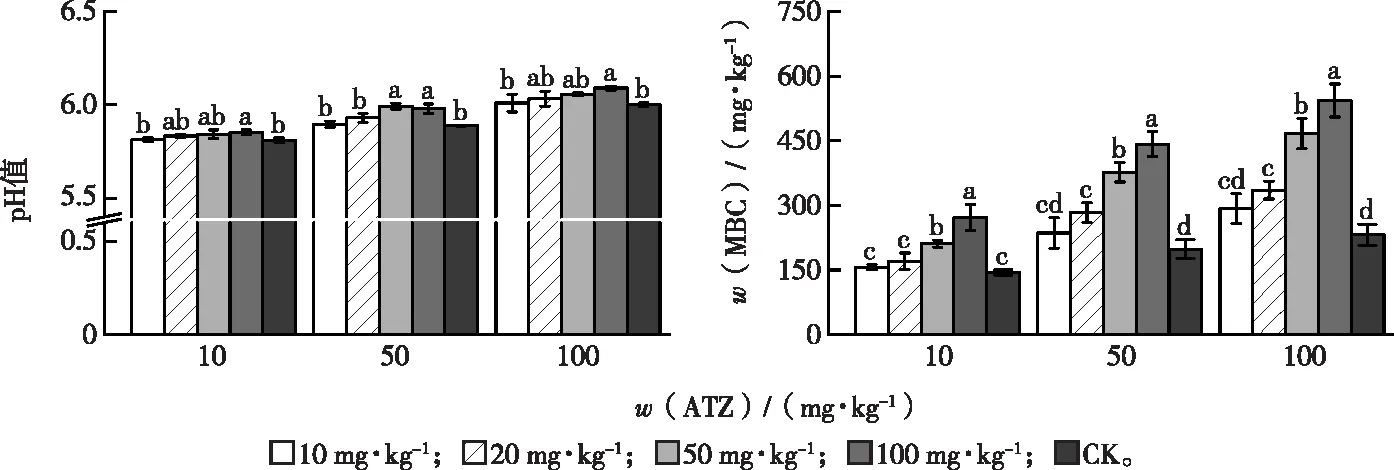
同一幅图中同组直方柱上方英文小写字母不同代表同一阿特拉津(ATZ)浓度下不同分泌物添加水平间某指标差异显著(P<0.05)。
添加香根草根系分泌物后土壤微生物生物量碳含量变化见图4。10、50和100 mg·kg-1阿特拉津污染浓度下,20、50 和100 mg·kg-1香根草根系分泌物添加处理的土壤微生物生物量碳含量随根系分泌物添加量增加而显著提高(P<0.05),而且均显著大于对照(P<0.05)。香根草根系分泌物添加量为100 mg·kg-1时,10、50 和100 mg·kg-1阿特拉津污染土壤中土壤微生物生物量碳含量分别比对照提高88.86%、122.93%和134.40%。另外,土壤中阿特拉津浓度增加,土壤微生物生物量碳含量随之显著增加(P<0.05)。试验结果说明香根草根系分泌物能够促进土壤微生物生长,而且土壤微生物活性也受到阿特拉津刺激。
3 讨论
3.1 阿特拉津胁迫对香根草根系分泌物组分和相对含量的影响
GC-MS在植物根系分泌物的检测和鉴定中已经得到广泛运用[40,42]。该研究利用GC-MS对阿特拉津胁迫下的香根草根系分泌物进行鉴定,共鉴定出83种化合物,主要包括烷、烯、酯、醇、胺、脂肪酸、酮和酚。研究表明,根系分泌物组成受多种因素影响,除植物种类外,还与栽培环境和植物发育阶段等因素有关[43]。RATHINAVELU等[44]研究发现,不同条件下香根草根系分泌物组分不同,主要有碳氢化合物、酯类、酮类和酚类。黄京华等[45]通过GC-MS鉴定香根草根系挥发性物质,结果表明其主要成分是烯、醇、酮和烷。石傲傲[34]利用GC-MS在水培的香根草分泌物中鉴定出22种化合物,主要包括烷、酯、醇、苯和酸。水培条件下香蒲根系分泌物中检出的化合物种类主要包括烷、烯、酯、胺、醇、酚、酮和有机酸,其中烷类化合物种类最多且相对含量最高[46]。相较而言,笔者鉴定出的香根草根系分泌物种类和数量更多。香根草作为一种水陆两栖的多年生植物,可生长于淹水土壤环境中(如湿地和湖河浅滩等)。为了更深入理解香根草修复阿特拉津污染土壤的机理,未来的研究有必要对淹水土壤中阿特拉津胁迫下的香根草根系分泌物特征进行研究。
根系分泌物是植物与微生物之间交流的信号,在根际微生态系统的迁移转化中发挥着重要作用[18],而污染物胁迫通常导致植物分泌物发生变化,这种变化是植物对有害物质的应激反应,有利于污染物分解[47]。研究发现,污染物胁迫下,根系分泌物数量会增加[46,48],但该试验中阿特拉津胁迫导致香根草根系分泌物数量出现小幅下降。推测植物根系分泌物数量与试验时间跨度有关,随着试验时间的延长,植物根系和环境中污染物浓度下降,对植物的胁迫减弱,因而分泌物数量变化较小。然而,经过60 d培养,阿特拉津胁迫减少了烷类化合物数量,增加了烯类和醇类化合物数量。说明即使在低浓度污染物胁迫下,植物仍然会调整根系分泌物的组分来适应不利环境。
遭受污染物胁迫时,植物不仅能够改变根系分泌物种类,还能够调节分泌物含量来响应不利环境[18]。阿特拉津胁迫下,香根草根系分泌物中醇和酚的相对含量增加,腈、酮、酸、烷、烯、酯、胺和酰胺类化合物的相对含量降低。研究表明,在盐分和其他非生物胁迫下,多酚化合物的合成和积累通常被诱导,这与酚类化合物有较强的抗氧化活性有关[49],而且酚对植物促生菌的繁殖起到促进作用,有助于改善土壤细菌群落结构[50]。该试验中相对含量最大的酰胺类物质属于弱碱性物质,有助于提高根际土壤pH值。另外,污染物胁迫下,植物分泌的有机酸、氨基酸和可溶性糖通常会明显增加[48-49],而该试验中未检测到这些物质的存在,这可能与培养时间和检测方法等因素有关,有待进一步研究。
3.2 香根草根系分泌物对土壤中阿特拉津去除的影响
根系分泌物的流动提高了许多常见代谢物的局部浓度,不仅可以改变土壤理化性质及微生物活性,还会影响土壤-植物界面的许多生理生化过程,直接或间接提高植物抗逆性[49]。该试验中,香根草根系分泌物显著提高了土壤中阿特拉津的去除率,原因可能在于根系分泌物改善了土壤性质,为微生物提供了更好的生长环境[51-52]。添加香根草根系分泌物后,土壤微生物生物量碳含量显著增加,也说明根系分泌物为微生物的生长繁殖提供了适宜的环境。另外,根系分泌物对阿特拉津的去除表现为适宜浓度促进,高浓度抑制。原因可能在于高浓度根系分泌物打破了细菌群落原有的平衡,导致群落多样性降低,活性受到抑制[38]。
4 结论
(1)在无阿特拉津和阿特拉津胁迫的香根草根系分泌物中分别检测到88和83种化合物,包括烷、烯、酯、酸、腈、酮、酰胺、醇和酚等。按各类化合物数量高低排序,前3位为烷、烯和酯;按各类化合物相对含量高低排序,前3位为酰胺、腈和烯。
(2)阿特拉津胁迫改变了香根草根系分泌物组分和含量。阿特拉津胁迫增加烯类和醇类化合物数量,减少烷类化合物数量;阿特拉津胁迫显著增加醇类和酚类化合物的相对含量,降低腈、酮、酸、烷、烯、酯、胺和酰胺类化合物的相对含量。
(3)香根草根系分泌物显著提高土壤阿特拉津去除率。在10~50 mg·kg-1添加范围内,阿特拉津去除率随根系分泌物添加量增加而显著提高。
