斯里兰卡木薯花叶病毒TVM3 分离物侵染性克隆构建及鉴定
2023-10-29余乃通冼淑丽尹慧祥赵羽涵郑小宝刘志昕
余乃通,冼淑丽,尹慧祥,赵羽涵,郑小宝,刘志昕
(1.中国热带农业科学院热带生物技术研究所,海南 海口 571101;2.海南省热带微生物资源重点实验室,海南 海口 571101;3.清华大学附属中学文昌学校,海南 文昌 571300)
【 研究意义】木薯(Manihot esculentaCrantz)是世界热区的重要口粮,也是重要的热带能源作物之一。木薯具有较强的耐旱、耐贫瘠能力,适应性强,目前已在世界热区广泛种植[1-2]。然而,由木薯双生病毒(Cassava mosaic geminivirus,CMVs)感染引起的木薯花叶病(Cassava mosaic disease,CMD)是世界木薯产业的主要限制因素,在非洲和东南亚广泛流行。引起CMD 的CMVs 病原及其变种有11 种,包括非洲木薯花叶病毒(African cassava mosaic virus,ACMV)、斯里兰卡木薯花叶病毒(SLCMV)、南非木薯花叶病毒(South African cassava mosaic virus,SACMV)等[3]。20 世纪初,SLCMV首先在斯里兰卡被发现和报道,目前已在亚洲的柬埔寨、泰国、越南、老挝、印度和中国等国家发现[4]。2018 年,在我国的福建和海南木薯上首次发现和报道了木薯花叶病的病原,即SLCMV[5-6],序列分析显示,SLCMV 中国分离株和斯里兰卡分离株以及印度分离株序列高度相似,同源性在98.5%以上。中国学者对SLCMV 及其他木薯双生病毒研究尚属起步阶段,且国内木薯种质资源对SLCMV的抗性背景也不清楚。此外,从亚洲各地区分离的不同SLCMV 株系,其致病性差异还未有研究。因此,开展SLCMV 病毒侵染性克隆及鉴定是解决上述问题的重要前期基础。【前人研究进展】SLCMV 是双生病毒科(Geminiviridae)的菜豆金色黄花叶病毒属(Begomovirus)成员,其基因组由2 条大小约2 800 nt 的单链环状DNA 组分组成,即DNA-A 组分和DNA-B组分[7-8]。本研究中SLCMV TVM3株系的DNA-A组分(GenBank序列号:KP455486.1)全长为2 747 nt,其正义链上含有2 个开放阅读框(ORF):AV1 和AV2,分别编码外壳蛋白(Coat protein,CP)和AV2 蛋白;反义链含有4个ORF:AC1、AC2、AC3 和AC4,分别编码复制相关蛋白(Replication-associated protein,Rep)、转录激活蛋白(Transcriptional activator protein,TrAP)、复制增强子(Replication enhancer,REn)和RNA 沉默抑制子AC4 蛋白。DNA-B 组分(GenBank 序列号:KP455487.1)全长为2 741 nt,其正义链和反义链各含有1 个ORF,即BV1 和BC1,分别编码核穿梭蛋白(Nuclear shuttle protein,NSP)和运动蛋白(Movement protein,MP)[9]。根据DNA-A组分全长序列构建系统发育树,Legg 等[10]把11种CMVs 及其变种分成3 组,分别为南亚组、西非组和东南非组。在亚洲地区,木薯花叶病由印度木薯花叶病毒(Indian cassava mosaic virus,ICMV)和SLCMV 的2 个株系感染引起,均属南亚组[11]。早在1993 年,就有学者成功构建了木薯花叶病毒侵染性克隆[12]。2002年,Saunders等[13]也成功构建了SLCMV 的侵染性克隆,初步阐明SLCMV 最早可能是单组分病毒,进化过程中获取了DNA-B 组分从而成为双组分病毒。
【本研究切入点】虽然木薯花叶病已在中国福建和海南等地方出现,但目前尚未在我国发生流行和大面积危害;国内木薯品种抗性不明及抗病种质资源缺乏的现状仍然存在,木薯花叶病一旦流行,将对我国木薯生产造成严重危害和经济损失。因此,开展病毒侵染性克隆构建是探究国内木薯种质资源抗花叶病遗传背景的有效手段。【拟解决的关键问题】利用分子生物学技术构建的病毒侵染性克隆,可通过农杆菌将含有目的病毒片段的质粒介导到植物体内,从而激活病毒蛋白表达和产生病毒全长基因组,最后包装成有侵染活性的病毒粒子,用于SLCMV 与宿主相互作用研究。本研究以SLCMV TVM3 株系为研究对象,旨在构建不含有编码区重复序列的病毒侵染性克隆,且能成功感染本生烟和拟南芥等模式植物,为下一步国内木薯种质资源抗花叶病遗传背景的精准鉴定、病毒基因功能鉴定以及病毒致病机理研究等提供重要前期基础。
1 材料与方法
1.1 试验材料
植物双元表达载体pCAMBIA1301 由本实验保存;EasyTaq DNA Polymerase、GV3101(pSoupp19)农杆菌感受态、大肠杆菌DH5a 感受态、质粒快速小提试剂盒、2k DNA Marker、12k DNA Marker 均购自北京全式金生物技术有限公司;快速植物DNA 提取试剂盒(RaPure Plant DNA Mini Kit)购自广州美基生物科技有限公司;T4 DNA 连接酶、SacI、SalI 限制性内切酶购自宝生物工程(大连)有限公司;本生烟(Nicotiana benthamiana)和拟南芥(Arabidopsis thaliana)种子为本实验室保存。
1.2 pDNA-A 和pDNA-B 侵染性克隆载体构建
以全长为2 747 nt 的SLCMV DNA-A 为模板,构建DNA-A 侵染性克隆载体。如图1A 所示,该侵染性克隆序列除了含有完整的DNA-A 全长序列外,其5′端还额外含有145 bp 的非编码区重复片段(DNA-A+2603~+2747),3′端也额外含有137 bp 的非编码区重复片段(DNA-A+1~+137),两端分别含有SacI 和SalI 酶切位点。将此DNA-A侵染性克隆序列送往通用生物(安徽)股份有限公司合成,通过T4 DNA 连接酶(16 ℃)构建到pCAMBIA1301 载体中,即pCAMBIA1301-DNA-A(pDNA-A)。通过化学转化法将pDNA-A 转化大肠杆菌DH5a 感受态细胞,随机挑取1 个重组子进行Sanger 测序,所用引物依次为1301-F、1301-R、DNA-A-seq1~DNA-A-seq4(表1);同时提取质粒,用SacI 和SalI 双酶切验证。

表1 所使用的引物列表Table 1 Primers used in this study

图1 pDNA-A(A)和pDNA-B(B)侵染性克隆构建示意图Fig. 1 Schematic diagram for the construction of pDNA-A(A) and pDNA-B (B) infectious clone
以全长为2 741 nt 的SLCMV DNA-B 为模板,构建DNA-B 侵染性克隆载体。如图1B 所示,该侵染性克隆序列除了含有DNA-B 完整的全长序列外,其5′端还额外含有106 bp 的非编码区重复片段(DNA-B+2636~+2741),同样,其3′端也额外含有119 bp 的非编码区重复片段(DNA-B+1~+119)。其他步骤同DNA-A,所用引物依次为1301-F、1301-R、DNA-B-seq1~DNA-B-seq4(表1)。
1.3 侵染性克隆接种本生烟和拟南芥植株
采用液氮冻融法,将pDNA-A、pDNA-B 分别转入GV3101(pSoup-p19)农杆菌感受态细胞,挑取阳性单菌落至500 μL 含有抗生素(50 μg/mL Kan,50 μg/mL Rif,50 μg/mL Strep)的LB 液体培养基中单独培养,28 ℃震荡培养24 h;按照1:50的比例扩大培养,同时加入终浓度为20 mol/L 的AS 和10 mmol/L 的Mes,28 ℃震荡过夜培养;4 ℃、5 000 r/min 离心10 min,去上清,菌体沉淀用500 μL 溶液(150 μmol/L AS,10 mmol/L Mes,10 μmol/L MgCl2)重悬,测定菌液OD600值,使两者的菌液OD600值一致(浓度范围0.4~0.6);然后1:1 混合两者的菌液,室温静置3~5 h;用0.2 mL 的无针头注射器将50 μL 处理好的农杆菌注入本生烟(5~6 叶期)叶片下表皮的叶脉之间,每个叶片注射1 个点,每株注射3 个叶片,共接种10 棵本生烟植株,同时设置接种空质粒的本生烟为对照,置于25 ℃精细培养房培养。
另将混匀的农杆菌侵染液倒入浅口容器中,将拟南芥植株(5~6 叶期)的花絮和茎浸入侵染液,静置1 min,共接种10 棵拟南芥植株,同时设置接种空质粒的拟南芥为对照,置于25 ℃精细培养房培养。
1.4 症状观察及PCR 检测
SLCMV 侵染性克隆通过GV3101 农杆菌接种本生烟和拟南芥植株后,每隔2~3 d 观察并记录植株症状。接种14 d(拟南芥接种18 d)后,采集本生烟和拟南芥植株的第3 片或第4 片新生叶片,用试剂盒(RaPure Plant DNA Mini Kit)提取其总DNA,利用引物DNA-A 2000F 和DNA-A 2400R(扩增目的片段约400 bp)、以及DNA-B 370F 和DNA-B 800R(扩增目的片段约430 bp)两对引物分别对病毒两个组分进行PCR 检测。PCR 程序:95 ℃预变性2 min;94 ℃变性40 s,56 ℃退火40 s,72 ℃延伸40 s,共35 个循环;最后72 ℃延伸10 min。取5 μL 于1%琼脂糖凝胶电泳,经凝胶成像系统观察并拍照。
1.5 SLCMV 侵染性克隆感染率检测
本生烟和拟南芥植株接种SLCMV 侵染性克隆后,每隔2~3 d 观察并记录植株症状,在第30 d 采集本生烟(10 株)和拟南芥(10 株)植株的新生叶片,利用引物DNA-A 2000F 和DNA-A 2400R 对病毒进行PCR 检测,PCR 程序同上。取5 μL PCR 产物于1%琼脂糖凝胶电泳,置于凝胶成像系统观察并拍照。3 次重复实验后,分别计算SLCMV 在本生烟和拟南芥植株中的感染率。
2 结果与分析
2.1 SLCMV 侵染性克隆质粒构建
将获得的pDNA-A 和pDNA-B 侵染性克隆质粒分别进行双酶切验证,结果显示均得到了3.1 kb左右的目的片段和12 kb 左右的载体片段(图2),Sanger 测序表明其序列与目标序列一致,说明pDNA-A、pDNA-B 侵染性克隆质粒构建成功;即成功获得了SLCMV 侵染性克隆质粒pCAMBIA1301-SLCMV,可用于下一步的病毒接种实验。

图2 SLCMV DNA-A 和DNA-B 侵染性克隆质粒构建Fig. 2 Construction of SLCMV DNA-A and DNA-B infectious clone plasmids
2.2 SLCMV 侵染本生烟和拟南芥植株症状观察及分子检测
本生烟接种SLCMV 侵染性克隆7 d 后,大部分本生烟植株新生叶片无明显症状;而在接种第10 d,本生烟植株的新生叶片开始出现扭曲、斑点褪绿等症状;接种第14 d,本生烟植株新生叶片出现严重扭曲、卷叶和明显的褪绿等症状;对照组新生叶片无症状(图3A)。PCR 检测结果显示,在接种SLCMV 的第14 d,染病本生烟植株新生叶片DNA中可检测出DNA-A和DNA-B的特异性条带,而对照植株无任何条带(图3B),表明SLCMV 病毒已在本生烟植株成功复制并产生相应症状。
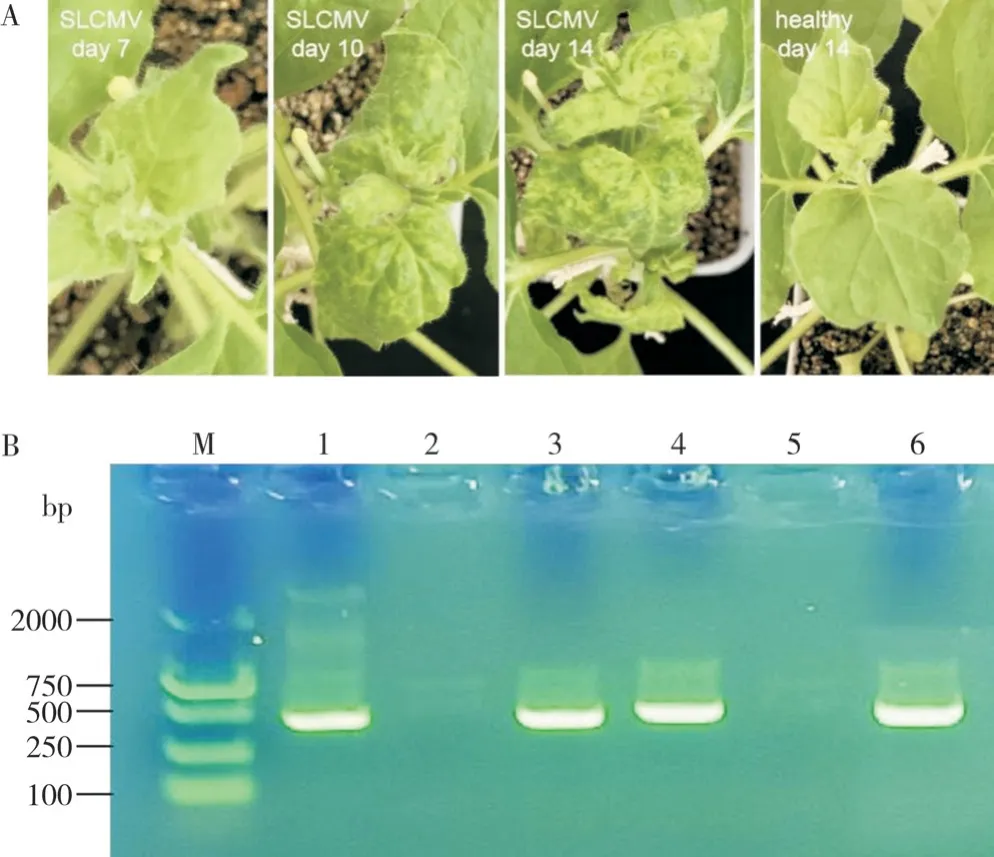
图3 SLCMV 侵染本生烟症状(A)及分子检测(B)Fig. 3 Symptoms (A) and molecular detection (B) of tobacco plants infected by SLCMV
接种SLCMV 侵染性克隆7 d 后,大部分拟南芥植株新生叶片无明显症状;而在接种第11 d,拟南芥植株的新生叶片出现轻微扭曲症状;第18 d,新生叶片出现轻微扭曲、老叶黄化等症状;对照组新生叶片无症状(图4A)。PCR检测结果显示,接种SLCMV 18 d 后,染病拟南芥植株新生叶片可见DNA-A 和DNA-B 的特异性条带,而对照组无任何条带(图4B),表明SLCMV 病毒已在拟南芥植株成功复制并产生相应症状。

图4 SLCMV 侵染拟南芥症状(A)及分子检测(B)Fig. 4 Symptoms (A) and molecular detection (B) of Arabidopsis plants infected by SLCMV
2.3 SLCMV 在本生烟和拟南芥中的病毒感染率
接种SLCMV 侵染性克隆后,本生烟植株前14 d 的病程与2.2 相似,而在15~30 d,表现出严重扭曲、卷叶和明显的褪绿等症状,且症状进一步加重。于第30 d 采集新生叶片对病毒DNA-A组分进行PCR 检测,结果显示,染病本生烟植株新生叶片均可检测到DNA-A 特异性条带,pDNA-A 质粒和pDNA-A/GV3101 菌液也检测出目的条带,而对照组无任何条带。统计结果表明,SLCMV 侵染性克隆在本生烟中的病毒感染率为96.67%(图5)。

图5 本生烟和拟南芥接种SLCMV 侵染性克隆后的病毒感染率Fig. 5 Viral infection rate of tobacco and Arabidopsis plants inoculated with SLCMV infectious clone
接种SLCMV 侵染性克隆后,拟南芥植株前18 d 的病程与2.2 相似;在第19~30 d,其症状未有明显变化,部分新生叶片仍出现轻微扭曲、老叶出现黄化等症状。于第30 d 采集新生叶片对病毒DNA-A 组分进行PCR 检测,结果显示,仅从部分拟南芥植株新生叶片中检测到DNA-A 特异性条带,而其他拟南芥植株新生叶片未检测到特异条带;pDNA-A 质粒和pDNA-A/GV3101 菌液也检测出目的条带,对照组无任何条带。统计结果表明,SLCMV 侵染性克隆在拟南芥中的病毒感染率为40 %(图5)。因此,SLCMV 侵染性克隆通过农杆菌接种本生烟的病毒感染率达到96.67%,远高于在拟南芥植株中的病毒感染率,差异显著(P< 0.05)。
3 讨论
病毒侵染性克隆是病毒反向遗传学操作的重要研究手段,也是病毒基因功能研究的基础工具。通过植物双向表达载体可将有侵染活性的病毒全长cDNA 在宿主体内转录表达,或体外转录病毒RNA 产物从而成功侵染宿主植物,两者都能产生病毒粒子。以此获得的病毒侵染性克隆,可用于病毒基因组的突变、缺失、插入、置换等研究,从而在寄主植物水平开展和鉴定病毒功能基因。植物DNA 病毒的侵染性克隆是1983 年在番茄金色花叶病毒(Tomato golden mosaic virus,TGMV)上首先构建成功的[14],随后其发展极为迅速,现已广泛应用于生物学和农学的各个领域。大量研究表明,植物环状DNA 病毒的侵染性克隆构建需要大于一个病毒基因组的全长序列,一般为1.3~1.9 倍(mer)于病毒基因组[15-16]。本研究构建的SLCMV 病毒侵染性克隆,其pDNA-A和pDNA-B 上的病毒序列分别为病毒原基因组DNA-A 和DNA-B 的1.1 倍(mer)和1.08 倍(mer),其重复序列主要来自非编码区,不含有编码区序列。因此,该SLCMV 病毒侵染性克隆在研究病毒功能基因的突变、缺失、插入、置换等DNA 重组技术带来更简便、更高效的研究方法。
本研究的SLCMV 病毒侵染性克隆(TVM3株系)通过农杆菌接种本生烟和拟南芥,其病毒接种率存在一定的差异。如通过叶下表皮注射本生烟叶片,其96.67%的本生烟植株均能感染SLCMV 病毒,而拟南芥植株的感染率仅为40%,两者差异显著(P<0.05)。其可能原因一是接种方法不同,拟南芥由于叶片偏小,主要采用的浸泡植物组织的方法,在效率上比直接注射体内会低一些。另一个原因是宿主植物差异,已有研究表明,菜豆金色黄花叶病毒属病毒更容易感染本生烟且表现出明显的症状,而在拟南芥中对SLCMV 敏感性低,在植物中表现的症状也较轻[17-18],因此在进化上,病毒在侵染宿主方面会更好的选择本生烟植株。
王国芬等[19]构建了SLCMV 两个中国分离物的侵染性克隆,SLCMV-Col 和SLCMV-DG1922。强致病分离物SLCMV-Col 侵染性克隆接种普通烟,在第27 d 可引起普通烟叶片向下卷曲,叶背出现耳突,扭曲变形和植株矮化。而弱致病分离物SLCMV-DG1922 侵染性克隆接种普通烟,在第27 d 普通烟症状不典型,植株新抽叶片无明显症状,植株生长正常。早在2008 年,SLCMVKer20 侵染性克隆被构建成功,其感染的普通烟症状也不典型,植株新抽叶片无明显症状,表明SLCMV-Ker20 也可能是弱毒株系[17]。而本研究所使用的SLCMV-TVM3 分离物感染本生烟后,在第14 d 新生叶片出现严重扭曲、卷叶和明显的褪绿等症状,表明该分离物为强致病株系。
综上所述,本文构建的SLCMV 病毒侵染性克隆为下一步探究国内木薯种质资源抗花叶病的遗传背景,病毒基因组结构和功能,以及寄主与病毒之间的相互作用提供重要前期基础,还可以利用该病毒侵染性克隆进行外源蛋白表达、基因沉默诱导等研究。
4 结论
本研究成功构建了斯里兰卡木薯花叶病毒TVM3 株系(SLCMV-TVM3)侵染性克隆并能侵染本生烟和拟南芥等模式植物。该侵染性克隆pDNA-A 和pDNA-B 上的病毒序列分别为病毒原基因组DNA-A 和DNA-B 大小的1.10 倍(mer)和1.08 倍(mer)且不含有重复的编码区序列,可为下一步国内木薯种质资源抗花叶病的遗传背景探究和病毒致病机理研究提供重要前期基础。症状跟踪观察和分子检测发现SLCMV 可在本生烟新生叶片上大量增殖,且引起典型的扭曲、卷叶和明显的褪绿等双生病毒典型症状,而在拟南芥新生叶片仅表型出轻微症状。此外,SLCMV 在本生烟中的病毒感染率达96.67%,而在拟南芥植株中仅为40%,两者差异显著,因此,本生烟更适用于双生病毒的致病机理研究。
