脱落酸对‘紫甜无核’葡萄果实品质的影响研究
2023-10-28邹东方陈荥李佳俊李志谦叶霞何畅冯建灿
邹东方,陈荥,李佳俊,李志谦,叶霞,何畅,冯建灿
(河南农业大学园艺学院,河南 郑州 450002)
葡萄果实形状、硬度和着色等外观品质,可溶性固形物和总酸等内在品质是葡萄果实品质的重要组成部分,也是影响葡萄商品价值的因素之一,其中果皮色泽是决定鲜食葡萄和葡萄酒颜色的主要因素之一[1]。随着消费水平的提高,消费者对葡萄品质的要求逐渐升高,安全有效的促进果实着色,提升果实品质逐渐成为研究的热点。
近年来,许多研究表明,使用植物生长调节剂、氨基酸和抗氧化剂等[2-4]可能是显著提高水果品质的可行策略。脱落酸(abscisic acid,ABA)作为一种重要的植物激素和信号分子,在植物发育、逆境反应和果实成熟过程中起着重要作用[5-6],其生物合成和信号转导机制已经在模式植物中得到了广泛研究。花青素是通过类黄酮生物合成途径合成的,葡萄色泽的积累主要与果实的成熟有关,ABA通过激活花色苷生物合成基因VvCHS、VvDFR、VvUFTG等和相关转录因子VvMYBPA1/2、VvMYBPA1/2、VvMYB5a/5b和VvMYBA1/2的表达促进葡萄花色苷的积累[7]。一些研究表明,在干旱胁迫条件下,克瑞森无核葡萄果实中较高的花青素含量可能是由于ABA水平的增加造成的[8-9]。叶绿素是绿色植物叶绿体内参与光合作用的重要色素,叶绿素的积累是果实早期成熟阶段呈现绿色的重要原因[10]。HU等[11]研究表明,ABA处理后,加速了果皮中叶绿素的降解。在柑橘、葡萄、黄瓜中,ABA处理促进花青素和糖的积累,降低有机酸含量和果皮中叶绿素含量,促进果实成熟[12-14]。
本研究以‘紫甜无核’葡萄品种为材料,在转色前10 d用质量浓度300 mg·L-1的ABA溶液对果穗进行蘸穗处理,观察果实颜色的变化,检测果实成熟相关指标的含量及相关通路基因的表达,分析ABA对果实转色和成熟的影响,为进一步促进葡萄果实着色、提高果实品质奠定一定的基础。
1 材料与方法
1.1 试验材料
试验所用材料为定植于河南农业大学科教园区的紫甜无核葡萄,南北行向,单干双臂整形。在转色前10 d对果穗进行蘸穗处理,选取穗型、大小、成熟度一致的葡萄植株,挂牌标记。处理方法:用300 mg·L-1的ABA(solarbio,北京)溶液浸泡果穗,以清水作为对照处理(CK)。分别在处理后0、7、14和21 d采集样品,每个处理采集5穗葡萄。将葡萄样品立即放置于液氮中,带回实验室,冻存于-80 ℃备用。
1.2 果实内源激素ABA含量测定
以异丙醇-水-盐酸提取植物样品内源性激素,利用ESI-HPLC-MS/MS 方法对植物激素进行定量分析,以安捷伦(Agilent)1290 高效液相色谱仪串联 AB Sciex QTRAP 6500+质谱仪测定植物内源性激素ABA含量,所有样品各重复3次。
1.3 单粒质量、纵横径、可溶性固形物、总酸、硬度指标测定
葡萄样品于实验室中剪成单独果粒混匀,每组样品随机选取20粒,采用电子天平(最小量度为0.01 g)进行果粒质量测量;与葡萄果实赤道线垂直的最大长度为纵径,与果实赤道线平行的最大宽度为横径,每组样品随机选取20粒,采用游标卡尺(最小量度为0.01 cm)进行果粒纵横径的测量;每组样品随机选取20粒,挤出汁液混匀,采用手持式折光仪测定果实可溶性固形物(TSS)含量,参考曹健康等[15]方法测量总酸(TA)含量;每组样品随机选取20~30粒,使用质构仪进行硬度测量,记录峰值,结果用平均值表示。
1.4 果肉果胶含量、纤维素及半纤维素含量、果皮叶绿素含量和花青素含量的测定
参考曹健康等[15]方法,测定原果胶和可溶性果胶含量;细胞壁纤维素和半纤维素含量均使用试剂盒测定(CLL-1-Y,BXW-1-G,科铭生物,江苏苏州),测定方法均参考试剂盒说明书;将每组样品的果皮于液氮中研磨成粉末,取0.1 g置入1.5 mL离心管中,避光加入1 mL 体积分数95%乙醇浸提,待组织变为白色,取200 μL浸提液于酶标板中,在酶标仪中分别测定波长649、665 nm下的吸光度,3次重复。按照公式(1)~(5)计算叶绿素含量:
叶绿素a质量浓度=
13.95×A665-6.88×A649
(1)
叶绿素b质量浓度=
24.96×A649-7.32×A665
(2)
叶绿素a含量=叶绿素a质量
分数×浸提液总量/质量×0.001
(3)
叶绿素b含量=叶绿素b质量
分数×浸提液总量/质量×0.001
(4)
叶绿素质量分数=叶绿素a
质量分数+叶绿素b质量分数
(5)
参考曹健康等[15]方法,测定花青素含量,利用甲醇溶液提取果皮中的花青素,利用紫外可见分光光度计测量波长530、600 nm处吸光度值,两者差值表示花青素含量。
1.5 叶绿素降解途径相关基因、花色苷途径相关基因、ABA途径相关基因的定量表达分析
总RNA提取使用诺唯赞公司FastPure Plant Total RNA Isolation Kit试剂盒(RC401-01,江苏南京)。使用诺唯赞公司HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒(R323-01,江苏南京)合成cDNA第一链。利用Primer 5.0软件设计特异性定量引物,以GAPDH作为内参基因。qRT-PCR引物序列如表1所示,于Applied Biosystems 7500 FAST荧光定量仪进行实时荧光定量分析。数据分析采用2-ΔΔCT方法[16]。
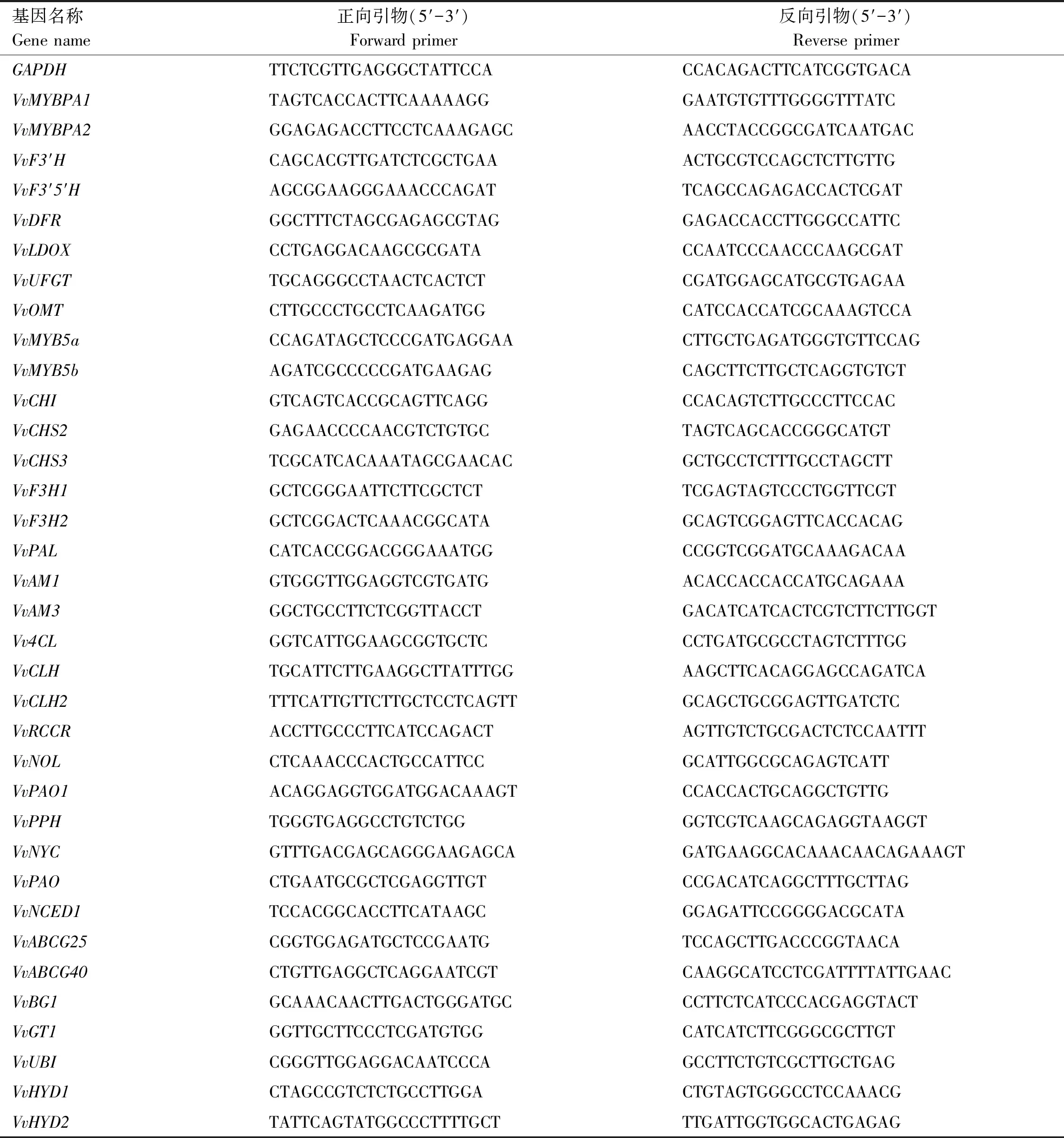
表1 qRT-PCR引物信息Table 1 Primer information for qRT-PCR
1.6 数据分析
每个试验设置3个生物学重复,利用SPSS 24.0软件进行独立样本t检验(p<0.5),利用GraphPad Prism 8软件进行图表制作。
2 结果与分析
2.1 ABA处理后葡萄果实的着色情况
观察发现,处理后7 d,ABA处理的果皮开始着色,而对照处理的果皮仍保持绿色;处理后14 d,对照处理的果皮开始着色,ABA处理的果皮大部分呈现紫红色;处理后21 d,对照处理的果皮仍有部分果粒未着色,ABA处理的果皮呈现出均匀的紫红色(图1)。由此说明,ABA处理能够显著促进‘紫甜无核’果实着色。

图1 ABA处理对‘紫甜无核’葡萄着色的影响Fig.1 The effects of ABA on the berry coloring in ‘Zitian seedless’ grape
2.2 ABA处理对葡萄果实ABA质量分数的影响
为研究处理后果实中ABA质量分数的变化,本研究对处理后果实中的ABA质量分数进行了测定。结果显示,ABA处理后果实中,ABA质量分数明显升高,在处理后7 d,果实中ABA质量分数达到最大值,随着处理后时间的延长,果实中ABA含量逐渐降低,但均显著高于对照处理(图2)。说明ABA处理后果实中ABA质量分数升高。
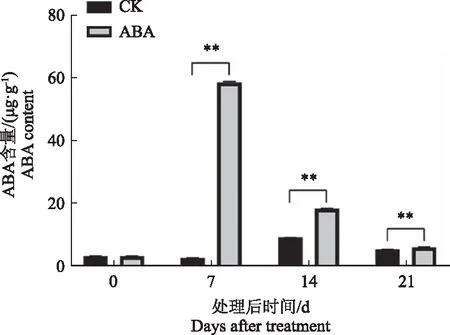
注:“*”表示与对照相比在0.05水平上差异显著,“**”表示与对照相比在0.01水平上差异显著。下同。Note:“*”indicates the significant difference at 0.05 level compared with the control; “**”indicates the significant difference at 0.01 level compared with the control. The same as below.
2.3 ABA处理对葡萄果实生长和品质指标的影响
‘紫甜无核’经ABA处理后,果实的单粒质量、纵径、横径、TSS、TA、硬度、花青苷含量、叶绿素含量均发生不同程度的变化(表2)。ABA处理后,各时期果实的单粒质量、纵径、横径,均显著高于对照处理,硬度显著低于对照处理。ABA处理中,0~7 d果实硬度下降趋势最大,随后7、14和21 d硬度变化并不大,但均显著低于对照处理;对照处理中,7~14 d果实硬度下降趋势最大。结果表明,ABA处理促进‘紫甜无核’果实的生长。
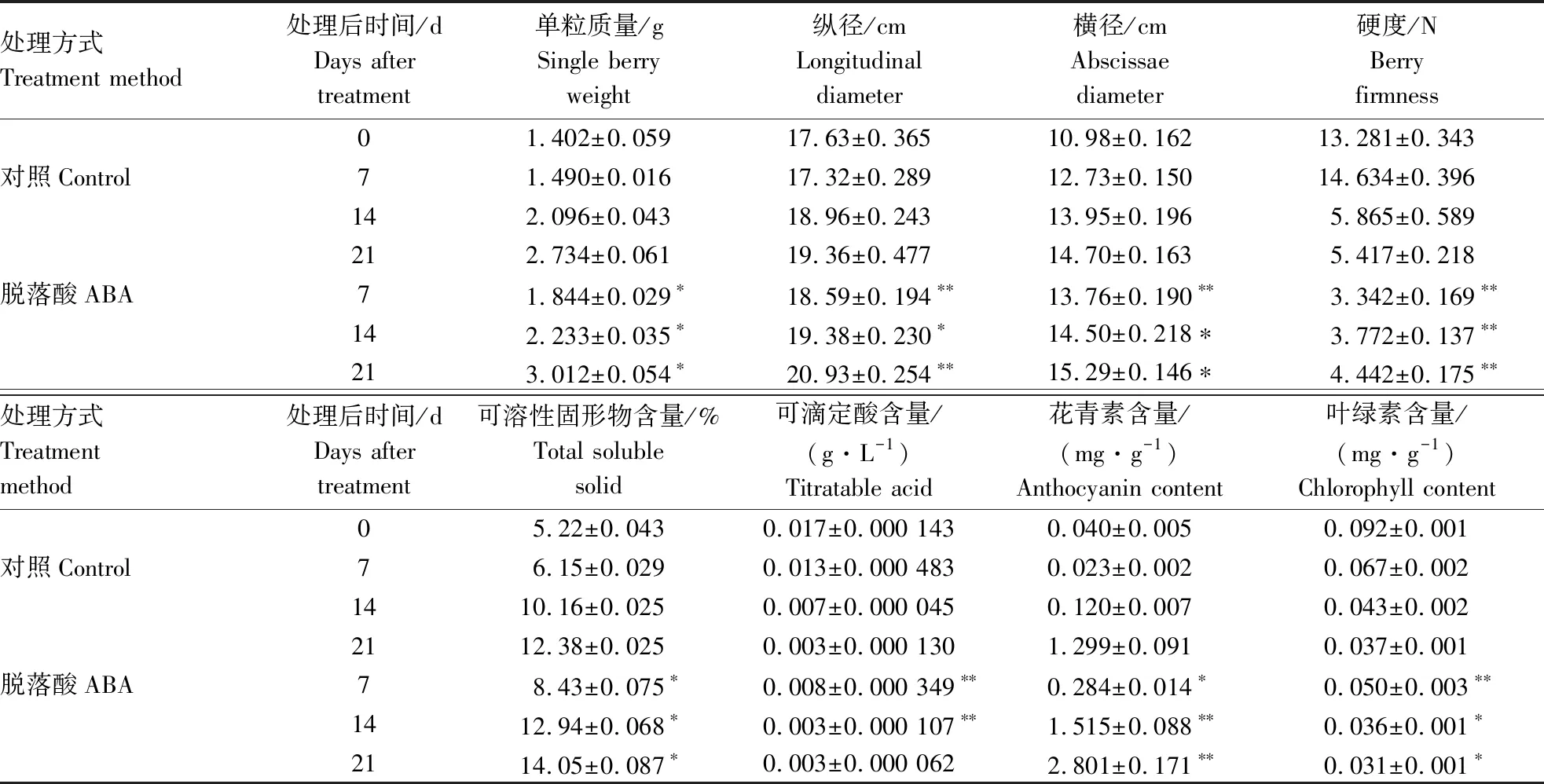
表2 ABA处理后生长和成熟相关指标变化Table 2 Changes of growth and ripening parameters in response to ABA treatment
ABA处理后,各时期果实的可溶性固形物和花青苷含量均显著高于对照处理,总酸(TA)和叶绿素含量均显著低于对照处理。其中花色苷含量,对照处理从14 d开始升高,ABA处理从7 d开始升高,与葡萄果实转色时期一致。结果表明,ABA处理可以促进葡萄果实的成熟。
2.4 ABA处理对葡萄果实细胞壁物质含量的影响
细胞壁物质的变化是果肉硬度下降的主要因素,ABA处理后,果实硬度明显降低,为进一步分析ABA对细胞壁物质的影响,本研究测定了ABA处理后果实中细胞壁相关物质的变化。在葡萄果实成熟过程中,原果胶含量总体呈现下降趋势(表3),ABA处理后3个时期的原果胶含量与对照处理相比,分别降低了25.27%、36.59%、31.11%,均显著低于对照处理;可溶性果胶含量总体呈现上升趋势(表3),3个时期的可溶性果胶含量与对照处理相比,分别升高了的13.56%、28.02%、5.2%,均显著高于对照处理。原果胶和可溶性果胶含量变化与葡萄果实硬度的变化呈正相关关系,果实越软,原果胶含量越低,可溶性果胶含量越高。
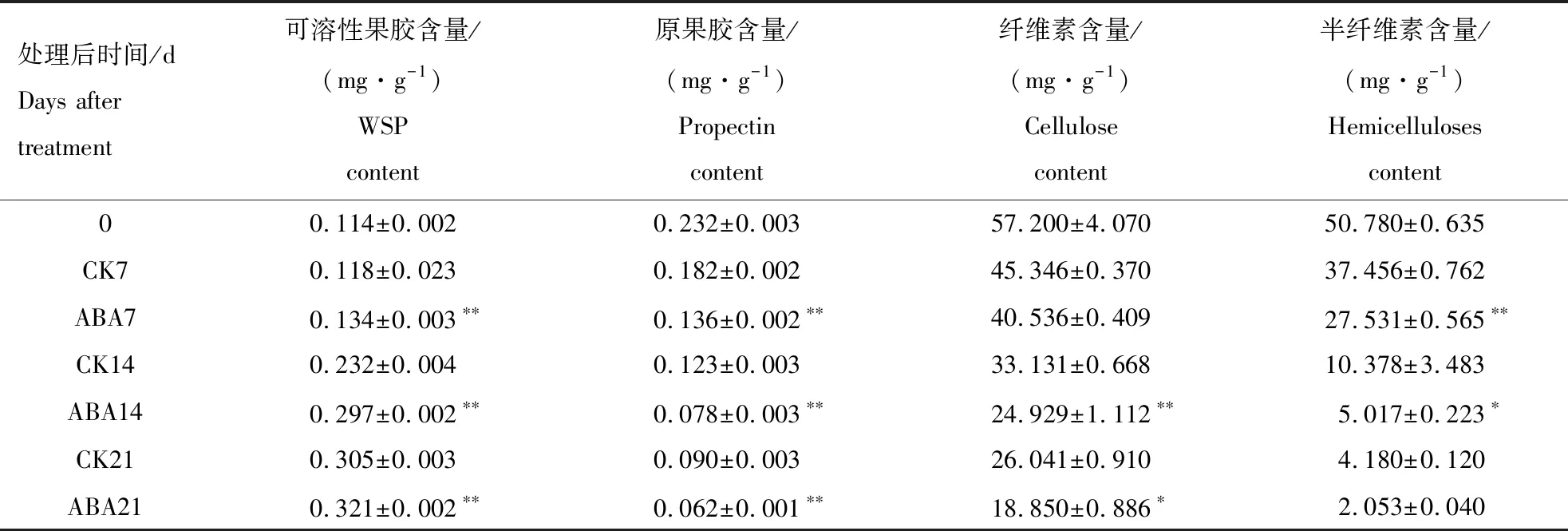
表3 ABA处理后葡萄果实可溶性果胶、原果胶、纤维素和半纤维素含量的变化Table 3 Changes of WSP,propectin,cellulose,hemicelluloses content in grape fruit in response to ABA treatment
纤维素和半纤维素含量总体呈现下降趋势(表3),ABA处理后3个时期的纤维素含量分别是对照处理的89.39%、75.24%、72.38%,半纤维素含量分别是73.5%、48.34%、49.11%。半纤维素含量的前期变化较为显著,后期与对照相比无显著差异;纤维素含量的后期变化较为显著,前期与对照相比无显著差异。
2.5 葡萄花青苷途径相关基因在果实成熟过程中的表达分析
为了进一步阐明ABA介导的花青苷在葡萄果实中的生物合成与积累的分子机制,本研究分析了花青素合成相关的转录调控基因和生物合成基因的表达水平。ABA处理后7 d,花青素生物合成基因VvCHS2、VvCHS3、VvF3H1、VvF3′5′H、VvLDOX、VvUFGT、VvOMT表现出一致的表达模式,总体呈现先升高再降低的趋势(图3),这些基因的表达量在14 d最高,除VvCHS3表达量在21 d最高,均显著高于对照处理;转录调控基因VvMYBA1的表达量差异最为显著,在处理后14 d达到最高。结果表明花青苷途径基因表达的变化与花青苷含量变化的趋势一致,在葡萄果实开始着色时基因的表达量显著升高,着色后期逐渐下降。
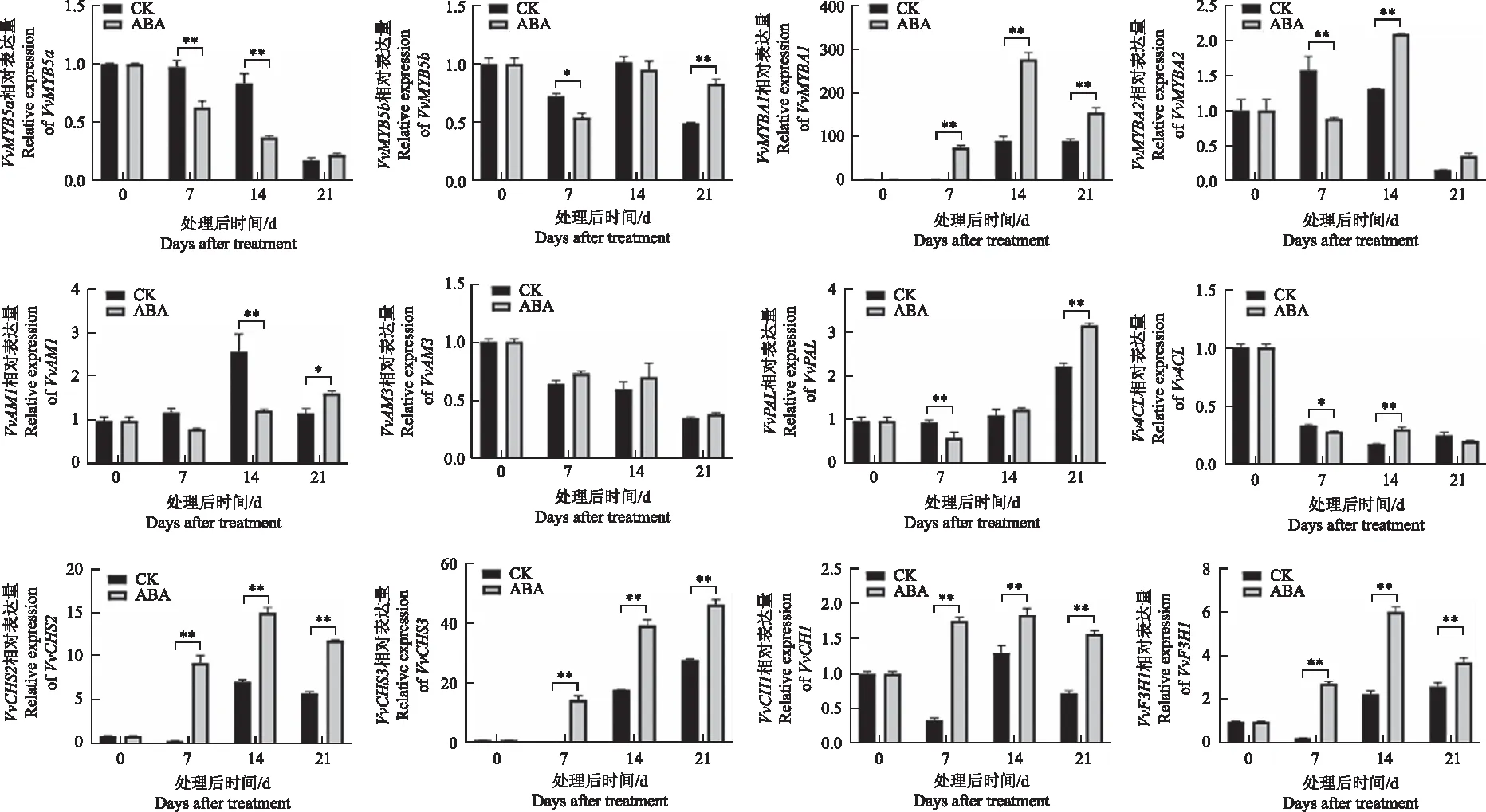
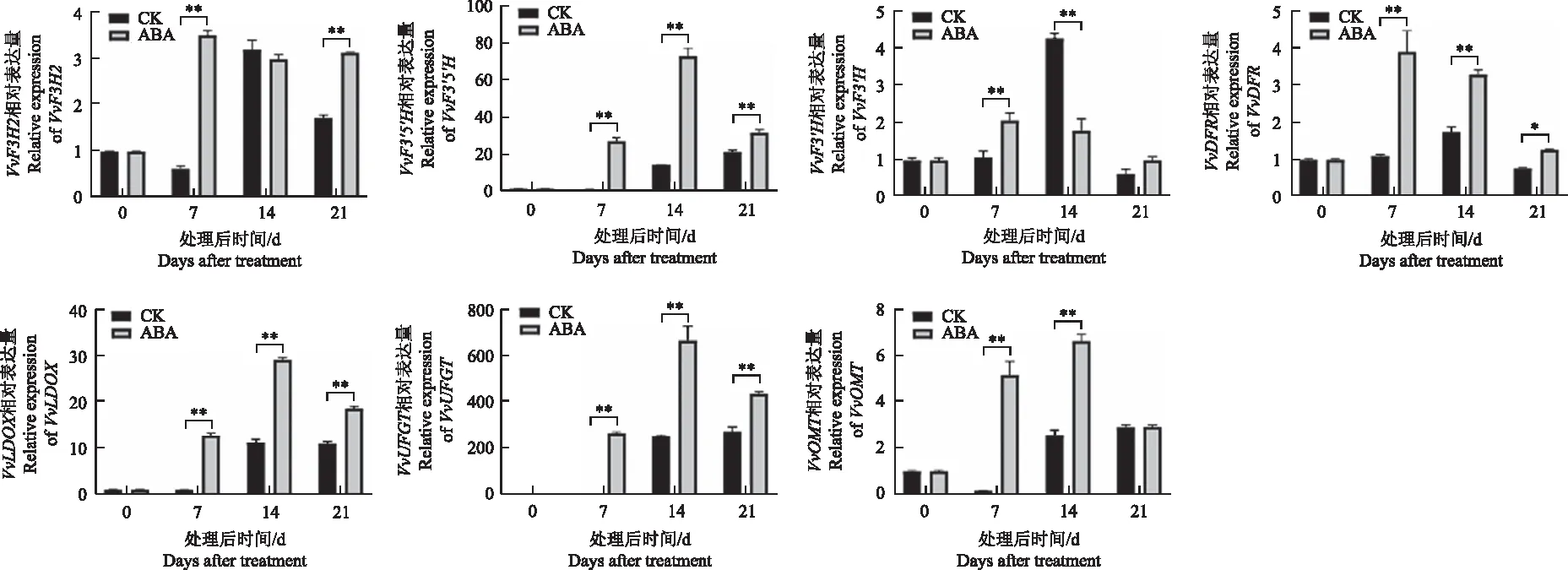
图3 ABA处理后花青素途径相关基因表达量的变化Fig.3 Changes of anthocyanin related genes expression in response to ABA treatment
2.6 葡萄叶绿素降解途径相关基因在果实成熟过程中的表达分析
ABA处理后,果皮中叶绿素含量明显降低,本研究进一步分析了叶绿素降解途径基因的表达。在葡萄果实的成熟过程中,VvNYC、VvPAO、VvPAO1的表达量总体呈现上升趋势,VvNOL、VvCLH2、VvPPH、VvRCCR的表达量呈现先上升再下降的趋势,VvCLH1的表达量呈现下降趋势(图4);ABA处理后,VvNYC、VvPAO的表达量总体呈现上升趋势,VvNOL的表达量呈现先下降再上升的趋势,VvCLH2的表达量在处理后21 d时显著高于对照,VvPPH、VvPAO1、VvRCCR的表达量在处理后7 d达到最高。结果表明,ABA可能通过调节叶绿素降解途径相关基因的表达进而调控叶绿素的降解。
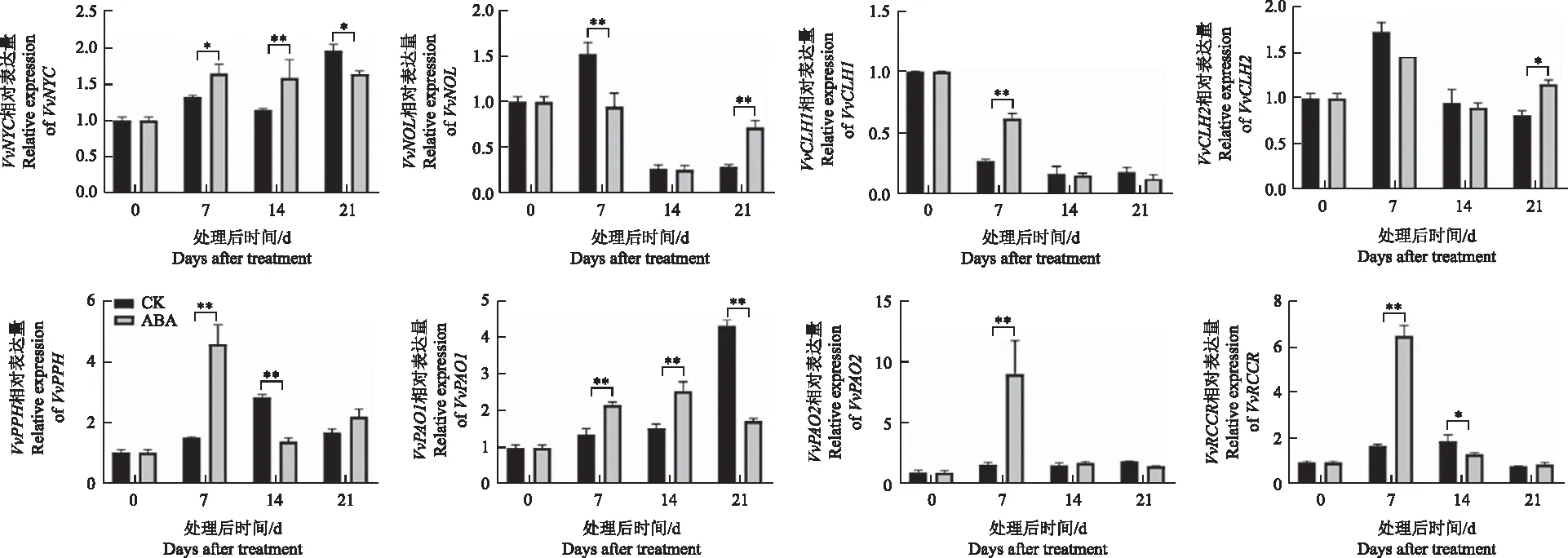
图4 ABA处理后叶绿素降解途径相关基因表达的变化Fig.4 Expression changes of chlorophyll degradation related genes in response to ABA treatment
2.7 葡萄ABA途径相关基因在果实成熟过程中的表达分析
为了了解葡萄果实发育和成熟过程中ABA含量变化的原因,检测了ABA生物合成、转录和代谢相关基因的表达变化。VvNCED的表达在ABA处理后无明显变化,在对照中呈现上升趋势,且在21 d表达最高;VvBG1的表达在ABA处理后7 d最高,VvHYD1、VvUBI的表达量在处理后14 d最高,VvGT1的表达在处理后被抑制,VvHYD2的表达呈现先升高再降低的趋势;VvABCG25、VvABCG40的表达在ABA处理后被抑制(图5)。
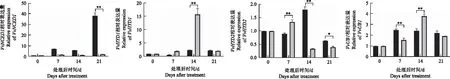
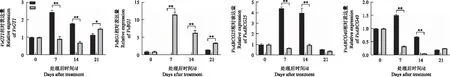
图5 ABA处理后ABA途径相关基因表达量的变化Fig.5 Changes of ABA related genes expression in response to ABA treatment
3 结论与讨论
ABA作为一种重要的植物激素和信号分子,在植物器官发育、逆境反应和果实成熟过程中发挥着关键作用[5-6]。已有研究表明,ABA处理显著促进了桃果实糖的积累[17]。张林山等[18]研究表明,葡萄转色期使用ABA溶液浸泡果穗,能够显著提高果实的单粒质量和纵横径,本研究与其研究结果一致,推测ABA能够加速葡萄果实的生长,从而提高果实单粒质量和纵横径。在葡萄上喷施ABA有助于花青素、类黄酮、白藜芦醇和其他酚类物质的积累[19-20]。本试验在葡萄转色前10 d通过ABA处理葡萄果实,提高果实单粒质量、纵横径,加速果实的生长,促进可溶性固形物的积累,降低果实总酸含量,提高葡萄果实品质,并且显著增加了花青素含量,加速果实成熟过程。研究结果表明,ABA在葡萄生长成熟过程中起促进作用。
葡萄果实的软化是果实成熟的显著特征之一。已有研究表明,非呼吸跃变型果实葡萄[21]、草莓[22]、樱桃[23],ABA处理可降低这些果实的硬度。果实成熟软化是由于在水解酶和扩展蛋白作用下,细胞壁物质(果胶、纤维素和半纤维素)的结构发生变化[24-25]。在巨峰葡萄果实软化过程中,果胶、纤维素和半纤维素含量的降低是前期硬度下降的主要原因之一[24]。本研究结果表明, ABA处理通过促进原果胶、纤维素和半纤维素含量的降低,可溶性果胶含量的升高,从而加速果实软化。
果实的颜色是影响消费购买水果的重要因素之一,其中果实的与ABA的含量密切相关[26]。植物激素在植物的生长、发育、成熟和衰老过程中并不独立起作用,它们在植物激素相互作用的复杂网络中共同调节一系列植物生命活动[27-28]。花青素的含量和组分决定了葡萄果皮的颜色,已有研究表明,基因型、温度、光照和植物激素等内外因素影响其含量和组分[29-33]。在植物激素应用方面,ABA可以促进果实着色[34-36]。本研究结果表明, ABA处理可以加速葡萄果皮中花青素的积累,增加了花青素生物合成基因VvCHS2、VvCHS3、VvF3H1、VvF3′5′H、VvLDOX、VvUFGT、VvOMT以及关键调控基因VvMYBA1的表达,这一结果与前人研究结果相似[7]。本研究结果表明,上述基因的表达趋势与ABA含量的变化趋势一致,说明葡萄果实成熟过程中,ABA含量的增加是引起花色苷合成的重要信号,ABA处理促进了葡萄果皮花色苷含量的积累。
已有研究表明, ABA处理促进了果实成熟过程,包括花青素生物合成、果实大小的增加以及叶绿素的降解[37-38]。在葡萄‘紫甜无核’成熟过程中,果实颜色从绿-红-紫红的转变,主要是由于经历了花色苷积累和叶绿素降解的过程。本研究结果显示,花青素含量的变化趋势与叶绿素含量的变化趋势相反,且花青素含量上升时期与叶绿素含量下降时期一致, ABA处理后,叶绿素降解途径基因VvNYC和VvPAO的表达量总体呈现上升趋势;7 d时ABA处理的果实颜色处于从绿-红的转变时期,对照组果实颜色未发生变化(图1),此时VvNOL的表达量显著下调,VvNYC、VvCLH1、VvPPH、VvPAO1、VvPAO2、VvRCCR的表达量显著上调;其中PPH酶是催化脱镁叶绿a(Phein a)形成脱镁叶绿酸a(Pheide a)的关键酶,PAO酶是Pheide a转化成红色叶绿素代谢产物(red chlorophyll carabolite)的关键酶[39-40],因此推测ABA促进紫甜无核葡萄果皮叶绿素降解主要是通过上调VvPPH和VvPAO的表达,从而加快果实褪绿过程[41]。
张培安等[42]研究表明,ABA可促进果实中ABA含量的增加,本研究中ABA处理显著增加了果实中ABA含量的积累,显著提高了VvHYD1、VvBG1的表达,果实中ABA含量在7~14 d时下降幅度较大,推测可能是受到这两个代谢基因的高表达影响。ABA处理后,抑制了VvABCG25和VvABCG40的表达,推测ABA可能通过负反馈机制调控这两个基因的表达,SUN等[43]研究表明,LeNCED2在未成熟阶段表达较高,随着成熟逐渐下降,推测是ABA处理后VvNCED的表达受到抑制的原因之一。
综上所述,ABA处理能够促进果实生长,原果胶、纤维素、半纤维素含量的降解和可溶性果胶含量的积累,加速果实软化;诱导VvHYD1、VvBG1的表达导致ABA含量上升,提高VvMYBA1、VvCHS2、VvCHS3、VvF3′5′h和VvUFGT的表达,促进果皮中花青素的积累,同时伴随着叶绿素含量的下降,推断主要是通过上调叶绿素降解关键基因VvPPH和VvPAO的表达,从而促进葡萄果实成熟,提高果实品质。
