小鼠体外受精代孕鼠体重和饲料对其生产的影响
2023-10-28刘亮亮
王 倩,刘亮亮
(华中科技大学同济医学院附属同济医院科研处实验动物中心,武汉 430000)
体外受精(In vitro fertilization,IVF)和胚胎移植是一项重要的辅助生殖技术。生物净化是利用受精卵透明带的屏障作用,结合体外受精和胚胎移植技术,可以去除目的品系小鼠所感染的细菌、病毒、体内外寄生虫等病原体,将小鼠微生物等级提升至SPF 级及以上,并有效减少或阻止病原体通过一个活体小鼠传染给饲养在屏障设施内的其他小鼠[1,2]。因此,科研人员坚持不懈研究可以提高体外受精率、胚胎发育率以及高产仔率的方法。洪胜辉等[3]研究发现在小鼠体外受精液(HTF)中添加GSH 1 mmol/L 时,体外受精效果最好。张景锋等[4]研究发现带颗粒的卵母细胞和不带颗粒的卵母细胞的最佳精卵孵育时间不同。张长勇等[5]研究发现妊娠期母鼠添加营养补充剂能够增加仔鼠的体质量,利于仔鼠的生长发育。也有研究表明母鼠年龄也会影响其妊娠结果和仔鼠行为学[6]。但是对于胚胎移植时,代孕母鼠自身体重和营养状态对后续妊娠率和产仔率的影响却少有研究。本研究通过比较在移植相同数量同等质量胚胎的情况下,不同体重范围代孕母鼠的妊娠率、产仔率的差异来探寻最佳状态的代孕母鼠;并比较移植后给孕鼠喂食不同饲料对其产崽造成的影响,以期为优化小鼠生物净化和扩繁提供理论依据。
1 材料与方法
1.1 试验动物
本研究所使用试验动物为6~10 周SPF 级ICR雌性小鼠,体重分为22~27 g、28~33 g、34~39 g 三组。3~4 周C57BL/6J 雌性小鼠和三月龄C57BL/6J雄性小鼠。以上小鼠均购于上海集萃药康生物有限公司。动物饲养在华中科技大学同济医学院附属同济医院实验动物中心SPF 级屏障环境中,小鼠生长环境维持在温度23~26 ℃,湿度40%~70%,自动光控(白昼黑夜各12 h),小鼠自由饮食饮水。小鼠在到达该中心后均喂养繁殖饲料,代孕ICR 母鼠在接受移植胚胎手术之后再进行分组饲养,一组进行繁殖饲料喂养,一组进行维持饲料喂养。
1.2 主要试剂和仪器
孕马血清促性腺激素(PMSG)购于北京索莱宝生物科技有限公司,人绒毛膜促性腺激素(HCG,PRS-HOR-250-2.5 mg)购于Prospectbio 博思配生物科技有限公司。精子体外获能液(HTF,KYD-008-02)购于Cosmo Bio 生物公司,卵母细胞体外成熟培养液(M2MR-015)和矿物油(M8410,500 mL)购于Sigma-Aldrich 西格玛奥德里奇。小鼠麻醉剂三溴乙醇(M2910,10 mL)购于南京爱贝生物科技有限公司。小鼠繁殖饲料和维持饲料均购于武汉万千佳兴生物科技有限公司。细胞培养皿购于Corning 康宁公司。细胞培养箱(赛默飞世儿Thermo Fisher),体视显微镜(Leica 徕卡),倒置显微镜(Olympus 公司)。
1.3 体外受精
1.3.1 小鼠卵子超排和取卵 将3~4 周C57BL/6J雌性小鼠腹腔注射PMSG,5 IU/只。间隔48 h 后注射HCG,5 IU/只[7]。在注射激素后15 h 取卵,采用颈椎脱臼法处死小鼠,剪取小鼠输卵管,在卵母细胞体外成熟培养液中清洗2 次后用精细镊划开壶腹部,将卵母细胞释放入提前6 h 在细胞培养箱预孵育的HTF 培养液中。每微升HTF 为80~100 个卵。
1.3.2 小鼠精子采集 将3 月龄C57BL/6J雄性小鼠用颈椎脱臼法处死,剪取小鼠附睾,在M2清洗2 遍,用精细镊划开附睾尾,挑取1 滴精液放入提前孵育过夜的HTF 培养液中,获能约1 h。
1.3.3 小鼠体外受精 在小鼠精子获能后,在显微镜下观察精子活力和浓度,采用精子计数板计数,在获能滴边缘吸取适量精子加入上述孵育的未受精小鼠卵子中,使其最终精子浓度为1×106个/mL[8]。
在受精6 h 以后,用预先拉制好的玻璃电极吸取受精卵在干净的已预孵的HTF 液滴中清洗2 次,放置于细胞培养箱中培养过夜。
1.4 胚胎移植
1.4.1 假孕鼠的准备 分别将挑选的3 个体重范围(22~27 g、28~33 g、34~39 g)处于发情周期的SPF级ICR 雌性小鼠在胚胎移植前1 d 下午5:00 左右与结扎的ICR 雄鼠合笼。第2 天早上8:00 左右将有阴道栓的雌鼠挑出,用于胚胎移植试验[9]。
1.4.2 双细胞受精卵的移植 将有阴道栓的代孕母鼠称重,按照每10 g 体重腹腔注射0.2 mL 三溴乙醇麻醉剂。待小鼠完全麻醉失去知觉后,用小鼠专用剃毛器剃去小鼠右侧肾部靠背部的毛,75%乙醇消毒后剪开,用镊子小心牵引出该侧卵巢脂肪垫和输卵管,找到输卵管膨大伞口,用拉制的移卵针连接上口吸管吸取分裂均一的双细胞受精卵,插入代孕鼠输卵管伞口,吹入13 颗双细胞至输卵管壶腹部。将卵巢、子宫等复位,缝合后消毒。将小鼠放在37 ℃热台待其苏醒。
1.5 已接受移植的小鼠饲养
每组体重范围的小鼠再分为2 组,一组饲养繁殖饲料,一组饲养普通维持饲料,其他饲养条件相同。
将已经接受过胚胎移植手术的小鼠单笼饲养,待小鼠生产后,统计各组代孕鼠妊娠率和窝产崽数,妊娠率=妊娠雌鼠数/移植总雌鼠数×100%。
1.6 数据分析与统计
采用SPSS 25.0 软件进行数据分析。采用单因素方差分析来分析同组体重下不同饲料是否对其生产产生影响。采用t检验对不同体重组间进行差异显著性分析,P<0.05 表示差异显著。计量资料均使用平均数±标准差表示。
2 结果与分析
2.1 不同饲料对代孕鼠生产的影响
在给不同体重组的代孕鼠移植相同数量、质量的胚胎后,将每组体重再分为2 组分别饲养繁殖饲料和维持饲料。如图1 所示,在相同体重区间内,繁殖饲料组和维持饲料组的窝产崽数并无显著差异(P>0.05)。结果表明,在代孕母鼠处于相同的体重区间内时,代孕鼠只在妊娠周期短期内的营养差异对其胚胎发育和生产影响不显著。

图1 繁殖饲料组和维持饲料组窝产崽数
2.2 代孕母鼠体重对其生产的影响
由表1 可知,在接受相同数量和相同质量的胚胎移植后,体重为22~27g 代孕母鼠组的窝产崽数为(3.65±2.81)只,以及其妊娠率均显著小于28~33 g、34~39 g 代孕母鼠组(P<0.05)。22~27 g 代孕母鼠组妊娠率为65%±49%,28~33 g 代孕母鼠组的妊娠率为95%±22%,34~39 g 代孕母鼠组的妊娠率为90%±31%。但28~33 g 与34~39 g 代孕母鼠组的窝产崽数以及妊娠率均无显著差异(P>0.05)。
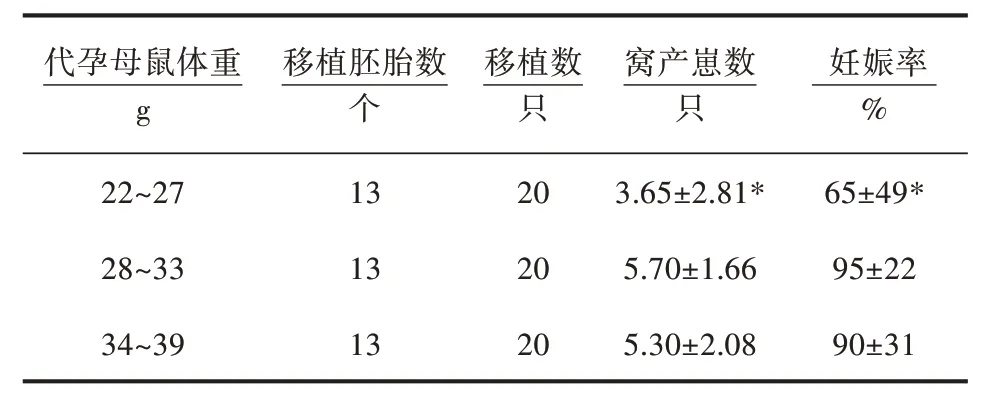
表1 各组窝产崽数和妊娠率比较
3 小结与讨论
生物净化技术已经成为预防小鼠引入污染的风险、确保设施生物安全的重要手段之一[10]。研究表明,移植胚胎的受精率和移植的胚胎数量会影响胚胎移植的产仔率和窝产仔数量[11]。胚胎的品系和背景也会对小鼠胚胎移植后的产仔率造成影响[12]。因此,本研究在保证胚胎品系、质量均相同的情况下,分析移植时代孕母鼠的体重对其产崽和生产情况的影响,结果表明,28~33 g 代孕母鼠组和34~39 g 代孕母鼠组的移植生产窝产崽数显著高于22~27 g 组,并且其妊娠率也相对较高。但是在34~39 g 代孕母鼠组生产后,发现偶尔出现鼠崽会被大体重母鼠压死的情况,导致小鼠净化和扩繁效率下降。因此,综合以上结果考虑,在小鼠体外受精时,代孕母鼠体重控制在28~33 g 时,生产效率最高。但是本研究对代孕母鼠的体重分组还不够细致,生产效率最高的母鼠体重还需要后续继续研究。
有研究表示辅酶Q10 联合生长激素用于IVF 患者备孕期营养补充效果良好,能显著改善IVF-ET结局,提高妊娠成功率[13]。不同的商品饲料对小鼠繁殖也会造成不同影响[14,15]。母鼠在产仔后也会因为营养问题影响其泌乳,泌乳不足则会出现食仔的现象,母鼠的营养状态会影响其生产[16]。但是本研究发现,只是在妊娠内的饲料差异对其生产的影响并不显著,不同饲料组间的窝产崽数并无显著差异,原因可能是因为小鼠在进行移植手术前均喂养相同的繁殖饲料,如果只在妊娠期短期内饲养不同的饲料可能对其生产影响不大。本研究只针对了一个厂家的饲料进行了短期研究,至于长期喂食不同厂家的饲料试验结果是否会出现差异,以及具体是何种成分对其造成影响还需要后续深入研究。
综上所述,本试验探究了在体外受精的生物净化中,不同体重区间的代孕母鼠对其生产效率的影响,发现28~33 g 组代孕母鼠的生产效率最高,最适宜用作胚胎移植的代孕母鼠。并且本研究也发现只在妊娠期喂食不同饲料,繁殖饲料与维持饲料对其生产影响差异不显著。通过研究在小鼠体外受精后,代孕母鼠体重及其摄入饲料类型对其生产效率的影响,为小鼠净化系统的优化提供了参考。
致谢:感谢华中科技大学同济医学院附属同济医院科研处实验动物中心余其林老师对试验的指导和支持。
