水质样品的色度对酶底物法测定总大肠菌群、粪大肠菌群的影响
2023-10-27邝小林
邝小林
(西安市环境卫生科学研究所,陕西 西安 710075)
根据HJ 1001—2018《水质 总大肠菌群、粪大肠菌群和大肠埃希氏菌的测定 酶底物法》标准的规定,总大肠菌群和粪大肠菌群是指分别在37 ℃和44.5 ℃培养24 h能产生β-半乳糖苷酶,分解选择性培养基中的邻硝基苯-β-吡喃半乳糖苷生成黄色邻硝基苯酚的肠杆菌科细菌[1],总大肠菌群和粪大肠菌群是水质检测中的重要指标之一,常用于衡量水质污染程度和致病风险。目前,我国用于水质总大肠菌群和粪大肠菌群的快速检测方法有很多,例如纸片法、滤膜法、酶底物法等,但是由于酶底物法易于操作、灵敏性高、准确率高、费用少的特点,被普遍用于水质总大肠菌群和粪大肠菌群的快速检测中[2]。
然而,针对地下水、地表水和生活污水和工厂废水中总大肠菌群和粪大肠菌群测定,标准HJ 1001—2018虽然规定了根据水质样品污染程度来确定接种量来减少水质样品色度对菌群检测结果的影响,但是水质样品色度较深也会影响阳性孔数的判读以及检测结果的准确性[1]。与此同时,水质色度对于水质检测存在干扰[3],但是关于水质样品色度对酶底物法测定总大肠菌群和粪大肠菌群的具体影响,至今还未见相关研究。鉴于此,为了深入探究水质样品的色度变化对总大肠菌群和粪大肠菌群测定的影响,本文设置了5个水质样品色度,采用酶底物法对其总大肠菌群和粪大肠菌群数值进行测定,并利用统计分析法对其差异进行了科学评估。
1 菌株与方法
1.1 菌株
本实验采用的总大肠菌群和粪大肠菌群(HJQC-004)购买于中国工业微生物菌种保藏中心。
1.2 试剂与仪器
1.2.1 试剂
本实验采用的科立得酶底物培养基和标准阳性比色盘均购买于美国爱德士生物科技公司;无菌水由实验室纯水仪并经高压蒸汽灭菌(121 ℃,20 min)制得。
1.2.2 仪器
本实验采用的实验仪器:97孔定量盘(美国爱德士生物科技公司);程控定量封口机(美国爱德士生物科技公司);恒温培养箱(上海科恒实业发展有限公司);半自动高压蒸汽灭菌锅(上海申安医疗器械厂);纯水仪(南京易普易达有限公司)。
1.3 色度样品原液准备
选取适当棕褐色液体为色度样品原液,将其于121 ℃下高压蒸汽灭菌20 min处理制得无菌色度样品原液。
1.4 样品分析
1.4.1 色度梯度
根据实际要求,将色度样品原液按照2∶1的比例进行稀释并得到了相应的色度梯度。本实验设置了五个样品色度梯度。
1.4.2 色度测定[4]
按照自然倍数稀释法,取静置15 min后的澄清样品倒入50 mL具塞比色管至50 mL刻度线,量取25 mL样品并加入25 mL水稀释混匀备用,按照2倍稀释方法由小到大逐级进行稀释,每稀释一次后按照目视比色方法观察,直至刚好与水无法区别时停止稀释,则得到样品的稀释倍数。
1.4.3 样品接种与培养[1]
量取95 mL样品色度稀释液于无菌瓶中,加入5 mL菌液,按照比例加入培养基。充分摇匀溶解后,将其全部转移至97孔定量盘中,消除气泡并封口。将封口后的97孔定量盘放置恒温培养箱,于(37±1)℃或(44.5±0.5)℃培养24 h。
1.4.4 质量控制
每个样品进行3次平行实验,用无菌水按照1.4.3进行实验室空白质量控制。
1.4.5 结果分析与计算
利用标准阳性比色盘,对样品培养结果进行判读。样品呈阳性反应,即变黄且颜色比标准阳性比色盘颜色深或相同,并记录阳性孔数。对照97孔定量盘法MPN表,查得样品对应的总大肠菌群和粪大肠菌群结果,如若样品进行了稀释,需进行相应换算。数据分析均采用统计分析方法,数据结果表示方式采用均值±标准差,组间数据显著性检验采用t检验[5]。
2 结果与分析
2.1 样品色度检测结果
本实验设置了5个色度梯度的样品,每个色度样品具体数值如表1所示。色度0样品的色度数值为0倍,色度1样品的色度数值为16倍,色度2样品的色度数值为32倍,色度3样品的色度数值为64倍,色度4样品的色度数值为128倍。

表1 样品色度
2.2 质量控制结果
将无菌水按照1.4.3步骤进行接种培养,接种无菌水的97孔定量盘呈阴性,表明本实验的实验室质量控制结果合格,本实验检测结果有效,符合质控要求。
2.3 样品色度对总大肠菌群测定的影响
为了评估样品色度对总大肠菌群的判读影响,本实验按照HJ 1001—2018标准要求对5个色度样品进行检测分析,色度检测的颜色变化结果如图1所示,色度0样品、色度1样品、色度2样品和色度3样品的阳性反应可判读,大孔数全为阳性,虚线方框表示其可判读阳性小孔,色度4样品的阳性反应无法判读。在5个色度样品接种总大肠菌群数一致的情况下,随着样品色度的增加,阳性反应的可判读阳性孔数逐渐减少,最终在色度达到128倍时阳性孔数显示无法判读。

图1 总大肠菌群检测结果
另外,为了进一步测试色度对总大肠菌群检测值的影响,本实验将5个色度样品的总大肠菌群的MPN值进行统计分析,分析结果如下图2a所示。色度0样品的总大肠菌群为371.2±14.1,色度1样品的总大肠菌群为348.9±4.5,色度2样品的总大肠菌群为240.7±3.7,色度3样品的总大肠菌群为205.2±2.4,色度4样品的总大肠菌群无法判读且记为0。由此可见,随着样品色度的增加,样品的总大肠菌群检测值呈现变小的趋势。
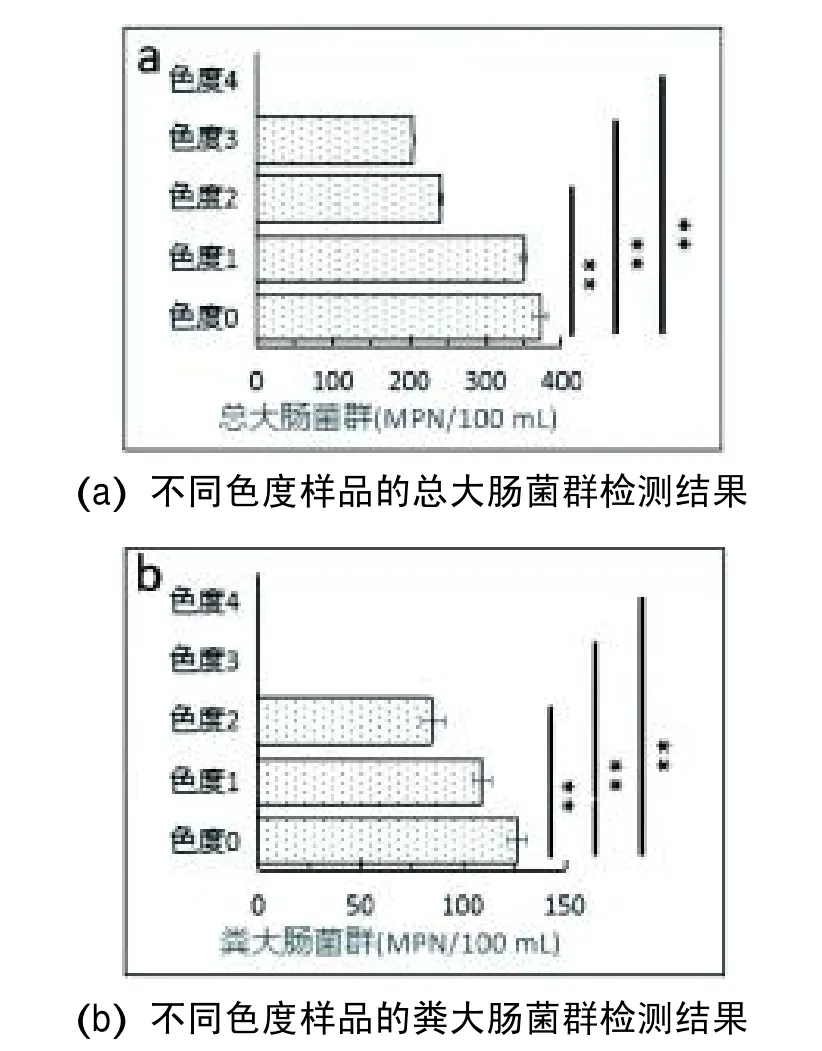
图2 不同色度样品的菌群检测结果
显著性检验采用t检验,样品其余色度的大肠菌群数检测值与其色度0的检测值的统计分析结果显示色度1样品的总大肠菌群与色度0样品的总大肠菌群相比在P<0.01水平上无显著性差异,其余3个样品色度(色度2、色度3和色度4)总大肠菌群的变化与色度0样品的总大肠菌群相比均存在较大变化,且在P<0.01水平上差异显著。
2.4 样品色度对粪大肠菌群测定的影响
同样,为了评估样品色度对粪大肠菌群的判读与检测值的影响,本实验按照HJ 1001—2018要求对5个色度样品进行检测分析,色度检测的颜色变化结果如图3所示,色度0样品、色度1样品和色度2样品的阳性反应可判读,实线方框为非阳性大孔,其余大孔为阳性大孔,虚线方框为可判读阳性小孔,色度3样品和色度4样品的阳性反应无法判读。在5个色度样品接种粪大肠菌群数一致的情况下,随着样品色度的增加,阳性反应的可判读阳性孔数逐渐减少,在色度达到64倍和128倍时阳性孔数均显示无法判读。另外,5个色度样品的粪大肠菌群检测结果如图2b所示,色度0样品的粪大肠菌群为126.3±7.3,色度1样品的粪大肠菌群为109.4±8.5,色度2样品的粪大肠菌群为85.1±9.9,色度3样品的粪大肠菌群无法判读且记为0,色度4样品的粪大肠菌群无法判读且记为0。与此同时,经统计分析结果显示色度1样品的粪大肠菌群与色度0样品的粪大肠菌群相比在P<0.01水平上无显著性差异,其余3个样品色度(色度2、色度3和色度4)的粪大肠菌群的变化与色度0样品的粪大肠菌群相比均存在较大变化,且在P<0.01水平上差异显著。

图3 粪大肠菌群检测结果
3 结论
本研究发现水质样品色度变化对酶底物法测定总大肠菌群和粪大肠菌群存在一定的影响,与于云江等[3]研究水质色度干扰水质指标测定结果一致,发现在总大肠菌群数和粪大肠菌群数含量不高的情况下,随着水质样品色度的增加,酶底物检测总大肠菌群和粪大肠菌群的可判读阳性孔数会逐渐减少,总大肠菌群和粪大肠菌群的MPN检测值也会逐渐变小。
本研究结果表明总大肠菌群在样品色度达到128时阳性孔数无法判读,粪大肠菌群在样品色度达到64时阳性孔数无法判读,说明水质样品色度变化会影响酶底物法阳性孔判读,从而在一定程度上降低其测定有色水质样品总大肠菌群和粪大肠菌群结果的准确性和可靠性。由此可见,当水质样品中总大肠菌群数和粪大肠菌群数含量不高且颜色较深的情况下不宜采用酶底物法来测定二者的菌群数。
综上所述,本研究关于评估水质样品色度变化对酶底物法测定总大肠菌群数和粪大肠菌群的影响得到的结论,为准确检测水质样品中总大肠菌群数和粪大肠菌群数提供一定的科学依据。
