LncRNA-MALAT1/miR-125b-5p/PDCD4分子轴参与心力衰竭发生发展的机制研究
2023-10-26赖纪英郭宗文岳霖琳沈恩芳欧阳松茂朱宏泉
赖纪英 郭宗文 岳霖琳 沈恩芳 欧阳松茂 朱宏泉
(赣南医学院第一附属医院重症医学科,江西 赣州 341000)
慢性心力衰竭是由于各种致病因素引起的心脏舒 张功能障碍或心脏负荷过重,导致心泵功能降低的临床综合征,是多种心血管疾病发展到终末阶段共同作用的结果[1]。《中国心血管报告2018》数据结果表明,我国心力衰竭患者约450万,每年新发心力衰竭患者约50万,且随着人口老龄化的加剧,使得慢性心力衰竭患病率呈上升趋势[2]。目前,临床上对于慢性心力衰竭竭以药物治疗为主,如醛固酮拮抗剂、利尿剂、伊伐布雷定等,尽管治疗方法不断改进,但是患者病死率、再住院率仍较高[3]。因此,积极探究心力衰竭细胞增殖、侵袭相关因子及信号通路,对于临床治疗心力衰竭、改善患者预后具有重要意义。LncRNA是近年治疗心力衰竭药物的重要方向,经检索大量文献发现,LncRNA在心力衰竭发展中具有调控作用,但是对于其机制研究未见具体实验报告[4]。在心力衰竭患者中,LncRNA-MALAT1表达显著下调,能竞争性结合miR-125b-5p,使其解除对PDCD4的抑制,促进PDCD4的表达,从而抑制炎性反应,但该结论尚未得到证实[5]。本研究主要探讨LncRNAMALAT1/miR-125b-5p/PDCD4分子轴参与心力衰竭发生发展的机制,报道如下。
1 材料与方法
1.1 动物材料 购置SD大鼠40只,随机取大鼠10只为对照组,剩余大鼠30只大鼠建立心力衰竭动物模型,建模成功后设为观察组;并将观察组随机分为模型组、空载组和MALAT1沉默组各10只。40只SD大鼠,雌雄随机,体质量180~220 g,平均(200.00±20.00)g。动物合格证号SCXX-2015-0021,所选动物均购置于中国医科大学实验动物中心;将购置的大鼠于动物房7 d适应性喂养,安静环境饲养,室温(22±2)℃,12 h交替光照,自由饮水。
1.2 仪器与设备 HE染色试剂盒及酶联免疫吸附试验试剂盒,购自于美国Roche公司;胎牛血清(FBS),购自于美国Hyclone公司;siRNA合成,购自于上海吉玛基因生物技术有限公司;超净工作台,购自于苏州净化设备有限公司;倒置显微镜,购自于日本Olympus公司;Bio-rad Real-Time QRT-QRT-PCR扩增仪,购自于美国Bio-rad公司;电泳装置,型号DYCP-31BM,购自于北京市六一仪器厂;凝胶成像及分析系统,型号LabWorks TM,购自于美国UVP公司;离心机,型号5415D,购自于德国Eppendorf公司。
1.3 方法
1.3.1 心力衰竭动物模型建立 30只采用结扎大鼠左冠状动脉前降支造成心肌梗死后形成心肌梗死模型,具体方法如下。取参与建模的SD大鼠,常规采用浓度为5%水合氯醛(6 mL/kg)腹腔注射麻醉,待麻醉生效后,大鼠保持仰卧位固位于鼠板上,并于大鼠左侧第三肋和第四肋间进行开胸,充分显露并将心脏挤出。在肺动脉圆锥和左心耳尖之间、距离左心耳下缘2 mm部位,常规采用5-0结扎线快速结扎,在操作完毕后,立即将心脏恢复原位,采用2-0缝合线进行缝合。建模5周后,对SD大鼠进行超声心功能检测,以左室射血分数(ejection fraction,EF)<50.0%为建模成功。于第14日取材组织并完成心功能测定,采用HE染色检测其病理学变化[6]。
1.3.2 心力衰竭大鼠处理方法 ①慢病毒注射。携带慢病毒转染干扰LncRNA-MALAT1序列(LVshMALAT1)及其空载(LV-Control),购自于吉凯基因。于建模前2周,利用离体定位仪,由微量加样器将慢病毒注入SD大鼠右侧连个位点。其中,位点1:A-P 1.0 mm,M-L-2.0 mm,D-V-1.2 mm;位点2:A-P-3.0 mm、M-L-1.5 mm、D-V-1.2 mm;每个位点2.5 μL;注射病毒的速度为0.5μL/mL,拔针前原位停留5 min。②实验分组。利用慢病毒转染干扰LncRNA-MALAT1序列(LV-shMALAT1)及其空载(LV-Control);观察治疗大鼠的干预效果[7]。
1.3.3 检测方法 采用实时荧光PCR法和Western Blot检测LncRNA MALAT1、miR-125b-5p和PDCD4表达水平。①实时荧光PCR法。常规采用miRNeasy Mini试剂盒提取组织总miRNA,通过TaqMan miRNA反转录试剂盒形成cDNA,通过TaqMan miRNA分析试剂盒完成miRNA测定。通过比较循环阈值并以U6作为内参,计算LncRNA MALAT1、miR-125b-5p和PDCD4 miRNA相对表达水平;采用RNeasy Mini试剂盒提取心肌组织总RNA。BestarTM qPCR试剂盒将其逆转录为cDNA;设定反应条件:37 ℃下15 min、98 ℃下下5 min,然后借助BestarTM qPCR预混液完成qPCT实验。设定反应条件:95 ℃下2 min、94 ℃下20 s、58 ℃下20 s、72 ℃下20 s,连续完成40个循环,最后72 ℃下完成4 min延伸。待上述操作完毕后,借助Agilent Stratagene Mx 3000P序列完成实时荧光PCR分析,以GAPDH为内参,计算LncRNA MALAT1、miR-125b-5p和PDCD4相对表达量[8]。②Western Blot检测。采用含有PMSF的RIPA裂解液,完成心肌组织中总蛋白的提取,冰上完成30 min孵育,10 min离心,速度8 000 r/min,温度为4 ℃,取上层清液。BCA试剂盒检测总蛋白浓度,取50 μg蛋白,将其溶于2×SDS上样缓冲液中煮沸,常规完成SDS-PAGE凝胶电泳,采用湿转发将蛋白转移到PVDF膜,5%脱脂奶粉于室温下完成1 h封闭,将PVDF膜与稀释的一抗、GAPDH作为内参,在4 ℃下孵育过夜,TBST连续完成3次洗涤,将膜与HRP标记的二抗山羊抗兔IgG H&L(HRP)孵育,经TBST漂洗后,置于干净的玻璃平板上。根据ECL荧光检测试剂盒中说明书完成。待上述操作完毕后,借助Bio-R心力衰竭图像分析系统照相,采用Quantity One V4.6.2软件进行分析,以相应的蛋白条带的灰度值表示相对蛋白含量[9]。
1.4 观察指标 ①心功能测定。各组大鼠处理完毕后,采用超声心动图测定大鼠EF和左室短轴缩短率。②HE染色。观察组与对照组大鼠以断颈方式处死,取心肌组织,经石蜡包埋后制备4μm切片,并完成HE染色[10]。③LncRNA MALAT1、miR-125b-5p和PDCD4表达水平。记录各组大鼠干预后LncRNA MALAT1、miR-125b-5p和PDCD4表达水平。④炎性因子。大鼠处理完毕后,以断颈方式处死,取尾末梢血3 mL,采用酶联免疫吸附试验测定炎性因子肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)[11]。
1.5 统计学分析 采用SPSS 26.0软件处理,计量资料采用表示,组间比较行t检验;计数资料采用n(%)表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 各组心功能及组织变化比较 观察组建模完毕后EF及左室短轴缩短率低于对照组(P<0.05);观察组中MALAT1沉默组EF及左室短轴缩短率高于模型组、空载组(P<0.05);模型组及空载组EF及左室短轴缩短率差异无统计学意义(P>0.05)。见表1。
表1 各组心功能水平比较()
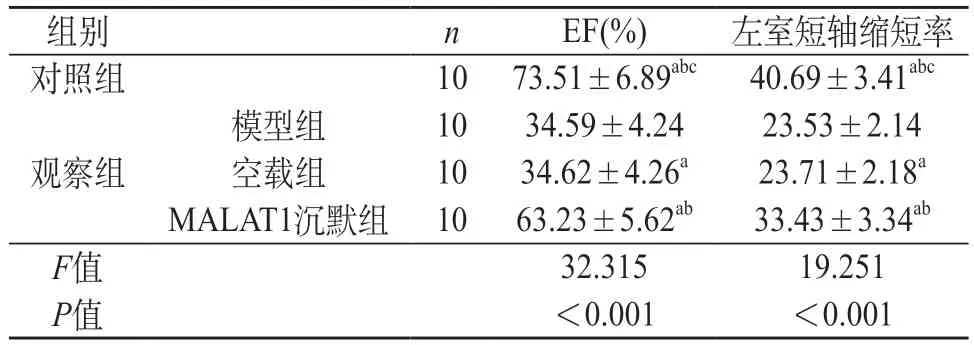
表1 各组心功能水平比较()
注:a与模型组比较,P<0.05;b与空载组比较,P<0.05;c与MALAT1沉默组比较,P<0.05。
2.2 各组HE染色结果比较 HE染色结果表明,模型组和空载组心肌纤维断裂,细胞核紊乱、肥大、间隙增宽、染色加深;MALAT1沉默组心肌纤维断裂有所改善,细胞排列相对整齐,见图1。

图1 各组大鼠HE染色结果
2.3 各组大鼠LncRNA MALAT1、miR-125b-5p和PDCD4表达水平比较 实时荧光PCR法和Western Blot法结果表明,模型组与空载组LncRNA MALAT1、miR-125b-5p和PDCD4 mRNA及蛋白表达差异无统计学意义(P>0.05);MALAT1沉默组LncRNA MALAT1 mRNA、miR-125b-5p及蛋白表达低于模型组与空载组(P<0.05);PDCD4 mRNA及蛋白表达高于模型组与空载组(P<0.05)。见表2和图2。

图2 各组大鼠相关蛋白水平

表2 各组大鼠LncRNA MALAT1、miR-125b-5p和PDCD4 mRNA比较(-x±s)
2.4 各组大鼠炎性因子比较 模型组与空载组炎性因子TNF-α和IL-1β水平差异无统计学意义(P>0.05);MALAT1沉默组炎性因子TNF-α和IL-1β水平低于模型组与空载组(P<0.05)。见表3。
表3 各组大鼠炎性因子比较()
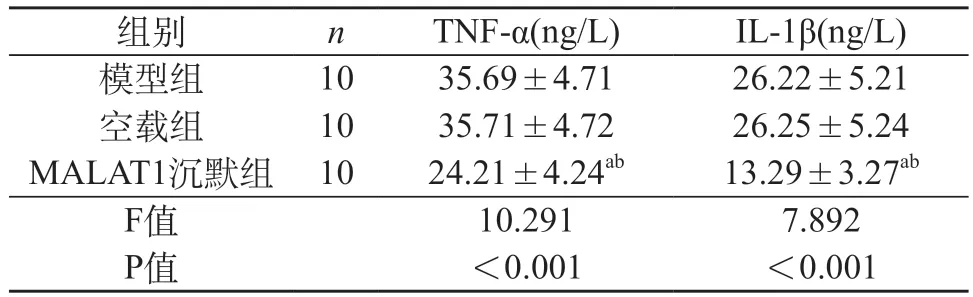
表3 各组大鼠炎性因子比较()
注:a与模型组比较,P<0.05;b与空载组比较,P<0.05。
3 讨论
目前,全球医学界对于心力衰竭的防治工作越发重视,探索心力衰竭发生发展分子机制,寻找心力衰竭诊疗新模式成为当前研究的热点。因此,针对心力衰竭的预防、早期诊断及治疗成为研究的重点,而无创性诊疗方法或分子靶标亟待被发现。PDCD4是细胞凋亡的关键诱导因子,当PDCD4被miRNA抑制后,心力衰竭患者心肌细胞凋亡降低,凋亡引起的心肌细胞丢失不但会影响心脏收缩功能,参与心力衰竭的发生及发展,亦可直接影响电信号的传递,导致心律失常。PDCD4与p53均为调节细胞凋亡的关键蛋白,miR-125b-5p能通过靶向抑制p53蛋白的表达,从而抑制心肌细胞凋亡,从而预防急性心肌梗死的发生[12]。本研究中,观察组EF及左室短轴缩短率低于对照组(P<0.05);MALAT1沉默组EF及左室短轴缩短率高于模型组及空载组(P<0.05);HE染色结果表明,模型组和空载组心肌纤维断裂,细胞核紊乱、肥大、间隙增宽、染色加深;MALAT1沉默组心肌纤维断裂有所改善,细胞排列相对整齐,从本研究结果看出,LncRNA-MALAT1/miR-125b-5p/PDCD4分子轴能直接参与心力衰竭的发生和发展。抑制PDCD4的表达能抑制心肌细胞凋亡,并缓解缺氧/复氧引起的心脏损伤,可显著促进心力衰竭所引起的炎性反应。因此,以此为靶点开发心力衰竭的治疗药物具有广泛的价值[13]。
miRNA是当前神经损失疾病中的热点之一,作为一类高度保守且于炎性反应相关的重要的调控因子,主要作用于靶基因'3-UTR区,能抑制靶基因翻译,亦可引起靶基因的降解。因此,靶基因的mRNA编码区以及蛋白翻译过程中均受到miRNA的调控。miRNA在心力衰竭的发生及发展中发挥了重要的作用,能调控宿主免疫反应,如miR-125b-5p、miR-155等,均能参与免疫和炎性反应[14]。特异性的miRNA通过靶向mRNA调节炎性反应,有望成为心力衰竭良好的替代方案。本研究中MALAT1沉默组LncRNA MALAT1 mRNA、miR-125b-5p及蛋白表达低于模型组与空载组(P<0.05);PDCD4 mRNA及蛋白表达高于模型组与空载组(P<0.05);模型组与空载组炎性因子TNF-α和IL-1β水平差异无统计学意义(P>0.05);MALAT1沉默组炎性因子TNF-α和IL-1β水平低于模型组与空载组(P<0.05)。从本研究结果可以看出,在心力衰竭大鼠中,能竞争性结合miR-125b-5p,提高PDCD4表达水平,从而抑制机体内的炎性反应。LncRNA能作为一种竞争性内源RNA,并以“海绵”吸附的方式通过共同的miRNA反应元件,相互竞争结合共同的miRNA,从而解除miRNA对靶基因mRNA的作用[15]。LncRNA为长度>200个核苷酸非编码RNA,能通过在转录、转录后及表观遗传水平调节基因表达。而miR-125b-5p能靶向调控PDCD4参与心力衰竭病理进程,竞争性结合miR-125b-5p靶向调控PDCD4促进心力衰竭的发生和发展,可为精准研发治疗心力衰竭的治疗药物提供科学依据,具有重要的实际意义。
综上所述,心力衰竭大鼠中LncRNA-MALAT1表达显著下调,能竞争性结合miR-125b-5p,使其解除对PDCD4的抑制,促进PDCD4表达,从而抑制炎性反应,为心力衰竭治疗提供新的思路。
