纳米生物材料:助力抗肿瘤药物研发
2023-10-23雷自文祁迎秋聂广军
雷自文 祁迎秋 聂广军
肿瘤已逐渐成为对人类公共健康构成重大威胁的疾病之一。近年来,肿瘤的发病率和死亡率呈持续上升态势,癌症的防治形势相当严峻。各国在针对癌症发生发展机理研究及诊治方案上投入了大量人力物力和财力。治疗方面,除了传统的药物治疗和放疗外,纳米技术的迅速发展为开发肿瘤特异性药物带来了全新的机遇。
纳米技术是一种研究物质在纳米尺度(通常是1~100纳米)下的特性和现象的科学技术。在生物医药应用方面,纳米技术可以制备出纳米级的药物载体,通过调整载体的形状、大小、组成和表面性质等特征,进而提高药物的稳定性和生物利用度,并实现药物的靶向传递,减少药物在体内正常组织的分布,提高药物的疗效,减少毒副作用,是抗肿瘤药物研发领域的“钢刀利刃”!
科学家已经利用纳米技术,根据肿瘤微环境的独特性,精心设计了多种不同类型的抗肿瘤纳米药物,主要包括DNA纳米药物、多肽纳米药物以及纳米肿瘤疫苗等。纳米药物实现了药物的高度靶向输送、可控释放以及对免疫系统的精准调节,即通过对肿瘤微环境进行更精确的调控,达到显著的抗肿瘤效果。这不仅极大提高了治疗效果,也減少了对正常组织的不良影响,为肿瘤治疗带来了前所未有的希望和可能。因此,纳米生物材料的应用为助力抗肿瘤药物研发揭开了崭新的篇章!
在肿瘤的生成和发展中,除了恶性肿瘤细胞自身,实体瘤内还存在一系列复杂的基质细胞和相关的细胞外组成成分。这些不同的成分相互作用,形成了一种特殊的“生态系统”,即肿瘤微环境。在这一微环境内,失控增殖的肿瘤细胞、功能受损的免疫细胞和异常的血管内皮细胞共同构成了一块“肥沃”的土壤,为肿瘤的快速发展提供了有利条件。这个微环境中不断发生着多种生物学过程,包括炎症反应、血管生成、免疫逃逸和细胞外基质重塑。炎症反应吸引免疫细胞,并释放多种细胞因子和化学介质来推动肿瘤细胞的增殖、侵袭和转移;新血管的生成为肿瘤生长提供营养和氧气,同时也为肿瘤细胞的转移提供通道;免疫抑制机制阻止了免疫细胞有效地消灭肿瘤细胞;细胞外基质的重塑促进了肿瘤细胞的侵袭和转移。所有这些过程共同促进肿瘤细胞的生长、转移和耐药性,形成一个恶性循环,使患者病情不断恶化[1]。这些肿瘤内发生的病理变化促进肿瘤发生发展的同时,也塑造了肿瘤微环境缺氧、酸化等特征。肿瘤细胞自身也会分泌相关因子进一步促进这些病理过程的进展。
然而,正是这些为肿瘤发展提供便利的微环境特性,为我们提供了研究和开发肿瘤特异性药物的机会,达到“以其人之道,还治其人之身”的目的。
纳米技术作为一项有巨大潜力的新兴技术,能够通过精确控制药物的输送、释放和靶向性,针对肿瘤微环境的特点进行针对性的药物设计。针对炎症反应,可以将纳米生物材料做成药物载体,将封装其中的药物通过针对肿瘤细胞表面特定受体的靶向作用,递送到特定的部位实现精确释放。应对肿瘤微环境中的血管生成,纳米生物材料可以针对肿瘤血管内皮细胞进行靶向作用,释放抗血管生成药物,有效地抑制肿瘤血管的生长,削弱肿瘤的血液和氧气供应[2]。通过设计纳米疫苗或纳米免疫佐剂等纳米生物材料,激活患者自身的免疫系统,增强其对肿瘤细胞的辨识和攻击能力,克服肿瘤微环境中的免疫逃逸[3]。同时,纳米免疫佐剂也有助于提升免疫细胞的活性,增强其抗肿瘤效果。此外,纳米生物材料还可干预细胞外基质的重塑,通过携带基质金属蛋白酶抑制剂等药物,靶向肿瘤细胞外基质,重新塑造其结构,从而有效阻止肿瘤的侵袭和转移。
针对肿瘤微环境中缺氧和酸化等特点,利用纳米技术精确设计缺氧或酸响应型的纳米药物载体,它们能在肿瘤组织内得到集中和渗透,实现药物在肿瘤组织或细胞内目标区域的有选择性释放,从而实现更高效和精准的治疗。
综上所述,纳米技术为应对肿瘤微环境的独特特点,提供了有针对性的纳米生物材料设计途径。这些纳米生物材料可以构建高效的药物输送平台,实现对肿瘤细胞的定向输送和调控肿瘤微环境,同时改善药物的药代动力学特性。这为抗肿瘤药物的研发带来了全新的思路和方法,有望在未来的临床应用中取得突破性进展,为肿瘤患者带来更好的治疗效果。
异常的血管新生是肿瘤生长的必要条件,它为肿瘤的增殖提供了必要的营养物质和氧气,针对肿瘤的抗血管生成药物已广泛运用于临床治疗中。如一种靶向抗肿瘤药贝伐珠单抗(针对结直肠癌、非小细胞肺癌、宫颈癌、卵巢癌等)可以选择性地抑制新生肿瘤血管的形成,减少肿瘤细胞的血液供应,从而抑制肿瘤细胞的生长;也可以剥夺肿瘤细胞的营养和氧气,使其大量死亡。凝血酶可以通过激活血小板,将纤维蛋白原转化为纤维蛋白,对血小板的富集进行调节,最终导致阻塞性血栓形成。由此可见,倘若能利用纳米药物载体将凝血酶靶向运输到肿瘤组织部位,则可以有效切断肿瘤细胞的营养供应。DNA分子已被证明是进行纳米药物载体设计的良好底物,可以通过DNA折纸技术,将天然DNA的长链进行反复折叠,并用短链进行固定,随后修饰上相关功能元件,使其能感应外界刺激进而发挥相应功能,故又可称其为“纳米机器人”。在抗肿瘤药物设计领域,可以通过化学方法将靶向肿瘤的配体分子结合到DNA上,使DNA纳米机器人获得“智能导航系统”,然后将抗肿瘤药物连接到DNA上,通过DNA纳米机器人将负载的药物靶向递送到肿瘤组织,实现精准治疗。

我们通过将多种功能元件,包括矩形DNA折纸、凝血酶、靶向序列(AS1411,一种靶向核仁素的核酸配体)、闭锁序列进行组装,设计了一种可有效诱导肿瘤组织血管发生血栓的DNA纳米机器人。当DNA纳米机器人被静脉注射入荷瘤小鼠体内,随着血液循环,纳米机器人在“智能导航系统”AS1411的引导下,到达肿瘤血管内皮细胞表面,与其细胞膜上特异性表达的特异性蛋白——核仁素结合,闭锁序列断开,管状的DNA纳米机器人转化为矩形的DNA折纸,包裹在内部的凝血酶得以暴露,随之启动凝血酶催化的凝血过程,诱导肿瘤血管发生血栓,有效切断对肿瘤细胞的营养供应,最终杀死肿瘤。
在这项研究中,DNA纳米机器人除具有DNA分子本身的高化学稳定性和生物相容性,还增加了药物负载、药物靶向递送等“智能功能”,实现了凝血蛋白酶对肿瘤血管的靶向递送,有效诱导肿瘤血管发生血栓。这种纳米药物载体的策略可以提供更精确和定向的治疗,避免对健康组织的过度伤害,为癌症的靶向治疗提供了新思路。相信随着技术的不断发展,DNA纳米机器人将在抗肿瘤治疗中发挥更大的作用[4]。
多肽是由氨基酸组成的短链蛋白质,具有结构多样性和生物活性,因此,我们可以通过调整氨基酸序列和空间构象,精准调控多肽纳米药物的特性和功能。例如,通过设计能与特定受体或细胞结合的多肽序列,实现药物的精准传递和靶向治疗,提升药物疗效,减少对正常细胞的不良影响。利用多肽的自组装特性,可进行纳米药物载体的设计,将抗肿瘤药物包裹在其内部,提高药物的稳定性和肿瘤细胞的摄取率,达到增效减毒的目的。同时,也可以通过修饰缺氧响应或酸响应序列,实现药物的可控释放。此外,还可根据肿瘤细胞外基质重塑过程中高表达的相关蛋白酶如基质金属蛋白酶(MMP),来针对性地设计酶响应多肽纳米药物。在此基础上还可通过多种靶向序列和响应序列的修饰,实现纳米药物的多重靶向和顺序响应,进一步提高药物疗效,减少不良反应。可见,具有“七十二变神通”的多肽纳米药物,能针对肿瘤微环境的多样性进行精准调控,使肿瘤无处遁形。
我们以肿瘤细胞膜上广泛表达的表皮生长因子受体(epidermal growth factor receptor, EGFR)蛋白为靶向目标,利用一段可与EGFR蛋白特异性结合的多肽序列作为亲水端,十八烷酸作为疏水端,构建了一类靶向型多肽自组装纳米载体。该载体本身可自组装形成纳米颗粒,与肿瘤细胞系中高表达EGFR的细胞结合后被内吞;当载体携带疏水化療药物成为功能化纳米药物时,通过靶向结合、释放化疗药物,就可达到协同杀伤肿瘤细胞的目的[5]。
由于肿瘤的细胞外基质屏障,会引起抗肿瘤药物渗透率不足。利用多肽的自组装特性,将疏水性抗癌药物阿霉素包裹在双亲性多肽CAP纳米颗粒中,当纳米颗粒到达肿瘤部位时,被肿瘤基质中高表达的FAP-α(一种肿瘤相关成纤维细胞表达的蛋白酶)切割,其中的药物释放出来,从而提高了药物在肿瘤组织中的渗透率,实现了优越的响应性释放和抗肿瘤效果[6]。
在肿瘤微环境下,为阻止PD-1/PD-L1信号通路激活及吲哚胺2,3-双加氧酶(IDO)大量分泌所引起的免疫抑制现象,通过设计一种双亲性多肽[由3-二乙基氨基丙基异硫氰酸酯分子(DEAP)、MMP-2特异切割序列(PLGLAG)和免疫检查点PD-L1短肽拮抗剂(DPPA-1)组成],经过其自组装过程,将IDO的小分子抑制剂(NLG919)包裹在纳米颗粒中,构建成顺序响应的多肽纳米药物。该药物在肿瘤微环境的弱酸性条件下,通过DEAP的质子化膨胀,暴露MMP-2特异切割序列;后者被肿瘤微环境中高表达的MMP-2切割,释放DPPA-1和NLG919。这种设计方案实现了对免疫检查点PD-1的阻断和IDO的抑制,实现了双重免疫治疗,并获得了出色的抗肿瘤效果[7]。
多肽自组装技术在抗肿瘤纳米药物研发中展现了巨大前景。通过调节多肽序列和环境条件,可实现纳米药物的靶向输送、药物的可控释放和免疫治疗等目标。
源自细菌的外膜囊泡(outer membrane vesicle, OMV)是一类由细菌分泌的微小囊泡,其内含细菌外膜蛋白、细胞壁成分和其他生物活性分子,它在肿瘤疫苗研发领域中具有广泛的应用潜力。
OMV可作为一种有效的抗原提呈系统,用于激发免疫系统对肿瘤细胞的免疫反应。通过调整OMV表面的化学性质或结构,可以实现免疫细胞(如树突状细胞,一种抗原提呈细胞,简称DC细胞)的特异性识别和定位,提高抗原提呈细胞对抗原的摄取效率,增强免疫反应的强度和效果。此外,OMV表面富含的病原体相关分子模式(PAMP),使其成为一种潜在的免疫佐剂,以增强免疫应答。例如,通过将OMV与自体肿瘤组织中获得的肿瘤细胞膜进行融合,可以构建个体化的肿瘤疫苗,同时共提呈抗原和免疫佐剂,以增强免疫反应的效力;甚至可以将经基因工程改造的细菌引入肠道。这些工程细菌通过穿透肠上皮屏障、释放OMV,诱导更强大的抗肿瘤免疫效应,并在免疫系统中建立更持久的免疫记忆效应。因此,OMV在肿瘤疫苗研发领域具有广泛应用前景。通过调节OMV的性质和应用方式,可以实现免疫系统的有效激活,为肿瘤治疗提供新的策略和途径。
小细菌的大用途:OMV肿瘤疫苗
免疫系统对肿瘤抗原的有效识别是成功实施肿瘤免疫治疗的关键。然而,令人遗憾的是,只有大约1%的外源性肿瘤抗原能够被机体免疫系统充分辨识。为成功开展肿瘤免疫治疗,必须使用适当的肿瘤抗原递送载体。同时,由于不同类型的肿瘤存在显著的差异,即使同一类型的肿瘤,它们在不同患者之间也可能存在差异。因此,如果能将不同的肿瘤抗原呈现在同一递送载体上,就能够开发出个性化的肿瘤疫苗。
OMV是一种有效的抗原递送载体,通过基因工程技术可以对产生OMV的细菌进行改造,在OMV表面表达融合蛋白[如细胞溶素A(cytolysin A, Cly A)-肿瘤抗原],实现OMV对多种不同的肿瘤抗原的有效负载。然而,在基因工程细菌生产OMV的过程中,肿瘤抗原已经被同时表达在OMV表面,无法实现OMV载体对肿瘤抗原的自由匹配。这样,不但限制了OMV肿瘤疫苗的规模化生产,同时也大大限制了OMV肿瘤疫苗在肿瘤个体化治疗中的应用,亟需开发一种更便捷高效的OMV肿瘤抗原递送系统。

基于此,我们利用基因工程技术和分子胶水技术,开发了一种“即插即用”型OMV腫瘤疫苗平台,能够快速展示多种肿瘤抗原并实现高效递送和免疫刺激。该肿瘤疫苗平台不仅可依赖其尺寸优势实现淋巴结的高效引流,还具备免疫佐剂功能激活多种天然免疫通路,实现有效的肿瘤免疫治疗[8]。这不仅满足了复杂多样的肿瘤抗原临床需求,还有望极大地推动个体化肿瘤疫苗的发展。
肿瘤的个性化治疗:杂合膜肿瘤疫苗
自体来源的肿瘤细胞膜富含肿瘤抗原,可唤起机体特异性免疫反应,但其自身免疫原性较低,单独作用下引发的免疫反应较弱。因此,需要佐剂辅助以增强机体对肿瘤抗原的免疫响应。细菌细胞膜作为佐剂,通过促使DC细胞成熟、激活T细胞等途径,增强免疫响应。与其他细菌来源的佐剂如脂多糖相比,细菌细胞膜还能有效减少急性毒性反应。
为了实现特异性的抗肿瘤反应、避免不良反应,我们开发了一种个性化杂合膜纳米肿瘤疫苗,它由源于自体肿瘤的细胞膜、大肠杆菌细胞膜和聚乳酸纳米颗粒构成。实验结果显示,在手术切除肿瘤后,这些杂合膜纳米颗粒诱导了强烈的肿瘤特异性免疫反应,提高了小鼠的存活率,能长期保护小鼠免受肿瘤的再次攻击。且没有因为细菌细胞壁污染导致的免疫系统过度刺激等不良反应。该研究表明,基于细菌细胞质膜有效激活先天免疫系统的个性化自体肿瘤抗原疫苗,实现了个性化肿瘤膜抗原和细菌细胞膜佐剂的有效递送,成功激发机体特异性免疫反应,提供了持久的免疫记忆保护效果,有效遏制了肿瘤的术后复发,在癌症术后患者的个性化治疗方面具有巨大潜力[9]。
未来的“糖丸”:口服肿瘤疫苗
口服给药通常被视为相较于注射更安全、患者更易依从及医疗费用更低的疫苗接种方法。肠道作为人体最大的免疫器官,含有约70%的免疫细胞,因此口服肿瘤疫苗有望引发强烈的抗肿瘤效应。然而,复杂的消化道环境和肠道上皮屏障限制了口服疫苗的开发。某些口服减毒活疫苗,如脊髓灰质炎疫苗,能够利用微生物在预防传染病领域的自然特性,有效克服肠道上皮屏障。然而,这种方法并不适用于口服肿瘤疫苗,因为肿瘤细胞本身不具备病毒所具有的穿越肠道上皮屏障的能力,并且减毒活疫苗仍然存在感染和传播的潜在风险。鉴于屏障穿透性、安全性和有效性等方面的考量,迫切需要开发新的口服疫苗技术。
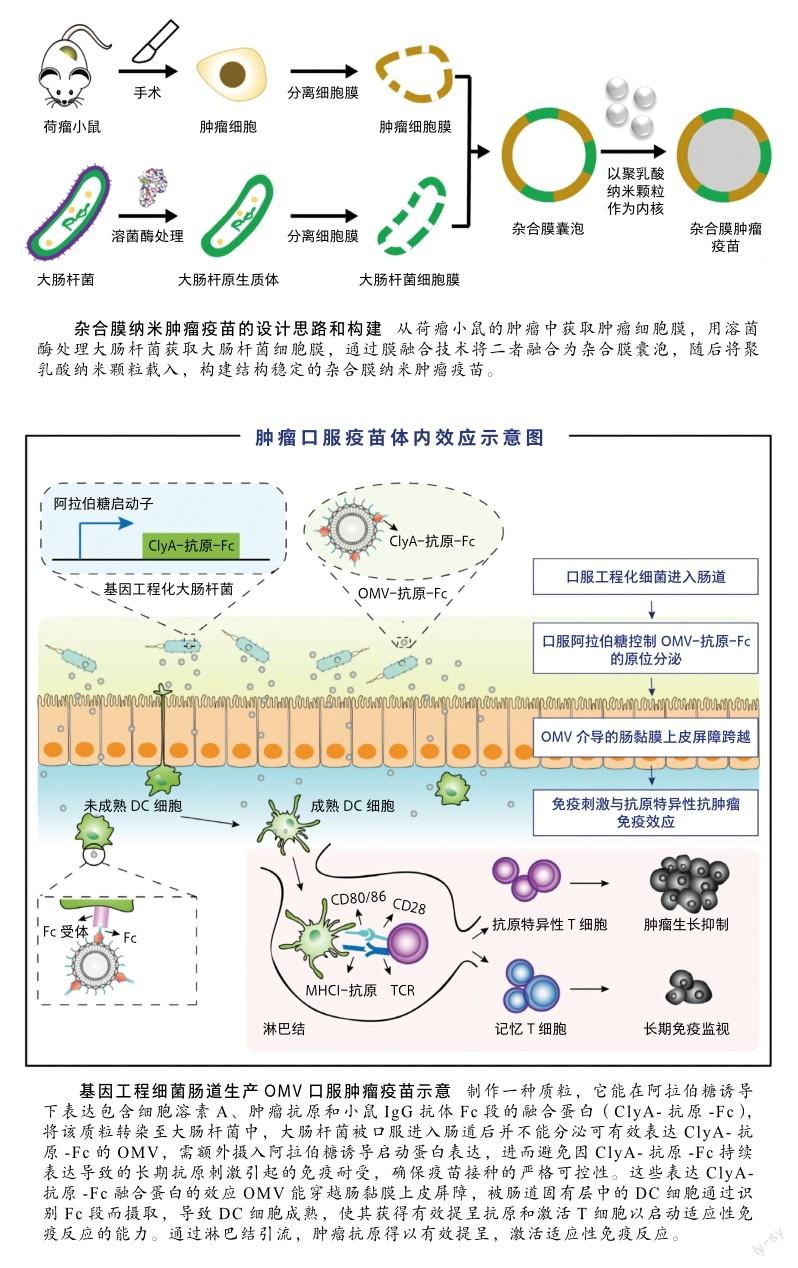
我们设计了一种基于基因工程细菌肠道生产效应OMV的口服肿瘤疫苗体系。这种口服疫苗在多种小鼠肿瘤模型中均能诱导机体产生强有力的抗肿瘤免疫效应和免疫记忆效应,有良好的临床应用前景[10]。
纳米生物材料基于生物分子的纳米结构整合了天然构建模块的材料和生物学优势,使得药物载体的多功能设计成为可能。然而,随着材料复杂性的增加,临床应用的挑战也相应增加。此外,为充分发挥基于生物分子的抗肿瘤纳米药物研发的应用潜力,需要全面理解纳米材料与肿瘤微环境之间的相互作用,以便进行针对性的纳米药物载体设计。只有这样才能实现药物的精确传输、控制释放、诊断监测以及改良优化,从而提高药物的疗效、改善患者的治疗体验。
[1]Karin E de V, Johanna A J. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell, 2023, 41(3): 374-403.
[2]Qin H, Ding Y, Nie G,et al. Tumor microenvironment targeting and responsive peptide-based nanoformulations for improved tumor therapy. Mol Pharmacol, 2017, 92(3): 219-231.
[3]Liang J, Zhao X. Nanomaterial-based delivery vehicles for therapeutic cancer vaccine development . Cancer Biol Med, 2021, 18(2): 352-371.
[4]Li S, Jiang Q, Liu S, et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nat Biotechnol, 2018, 36(3): 258-264.
[5]Du C, Qi Y, Zhang Y, et al. Epidermal growth factor receptortargeting peptide nanoparticles simultaneously deliver gemcitabine and olaparib to treat pancreatic cancer with breast cancer 2 (BRCA2) mutation. ACS Nano, 2018, 12(11): 10785-10796.
[6]Ji T, Zhao Y, Ding Y, et al. Transformable peptide nanocarriers for expeditious drug release and effective cancer therapy via cancerassociated fibroblast activation. Angew Chem Int Ed Engl, 2016, 55(3): 1050-1055.
[7]Cheng K, Ding Y, Zhao Y, et al. Sequentially responsive therapeutic peptide assembling nanoparticles for dual-targeted cancer immunotherapy. Nano Letters, 2018, 18(5): 3250-3258.
[8]Cheng K, Zhao R, Li Y, et al. Bioengineered bacteria-derived outer membrane vesicles as a versatile antigen display platform for tumor vaccination via plug-and-display technology. Nat Commun, 2021, 12(1): 2041
[9]Chen L, Qin H, Zhao R F,et al. Bacterial cytoplasmic membranes synergistically enhance the antitumor activity of autologous cancer vaccines. Sci Transl Med, 2021, 13(601): eabc2816.
[10]Yue Y L, Xu J Q, Li Y, et al. Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria. Nat Biomed Eng, 2022, 6(7): 898-909.
关键词:纳米生物材料 肿瘤微环境 抗肿瘤药物 纳米机器人多肽纳米药物 肿瘤疫苗 ■
