CT影像组学列线图模型预测胃肠道间质瘤危险度分级
2023-10-20贾济波张万军刘原庆冯飞文胡粟胡春洪
贾济波,张万军,刘原庆,冯飞文,胡粟,胡春洪
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是消化系统的一种常见间叶组织来源肿瘤,组织学上有梭形细胞和上皮细胞,生物学行为上具有恶性潜能[1]。研究表明[2]对于局部进展期或晚期GIST,术前治疗可提高手术切除率,保护脏器功能,降低复发率,甚至带来生存获益。Tirumani等[3]研究发现中高危GIST易发生复发及转移。因此,术前预测GIST的危险度分级可为是否需要术前行辅助化疗提供参考依据。目前主要通过术前穿刺活检或手术切除病理来评价GIST危险度分级。但是,由于病理取材有限,可能导致病理结果并不能准确反映肿瘤整体危险度分级,此外穿刺活检还存在并发症风险[4]。因此,寻找一种能可靠、准确、全面评估GIST患者术前危险度分级的无创方法具有重要的临床意义。本研究建立基于CT图像的影像组学列线图模型,用于术前预测GIST危险度分级,以指导临床诊疗及判断预后。
材料与方法
1.临床资料
搜集本院和二院2016年1月-2022年4月经病理证实为GIST患者266例的临床及CT图像资料进行回顾性分析。纳入标准:病理诊断为GIST且进行危险度分级;术前或活检前2周内行腹部增强检查。排除标准:①检查前接受过治疗(包括手术及新辅助化疗);②手术合并其他肿瘤;③影像检查与手术或活检间隔时间超过2周;④图像质量不佳或影像资料不全者;⑤术中肿瘤破裂,病理无法评估危险度者。
2.检查方法
检查设备包括GE revolution CT、Philips Brilliance iCT、SIEMENS Somatom Definition Flash螺旋CT以及SIEMENS Somatom Sensation 64层螺旋 CT 。扫描范围包括全部病灶区域。扫描期相包括平扫期、动脉期以及静脉期。增强扫描使用高压注射器系统。对比剂剂量1.5~2.0 mL/kg,注射流率3~4 mL/s。注射对比剂后25~30 s进行动脉期扫描,55~60 s行门静脉期扫描(表1)。
3.CT特征分析
两名放射科医生对所有CT图像进行独立阅片,记录CT特征,主要包括肿瘤部位、大小、边界、形态、有无囊变坏死、溃疡、钙化、强化方式等(图1)。意见分歧时进行协商取得一致。
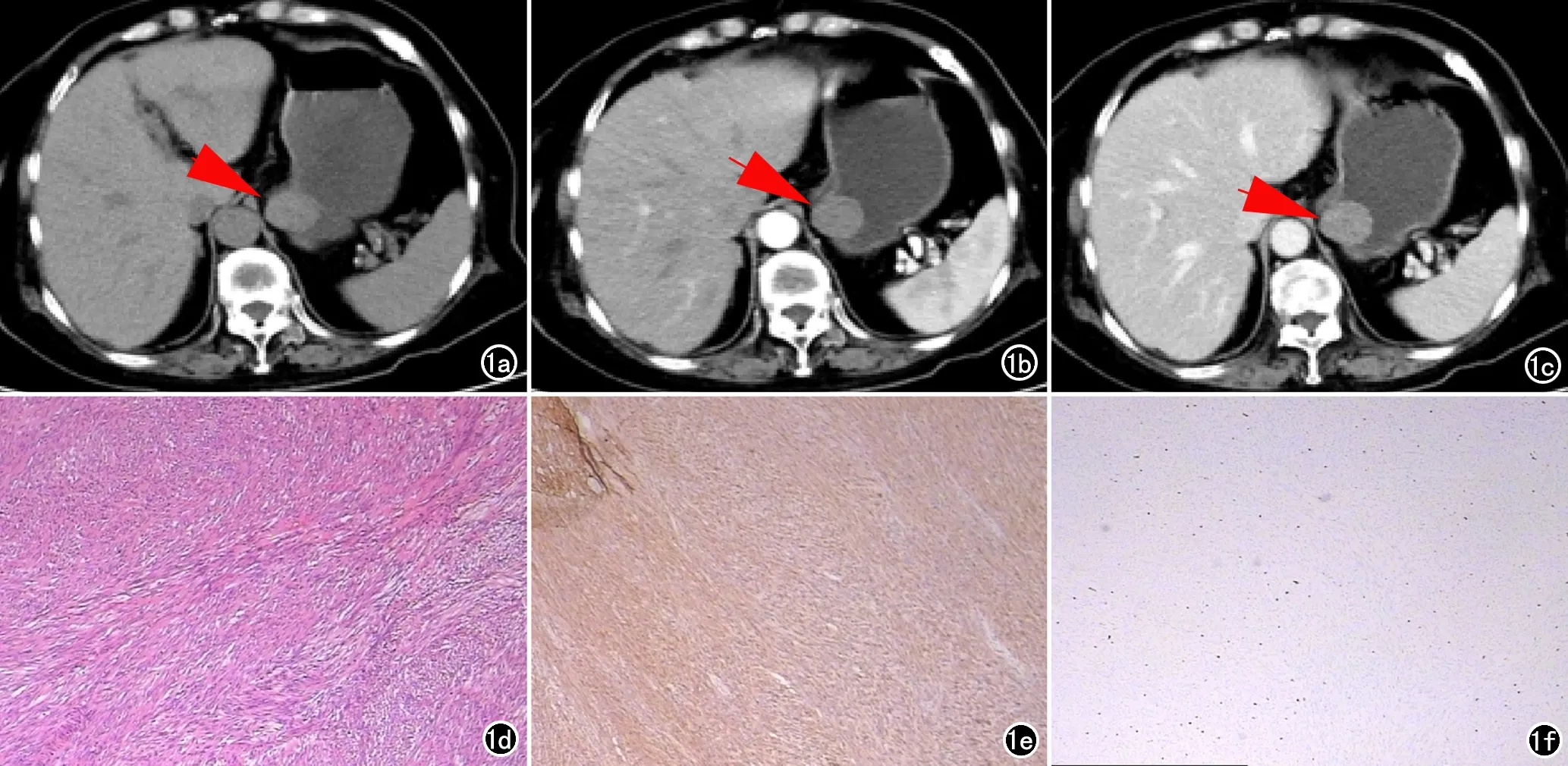
图1 (贲门下、大弯侧)胃间质瘤,危险度分级:低危险度。a)CT平扫贲门下、胃大弯侧类圆形软组织肿块(箭);b)动脉期病灶轻度均匀强化(箭);c)静脉期病灶进一步均匀强化(箭);d)镜下见梭形细胞(×100,HE);e)CD117(+);f)Ki67(+,约1%)。
4.CT图像分割与放射组学特征提取
首先由1名放射科医师使用ITK-SNAP(v3.8.0;www.itksnap.org)软件对肿瘤平扫期、动脉期及静脉期图像逐层进行勾画和分割,生成体积感兴趣区(VOI)。VOI包括全部肿瘤,避开内部坏死区,边缘气体、肠腔内容物、脂肪以及周围血管(图2)。两周后该医生和另一名放射科医生分别对50例(随机选取)肿瘤各期图像再次进行分割,以行观察者间和观察者内的一致性评估。基于上述VOI,使用FAE软件对CT图像进行肿瘤特征提取。
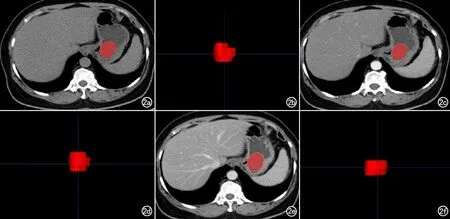
图2 a) 平扫期横断面肿瘤ROI分割图; b) 平扫期肿瘤VOI; c) 动脉期横断面肿瘤ROI; d) 动脉期肿瘤VOI; e) 静脉期横断面肿瘤ROI分割图; f) 静脉期肿瘤VOI。
5.危险度分级
据美国国立卫生研究院(NIH)2008改良版[5],将极低危和低危合并为低恶性风险组,中危和高危合并为高恶性风险组。
6.建立临床模型、影像组学模型及联合模型
将临床资料及CT图像特征、平扫期(N)、动脉期(A)、静脉期(V)、影像3期(N+A+V)提取的组学特征导入数坤科研平台(https://science.shukun.net)通过Select Percentile和最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法降维,使用5个分类器(Random Forest、Logistic Regression、SVM、SGD、XGBoost)建立临床模型、各期组学模型以及临床-组学联合模型。
7.统计分析
使用IBM SPSS 22.0统计软件进行统计分析。采用组内相关系数(intraclass correlation coefficients,ICC)评估观察者间和观察者内在影像组学特征上的一致性(ICC>0.75时认为重复性较好)。采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)对各模型训练组与测试组进行量化。采用灵敏度、特异度、准确度、阳性预测值和阴性预测值来评价模型的诊断效能。使用Delong检验比较各模型间AUC值差异。
结 果
1.临床资料及CT图像特征比较(表2)
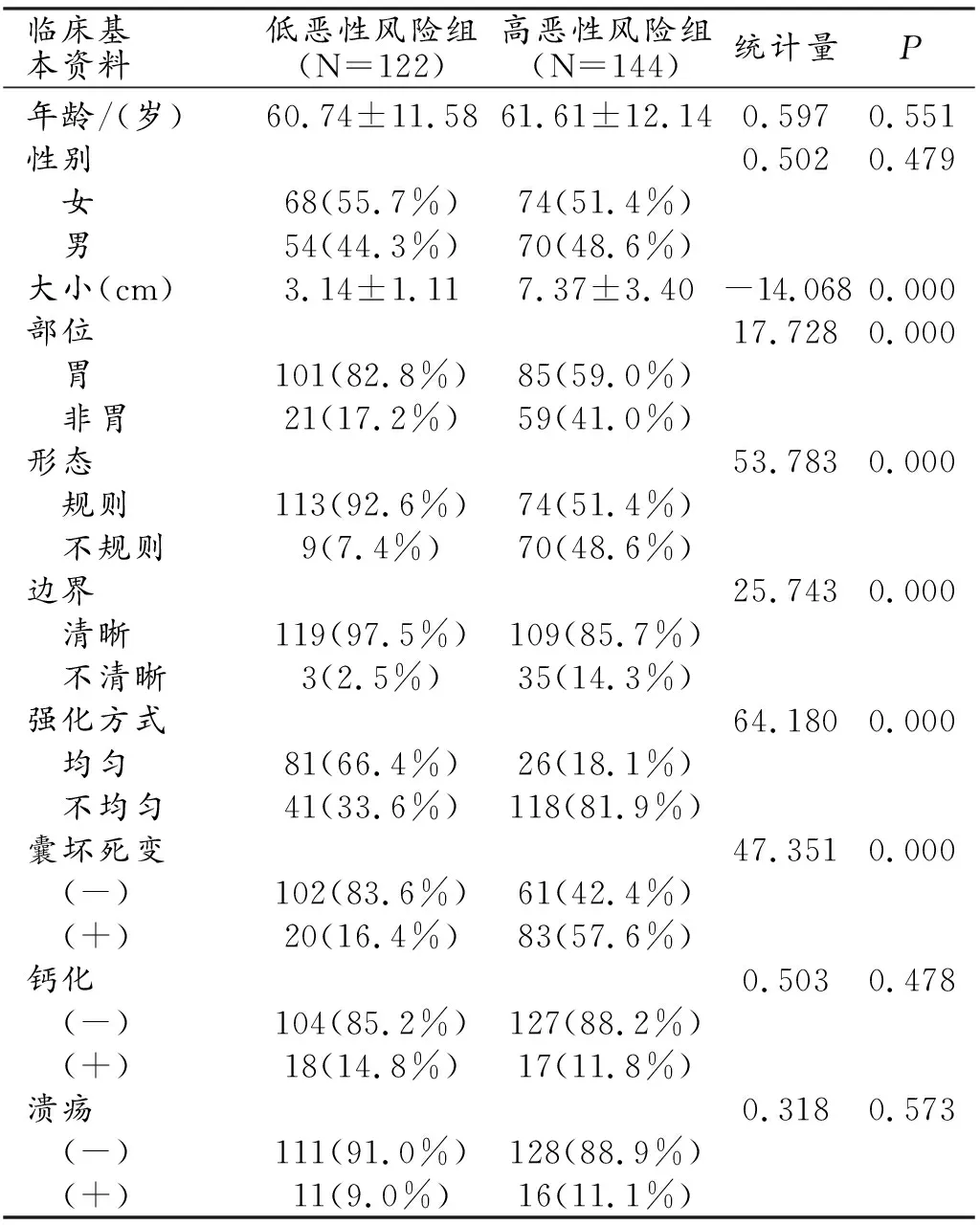
表2 2组患者临床资料及CT图像特征比较
266例患者中低恶性风险组122例,女68例,男54例,平均年龄(60.74±11.58)岁,肿瘤生长于胃腔者101例,非胃腔者21例(十二指肠8例,小肠11例,空肠1例,腹腔1例);高恶性风险组144例,女74例,男70例,平均年龄(61.61±12.14)岁,肿瘤生长于胃腔者85例,非胃腔者59例(食管2例,十二指肠7例,小肠36例,直肠2例,肠系膜2例,肝脏1例,后腹膜2例,腹腔7例)。肿瘤大小、部位、形态、边界、强化方式及有无囊变坏死在两组中均有统计学差异(P<0.05),而年龄、性别、有无钙化及溃疡在两组中均无统计学差异(P>0.05)。
2.临床特征筛选及模型建立
按照7:3的比例随机分组,训练组186例,测试组80例。临床资料及CT图像特征经select percentile和LASSO算法筛选出2个特征(大小、强化方式)建立临床模型,LASSO特征权重系数分别为0.08、0.20(图3)。
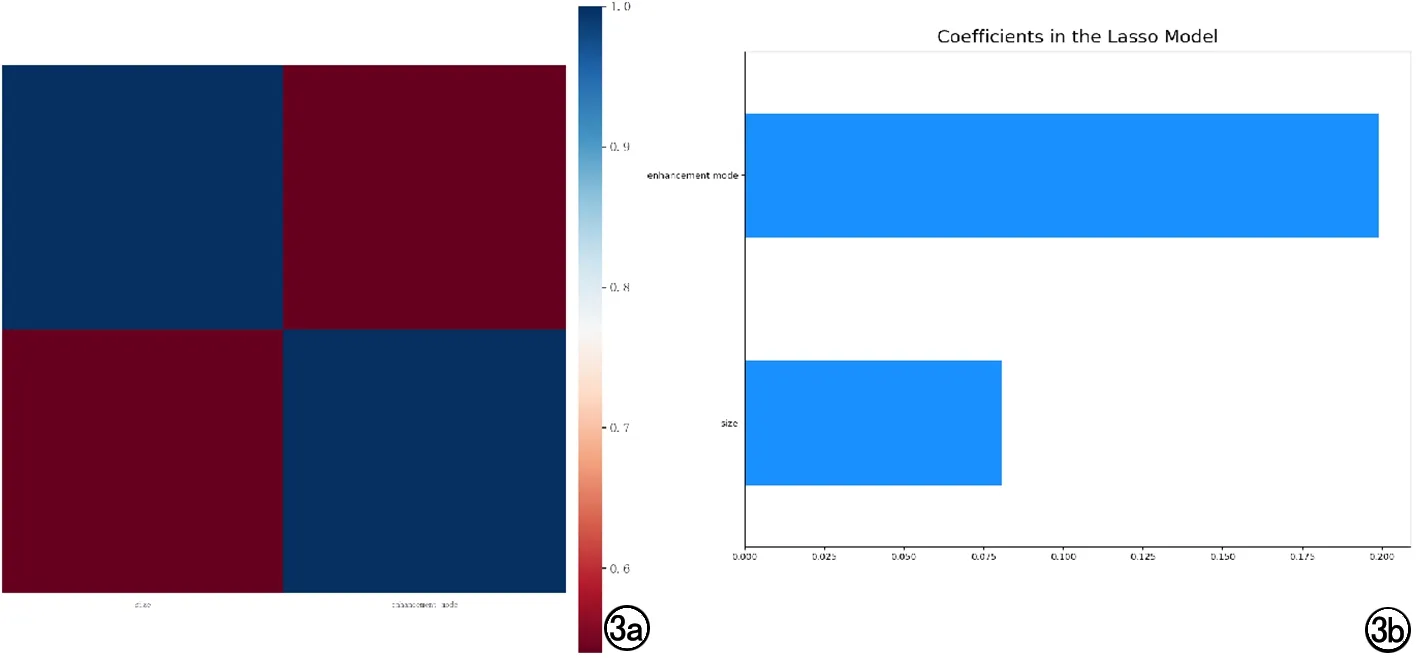
图3 a)LASSO算法筛选临床特征;b) 临床特征权重系数。
3.组学特征筛选和模型建立
对肿瘤提取特征进行一致性检验,各期像有1781个组学特征具有较好一致性(ICC>0.75)。按照7:3的比例随机分组,训练组186例,测试组80例。首先,将各期像提取的组学特征,经select percentile和LASSO算法降维后,平扫期(图4a)、动脉期(图4b)、静脉期(图4c)获得的组学特征分别为5个、24个、24个,而影像3期(N+A+V)共得到8个组学特征(图4d)。平扫期1个、动脉期2个、静脉期5个。应用上述筛选后组学特征,使用5个分类器建立各期组学模型。然后,据AUC值进行各期模型组内比较,选出组内最优模型。最后,共建立6个预测模型(表3),包括1个临床模型、 4个影像组学模型(平扫期、动脉期、静脉期、平扫期+动脉期+静脉期)及1个组合模型(临床-影像-期组学模型)。
4.模型的比较与验证
6个模型的ROC曲线如图5所示。通过Delong检验进行比较(图6),临床模型联合影像3期 (N+A+V) 组学模型与平扫期模型及影像3期模型有统计学差异,其余各模型间无统计学差异。基于XGBoost分类器构建的临床模型联合影像3期 (N+A+V) 组学模型为最佳模型,具有最高的预测效能(训练组AUC=0.98(95%CI:0.97~0.99);测试组AUC=0.95(95%CI:0.89~0.98))。据该最佳模型生成临床-CT影像组学列线图实现模型可视化(图7)。
讨 论
GIST起源于胃肠道Cajal间质细胞或其前体细胞[6],全球发病率约10~15例/100万[7]。肿瘤较小时常无明显临床症状。随着肿瘤体积增大,常出现腹痛、腹部肿块、消化道出血等症状[8]。手术治疗是GIST首选治疗方法[9],但GIST危险度分级为中高危的患者,存在复发和转移的风险,需辅以辅助治疗。术前行靶向药物治疗缩小肿瘤体积,不仅可避免不必要的联合脏器切除,降低手术风险,还可增加肿瘤根治性切除机会;对于特殊部位的肿瘤,还可保护其结构和功能[1]。
本研究筛选临床特征的方法与既往研究不同,既往研究[10-13]临床特征先行单因素分析,有统计学差异的特征再进一步行多因素逻辑回归分析。本研究采用数坤科研平台select percentile和LASSO算法进行特征筛选,最终筛选出肿瘤大小和强化方式2个特征建立临床模型,LASSO特征权重系数分别为0.08、0.20。基于XGBoost分类器临床模型具有较高的诊断效能,训练组和测试组AUC值分别为0.95和0.91。据美国国立卫生研究院(NIH)2008改良版,肿瘤大小、核分裂象计数和肿瘤原发部位是GIST危险度分级的主要参数。但在本研究中肿瘤原发部位特征权重系数较低,不能用于构建临床模型。张丽静等[14]研究也表明肿瘤原发部位不是GIST危险度分级的独立危险因素。但陈媛慧等[15]研究发现胃底间质瘤比小肠间质瘤高危概率大,董婷宇等[16]基于增强CT影像组学术前预测GIST危险度分级的研究也发现肿瘤部位在两组间存在统计学差异。她们将性别、年龄、肿瘤部位及Ki-67表达情况仅采用卡方检验比较两组间的差异,未进一步进行多因素回归分析,单因素分析诊断效能价值有限。本研究中肿瘤强化方式也具有较高的特征权重系数。高恶性风险组(中危、高危)肿瘤一般体积较大,密度欠均匀,内部血供不均匀,易出现囊变坏死,故强化不均匀,而低恶性风险组(极低危、低危)肿瘤体积相对较小,内部密度均匀,强化也均匀,与母青林等[17]报道一致。本研究中其他临床及CT图像特征权重系数均较低,不能用于构建临床模型。
目前已有利用放射组学预测GIST危险度分级的报道。Chu等[10]利用增强CT静脉期图像构建放射组学术前预测GIST危险度分级模型,该模型在训练组、验证组的AUC分别为0.793、0.791。同时,他们的研究还建立了基于患者年龄、肿瘤直径和形态的临床模型,AUC值为0.718。本研究构建了4个组学模型,包括平扫期(N)、动脉期(A)、静脉期(V)以及3期联合(N+A+V)模型以充分提取各期组学特征;另外,还使用5个分类器对各期特征进行训练建模,对比了不同模型间的诊断效能。研究结果发现平扫期、动脉期、静脉期组学模型在测试组对GIST危险度分级预测能力相当,AUC分别为0.84、0.87、0.84,影像3期模型AUC略提高为0.88,较他们仅利用静脉期图像建立组学模型预测效能明显提高。同时,本研究基于肿瘤大小和强化方式建立的临床模型,AUC值为0.91,较他们的临床模型预测效能亦明显提高。WANG等[18]基于动脉期和静脉期图像构建放射组学模型预测GIST危险度分级。研究发现使用随机森林模型在训练组、外部验证组具有最高AUC分别为0.88±0.06、0.90,具有较高的预测效能,与本研究影像3期组学模型预测效能差别不明显,但未建立临床模型。本研究临床模型与影像3期(N+A+V)建立的联合模型在训练组和测试组的AUC分别为0.98、0.95,预测效能较他们仅构建组学模型有明显提高。本研究通过勾画全瘤体、多期像、多算法联合临床及CT图像特征的模型,可使组学特征信息与临床信息相互补充,从而提高了诊断效能及准确性。
本研究虽为双中心,但是非前瞻性,结果可能存在选择偏倚,需要更多前瞻性数据,以便进一步验证模型效能;此外,本研究包括多种机器类型,对结果也可能存在影响。
综上所述,本研究基于XGBoost分类器建立了临床-CT影像组学列线图,其在术前预测GIST危险度分级上具有较高临床价值。
