镍铜层状双金属氢氧化物/碳布电极的制备及其电催化氧化氨氮性能
2023-10-19游葭宁崔建国
游葭宁,崔建国,张 峰
(太原理工大学 环境科学与工程学院,山西 晋中 030600)
高浓度氨氮工业废水的排放是造成水体富营养化的主要原因之一,此类废水pH差异大,但大多集中在9~13范围内[1-4]。废水中的氨氮以游离态氨(NH3)和离子态铵(NH4+)的形式存在,当pH高于9.25时,氨氮主要以游离态氨的形式存在,其生物毒性比离子态铵高几十倍[5]。因此,氨氮废水的有效处理被认为是环保研究的重点领域之一。传统生物处理法对高浓度氨氮工业废水的耐受性较差,高氨氮浓度、高pH及有毒污染物都可能影响微生物的活性,降低反应效率。电催化氧化技术因操作简便、效率高、对污染物耐受性高等优点,为强碱性高浓度氮氮工业废水的预处理提供了新的思路[6]。开发具有高电催化性能与稳定性的低成本阳极材料是该技术的关键。近年来,层状双金属氢氧化物(LDH)由于低成本、高氧化还原活性、环境友好等特点,在电催化领域表现出巨大的发展潜力[7]。镍基多金属(如NiFe[8]和NiV[9])氢氧化物,已被证明在电解水中具有优异的催化性能。Cu是促进氨氮电化学氧化最活跃的金属之一,因其具有高导电性和丰富的活性位点[10]。然而,Cu与N原子的结合能力较弱,这在一定程度上限制了其催化氧化氨氮的性能。而Ni能强烈结合N原子,在Cu和Ni的协同作用下,镍铜层状双金属氢氧化物(NiCu-LDH)有望成为电化学氧化氨氮的优良催化电极。
本研究以碳布(CC)为基底,通过水热法制备了NiCu-LDH/CC电极,评价了其电催化氧化氨氮的性能,并将催化电极用于处理模拟强碱性氨氮废水,考察了应用电位、初始废水pH、初始氨氮质量浓度等因素对氨氮去除效果及产物选择性的影响,最后通过循环实验测试了该电极的稳定性。
1 实验部分
1.1 电极的制备
CC基底的预处理:将CC(20 mm×30 mm×0.36 mm,苏州晟尔诺科技有限公司)浸泡于2 mol/L盐酸中超声处理20 min,再依次于丙酮、无水乙醇和去离子水中超声清洗20 min,置于真空干燥箱中,60 ℃烘干备用。
采用水热法合成电极材料。按一定Ni与Cu的摩尔比称取六水合硝酸镍、三水合硝酸铜,总量为5 mmol,加入10 mmol尿素,充分溶解于去离子水中。将80 mL混合溶液转入聚四氟乙烯内衬中,加入预处理好的CC,密封于100 mL反应釜内,置于电热恒温鼓风干燥箱中于120 ℃加热反应12 h。水热反应结束后,取出产物,用无水乙醇、去离子水反复清洗数次,放入真空干燥箱,于60 ℃干燥12 h,得到NiCu-LDH/CC电极。在1 mol/L KOH溶液中通过循环伏安法激活电极,扫描区间0.6~2.1 V(相对于可逆氢电极,下同),扫描速率100 mV/s,扫描200圈。
1.2 电极的表征
采用荷兰帕纳科公司Aeris型X射线衍射仪分析电极材料的晶体结构。采用上海辰华公司CHI600E型电化学工作站测试电极材料的电化学性能:在三电极体系下,分别以Hg/HgO电极(1 mol/L KOH)和Pt电极作为参比电极和对电极,制备好的NiCu-LDH电极为工作电极,以0.5 mol/L KOH溶液或0.5 mol/L KOH+55 mmol/L氨氮(用(NH4)2SO4配制)混合溶液为电解质溶液,进行循环伏安测试、线性伏安测试及电化学交流阻抗测试。
1.3 氨氮废水的处理实验
以(NH4)2SO4作为氨氮来源,配制模拟氨氮废水。取70 mL一定浓度的废水于100 mL密封电解池中进行长时间电解实验。在三电极体系下,以电化学工作站作为工作电源,控制应用电位。电解槽置于恒温磁力搅拌器上,连续搅拌使溶液混合均匀。以2 mmol/L K2SO4为支持电解质,用1 mol/L硫酸或KOH溶液调节废水pH,在不同的影响因素下进行12 h实验。实验过程中,每隔2 h从电解池中取样。
按照《水质 氨氮的测定 纳氏试剂分光光度法(HJ 535—2009)》[11]测定水样氨氮质量浓度,计算氨氮去除率;按照《水质 亚硝酸盐氮的测定 分光光度法》(GB 7493—1987)[12]测定水样NO2--N质量浓度;按照《水质 硝酸盐氮的测定 紫外分光光度法(试行)》(HJ/T 346—2007)[13]测定水样NO3--N质量浓度。采用上海珀金埃尔默企业管理有限公司PinAAcle 900T型原子吸收光谱仪测定溶液中金属离子的浓度,评估电极材料中金属离子的浸出量。按式(1)~(3)分别计算电催化氧化氨氮的产物选择性(S,%)、电流效率(η,%)和能耗(Ec,kW·h/kg(以N计))。根据相关文献[14-15],氨氮在催化氧化过程中,其产物主要为NO2--N、NO3--N和N2,而其他气态产物如NO2、NO和N2O因含量极少,常低于检测下限,可以忽略不计。因此,N2的选择性可由100%减去NO2--N和NO3--N的选择性得出。
式中:t为反应时间,h;y为NO2--N或NO3--N;ρy t为反应t时刻NO2--N或NO3--N的质量浓度,mg/L;ρ0和ρt分别为初始和t时刻的氨氮质量浓度,mg/L;V为溶液体积,L;M为氨氮的摩尔质量,g/mol;n为每摩尔氨氮氧化为N2所需的电子数;F为法拉第常数,96 485 C/mol;J为电流密度,A/m2;A为电极的工作面积,m2;U为应用电位,V。
2 结果与讨论
2.1 电极材料对氨氮去除效果的影响
采用不同条件下制备的电极,在初始氨氮质量浓度为750 mg/L、初始废水pH为12、应用电位为1.62 V的条件下处理废水12 h,结果如图1所示。由图1可见,Ni与Cu的摩尔比为0.8∶0.2时制备的电极(Ni0.8Cu0.2-LDH/CC),其氨氮去除率最高,为85.86%,明显优于Ni(OH)2、Cu(OH)2和其他摩尔比的电极,实现了最高的电流效率和最低的能耗,表现出高的能量利用率和良好的氨氮去除效果,可认为是电催化氧化氨氮的有效电极材料。

图1 不同电极的氨氮去除效果对比
2.2 电极电催化氧化氨氮的性能
2.2.1 氨氮的电催化氧化过程分析
进行长时间电解实验前,需要在碱性条件下激活电极。因为未经电化学活化的NiCu-LDH/CC表面暴露的活性位点较少,通过活化可提高和稳定催化性能[16]。图2显示了Ni0.8Cu0.2-LDH/CC电极的电化学活化过程。随着扫描圈数的增加,出现一对氧化还原峰,且峰强越来越强,达到一定程度后循环伏安曲线趋于稳定。活化后,观察到电极表面由绿色转变为黑色。

图2 Ni0.8Cu0.2-LDH/CC电化学活化过程的循环伏安曲线
对活化前后的电极材料进行XRD分析(图3),发现活化前电极材料的出峰位置主要对应于α-Ni(OH)2和Cu(OH)2的特征峰。其中:2θ为11.6°、35.1°和60.8°处分别对应α-Ni(OH)2(JCPDS 00-022-0444)的(001)、(111)和(301)晶面;2θ为13.7°、23.8°、39.7°、43.5°、47.0°、56.3°、62.1°和81.4°处分别对应Cu(OH)2(JCPDS 00-035-0505)的(020)、(021)、(130)、(131)、(112)、(151)、(113)和(044)晶面。经电化学活化后,2θ为11.6°处的α-Ni(OH)2(001)晶面和2θ为13.7°处的Cu(OH)2(020)晶面的衍射峰消失,而在2θ为28.1°和31.2°处出现新峰,分别对应NiOOH(JCPDS 00-027-0956)的(110)晶面和(101)晶面。
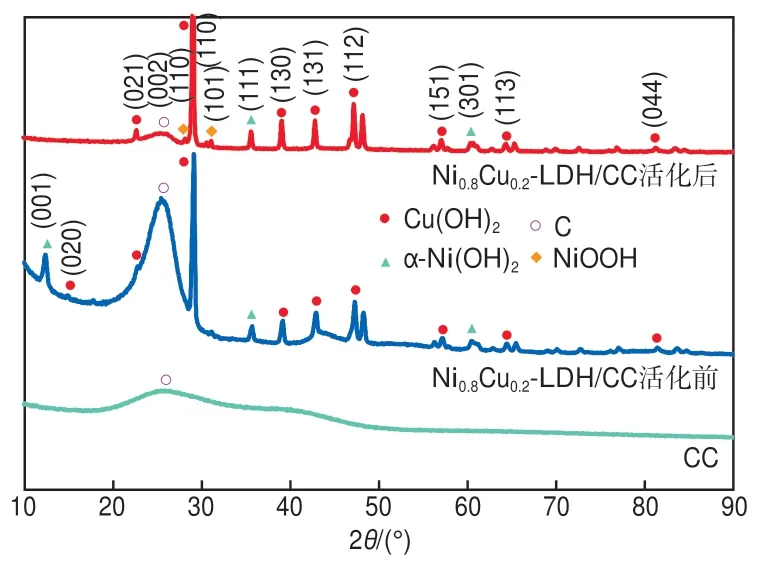
图3 电化学活化前后Ni0.8Cu0.2-LDH/CC的XRD谱图
由此推测,活化过程中的部分α-Ni(OH)2和Cu(OH)2转变为NiOOH和与NiOOH同晶的镍铜羟基氧化物Ni1-xCuxOOH[17]。图2的氧化还原峰对应NiⅡ/NiⅢ和CuⅡ/CuⅢ的可逆氧化还原反应(式(4)和式(5)),其中Ni1-xCuxOOH活性物质的形成是促进氨氮电催化氧化过程的关键[14,16]。
对图1的氨氮氧化产物的选择性进行分析,结果见图4。由图4可见,在NiCu-LDH/CC电极作用下,N2和NO2--N是氨氮的两种主要氧化产物,这可能是镍和铜氢氧化物共同作用下的结果。Ni(OH)2/CC对N2的选择性最高,其中65.6%的氨氮被氧化为N2,20.23%和14.17%的氨氮分别被氧化为NO2--N和NO3--N。Ni(OH)2/CC较高的N2选择性可能是由反应速率导致的,而非反应能导致[14]。考虑到Ni(OH)2较低的反应活性,用其进一步提高N2的选择性较为困难。在Cu(OH)2/CC作用下,NO2--N的选择性最高,78.96%的氨氮被氧化为NO2--N,11.43%和9.61%的氨氮分别被氧化为NO3--N和N2。不同Ni与Cu摩尔比的NiCu-LDH/CC电极对NO3--N的选择性均极低,其中Ni0.8Cu0.2-LDH/CC实现了46.38%的最高N2选择性及最佳的氨氮去除效果(见图1),在同型电极中表现最佳,因此选择Ni0.8Cu0.2-LDH/CC电极进行后续的电催化氧化氨氮实验。

图4 不同电极催化氧化氨氮的产物选择性
根据实验结果,结合KAPAŁKA等[18]提出的Ni(OH)2对氨氮的电催化氧化机理,推测氨氮在NiCu-LDH/CC电极上的电催化氧化过程见式(6)~(8),式中ads代表吸附态。部分催化剂在碱性条件下转变为Ni1-xCuxOOH,NH3在催化剂表面发生吸附,吸附的NH3在Ni1-xCuxOOH作用下直接发生失电子反应而被氧化[16,18]。
2.2.2 电极的电化学活性
图5显示了不同电极在0.5 mol/L KOH溶液和0.5 mol/L KOH+55 mmol/L氨氮溶液中的循环伏安曲线。可以观察到,在0.5 mol/L KOH溶液中,Ni0.8Cu0.2-LDH/CC电极对应的曲线在1.1~1.6 V有一对明显的氧化还原峰,可归因于NiⅡ/NiⅢ和CuⅡ/CuⅢ的氧化还原反应。加入(NH4)2SO4后,从约1.38 V起氧化电流密度明显增大,说明Ni0.8Cu0.2-LDH/CC电极对氨氮电催化氧化具有较高的催化活性。对于Ni(OH)2/CC电极,氨氮存在和不存在的条件下,1.1~1.6 V范围内均能观察到一对氧化还原峰,对应NiⅡ/NiⅢ的氧化还原反应[19]。Ni(OH)2/CC电极在加入氨氮后峰值电流有所增加,说明它对氨氮具有一定的电催化氧化活性,但与Ni0.8Cu0.2-LDH/CC电极相比还有很大差距。对于Cu(OH)2/CC电极,1.6 V后才有较小的电流密度增加,说明它对氨氮的电催化氧化活性较低。与单一金属氢氧化物电极相比,Ni0.8Cu0.2-LDH/CC电极对氨氮的电催化氧化活性显著提高,可以确定Cu和Ni的协同效应。
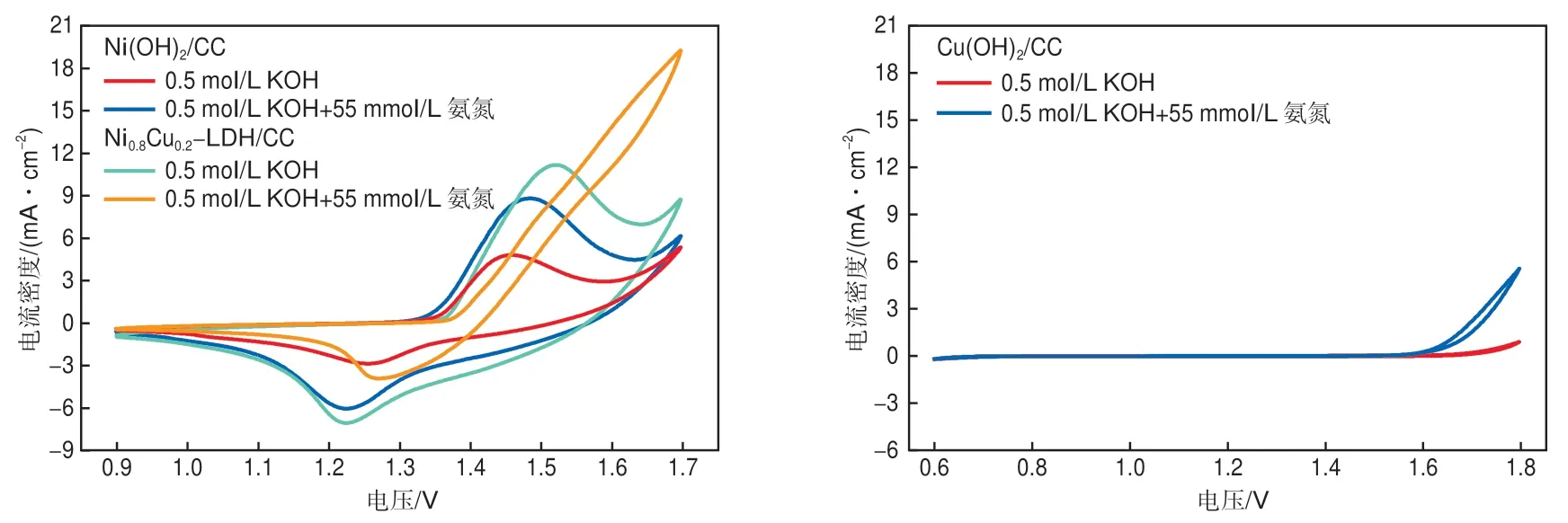
图5 不同电极的循环伏安曲线
线性伏安曲线显示(图6a),与Ni(OH)2/CC和Cu(OH)2/CC电极相比,Ni0.8Cu0.2-LDH/CC的起始电压显著降低,且在起始电压之后氨氮氧化的电流密度急剧增加,相同条件下表现出最高的电流密度。这表明,适当比例的Cu掺入可以显著提高电极的催化活性。

图6 不同电极的线性伏安曲线(a)和电化学阻抗谱(b)
采用电化学交流阻抗测试进一步解释电极的动力学机理。如图6b所示。据JIANG等[14]的研究,Ni(OH)2电极的电子转移路径为液体界面-金属氢氧化物层界面-衬底的过程。类似地,Ni0.8Cu0.2-LDH/CC的电子转移路径可能遵循氨氮-镍铜氢氧化物层界面-CC的过程,结合式(6)~(8)中氨氮在Ni0.8Cu0.2-LDH/CC电极上的电催化氧化机理可推测,NH3在活性物质Ni0.8Cu0.2OOH作用下的直接失电子反应对应高频区域半圆弧的出现,其半圆直径用R1表示。其中Ni0.8Cu0.2-LDH/CC的R1值(1.191 Ω)小于Cu(OH)2/CC的(2.284 Ω)和Ni(OH)2/CC的R1值(1.519 Ω)。较低的R1值使催化电极具有更高的电导率,可在关键电极(Ni0.8Cu0.2-LDH/CC)和电解质(氨氮)界面保持更快的电子转移速率,使得催化活性大幅提高。
2.3 废水的电化学处理效果
2.3.1 应用电位的影响
应用电位对电解系统中氨氮去除效果及氨氮氧化产物有很大影响[20]。根据图5的实验基础,选取1.47,1.52,1.57,1.62,1.67,1.72 V 6个应用电位,在初始氨氮质量浓度为750 mg/L、初始废水pH为12的条件下处理废水12 h,结果见图7。如图7a所示:当应用电位从1.47 V增至1.62 V时,氨氮去除率不断增加,在1.62 V实现85.86%的最高去除率;继续升高应用电位,氨氮去除率有所降低,这可能与电极表面的析氧副反应有关[14],随着电位增大副反应加剧,氨氮去除率和能量效率变差。利用阳极氨氮电催化氧化的电流效率来表征能量利用效率。如图7b所示,随着应用电位的增大,电流效率下降,同时能耗增大。这意味着施加较大的应用电位时,析氧反应显著增加。析氧反应的发生不仅导致氨氮电化学氧化反应与析氧反应的竞争,降低氨氮去除率,还显著影响氨氮电化学氧化产物的选择性。如图7c所示:当应用电位低于1.62 V时,氧化产物主要由NO2--N和N2组成,在1.47 V应用电位下获得51.05%的最高N2选择性;当应用电位高于1.62 V时,加剧了过度氧化现象,产物对NO3--N的选择性大幅上升。从能效方面考虑,氨氮电催化氧化的应用电位越低越好,但考虑到氨氮去除率等因素,选择1.62 V的应用电位较适宜。
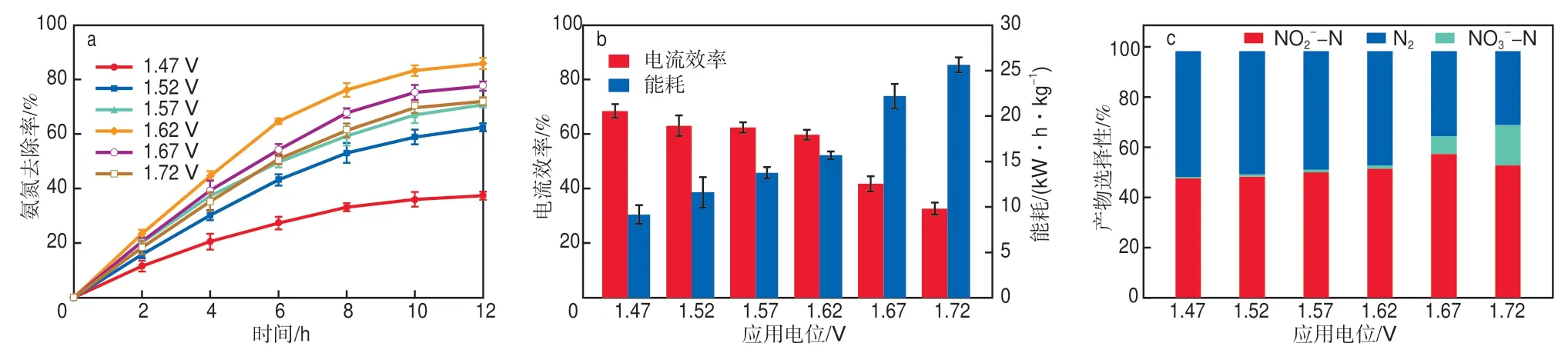
图7 应用电位对氨氮去除率(a)、能效(b)和产物选择性(c)的影响
2.3.2 初始废水pH的影响
初始废水pH是影响氨氮存在形式、催化电极氧化活性以及氨氮氧化产物的重要参数[20]。NH4+/NH3的酸度系数(pKa)为9.25,当pH低于9.25时,NH4+占主导地位;当pH高于9.25时,NH3占主导地位。在应用电位为1.62 V、初始氨氮质量浓度为750 mg/L的条件下处理废水12 h,考察初始废水pH对处理效果的影响,结果见图8。如图8a所示,初始废水pH越高,对应的氨氮去除率也越高。这一现象可能是电极催化活性的变化引起的,据式(5),pH越高,OH-浓度越大,越有助于Ni1-xCuxOOH活性物质的生成,进而促进催化活性的提高[16]。但是,高pH条件下伴随更多NO2--N的生成,如图8b所示。当初始废水pH为13时,产物NO2--N的选择性显著上升,N2选择性显著下降;当初始废水pH为9时获得52.11%的最高N2选择性,但氨氮去除效果较差,去除率仅为25.43%。综合考虑,选择初始废水pH为12较适宜,12 h的氨氮去除率为85.86%,N2选择性为46.38%。此外,随着反应的进行,体系的pH逐渐降低(见图8c),最终稳定在8~10范围内,满足一般生化反应的酸碱性要求,有利于进行后续深度处理工艺。
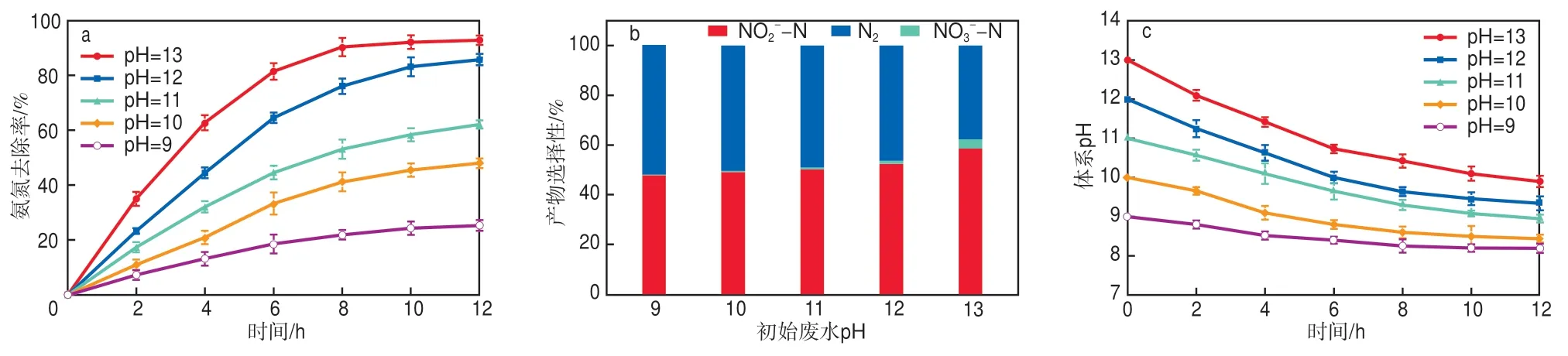
图8 初始废水pH对氨氮去除率(a)、产物选择性(b)和体系pH(c)的影响
2.3.3 初始氨氮质量浓度的影响
在应用电位为1.62 V、初始废水pH为12的条件下处理废水12 h,考察初始氨氮质量浓度对处理效果的影响,结果见图9。由图9a可见,平均去除速率随初始质量浓度的增加而增大,这可能与传质速率有关[21]。高质量浓度的氨氮废水能促进反应物从主体溶液到电极表面的传质,减小浓差极化,有利于氨氮电化学氧化反应的发生[16]。当初始氨氮质量浓度分别为450,600,750,900,1 100,1 300 mg/L时,氨氮的去除率分别为94.51%,90.02%,85.86%,83.85%,79.83%,75.53%,表明Ni0.8Cu0.2-LDH/CC电极在较高质量浓度氨氮废水中,仍表现出良好的电催化氧化性能,此时氨氮去除率较高,稳定在75%~95%之间,用于高浓度氨氮工业废水处理具有良好应用前景。此外,由图9b可见,在高浓度氨氮废水电化学处理中,N2选择性最高可达53.47%,对应其他氧化产物中NO2--N占比44.91%,NO3--N占比1.62%。利用Ni0.8Cu0.2-LDH/CC电极优异的氨氮去除效果以及对氨氮的电催化氧化产物主要为N2和NO2--N的特点,可使其成为一种强碱性高浓度氨氮工业废水的预处理手段,后续联合生物短程反硝化工艺,为该类废水的处理提供一种可行的策略。

图9 初始氨氮质量浓度对氨氮去除(a)和产物选择性(b)的影响
2.4 电极的稳定性
在初始氨氮质量浓度为450 mg/L、初始废水pH为12、应用电位为1.62 V的条件下,用Ni0.8Cu0.2-LDH/CC电极进行7次电化学循环实验以测试其稳定性,结果如图10所示。7次循环实验中,氨氮去除率均保持在90%以上,并且电极表面无明显变化。更重要的是,对电解反应结束后溶液中镍和铜离子的浸出量进行了测试,结果表明溶液中几乎未检测到镍和铜离子的浸出,表明Ni0.8Cu0.2-LDH/CC电极对氨氮的电催化氧化具有良好的稳定性。
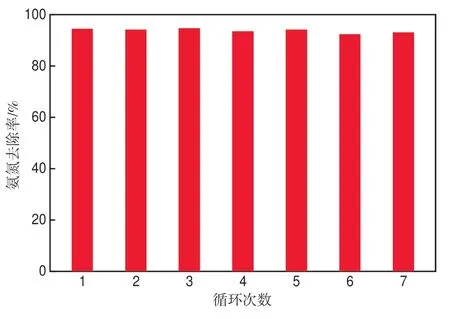
图10 Ni0.8Cu0.2-LDH/CC电极的稳定性评价
3 结论
a)以CC为基底用水热法制备了NiCu-LDH/CC电极。电化学表征结果显示,与Ni(OH)2和Cu(OH)2电极相比,Ni和Cu的协同效应使Ni0.8Cu0.2-LDH/CC电极对氨氮电催化氧化具有优异的催化活性。
b)采用Ni0.8Cu0.2-LDH/CC电极电催化氧化处理模拟氨氮废水,在应用电位为1.62 V、初始废水pH为12的适宜条件下,处理氨氮质量浓度450~1 300 mg/L的废水12 h,氨氮去除率稳定在75%~95%,产物中N2选择性最高可达53.47%,对应的NO2--N选择性为44.91%,NO3--N选择性为1.62%。
c)处理后废水pH从9~13降至8~10,可满足一般生化反应的酸碱性要求,废水中NO2--N占比较高,NO3--N占比很低,这些条件均有利于后续生物短程反硝化进一步脱氮,表明该工艺可作为一种高效的强碱性氨氮工业废水预处理技术。
d)7次循环实验后,Ni0.8Cu0.2-LDH/CC电极表现出良好的催化稳定性和极低的镍铜离子浸出量,有利于氨氮电催化氧化的实际应用。
