黄酮类衍生物的合成及对黄嘌呤氧化酶活性的影响*
2023-10-18谢珺苗菁崔杏王建塔王聪汤磊
谢珺, 苗菁, 崔杏, 王建塔, 王聪, 汤磊
(贵州医科大学 药学院, 贵州 贵阳 550025; 贵州省化学合成药物研发利用工程技术研究中心, 贵州 贵阳 550004)
痛风是由长期高尿酸(uric acid, UA)血症引起的一组异质性代谢性疾病[1]。UA在关节、肾脏及其他器官的积累可引起痛风性关节炎、肾结石、胰岛素抵抗、Ⅱ型糖尿病及肥胖,并加速心血管和周围血管疾病及肾脏损害[2]。黄嘌呤氧化酶(xanthine oxidase, XO)是嘌呤代谢途径中的关键酶,催化次黄嘌呤氧化为黄嘌呤,并由黄嘌呤氧化为UA[3]。目前痛风的治疗方法是通过抑制XO、刺激UA排泄或碱化尿液来降低血清UA水平。对于高UA血症患者,使用XO抑制剂治疗是最有效的方法,可直接阻止次黄嘌呤和黄嘌呤氧化为UA[4]。XO抑制剂一般分为嘌呤类和非嘌呤类,目前已开发获临床批准的有别嘌醇、非布索坦及托吡司他等,但药物存在一些副作用,如别嘌呤醇和非布索坦长期口服可造成肝肾损伤[5],托吡司他可引起爆发性肝炎[6-7]。随着全球痛风患者数量的增加,寻找新的非嘌呤XO抑制剂可为临床治疗痛风提供潜在的解决方案[8]。近年研究发现,许多中药中含黄酮类结构的化合物在体外可抑制XO的活性,如山奈酚[9]、香豆酸[10]、槲皮素和黄芩素[11]及木犀草素[12]等。槲皮素的苯并吡喃部分夹在Phe914和Phe1009氨酸残基之间,其共轭三环结构与氨基酸残基之间的空间互补作用以及范德华力也使其能形成紧密复合物[13]。近年来,槲皮素衍生物的合成研究主要是在环上的修饰[14],拼合设计化合物的研究报道较少。因此,本研究将槲皮素的苯并吡喃酮与苯溴马隆的二溴苯酚进行拼合,合成了黄酮类衍生物并进行了XO的活性研究,以期发现有苗头的先导化合物。
1 材料与方法
1.1 实验材料
1.1.1材料及主要试剂 黄嘌吟氧化酶(西格玛奥德里奇公司),实验柱层析所用200~300目的硅胶(烟台新诺化工),实验所用化学反应试剂和层析溶剂均为分析纯(上海沃化化工);试剂为国产市售分析纯试剂,GF254薄层层析硅胶和200~300目柱层析硅胶(青岛海洋化工有限公司)。
1.1.2主要仪器 Bruker Avance 400 MHz核磁共振仪(美国Varian公司),Bruker Daltonics Bio-TOF-Q Ⅲ型质谱仪(美国 Waters 公司),81-2型恒温磁力搅拌器(上海司乐仪器有限公司),ZF-2型三用紫外仪(上海安亭仪器厂)。
1.2 研究方法
1.2.1目标化合物的合成 10 mL圆底烧瓶中加2, 4, 6-三羟基苯乙酮0.2 mmol、碳酸钾300 mg及丙酮3 mL,滴加氯甲基甲醚0.05 mL,回流1 h、冷却、过滤,减压浓缩后硅胶柱层析分离纯化得化合物1;5 mL圆底烧瓶中加0.2 mmol 化合物1、 二溴对羟基苯甲醛0.19 mmol、乙醇2 mL及四氢呋喃(tetrahydrofuran,THF)0.17 mL,0 ℃冷却,加氢氧化钾0.22 g,室温搅拌36 h、升温40 ℃、搅拌4 h,减压浓缩后硅胶柱层析分离纯化得化合物2;5 mL圆底烧瓶中加0.112 mmol 化合物2和甲醇1 mL搅拌,加热至40 ℃,逐滴加盐酸0.6 mL,反应2 h,减压浓缩后硅胶柱层析分离纯化得化合物3;25 mL单颈瓶中加0.056 mmol化合物3、无水醋酸钠48 mg及甲醇12 mL,40 ℃回流,搅拌5 h,减压浓缩后硅胶柱层析分离纯化得化合物a;无水、无氧条件下间苯三酚0.05 mol、氯乙腈0.1 mol及无水氯化锌1.3 g混合,加无水乙醚30 mL,冰盐浴冷却,通入干燥氯化氢2 h,置于冰箱1 h,再通氯化氢2 h、置于冰箱3 d,倾出乙醚,粗体物经热水转至圆底烧瓶,回流1 h,静止过夜,水重结晶得化合物4;在圆底瓶中加0.165 mmol化合物4、氢氧化钠0.5 g、水1 mL、乙醇4 mL及二溴对羟基苯甲醛0.11 mmol 混合搅拌,10%盐酸调pH至7,室温搅拌48 h,抽滤,95%乙醇重结晶,得化合物b;100 mL圆底烧瓶中加对羟基苯丙酸0.01 mol和冰醋酸50 mL,15 ℃搅拌,缓慢滴加溴素0.021 mol,搅拌48 h,处理冷却,加水100 mL,固体析出、抽虑,得化合物5;10 mL圆底烧瓶中加1.5 mmol化合物5、间苯二酚1.5 mmol及BF3·OEt20.1 mL,氮气保护,80 ℃搅拌24 h,冷却,倒入水中,乙酸乙酯萃取(20 mL,3次),水洗有机相,干燥、蒸干,硅胶柱层析分离得化合物6;10 mL圆底烧瓶中加0.025 mmol化合物6和BF3·OEt20.7 mL、搅拌5 min、加N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)0.7 mL得反应液Ⅰ,10 mL圆底烧瓶中加三氯氧磷和DMF各0.7 mL得反应液Ⅱ,反应液Ⅱ慢慢滴入反应液Ⅰ中,回流3 h,冷却,倒入水中,过滤得粗品,重结晶得化合物c。
1.2.2XO的活性测试 XO是体内嘌呤代谢的关键酶,能催化黄嘌呤氧化生成UA,UA的生成量与XO的酶活力成正比;UA于295 nm处有特征吸收峰,采用酶标仪检测295 nm处体系UA的变化量,进而得到XO酶活力的大小;96孔板中5个复孔,加25、50、100 及 200 μmol/L 不同浓度的样品溶液[终浓度含1% 的二甲基亚砜(Dimethyl sulfoxide,DMSO)∶吐温=1∶1溶液] 50 μL、磷酸盐缓冲液(phosphate buffered solution,PBS)50 μL、XO溶液50 μL(终浓度25 mg/L)及底物50 μL(终浓度0.225 mmol/L),混合均匀,37 ℃下酶标仪记录295 nm处的光密度(optical density,OD)值;对照样中把XO用PBS代替,空白对照中不加待测化合物或阳性药,用PBS(终浓度含1%DMSO∶吐温=1∶1溶液)代替,最后计算抑制率(%)。
1.2.3分子对接 用药物与分子设计专业工具,SYBYL-X软件绘图工具绘制XO抑制剂非布索坦和黄酮类衍生物的三维结构并进行结构优化;检索自结构生物信息学蛋白质数据(structural bioinformatics protein data bank,RCSB;http://www.rcsb.org/pdb/home/home.do),下载编号为1FO4的蛋白晶体结构,应用SYBYL-X 2.0软件包对该蛋白结构进行蛋白准备,采surflex-dock模块对上述小分子化合物与XO进行虚拟对接,得到打分值。
2 结果
2.1 化合物的结构表征
2.1.1化合物1系1-[2-羟基-4,6-双(甲氧基甲基)苯基]甲酮,黄色固体,熔点163~165 ℃,收率97%;1H NMR (400 MHz,CD3OD)δ为6.15~6.23(d,J=1.8 Hz,1H),6.20~6.20(d,J=2.43 Hz,1H),5.25~5.35(q,J=43.2 Hz,4H),3.45~3.56(m,J=21.3 Hz, 6H);HRMS (ESI),m/z为C12H16O6,257.102 4(理论值257.102 5)[M+H]+。
2.1.2化合物2系(E)-3-(3, 5-二溴-4-羟基苯)-1-[2-羟基- 4, 6-双(甲氧基甲基)苯基]-2-丁烯-1-酮,黄色固体,收率10%,熔点253~255 ℃;1H NMR (400 MHz,CD3OD)δ为7.79~7.83(d,J=15.2 Hz,1H),7.70(s,2H),7.55~7.59(d,J=27.9 Hz,1H),6.32~6.33(d,J=1.6 Hz,1H),6.21~6.22(d,J=2.39 Hz,1H),5.20~5.30(q,J=42.8 Hz,4H),3.44~3.57(m,J=20.4 Hz, 6H);HRMS(ESI),m/z为C20H20Br2O7,530.965 3(理论值530.965 4)[M+H]+。
2.1.3化合物3系(E)-3-(3,5二溴-4-羟基苯)-1-(2,4,6-三羟基苯)丙-2-烯-1-酮,黄色固体,收率21%,熔点248~249 ℃;1H NMR (400 MHz,CD3OD)δ为7.91(s,2H),7.55~7.59(d,J=27.9 Hz,1H),6.42~6.45(d,J=1.7 Hz,1H),6.31~6.35(d,J=4.2 Hz,2H),5.23~5.35(q,J=48 Hz,4H),3.34~3.41(m,J=28 Hz, 2H);HRMS(ESI),m/z为C16H12Br2O5,442.913 1(理论值442.913 0)[M+H]+。
2.1.4化合物a系2-(3,5 -二溴-4 -羟基苯)-5,7-二羟基-苯并哌喃- 4-酮,浅黄色固体,收率70%,熔点237~238 ℃;1H NMR (400 MHz,CD3OD)δ为7.02~7.07(m,2H),5.86~5.88(d,J=1.6 Hz,1H),5.80~5.81(d,J=2.0 Hz,1H),3.14~3.18(q,J=4 Hz,2H),2.83~2.89(q,J=7.2 Hz,1H);HRMS(ESI ),m/z为C15H10Br2O5,428.897 2(理论值428.897 3)[M+H]+。
2.1.5化合物4系2 -氯-1-(3,5-三羟基苯)-乙酮,黄色固体,收率50%,熔点175~178 ℃;1H NMR (400 MHz,CD3OD)δ为4.56(s,2H),5.88~5.88(d,J=1.60 Hz,1H),5.94~5.95(d,J=2.0 Hz,1H);HRMS(ESI),m/z为C8H7ClO3,187.016 3(理论值187.016 2)[M+H]+。
2.1.6化合物b系 2-(3,5-二溴- 4 -羟基苯)- 5,7 -二羟基-4H-苯并哌喃-4-酮,黄色固体,收率70%,熔点 303~305 ℃;1H NMR(400 MHz,CD3OD)δ为7.90(s,2H),6.42(s,1H),6.14(s,1H),5.93(s,1H);HRMS(ESI),m/z为C15H8Br2O5,426.881 6(理论值426.881 7)[M+H]+。
2.1.7化合物5系二溴对羟基苯丙酸,粉色固体3.475 g,熔点196~197 ℃;1H NMR(400 MHz,CD3OD)δ为7.10(s,2H),5.42(s,1H),3.83(s,1H);HRMS(ESI ),m/z为C8H6Br2O3,308.876 0(理论值308.876 2)[M+H]+。
2.1.8化合物6系2-(3,5-二溴-4-羟基苯)-1-(2,4-二羟基苯)丙酮,棕色油状物,收率13%,熔点232~233 ℃;1H NMR(400 MHz,CD3OD)δ为7.56(d,J=7.8,1H),7.17(d,J=1.8 Hz,2H),6.47(m,1H),6.35(s,1H),5.40(s,3H),4.28(s,1H);HRMS(ESI),m/z为C14H10Br2O4,400.902 2(理论值 400.902 4)[M+H]+。
2.1.9化合物c系3-(3,5-二溴-4-羟基)-7-羟基-4-色原烷酮,黄色固体,收率30%,熔点278~280 ℃;1H NMR(400 MHz,CDCl3)δ为10.11(s,1H),8.56(s,1H),8.00(d,J=8.8 Hz,1H),7.80(s,2H),7.18(d,J=2.0 Hz,1H),7.07(dd,J=8.8, 2.0 Hz,2H);HRMS(ESI),m/z为C15H10Br2O4,412.902 2(理论值412.902 4)[M+H]+。
2. 2 XO活性测试
目标化合物对XO的抑制活性从表1中可以看出,所设计的化合物均有一定XO抑制活性,其中活性最好的是黄酮类化合物(化合物b),XO的抑制作用优于二氢黄酮类(化合物a)和异黄酮类化合物(化合物c)。
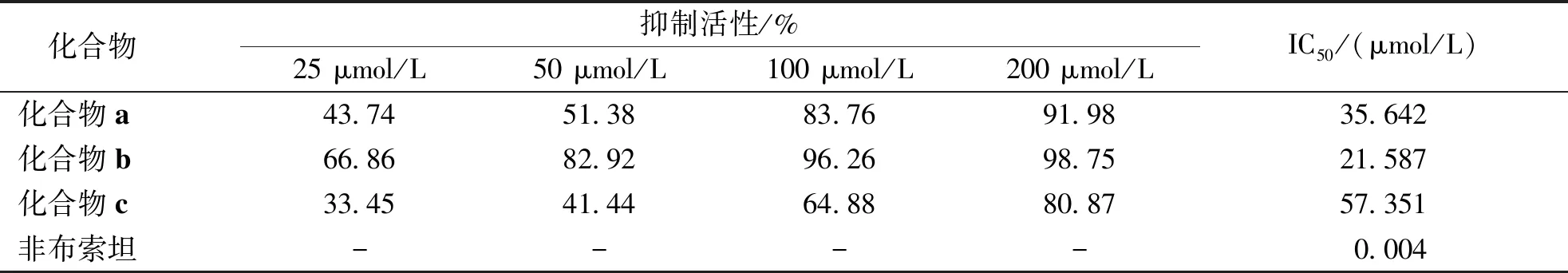
表1 化合物对XO的抑制活性
2.3 分子对接
用surflex-dock模块对目标化合物与XO进行虚拟对接,打分值见表2,非布索坦和黄酮类衍生物(化合物a~c)打分值均达到4.0以上;非布索坦与XO的相互作用结果表明(图1),非布索坦分子中的2个环与氨基酸Ile431之间存在π-烷基疏水作用,五元环上的的甲基也与该氨基酸之间存在明显的烷基疏水作用,而分子中的羧基与Glu45、Gly47,氰基与Asp360、Ser359以及异丁氧基中的氧与Ser356之间均形成了明显的氢键相互作用;黄酮类化合物(化合物b)与XO受体的相互作用结果表明(图1),二者间有多个氨基酸结合位点,如与氨基酸Ala338、Phe337及Asp360形成多个π-烷基疏水作用,而与氨基酸Gly47和Glu45形成典型和非典型的氢键。

图1 非布索坦、化合物b与XO受体结合位点的相互作用

表2 非布索坦和黄酮类衍生物虚拟对接的surflex-dock模块打分值
3 讨论
XO是包括人类在内的一些物种嘌呤分解代谢的关键酶,在次黄嘌呤氧化为黄嘌呤和黄嘌呤氧化为UA的过程中起主要作用[15]。由于XO活性异常,UA产生过多导致高UA血症,这也与痛风有关[16]。痛风是一种代谢性疾病,UA水平过高导致关节UA盐结晶沉积[17]。此外,高UA血症还与其他疾病相关,如炎症、慢性肾脏疾病、高血压疾病及心血管疾病等[18]。XO抑制剂可以阻断嘌呤生物合成UA,从而降低UA的产量[19];别嘌呤醇、非布司他和托吡洛司他是XO的临床抑制剂,用于治疗高UA血症[20];目前XO的抑制剂有几种副作用(如皮疹、过敏反应、血压升高和白内障风险增加等),因此需要有更好疗效和更低副作用的XO抑制剂被研发出来[21]。
杂环化合物因其结构特点和优越的生物活性,在药物合成领域有着广泛的应用[22]。近年来,研究重点转向发现基于杂环化合物的新型有效、廉价且副作用最小的XO抑制剂[23]。噻唑烷是五元杂环化合物的代表,已被广泛应用于医药、材料、生物染料及离子受体等不同领域[24];作为一种典型的噻唑烷衍生物,噻唑环是制药和农用化学品的重要有机中间体,具有多种生物活性,如醛糖还原酶抑制剂、抗癌、抗炎和抗真菌等[25]。近年来,许多非嘌呤类似物化合物,如姜黄素、萘吡喃、芦荟大黄素衍生物、吡喃(3,2-d)嘧啶衍生物、羟基查维醇类似物、黄酮类化合物及查尔酮和黄酮衍生物被报道为XO抑制剂[26]。
黄酮类化合物降UA作用的机制主要表现为抑制UA生成和促进UA排泄[27]。XO是复合黄素酶,在UA的形成过程中主要起催化黄嘌吟和次黄嘌吟的作用,一些黄酮类化合物可有效抑制XO酶,从而减少UA生成,例如山奈酚、樹皮素、芦丁以及艾叶的乙醇提取物可显著降低小鼠血清中的UA、肌酐、尿素氮水平,抑制肝脏XO活性[28]。另有研究指出,一些黄酮对肾脏近端小管上皮细胞顶端膜上的UA盐转运蛋白 1(recombinant urate transporter 1,URAT1)表达具有有效的抑制作用,从而降低UA被肾脏重吸收的量,促进UA被排出体外,例如糊皮素[29];有研究结果显示,芹菜素可抑制XO,同时也可下调高UA小鼠肾脏中URAT1蛋白的表达,最终达到降低UA的目的[ 30]。
本研究采用药物化学的拼合原理设计并合成了去氢黄酮类化合物(化合物a)、黄酮类化合物(化合物b)及异黄酮类化合物(化合物c);化合物的结构通过1H NMR和HRMS检测手段验正;通过XO抑制作用活性测试,目标化合物均有XO抑制活性,且化合物b活性较好,可作为进一步结构优化的先导化合物;非布索坦和黄酮类衍生物打分值均达到4.0以上,从打分结果可以认为在虚拟对接条件下,小分子配体与蛋白受体之间具有较好的相互作用。分子对接显示黄酮类化合物(化合物b)与XO受体结合的位置和非布索坦相近,均与氨基酸Gly47和Glu45形成氢键。本研究可为后期XO抑制的研究提供参考依据。
