铜离子胁迫对淡水石首鱼幼鱼急性毒性、抗氧化及免疫相关酶活性的影响
2023-10-17吕国华郑冰清马学艳金武李红霞宋长友徐跑顾若波闻海波
吕国华,郑冰清,马学艳,金武,李红霞,宋长友,徐跑,顾若波,闻海波*
(1.南京农业大学无锡渔业学院,江苏 无锡 214128;2.中国水产科学研究院淡水渔业研究中心农业农村部稻渔综合种养生态重点实验室,江苏 无锡 214081)
淡水石首鱼(Aplodinotusgrunniens)属鲈形目、石首鱼科,俗称淡水大黄鱼、淡水黄花鱼,其适应性广,是北美洲分布最广泛的淡水鱼类[1]。淡水石首鱼因肉质鲜美、营养丰富且无肌间刺而受到人们喜爱,并具有巨大的经济前景[2]。目前国外对淡水石首鱼研究较多,主要有生长与繁殖特性[3-6]、捕捞特征[7]、食性差异[8]以及出血病抗体检测[9]等方面,而国内对淡水石首鱼研究较少,仅见营养成分分析[10]、人工催产与胚胎发育研究[11]、幼鱼外部形态与内部解剖学特征研究[2]、线粒体基因组特征研究[12]以及饥饿胁迫对形体指标、肌肉脂肪酸和肝脏代谢基因表达的影响[13]等方面。中国水产科学研究院淡水渔业研究中心于2016年从美国引进一批淡水石首鱼并开展人工驯养和繁育试验,取得了显著成效,为我国淡水养殖业提供了新的养殖品种。
铜是广泛应用于农业生产活动中杀藻剂和杀菌剂中的有效成分,水体中Cu2+超标会对养殖水体产生严重的污染,并通过生物富集作用对鱼类产生较强的毒害作用[14],引起鱼类行为异常、生理功能紊乱以及细胞组织病变甚至死亡等[15]。铜也是生物体内最基本的微量重金属元素之一,作为氧化还原剂或氧载体存在于30多种酶中,参与脊椎动物体内黑色素的合成和造血等过程,是鱼体内不可或缺的微量元素[15]。
有关重金属污染对鱼类毒性效应的研究已有不少报道[15-17],但Cu2+对淡水石首鱼抗氧化以及免疫系统的影响尚未见报道。本试验主要研究了水体中不同浓度Cu2+胁迫对石首鱼幼鱼死亡率的影响以及对石首鱼幼鱼肝脏组织中的过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化酶(glutathione peroxidase,GPx)、谷胱甘肽(glutathione,GSH)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST),鳃Na+-K+-ATP酶(Na+-K+-ATPase),肠道中α-淀粉酶(α-amylase,α-AMS)、脂肪酶(lipase,LP)和胃蛋白酶(pepsin,PP)活性以及皮质醇(cortisol,COR)、丙二醛(malondialdehyde,MDA)含量的影响,以阐明重金属Cu2+对石首鱼幼鱼的抗氧化系统和免疫系统的毒性作用,为水体Cu2+对鱼类的毒性作用机制研究提供参考。
1 材料与方法
1.1 试验材料
以2016年美国引进的淡水石首鱼F2代幼鱼为试验对象,质量为(47.2±8.7)g,全长(17.8±1.0)cm。试验前30 d选取活力良好的幼鱼在实验室内暂养,试验用水为曝气自来水,温度(17±1)℃。
1.2 试验方法
1.2.1 Cu2+急性毒性试验在0.1~1.5 mg·L-1Cu2+质量浓度范围内根据等间距法选取5个不同质量浓度组:0.100、0.197、0.387、0.762、1.500 mg·L-1,以及1个不含Cu2+的对照组,每组15尾鱼。试验过程中不投喂、不换水,水温(17±1)℃,每8 h观察1次,记录死亡数量并将死鱼捞出。试验进行96 h。根据死亡数据采用直线内插法计算24和96 h的毒性试验回归方程、半致死浓度和安全浓度。
1.2.2 Cu2+胁迫对肝脏、鳃和肠道酶活性影响试验根据急性胁迫试验,选定0.197 mg·L-1Cu2+作为酶活性试验浓度,同时设定铜离子浓度为0 mg·L-1的空白对照组,每组3个平行,每个平行放20尾。分别在0、4、12、24、48 和96 h 6个时间点取样,每个平行组取3条,用鱼安定(MS-222)将石首鱼幼鱼麻醉,测量体重、体长等数据,分别取肝脏、鳃和前肠暂存液氮罐中,置于-80 ℃冰箱保存待测。
1.3 抗氧化和免疫相关指标的检测方法
准确称取待测的鳃、肝脏、前肠等组织,加入一定体积的PBS(pH7.4),用组织匀浆仪充分匀浆,2 500 r·min-1离心20 min,取上清液分装冷冻后分别进行过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化酶(GPx)、谷胱甘肽(GSH)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、Na+-K+-ATP酶(Na+-K+-ATPase)、α-淀粉酶(α-AMS)、脂肪酶(LP)和胃蛋白酶(PP)酶活性以及皮质醇(Cortisol)、丙二醛(MDA)含量检测。试剂盒购自上海酶联生物有限公司。
1.4 数据处理与分析
2 结果与分析
2.1 Cu2+对淡水石首鱼幼鱼的急性毒性
从表1可以看出:Cu2+质量浓度范围在0.100~0.197 mg·L-1时淡水石首鱼幼鱼死亡率较低,且48、72 和96 h没有累加死亡;Cu2+浓度高于0.387 mg·L-1时死亡率较高,96 h的死亡率可达93.33%;而24 h时0.762、1.500 mg·L-1Cu2+处理组死亡率已达100%。根据死亡率计算Cu2+胁迫淡水石首鱼幼鱼24 h回归方程,Y=1.405 4X+0.024 6,R2=0.888 7,半数致死浓度为0.313 mg·L-1;96 h回归方程,Y=1.435 5X+0.038 2,R2=0.827 3,半数致死浓度为0.291 mg·L-1,安全浓度为0.029 mg·L-1。

表1 不同Cu2+质量浓度处理淡水石首鱼的死亡率Table 1 Mortality of juvenile Aplodinotus grunniens exposed to different Cu2+ concentrations %
2.2 Cu2+胁迫对淡水石首鱼幼鱼肝脏抗氧化指标的影响
2.2.1 Cu2+胁迫对淡水石首鱼幼鱼肝脏CAT活性的影响如图1-A所示:不同处理时间对照组淡水石首鱼幼鱼肝脏CAT活性无显著差异(P>0.05),而试验组CAT活性呈先上升后下降趋势,48 h 时达到最高(127.23±4.77)ng·g-1并显著高于对照组(P<0.05),试验组各时间点CAT活性无显著差异(P>0.05)。
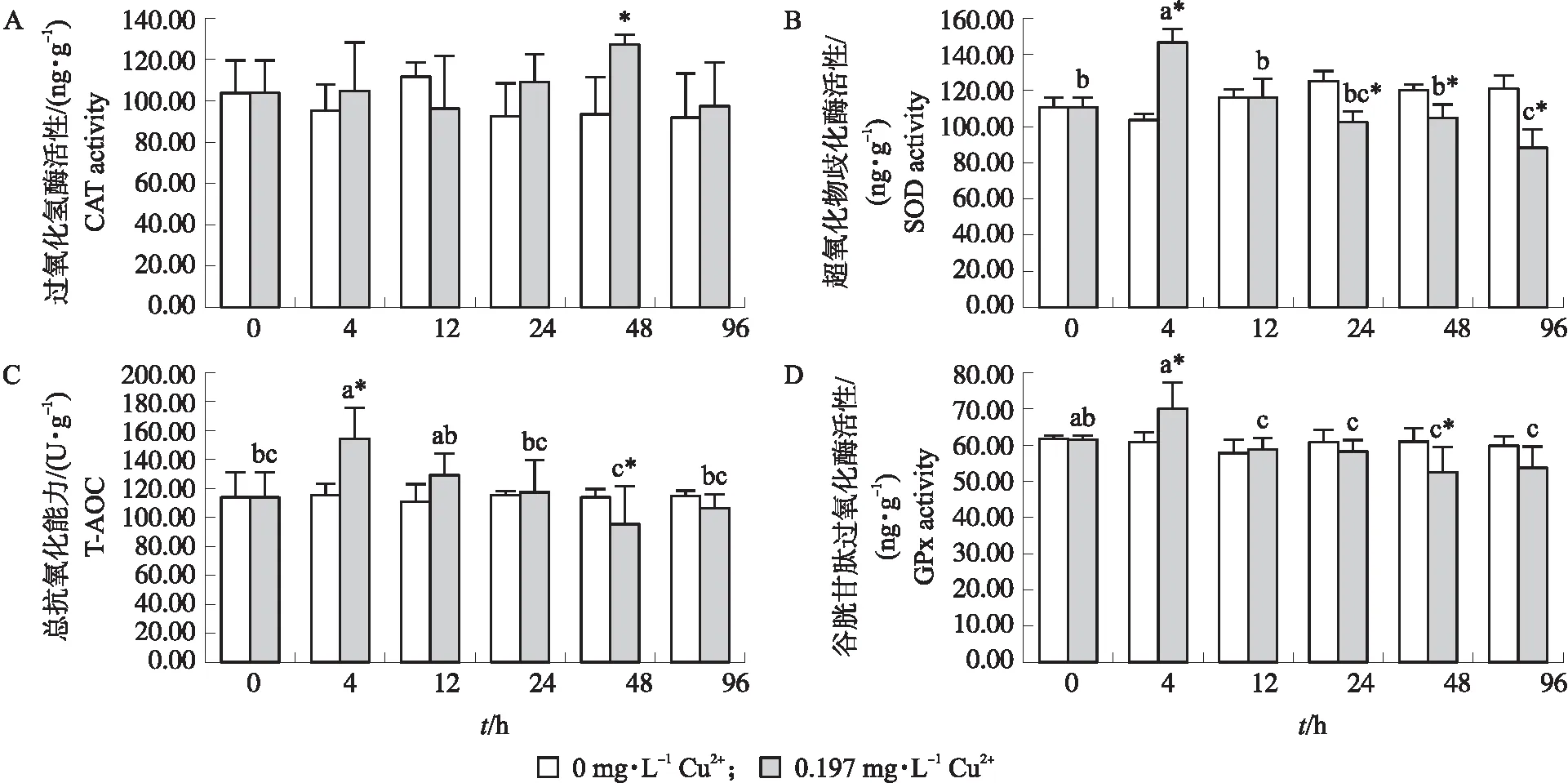
图1 Cu2+胁迫对淡水石首鱼幼鱼肝脏抗氧化性酶活性的影响Fig.1 Effects of Cu2+ stress on the activity of antioxidant enzymes in the liver of juvenile A. grunniensA. CAT:Catalase;B. SOD:Superoxide dismutase;C. T-AOC:Total antioxidant capacity;D. GPx:Glutathione peroxidase不同字母表示试验组不同时间存在显著差异,*表示试验组与对照组存在差异。下同。Different letters indicate that there are significant differences in experimental group at different times,*indicates that there is a difference between the experimental group and the control group. The same below.
2.2.2 Cu2+胁迫对淡水石首鱼幼鱼肝脏SOD活性的影响如图1-B所示:不同处理时间对照组淡水石首鱼幼鱼肝脏SOD活性无显著差异(P>0.05),试验组SOD活性呈先升高后下降的趋势,在4 h达到最大值(146.19±8.36)ng·g-1并显著高于对照组(P<0.05),24 h开始均显著低于对照组,96 h达到最低值(88.36±10.60)ng·g-1。4 h 时SOD活性显著高于其他时间(P<0.05),96 h时 SOD活性与24 h差异不显著(P>0.05),但显著低于其他时间(P<0.05)。
2.2.3 Cu2+胁迫对淡水石首鱼幼鱼肝脏T-AOC的影响如图1-C所示:不同处理时间对照组淡水石首鱼幼鱼肝脏T-AOC无显著差异(P>0.05),试验组T-AOC随胁迫时间增加先上升又下降然后又上升,在4 h达到最大值(154.94±21.65)U·g-1并显著高于对照组(P<0.05),48 h时达到最小值(95.69±25.76)U·g-1并显著低于对照组(P<0.05),其他时间与对照组无显著差异(P>0.05)。4 h时 T-AOC 与 12 h 差异不显著(P>0.05),但显著高于其他时间(P<0.05),48 h时T-AOC显著低于4 h和12 h(P<0.05),而与其他时间差异不显著(P>0.05)。
2.2.4 Cu2+胁迫对淡水石首鱼幼鱼肝脏GPx活性的影响如图1-D所示:不同处理时间对照组淡水石首鱼幼鱼肝脏GPx活性无显著差异(P>0.05),试验组GPx活性随胁迫时间增加呈先上升后下降再上升趋势,在4 h时达最高(702.21±76.05)ng·g-1且显著高于对照组(P<0.05),48 h达最低(525.90±68.62)ng·g-1并显著低于对照组(P<0.05),其他时间与对照组差异不显著(P>0.05)。4 h时GPx活性与0 h差异不显著(P>0.05),但显著高于其他时间(P<0.05)。
2.2.5 Cu2+胁迫对淡水石首鱼幼鱼肝脏GSH活性的影响如图2-A所示:不同处理时间对照组淡水石首鱼幼鱼肝脏GSH活性无显著差异(P>0.05),试验组GSH活性随胁迫时间增加呈先上升后下降趋势,在4 h时达最高(2 983.13±362.47)μg·g-1并显著高于对照组(P<0.05),96 h时最低为(1 890.14±122.58)μg·g-1并显著低于对照组(P<0.05),其他时间与对照组差异不显著(P>0.05)。4 h时GSH活性显著高于其他时间(P<0.05),48和96 h GSH活性与24 h差异不显著(P>0.05),显著低于其他时间(P<0.05)。
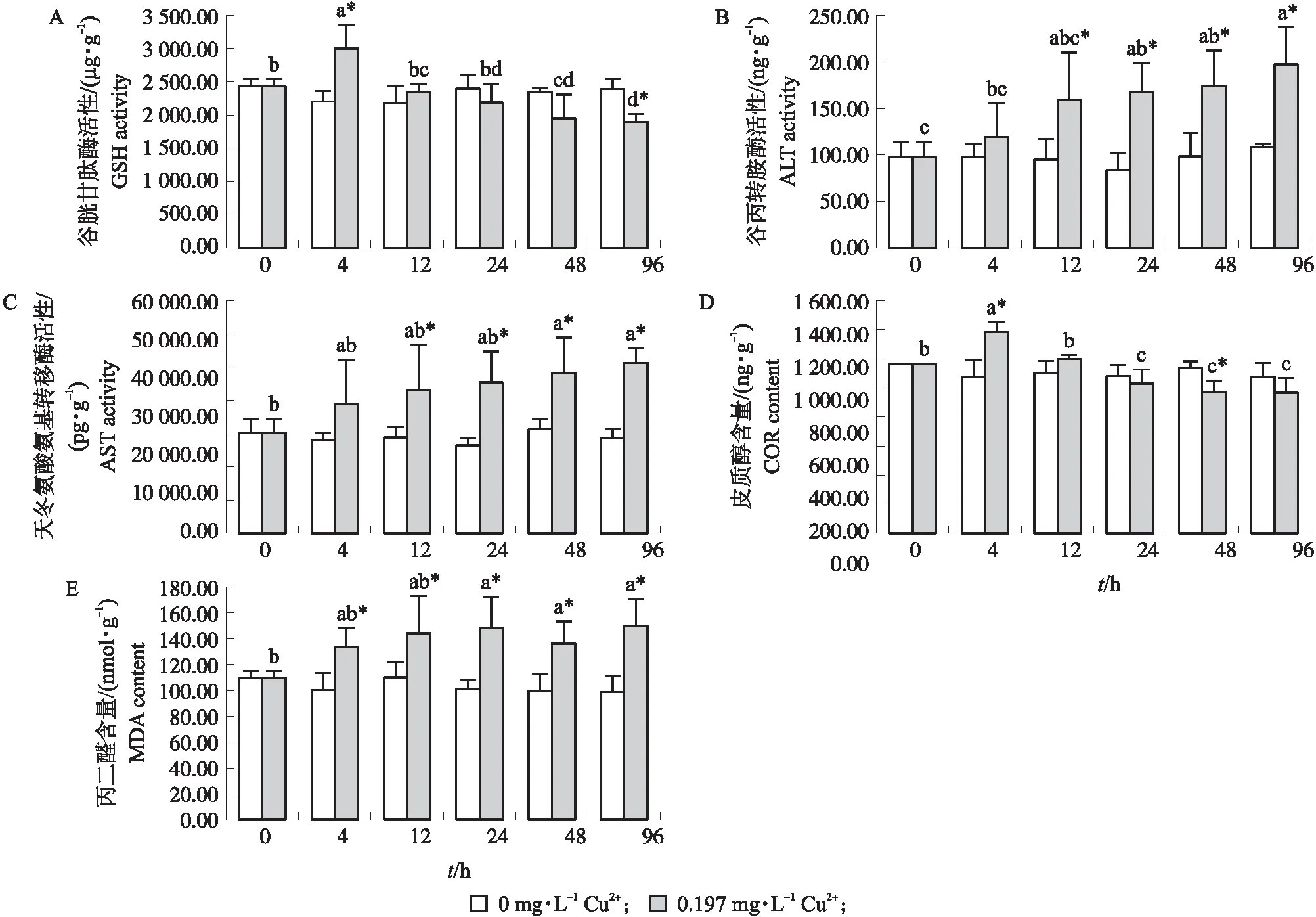
图2 Cu2+胁迫对淡水石首鱼幼鱼肝脏抗氧化酶活性(A—C)和皮质醇(D)、丙二醛(E)含量的影响Fig.2 Effects of Cu2+ stress on the activity of antioxidant enzymes(A-C)and cortisol(COR,D),malondialdehyde(MDA,E)content in the liver of juvenile A. grunniensGSH:Glutathione;ALT:Alamine aminotransferase;AST:Aspartate aminotransferase.
2.2.6 Cu2+胁迫对淡水石首鱼幼鱼肝脏ALT活性的影响如图2-B所示:不同处理时间对照组淡水石首鱼幼鱼肝脏ALT活性无显著差异(P>0.05),试验组ALT活性随胁迫时间增加呈上升趋势,12 h开始显著高于对照组(P<0.05),在96 h达到最大值(197.17±40.39)ng·g-1。96 h ALT活性显著高于0和4 h(P<0.05),与其他时间差异不显著(P>0.05)。
2.2.7 Cu2+胁迫对淡水石首鱼幼鱼肝脏AST活性的影响如图2-C所示:不同处理时间对照组淡水石首鱼幼鱼肝脏AST活性无显著差异(P>0.05),试验组AST活性随胁迫时间增加呈上升趋势,12 h开始显著高于对照组(P<0.05),在96 h达到最大值(43 848.48±3 665.62)pg·g-1。48和96 h AST活性显著高于0 h,但与其他时间差异不显著(P>0.05)。
2.2.8 Cu2+胁迫对淡水石首鱼幼鱼肝脏皮质醇含量的影响如图2-D所示:不同处理时间对照组淡水石首鱼幼鱼肝脏皮质醇含量无显著差异(P>0.05),试验组皮质醇含量随胁迫时间增加呈先上升后下降趋势,4 h时达最高(1 378.14±72.68)ng·g-1并显著高于对照组(P<0.05),48 h皮质醇含量显著低于对照组(P<0.05),96 h 最低为(962.85±104.93)ng·g-1,但与对照组差异不显著(P>0.05)。4 h时皮质醇含量显著高于其他时间(P<0.05),24、48 和96 h皮质醇含量无显著性差异(P<0.05),但显著低于其他时间(P<0.05)。
2.2.9 Cu2+胁迫对淡水石首鱼幼鱼肝脏MDA含量的影响如图2-E所示:不同处理时间对照组淡水石首鱼幼鱼肝脏MDA含量无显著差异(P>0.05),试验组MDA含量随胁迫时间增加呈上升趋势,4 h开始显著高于对照组(P<0.05),在96 h达到最大值(150.10±21.44)nmol·g-1。24和96 h MDA含量显著高于0 h(P<0.05),但与其他时间差异不显著(P>0.05)。
2.3 Cu2+胁迫对淡水石首鱼幼鱼鳃Na+-K+-ATP活性的影响
如图3-A所示:不同处理时间对照组淡水石首鱼幼鱼鳃Na+-K+-ATP活性无显著差异(P>0.05),试验组Na+-K+-ATP活性随胁迫时间增加先上升后下降并保持稳定,在4 h时达最高(135.65±9.40)μmol·g-1并显著高于对照组(P<0.05),在48 h时最低为(95.83±13.22)μmol·g-1并显著低于对照组(P<0.05)。4 h时Na+-K+-ATP活性显著高于其他时间(P<0.05),48 h Na+-K+-ATP活性显著低于4和12 h,与其他时间差异不显著(P>0.05)。
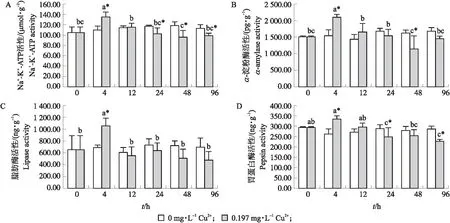
图3 Cu2+胁迫对淡水石首鱼幼鱼鳃和肠道酶活性的影响Fig.3 Effects of Cu2+ stress on gill and intestinal enzyme activity of juvenile A. grunniens
2.4 Cu2+胁迫对淡水石首鱼幼鱼肠道酶活性的影响
2.4.1 Cu2+胁迫对淡水石首鱼幼鱼肠道α-淀粉酶活性的影响如图3-B所示:不同处理时间对照组淡水石首鱼幼鱼肠道α-淀粉酶活性无显著差异(P>0.05),试验组α-淀粉酶活性随胁迫时间增加呈先上升后下降再上升趋势,在4 h时最高为(2 097.98±93.66)pg·g-1并显著高于对照组(P<0.05),48 h时最低为(1 142.41±399.89)pg·g-1并显著低于对照组(P<0.05)。4 h时α-淀粉酶活性显著高于其他时间(P<0.05),48 h时与0和96 h差异不显著(P>0.05),但显著低于其他时间(P<0.05)。
2.4.2 Cu2+胁迫对淡水石首鱼幼鱼肠道脂肪酶活性的影响如图3-C所示:不同处理时间对照组淡水石首鱼幼鱼肠道脂肪酶活性无显著差异(P>0.05),试验组脂肪酶活性随胁迫时间增加先上升后下降并保持稳定,在4 h时最高为(1 057.34±138.01)ng·g-1并显著高于对照组(P<0.05),在96 h时最低为(481.60±138.43)ng·g-1,与对照组差异不显著(P>0.05)。4 h时肠道脂肪酶活性显著高于其他时间(P<0.05)。
2.4.3 Cu2+胁迫对淡水石首鱼幼鱼肠道胃蛋白酶活性的影响如图3-D所示:不同处理时间对照组淡水石首鱼幼鱼胃蛋白酶活性无显著差异(P>0.05),试验组胃蛋白酶活性随胁迫时间增加呈先上升后下降趋势,在4 h时最高为(336.57±15.96)ng·g-1并显著高于对照组(P<0.05),在96 h时最低为(228.84±8.99)ng·g-1且显著低于对照组(P<0.05)。4 h时胃蛋白酶活性与12 h差异不显著(P>0.05),但显著高于其他时间(P<0.05),24和 96 h 胃蛋白酶活性与48 h差异不显著(P>0.05),但显著低于其他时间(P<0.05)。
3 讨论
3.1 Cu2+胁迫对淡水石首鱼幼鱼存活的影响
工业废水的不合理排放以及农业杀虫剂的滥用会对水体生态系统造成严重影响,威胁鱼类生存。铜作为鱼类不可或缺的微量元素,在水体中的浓度影响石首鱼的健康养殖。研究表明:不同物种对Cu2+的耐受性和敏感程度存在较大差异,日本黄姑幼鱼(Nibeajaponica)的Cu2+安全浓度为0.263 mg·L-1[17],中国花鲈幼鱼(Lateolabraxmaculatus)的Cu2+安全浓度为0.086 mg·L-1[18],草鱼幼鱼(Ctenopharyngodonidella)的Cu2+安全浓度为0.008 mg·L-1[14],广东鲂幼鱼(Megalobramaterminalis)的Cu2+安全浓度为0.01 mg·L-1[19]。本研究发现淡水石首鱼幼鱼对Cu2+的耐受性较差,Cu2+的安全浓度为0.029 mg·L-1。根据《危险化学品鱼类急性毒性分级试验方法:GB/T 21281—2007》可判断Cu2+对淡水石首鱼幼鱼的危害等级为剧毒。《污水综合排放标准:GB 8978—1996》中铜排放一级标准为0.5 mg·L-1,远高于淡水石首鱼幼鱼的安全浓度,含铜废水的排放将给鱼类和其他水生生物带来较大的危害,因此在养殖过程中应注意水环境管理和含铜水产药物的安全使用。但本试验得到的淡水石首鱼幼鱼Cu2+安全浓度是在Cu2+单独作用下的试验结果,在实际生产中水中的悬浮物、有机质、钙镁离子等都能降低硫酸铜的毒性[17],因此需要结合实际情况进行具体分析和处理。
3.2 Cu2+胁迫对淡水石首鱼幼鱼肝脏抗氧化酶活性的影响
受到重金属胁迫,鱼体会产生不同程度的氧化应激反应,导致活性氧自由基(reactive oxygen species,ROS)增多,当超出鱼体耐受范围时,会造成鱼体脂质过氧化损伤。研究表明,鱼体清除ROS存在一定规律,首先会利用一些小分子非酶抗氧化产物(例如GSH、维生素C、维生素E等)清除过多ROS,当非酶抗氧化产物无法清除过多ROS时,鱼体则开始合成抗氧化酶来缓减氧化压力[19]。SOD是一种金属酶,负责清除超氧阴离子,形成过氧化氢,而CAT则负责将过氧化氢分解为水和分子氧[20]。GPx能以GSH为特异性底物,降解有机过氧化物和过氧化氢,维持细胞膜结构和功能完整[21]。高春生等[22]研究发现Cu2+浓度较低时黄河鲤(Cyprinuscarpio)肝脏SOD、GPx活性和T-AOC随胁迫时间增加酶活性先上升后下降,Cu2+浓度较高时则表现明显的抑制作用。潘鲁青等[23]研究发现短时间的金属离子刺激可使中华绒螯蟹(Eriocheirsinensis)肝胰脏SOD和CAT活性升高,而较长时间的刺激则会导致酶活性受到抑制。本试验结果显示:在受到Cu2+胁迫后淡水石首鱼幼鱼SOD、GSH、GPx活性和T-AOC均显著上升,在4 h时达到最大值,这是因为机体在受到Cu2+胁迫后分泌大量抗氧化酶来清除过多的ROS。96 h时SOD和GSH活性表现为显著的抑制作用,这是因为随胁迫时间延长,ROS不断消耗产生的抗氧化酶,且ROS产生速度非常快,未及时清除的自由基会对肝脏细胞产生不可逆的伤害,导致酶活性下降[24]。CAT活性显著升高后恢复,且应激响应速度较其他抗氧化酶滞后,可能与不同酶在应急防御体系中承担的功能不同有关[25]。研究表明SOD是机体防御自由基侵害的第一道防线[26],也是受到Cu2+胁迫最敏感的抗氧化酶[27]。本研究结果显示SOD活性相较于其他抗氧化酶受Cu2+抑制最严重,因此可作为早期Cu2+污染的首选指示目标。
鱼类在受到刺激后,头肾细胞会在下丘脑-垂体-肾上腺轴(HPI)分泌的促肾上腺皮质激素作用下分泌产生皮质醇激素,皮质醇常被作为衡量鱼类应激程度的指标。研究发现,应激反应会导致翘嘴鲌(Culteralburnus)[28]和斑点叉尾洄(Ictaluruspunctatus)[29]体内皮质醇含量快速增加,且受到的刺激越大皮质醇含量越高[30]。本试验中,Cu2+胁迫4 h 皮质醇含量会显著升高,然后慢慢下降,说明鱼体刚接触Cu2+环境时受到刺激较大,分泌大量皮质醇。但随时间延长皮质醇含量下降,推测可能是鱼体内铜耐受策略起作用,促进了体内皮质醇的清除[31-32]。
MDA是机体细胞受到攻击时,由生物大分子和膜脂质过氧化产生,MDA含量高低可以反映细胞受损伤程度[33-34]。Cd暴露会对草鱼(Ctenopharyngodonidellus)肝脏产生脂质过氧化作用,导致MDA含量上升[35]。ALT和AST是广泛存在于肝组织细胞内的氨基转移酶,在机体蛋白质代谢中起着重要作用,当肝细胞受到损伤时,会导致ALT和AST活性升高,ALT和AST也被认为是肝功能受损的检测指标[36]。Üner等[37]研究发现有毒物质对机体产生损伤时,会导致ALT活性突然持续性增强。王少博等[16]研究发现镉中毒早期草鱼肝脏ALT活性显著上升。王丙莲等[38]研究发现低浓度Cd2+会引起泥鳅(Misgurnusanguillicaudatus)肝胰脏ALT和AST活性升高。本试验中,MDA含量和ALT、AST活性随胁迫时间增加显著升高,MDA含量从胁迫4 h开始显著高于对照组,ALT和AST活性从12 h开始显著高于对照组。这说明Cu2+胁迫初期,即对淡水石首鱼幼鱼肝脏造成损伤,且随胁迫时间增加损伤不断加重,最终可能造成肝功能损伤。
3.3 Cu2+胁迫对淡水石首鱼幼鱼鳃Na+-K+-ATP活性的影响
Na+-K+-ATP在生物体能量转换、物质运输和信息传递方面具有重要作用。研究表明水体中的铜短时间内(7 d)在鱼鳃中的累积量大于肝脏和肾脏,鳃组织也最先受到Cu2+的毒性作用[39]。高春生等[39]研究发现,Cu2+浓度较低时(0.01~0.05 mg·L-1)对黄河鲤鳃Na+-K+-ATP活性具有促进作用,Cu2+浓度较高时(>0.1 mg·L-1)表现为抑制作用,且随处理时间延长抑制作用增强。苗晶晶等[40]研究发现Cu2+胁迫对褐牙鲆(Paralichthysolivaceus)鳃丝Na+-K+-ATP酶有显著的剂量和时间效应,Na+-K+-ATP酶活性随胁迫时间增加显著上升后又逐渐趋于稳定。本试验结果显示:在0.197 mg·L-1Cu2+胁迫下,淡水石首鱼幼鱼鳃组织中Na+-K+-ATP活性在4 h显著上升,然后显著下降并逐渐趋于稳定。这可能是因为鱼体暴露在Cu2+水体中,会导致体内Na+和Ca2+短暂流失,鱼体立即开启应激响应即增强Na+-K+-ATP酶活性来维持体内离子平衡,随着进入体内的重金属增多,金属离子与膜上蛋白质结合位点结合,引起蛋白质构象发生变化,导致酶活性显著下降。鱼类去毒生理反应即鱼鳃黏液分泌量增加,改变鱼鳃微环境中金属离子的分布或提高能络合金属离子的金属硫蛋白浓度等方法使Na+-K+-ATP酶活性逐渐趋于稳定[40]。本试验结果与高春生等[39]研究结果不同,可能与鱼种类和Cu2+浓度及胁迫时间有关。
3.4 Cu2+胁迫对淡水石首鱼幼鱼肠道酶活性的影响
消化酶活性是判断鱼类消化生理的主要指标,α-淀粉酶、胃蛋白酶和脂肪酶分别负责消化道中淀粉、蛋白质和脂肪的消化与代谢。研究发现金属离子可以与底物和酶产生极强的亲和力,从而改变酶活性[41]。重金属Cu2+诱导酶活性增加可能是因为Cu2+与调节操控基因的阻遏蛋白形成复合物导致阻遏作用失效,酶合成增加;而Cu2+对酶活性的抑制作用可能是因为Cu2+与机体产生的金属硫蛋白结合而解毒,金属硫蛋白饱和后多余的Cu2+与消化酶活性中心的半胱氨酸残基的巯基结合或者与酶的非活性中心部分结合,改变蛋白质结构,从而导致蛋白质失活抑制了酶活性[42]。陈肖肖等[43]研究发现低浓度Cu2+对泥蚶(Tegillarcagranosa)淀粉酶活性起到先激活后抑制作用;高浓度Cu2+对脂肪酶活性起到先激活后抑制作用;Cu2+对胃蛋白酶起到先激活后抑制作用。王海英等[44]研究发现Cu2+对大菱鲆(Scophthalmusmaximus)肠道蛋白酶有抑制作用。章龙珍等[42]对中华鲟(Acipensersinensis)幼鱼研究发现,Cu2+对消化道中的淀粉酶和蛋白酶有抑制作用,而对脂肪酶具有激活作用。Jiang等[45]研究发现Cu2+对鲫鱼(Carassiuscarassius)肠道中蛋白酶和淀粉酶均有抑制作用。综上研究表明:当水体Cu2+达到一定浓度时,对水生动物消化酶存在一定的激活或抑制作用,不同种类消化酶的作用效果并不完全一致。本试验结果显示,淡水石首鱼幼鱼在受到0.197 mg·L-1Cu2+胁迫时,α-淀粉酶、脂肪酶和胃蛋白酶均显著上升后又显著下降。这说明短时间(<4 h)的Cu2+胁迫对α-淀粉酶、胃蛋白酶和脂肪酶活性均起到激活作用,加快淡水石首鱼幼鱼对淀粉、蛋白质和脂肪的消化,而长时间(≥24 h)胁迫则会抑制α-淀粉酶和胃蛋白酶活性,影响淀粉和蛋白质的消化,但不会抑制脂肪酶活性。
