鹅膏毒肽中毒动物模型建立的研究进展
2023-10-16张慧洁杨根梦王浩伟曾晓锋李桢
张慧洁杨根梦王浩伟曾晓锋李桢
(国家卫健委毒品依赖和戒治重点实验室/昆明医科大学法医学院法医系,昆明 650500)
我国毒蘑菇种类丰富,国内中毒事件频发,中国疾病预防控制中心发布的数据显示,在2010 ~2020 年期间共报告10036 起蘑菇中毒事件,导致788 人死亡[1]。 云南、湖南、四川等地发生率最高,多集中在5 ~10 月[1]。 灰花纹鹅膏、致命鹅膏、鳞柄白鹅膏及淡红鹅膏等蘑菇为剧毒。 目前,分离出的毒素主要为鹅膏毒肽、鬼笔毒肽及毒伞肽3 类,而鹅膏毒肽则是致人死亡的最主要有毒物质[2]。
1 鹅膏毒肽
鹅膏菌(Amanita)属于担子菌门中的一种真菌,多由菌盖、菌褶、菌柄、菌环及菌托5 部分组成,但存在形态差异[3]。 有毒鹅膏菌各部位所含鹅膏毒肽含量有所差别,菌盖及菌褶处含量相对较高。 不同发育时期的鹅膏菌所含鹅膏毒肽含量也有不同,早期发育阶段含量相对较高[4]。 鹅膏毒肽不仅存在于鹅膏菌属部分蘑菇内,也存在于盔孢菌属、环柄菇属及丝盖伞属等部分的蘑菇中[2]。 根据侧链取代基不同,鹅膏毒肽可以分为α-鹅膏毒肽、β-鹅膏毒肽、γ-鹅膏毒肽、ε-鹅膏毒肽、鹅膏酸、鹅膏酰胺、鹅膏蕈、鹅膏蕈酸和普罗马琳等[5]。 目前,研究多集中在α-鹅膏毒肽、β-鹅膏毒肽上。 鹅膏毒肽为双环八肽,分子量约为900 Da,其化学性质稳定,耐高温、耐酸碱等的特点使得在加热烹饪后仍具毒性,仅0.1 mg/kg 剂量可致人死亡。 新鲜蘑菇组织中鹅膏毒肽含量较高时,食用少于50 g 足以导致中毒死亡[6]。 鹅膏毒肽是一类迟发性毒素,中毒后早期无明显症状,待出现症状后已经造成人体损伤,部分患者经治疗后症状会有所缓解,往往会被误以为处于恢复期,然而随着中毒时间的延长,患者则会出现肝功能衰竭,更甚者出现多器官衰竭[7-8]。 由于鹅膏毒肽特殊毒理特性,可以特异性抑制RNA 聚合酶Ⅱ,其被用于生物转录相关研究中。 此外,鹅膏毒肽在抗肿瘤、抗病毒领域也发挥重要作用[9]。
2 鹅膏毒肽中毒的评估
临床上,经过潜伏期后,患者会出现恶心、呕吐、腹痛等胃肠炎症状,严重者可出现脱水,甚至休克。 随着中毒时间的延长,经实验室检查可以发现, 血清中丙氨酸氨基转移酶 ( alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、胆红素等会升高。中毒晚期,患者可能出现多器官衰竭,甚至死亡[2,7-8]。 其他动物的生理结构与人类存在一定差异。 因此,在建立动物模型时,需结合动物本身的特点,对动物进行中毒评估。
2.1 一般观察指标
建立鹅膏毒肽动物模型后,密切观察实验动物的存活情况。 由于鹅膏毒肽毒性特点,研究发现,鹅膏毒肽中毒后,实验动物中毒早期可能会出现警惕性下降、嗜睡、活动减少、摄食减少、体重下降等改变;中毒加深后可能会出现呼吸困难、抽搐,甚至死亡[10]。 根据实验需要可建立实验动物观察标准,如观察实验动物运动姿势、整理毛发等外观改变;体重、心率、呼吸、精神状态等临床指标,依据观察标准进行评分[11]。 对于中毒治疗模型,可记录实验动物的脏器系数,实验动物某器官的重量与其自身体重的比值可以反应器官损害程度,也可作为药物减轻鹅膏毒肽对器官损害的指标[12]。
2.2 设备辅助观察与检测
取出的动物器官进行甲醛固定、脱水、切片、染色、封片、病理学观察等,镜下较为直观地观察组织细胞的改变,如肝细胞坏死、炎性细胞浸润等改变。此外,有实验室检查结果也可反应鹅膏毒肽对组织器官的损伤程度。 血液进行血生化检测,检测肝功能,如ALT、AST、胆红素等指标。 还可通过检测仪器,如液相色谱-质谱联用(liquid chromatographymass spectrometry,LC-MS),检测血液、尿液、胆汁、组织器官等中的鹅膏毒肽的浓度[13-14],反应鹅膏毒肽在体内的代谢与分布情况。
3 建立鹅膏毒肽中毒的动物模型
3.1 建立鹅膏毒肽中毒的毒理学模型
鹅膏毒肽进入机体后,肝细胞膜上相关转运受体可将其转入肝细胞内。 鹅膏毒肽可特异性抑制真核细胞RNA 聚合酶Ⅱ,从而导致肝细胞mRNA转录及蛋白质合成障碍。 此外,鹅膏毒肽还导致肝组织发生氧化应激,活性氧(reactive oxygen species,ROS)产生增多,氧化/抗氧化系统失衡引起肝组织损伤。 鹅膏毒肽通过线粒体途径诱导肝细胞凋亡外,还可以通过TNF-α 途径介导凋亡[2]。 鹅膏毒肽可诱导肝细胞自噬,但自噬与凋亡之间的相互作用关系,尚不明确[15-17]。
Lu 等[18]建立鹅膏毒肽中毒模型,选用Oatp1b2敲除成年雄性小鼠,腹腔注射1 mg/kg α-鹅膏毒肽,16 h 后在戊巴比妥麻醉下收集血样及肝组织样本。选用与实验组年龄相匹配的雄性C57BL/6 和129Sv小鼠作为野生型对照,验证Oatp1b2 受体转运α-鹅膏毒肽的功能。 Dündar 等[13]选用28 ~40 g 的雄性BALB/c 小鼠,分别腹腔注射0.2、0.6、1.0 mg/kg α-鹅膏毒肽,48 h 后取血安乐死小鼠。 通过检测氧化应激等指标,说明氧化应激在α-鹅膏毒肽诱导肝毒性中的重要作用。 而Chen 等[10]选用7 周18 ~22 g 雄性BALB/c 小鼠,采用0.23、0.28、0.35、0.43、0.53 mg/kg 等比剂量给小鼠腹腔注射α-鹅膏毒肽。 根据其浓度对小鼠的作用,再选择0、0.23、0.35 mg/kg 的α-鹅膏毒肽腹腔注射小鼠,于4、8、12、24、48、72 h 各时间点进行眶后静脉丛采血和取肝组织,用于肝功能检测及对肝组织进行病理检查。 进一步实验证实α-鹅膏毒肽通过氧化应激相关凋亡途径造成肝损伤。 Zhao 等[19]同样选用雄性BALB/c 小鼠进行建模,但采用尾静脉注射方式注射α-鹅膏毒肽。 将小鼠随机分组成0.25、0.30、0.35、0.40、0.45、0.50 mg/kg 剂量组,静脉注射α-鹅膏毒肽后观察小鼠存活,从而得出半数致死量(lethal dose 50%,LD50)0.327 mg/kg。 根据LD50再次尾静脉注射α-鹅膏毒肽,并于0、24、36、48、60 h 各时间点进行左、右眶静脉采血并取内脏器官。 通过计算脏器指数反应器官的损伤程度。Wu 等[20]根据相关研究选择0.33 mg/kg 及0.66 mg/kg 剂量,采用腹腔注射方式注射α-鹅膏毒肽,但选用2 月龄左右ICR 小鼠建立动物模型,研究α-鹅膏毒肽中毒的量效关系。 综上,毒理动物模型多选用小鼠建立,注射方式多选择腹腔注射,便于操作。 灌胃方式可较好模拟人食用有毒蘑菇,但操作具有一定难度。 α-鹅膏毒肽的剂量选择上存在差异,因此,实验前需确定中毒量效关系,验证后选择合适的实验剂量与时间。 根据实验将实验动物、注射方式、毒物类型及剂量选择汇总成下表1。
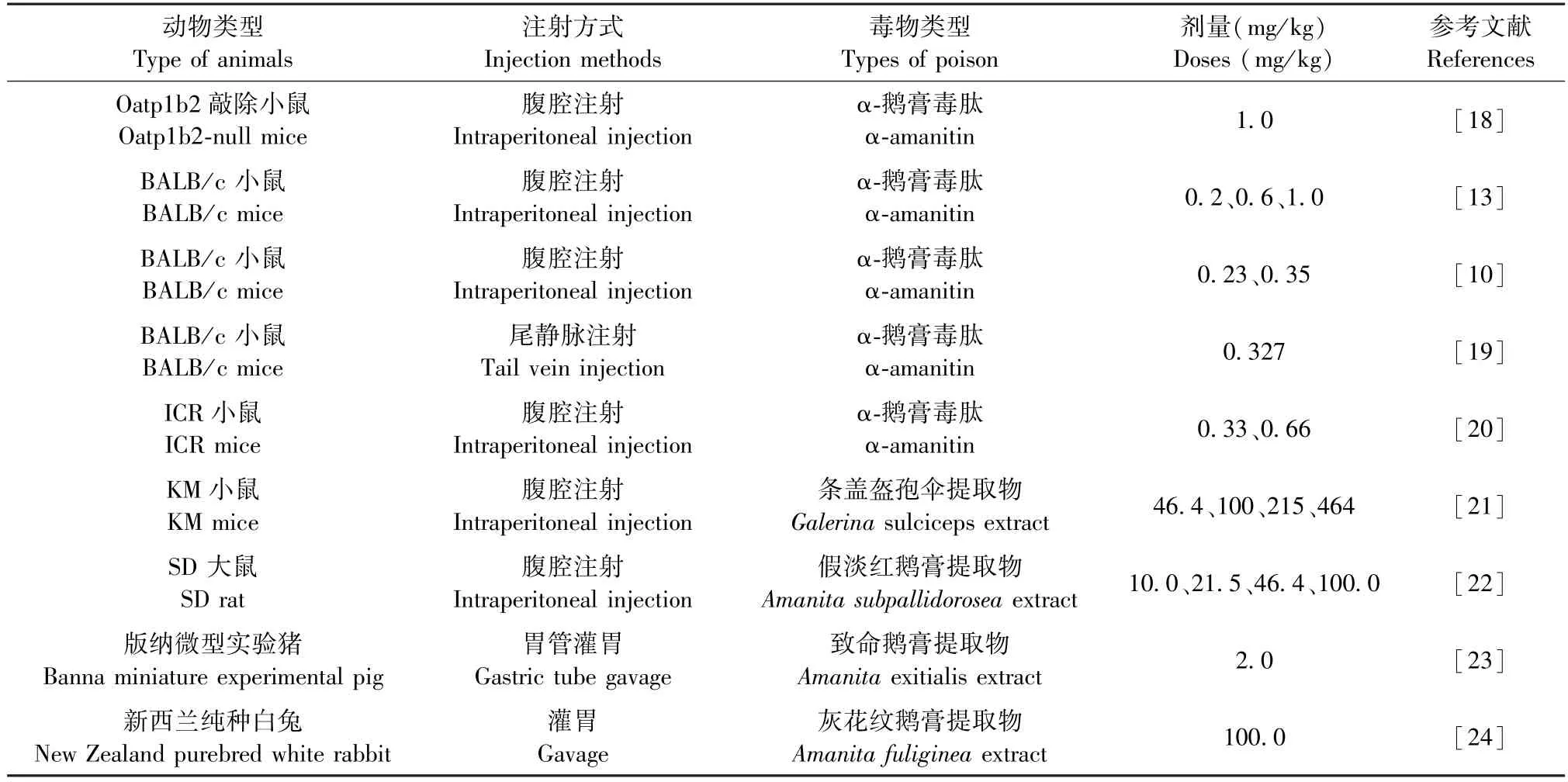
表1 实验动物、注射方式、药物及剂量汇总Table 1 Summary of experimental animals, injection methods, types of poison and doses
3.2 建立鹅膏毒肽中毒的毒代动力学模型
鹅膏毒肽化学性质稳定,经消化道消化后仍可保持活性,吸收入血,经门静脉进入肝,随之进行血液循环。 鹅膏毒肽在血液中蛋白结合率极低,同时较快被清除,经尿液排出体外[25]。 超过48 h 后不易从血液中检测,而3 d 后仍可从尿液中检测出鹅膏毒肽,在体内不经转化以原形排出。 部分鹅膏毒肽随胆汁排泄后经肠道吸收再次入血,形成肝肠循环。 鹅膏毒肽不经母乳排出,也不能通过胎盘屏障[2,26-27]。
Li 等[28]用大鼠建立动物模型,选用6 ~8 周185 ~215 g SD 大鼠,腹腔注射0.5 mg/kg α-鹅膏毒肽。 通过眶静脉采血的方式收集5、10、20、30、45、75、135、195 min 的血液至抗凝管内,离心后检测血清中α-鹅膏毒肽。 注射200 min 后,血清中检测不出α-鹅膏毒肽。 Mao 等[29]选择SD 大鼠建立动物模型时,采用静脉注射的方式注射亚急性毒性剂量0.1 mg/kg α-鹅膏毒肽。 并于0、3、8、15、30、45、60、90、120、240、360、480 min 收集血液至抗凝管。离心后检测血清中α-鹅膏毒肽,结果显示α-鹅膏毒肽在注射120 min 内,从血液中被迅速清除。 SD 大鼠可以进行多次采血,因此,实验中所需动物数量较少,仅为3 ~6 只,这样模型多用于建立检测方法,并且用于α-鹅膏毒肽毒代动力学研究。 Sun等[30]选用8 ~10 月龄9 ~11 kg 的雄性比格犬建立动物模型。 提前处理致命鹅膏菌粉末并鉴定粉末中肽类毒素含量,喂食比格犬20 mg/kg 及60 mg/kg 粉末胶囊。 经头静脉收集0、0.25、0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0、8.0、10.0、12.0、14.0、24.0、36.0、48.0 h 血液。 收集每天尿液,连续5 d,分析血浆及尿液中各肽类毒素。 为了验证胆汁引流对致命鹅膏的毒性影响,Sun 等[14]给比格犬静脉注射戊巴比妥钠(3%,1 mL/kg),在麻醉后实施胆道引流手术。 术后第8 天,20 mg/kg 及60 mg/kg 组喂食致命鹅膏粉末胶囊,而对照组和胆汁引流组喂食空胶囊。 根据实验需要收集血液、胆汁、尿液等样本,并检测样本中α-鹅膏毒肽的浓度。 该模型选择的药物可以很好反应鹅膏菌对于机体的毒性作用,由于粉末胶囊中含有多种鹅膏毒肽,不利于单一鹅膏毒肽的研究。 在研究多种鹅膏毒肽相互作用时可以考虑选择这种药物效应方案。 Thiel 等[31]验证鹅膏毒肽肝肠循环时,选用雌性德国长白猪建立动物模型,经门静脉注射0.15 mg/kg 及0.35 mg/kg α-鹅膏毒肽。 所有实验猪在麻醉下观察3 d,并收集实验所需血液、胆汁及尿液等样本。 该动物模型使用较长时间的麻醉剂维持麻醉,值得注意的是麻醉剂可能会对实验结果造成影响[32]。 选用体格较大的动物进行建模,需消耗大量的药物。 其次,实验实施难度较大,对于实验设备及环境要求高。Bang 等[33]研究β-鹅膏毒肽毒代动力学选用雄性8周龄ICR 小鼠,体重25.1 ~29.7 g,采用尾静脉注射和灌胃2 种方式使不同浓度的β-鹅膏毒肽作用于小鼠体内。 研究发现,灌胃组相较于尾静脉注射组,其血浆中β-鹅膏毒肽半衰期较长。 此外,48 h内,尾静脉注射组尿液清除率高于粪便清除率,而灌胃组与之相反。 研究还发现,2 种不同注入方式会对β-鹅膏毒肽组织分布造成影响,灌胃组肠、胃组织的分布较高,静脉注射组肠、胃的分布则较低,但两组中肾组织均存在较高分布。 根据实验内容不同将Bang 等[33]实验设计汇总成表2。
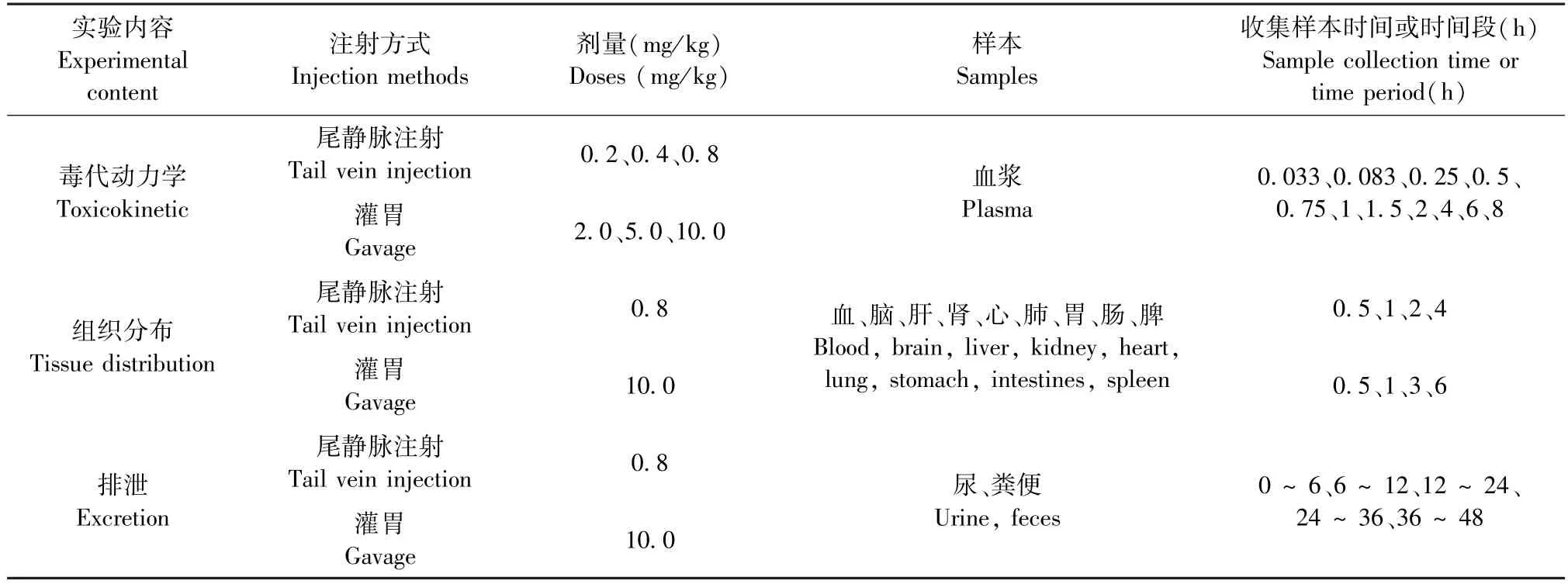
表2 实验内容、注射方式、剂量、样本等汇总Table 2 Summary of experimental content, injection methods, doses, samples et al
3.3 建立鹅膏毒肽中毒的药物治疗模型
目前,临床仍无有效药物可以完全治愈鹅膏毒肽中毒,但早期及时清除消化道及血液中的鹅膏毒肽具有一定意义。 鹅膏毒肽中毒后早期无明显的症状,易造成诊断治疗的延误。 除了维持体液平衡及纠正凝血障碍等支持治疗,及时使用药物进行干预可以降低鹅膏毒肽中毒的病死率。 水飞蓟提取物水飞蓟宾(silibinin,SIL)、青霉素G 等药物可以阻止鹅膏毒肽的转运。 N-乙酰半胱氨酸( N-acetylcysteine,NAC)具有抗氧化的作用,可以降低鹅膏毒肽诱导肝细胞氧化应激造成的损伤[2,7-8,34-35]。
Garcia 等[36]构建鹅膏毒肽中毒治疗模型,选用20 ~30 g 雄性CD-1 小鼠,腹腔注射0.45 mg/kg 的α-鹅膏毒肽,在注射α-鹅膏毒肽之后,每4 h 注射1 次生理盐水,直至12 h,建立中毒模型组。 选用环孢霉素A(cyclosporine A,CsA)作为治疗药物。 在注射0.45 mg/kg 剂量的α-鹅膏毒肽后,再腹腔注射10 mg/kg 剂量的环孢菌素A,每4 h 注射1 次,直至12 h,构建中毒治疗模型。 此外,Garcia 等[11]选择多粘菌素B(polymyxin B,poly B)联合甲基强的松(methylprednisolone,MP)治疗鹅膏毒肽中毒。 腹腔注射α-鹅膏毒肽的剂量则是0.33 mg/kg,药物干预时间保持一致,仍为4 h,但甲基强的松龙干预的次数仅为1 次。 注射鹅膏毒肽4 h 后,腹腔注射10 mg/kg甲基强的松龙,之后每隔4 h 注射生理盐水,直至12 h。 联合治疗时,4 h 后与2.5 mg/kg 多粘菌素B 同时注射,此后于8、12 h 注射2.5 mg/kg 多粘菌素B。黄艳娟等[12]用灵孢多糖作为α-鹅膏毒肽中毒治疗药物,旨在探究其是否对中毒小鼠的肝肾具有保护作用。 用KM 小鼠,腹腔注射0.35 mg/kg 剂量α-鹅膏毒肽,4 h 后注射生理盐水,每日1 次,连续3 d,建立小鼠中毒模型。 治疗组则是注射相同剂量α-鹅膏毒肽,4 h 后,腹腔注射不同剂量的灵孢多糖,每日1 次,治疗3 d。 吴鑫等[37]用KM 小鼠建模,腹腔注射α-鹅膏毒肽的剂量则是0.60 mg/kg。 水飞蓟宾是较为有效的治疗鹅膏毒肽中毒的药物,故选其作为对照,剂量为20 mg/(kg·d)。 注射0.6 mg/kg α-鹅膏毒肽5 h 后,第1 次腹腔注射水飞蓟宾,之后每隔6 h 注射1 次,每日4 次,至48 h。 灵芝总三萜作为实验治疗药物,其采用灌胃方式进行干预,剂量为50、100、200 mg/(kg·d),干预时间及次数与水飞蓟宾一致。 刘德明等[38]给KM 小鼠腹腔注射0.10、0.20、0.35、0.70、1.32、2.50 mg/kg 剂量α-鹅膏毒肽,根据小鼠存活情况计算出α-鹅膏毒肽的LD50(0.36 mg/kg)。 注射LD50 剂量的α-鹅膏毒肽10 min 后,尾静脉注射100 mg/kg 水飞蓟宾,进行治疗,治疗36 h。 将中毒治疗动物模型汇总为表3。
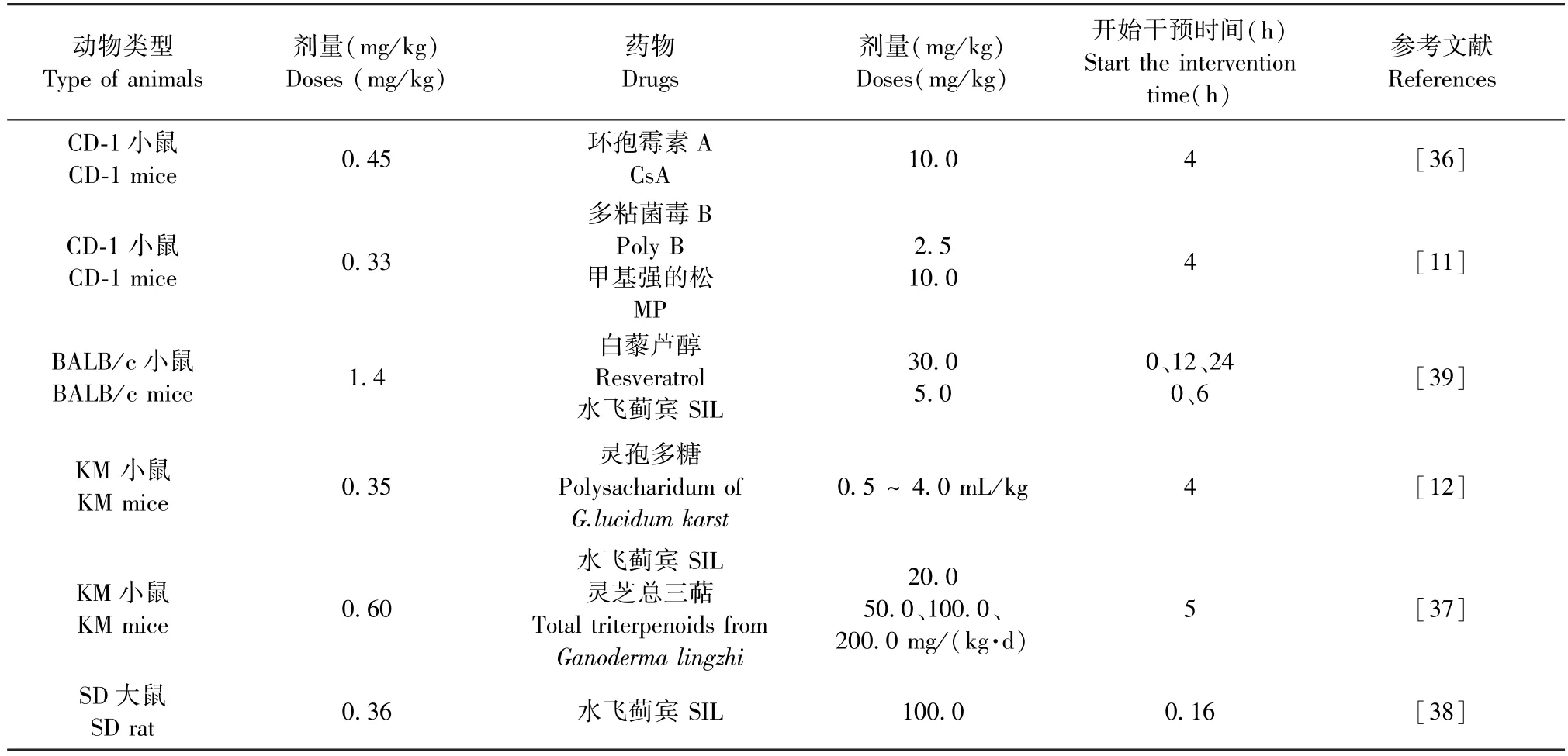
表3 α-鹅膏毒肽中毒药物治疗模型汇总Table 3 Summary of α-amanitin poisoning drug treatment models
4 小结
误食有毒鹅膏菌会对人体造成严重的损害,目前对于鹅膏毒肽中毒治疗,仍无特效药可以治愈鹅膏毒肽中毒。 迫切需要理想鹅膏毒肽中毒的动物模型,用于毒理机制、毒代动力学及中毒治疗的研究。 由于不同动物对鹅膏毒肽的耐受不一,理想的鹅膏毒肽中毒动物模型,应尽可能模拟人误食鹅膏菌后临床表现、病理生理变化、代谢分布及临床转归等特点。 从以上建立的动物模型不难看出,相同动物注射的剂量也存在一定差异;相同治疗药物也存在治疗方法及剂量不同。 总之,鹅膏毒肽中毒动物模型仍需优化和提升,对于揭示鹅膏毒肽毒理机制和药物治疗等具有重要意义。 有毒蘑菇的危害知识还需加强普及和宣传,从“口”防起;其次,对临床鹅膏毒肽中毒病例也需进一步研究,有助于鹅膏毒肽中毒的防治。 鹅膏毒肽对人体可造成严重损伤,但其本身仍具极高的应用价值。 加强对鹅膏毒肽的开发与利用,使其在生物研究、肿瘤治疗等领域发挥重要的作用。
