蛋氨酸二肽对Transwell小室培养的奶牛乳腺上皮细胞中乳蛋白合成的影响
2023-10-16祁业辉杜心怡刘桂芹王长法周苗苗
祁业辉 黄 飞 杜心怡 刘桂芹 王长法 周苗苗
(聊城大学农学与农业工程学院,聊城 252000)
乳腺以血液中的氨基酸为前体物质来合成乳蛋白。然而,乳腺对一些必需氨基酸的摄取量低于乳中的排出量,乳腺摄取的游离氨基酸并不能完全满足乳蛋白合成的需要[1]。为了弥补游离氨基酸的不足,乳腺必须摄取肽结合形式的氨基酸。反刍动物乳蛋白的合成过程中,多肽及小肽的作用已引起重视。研究表明,奶牛乳腺可以摄取血液中的肽结合氨基酸,乳腺酪蛋白合成所需蛋氨酸(Met)的8%~18%来源于血液中的小肽[1-2]。奶牛饲养试验发现,饲粮中添加小肽可显著增加奶牛乳汁中乳蛋白含量[3-4]。奶牛乳腺上皮细胞(bovine mammary gland epithelial cells,BMECs)体外培养研究发现,许多必需氨基酸组成的小肽均显著提高了BMECs中酪蛋白基因表达或培养液中酪蛋白浓度[5-9]。已有研究证实BMECs中有小肽转运载体2(oligopeptide transporter 2,PepT2)蛋白的表达,小肽转运载体在乳腺小肽吸收利用过程中发挥重要作用[10-11]。然而,乳腺上皮细胞属于极性细胞,其物质的吸收和乳汁的分泌具有方向性,即:从基底膜侧(血液)摄取营养底物,而从顶膜侧(腺泡)分泌乳汁颗粒。目前,相关研究所用BMECs的培养方式均为贴壁培养[5-9],不能保证细胞的极性状态,破坏了物质吸收和乳汁分泌的方向性,不能完全代表奶牛乳腺的正常生理状态。小肽转运载体是否在乳腺从血液(基底膜侧)摄取小肽过程中发挥作用需要进一步的研究。
Transwell小室,即穿透小室,可用于生物屏障的建立、细胞共培养、细胞趋化、细胞迁移和细胞侵袭等多方面的研究[12-13]。Transwell小室可放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上、下层培养液以聚碳酸酯膜相隔。细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。Lin等[14]利用Transwell小室培养的Caco-2细胞层研究了具有降压功能的大豆蛋白源三肽[亮氨酸-丝氨酸-色氨酸(Leu-Ser-Trp,LSW)]的转运机理,结果显示,LSW从顶膜侧到基底膜侧的转运明显高于相反方向,且完整LSW主要通过细胞旁路和小肽转运载体1(oligopeptide transporter 1,PepT1)介导的主动转运进行跨膜转运。Lacroix等[15]以Transwell小室培养的Caco-2细胞层为模型,研究了5种乳源肽的转运形式和生物活性,结果发现绝大部分乳源肽在跨膜转运过程中被肽酶水解而丧失生物活性。细胞培养结合Transwell小室被广泛应用于营养物质或药物转运研究。因此,本试验将BMECs结合Transwell小室进行极化培养,研究BMECs对Transwell上室和下室培养液中蛋氨酸二肽(Met-Met)的摄取和利用机制。
1 材料与方法
1.1 试验设计
将BMECs培养在Transwell小室(Corning,美国)中,待培养的BMECs形成细胞层后,以不添加Met-Met作为对照,分别在上室和下室培养液中添加0.5 mmol/L的Met-Met进行试验。继续培养24 h后,收集BMECs,采用Western blot检测β-酪蛋白(β-casein)、PepT2蛋白的相对表达量以及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、核糖体蛋白S6激酶1(ribosomal protein S6 kinase 1,S6K1)和蛋白激酶B(protein kinase B,AKT)的磷酸化水平。每个试验重复3次。
1.2 BMECs的Transwell小室培养
选取3头泌乳中后期的中国荷斯坦奶牛,于屠宰场宰杀后取乳腺腺泡组织,清洗并剪碎至1 mm3大小。参照Zhou等[6]的方法分离纯化BMECs。调整BMECs浓度为1×105个/mL后,将细胞接种在12孔Tranwell小室中,分别在上室和下室中添加0.5和1.5 mL含有10%胎牛血清的DMEM(Dulbecco’s modified Eagle’s medium)-F12培养液(Gibco,美国)(添加1%谷氨酰胺、100 IU/mL青霉素、100 μg/mL链霉素、5 μg/mL胰岛素、1 μg/mL氢化可的松)。然后将细胞置于37 ℃二氧化碳培养箱进行培养,每2 d换1次培养液。待Transwell小室中培养的BMECs形成细胞层后进行后续试验。
1.3 细胞层跨膜电阻(trans-epithelial electrical resistance,TEER)测定
通过测定细胞层TEER来检测BMECs细胞层的紧密性。TEER用电阻仪(WPI EVOM,美国)测定,在使用前,其2个电极先用75%酒精浸泡5 min消毒,再用D-Hanks冲洗电极,洗去酒精。从细胞接种到Transwell滤网上第1天开始,以未接种细胞的Transwell小室为空白对照,每天同一时间用电阻仪测3个孔的细胞层TEER并记录,连续测10 d。
细胞层TEER(Ω·cm2)=(TEER细胞-TEER对照)/
有效膜面积(1.12 cm2)。
1.4 Western blot
以磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,检测β-酪蛋白、PepT2蛋白以及mTOR1、S6k1和AKT蛋白及磷酸化蛋白的相对表达量。试验结束后,收集BMECs,弃去细胞培养液,用含有完全蛋白酶抑制剂的RIPA缓冲液裂解收集的细胞。然后将样品100 ℃煮沸10 min,16 000×g离心1 min,提取细胞中总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及Western blot操作。最后将膜在吸水纸上沥干,置于平板上,放入化学发光成像仪中,拍照记录并分析。试验所用抗体分别进行稀释后用于Western blot检测,稀释倍数见表1。
1.5 统计分析
本试验所有数据用GraphPad Prism 6的t检验进行分析,数据柱以平均值表示,误差线为标准差。当P<0.05时认为差异显著。
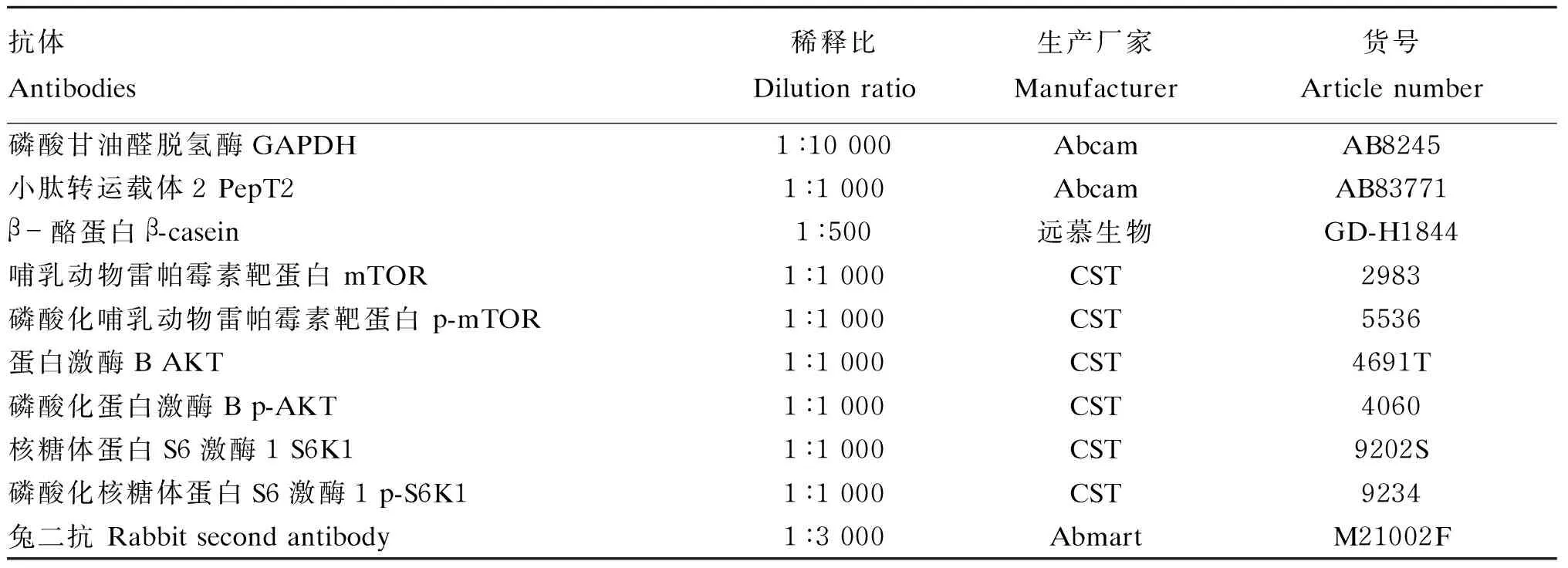
表1 Western blot所用抗体
2 结果与分析
2.1 Transwell小室培养的BMECs层TEER
经测定发现,BMECs接种于Transwell滤网约6 d时细胞层TEER达到平台期(图1),反映细胞层紧密性良好。
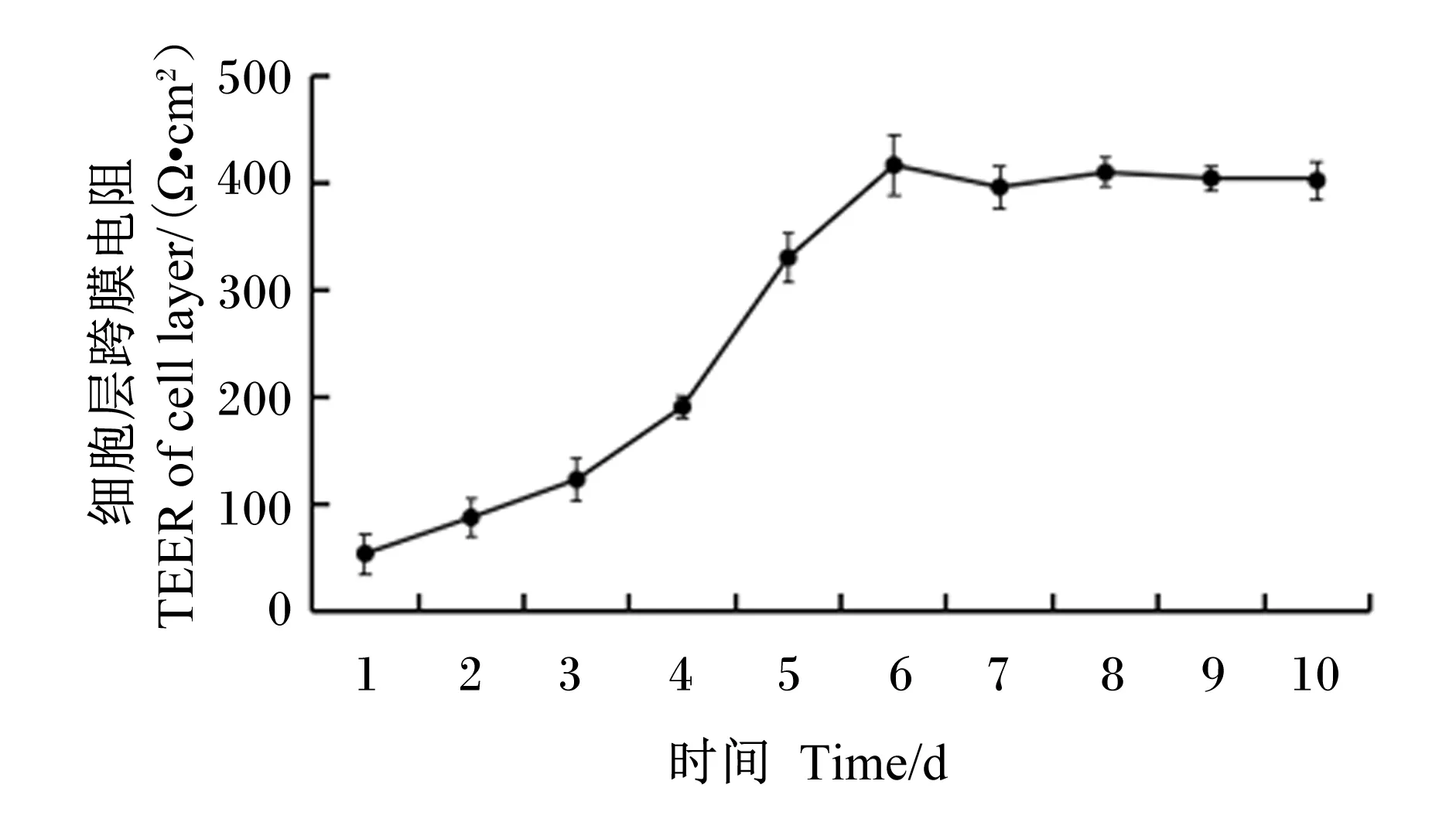
图1 奶牛乳腺上皮细胞层跨膜电阻
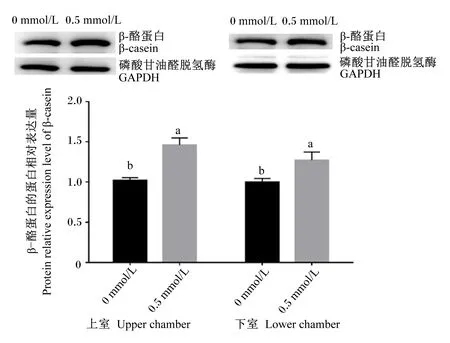
2.2 Met-Met对BMECs中β-酪蛋白蛋白表达的影响
结果显示,Transwell上室和下室培养液中添加0.5 mmol/L Met-Met均可显著增加BMECs中β-酪蛋白的蛋白相对表达量(P<0.05,图2)。
2.3 Met-Met对BMECs中PepT2蛋白表达的影响
结果显示,Transwell上室和下室培养液中添加0.5 mmol/L Met-Met均显著提高了BMECs中PepT2的蛋白相对表达量(P<0.05,图3)。
数据柱形标注不同小写字母表示差异显著(P<0.05)。图3、图4同。
2.4 Met-Met对BMECs中mTOR、S6K1和AKT磷酸化水平的影响
结果显示,Transwell下室培养液中添加0.5 mmol/L Met-Met显著提高了mTOR、S6K1和AKT的磷酸化水平(P<0.05,图4) 。
3 讨 论
乳蛋白的合成和分泌是一个复杂的生物过程,受到很多因素的影响[16]。其中,氨基酸和小肽作为乳蛋白合成的前体物质,是影响乳蛋白合成的主要因素[15]。众多研究表明小肽可以调控乳蛋白的合成[5,17]。但是BMECs上皮细胞摄取血液小肽的机制还不十分清楚。已有研究表明PepT2在BMECs小肽摄取过程中发挥重要作用[6,18]。然而,另有研究证实,PepT2在大鼠乳腺上皮细胞的顶膜侧表达,在从乳汁重吸收小肽类物质(乳蛋白水解物和肽结构类似药物)的过程中发挥作用[19-20]。所以,Met-Met等小肽对PepT2表达和乳蛋白合成的促进作用可能发生在乳腺上皮细胞顶膜侧。因为在BMECs贴壁培养模式下,添加培养液侧即为乳腺腺泡侧(顶膜侧),在培养液中添加Met-Met可使乳腺腺泡侧Met-Met浓度升高,从而增加了PepT2表达和乳蛋白合成。乳腺上皮细胞属于极性细胞,其物质的吸收和乳汁的分泌具有方向性,贴壁培养不能保证细胞的极性状态,破坏了物质吸收和乳汁分泌的方向性。小肽转运载体是否在乳腺从血液摄取小肽过程中发挥作用需要进一步的研究。
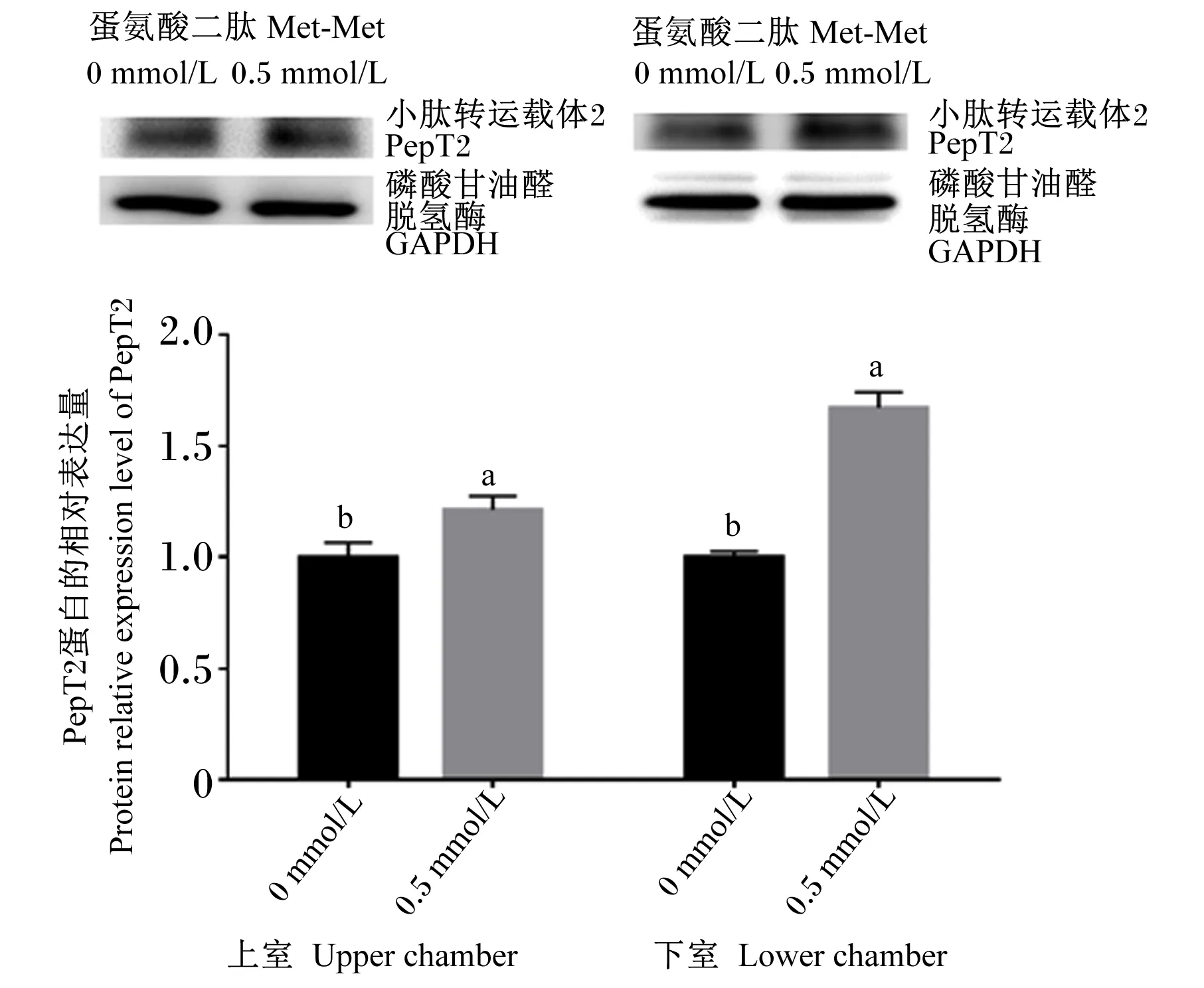
图3 Transwell上室和下室培养液中添加
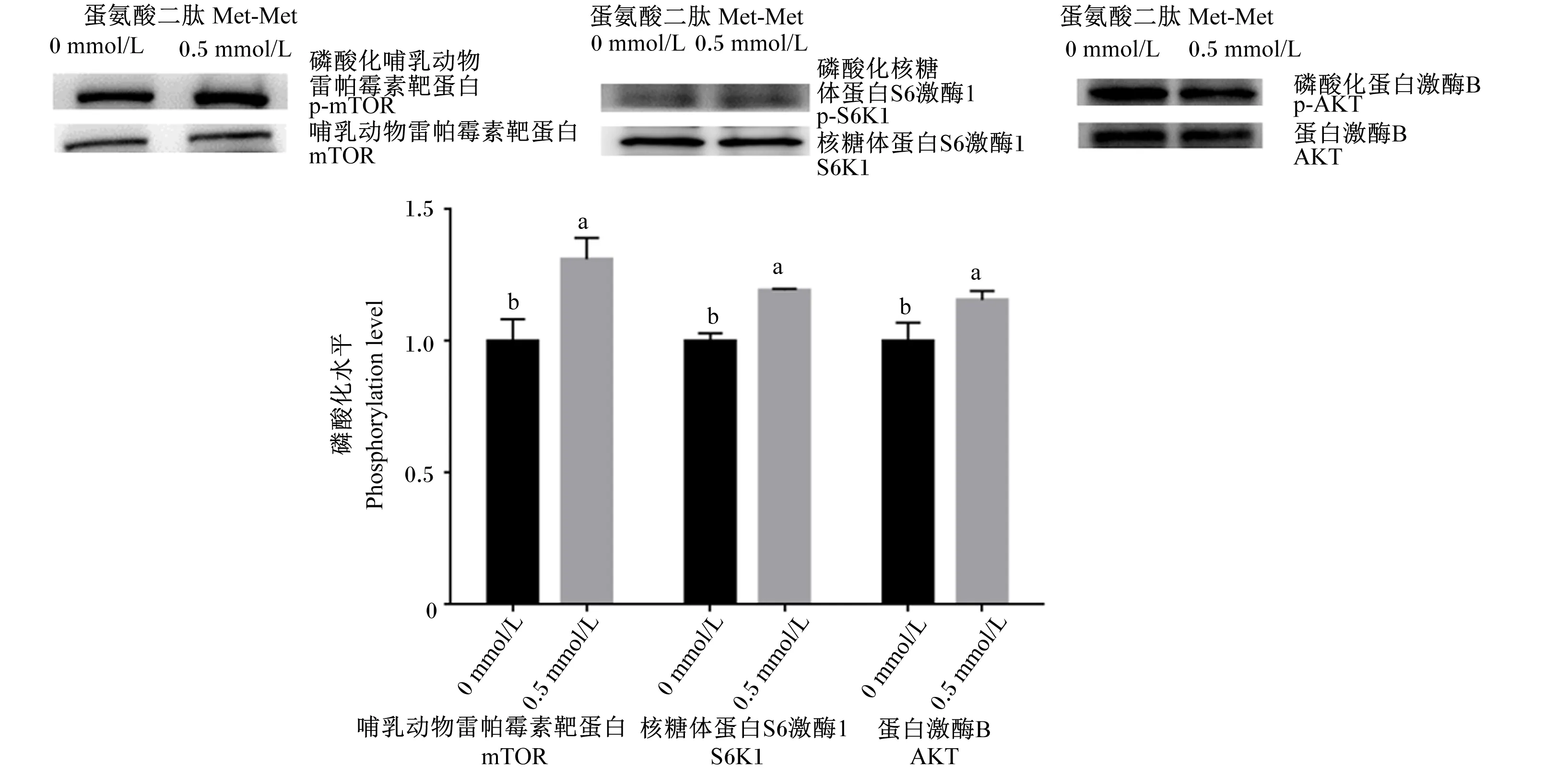
图4 Transwell下室培养液中添加Met-Met对mTOR、S6K1和AKT磷酸化的影响
鉴于此,本研究将BMECs在Transwell小室内进行培养,探讨BMECs对上室和下室培养液中Met-Met的摄取利用。采用BMECs结合Transwell小室进行极化培养,上室代表上皮细胞顶膜侧(腺泡腔),下室代表上皮细胞基底膜侧(血液),这种屏障模型能代表BMECs的正常生理状态,便于更准确地研究小肽在BMECs中的摄取机理。试验结果表明,BMECs接种于Transwell小室培养6 d后细胞层TEER达到平台期,说明成功建立了细胞屏障,可用于跨膜转运试验。进一步研究发现,Transwell上室和下室培养液中添加Met-Met均显著增加了β-酪蛋白和PepT2的蛋白相对表达量。以上结果提示Transwell上室和下室培养液中的Met-Met均可被BMECs吸收用于乳蛋白的合成,PepT2在BMECs顶膜侧和基底膜侧小肽的摄取过程中均发挥作用。Wang等[17]研究表明,PepT2蛋白在BMECs顶膜侧和底膜侧均有表达,其在奶牛乳腺小肽摄取过程中发挥重要作用。Shennan等[19-20]研究证实,PepT2蛋白在大鼠乳腺上皮细胞的顶膜侧表达,在从乳汁重吸收小肽类物质的过程中发挥作用。本试验结果同以上研究结果一致。
被BMECs吸收后,小肽不仅可以作为底物参与乳蛋白合成,还可以作为信号分子调控乳蛋白的合成[21]。mTOR是一种哺乳动物丝氨酸/苏氨酸激酶,它能感受来自营养素(氨基酸、小肽)等的信号来调控蛋白质合成和细胞生长[22]。S6K1是mTOR的直接靶元件。活化的S6K1促进mRNAs的5’端翻译增加,这些mRNAs转录一些蛋白质翻译相关的组分(核糖体蛋白、延长因子和PolyA结合蛋白),因而可以促进蛋白质的合成[23]。AKT是调控mTOR活性的一个关键的正调控因子[24]。本研究中,Transwell下室培养液中添加Met-Met显著增加了BMECs中mTOR、S6K1和AKT的磷酸化水平,结果提示Met-Met通过激活mTOR和AKT信号通路促进了乳蛋白的合成。Wang等[17]研究结果亦表明,Met-Met通过激活BMECs中信号转导和转录激活因子5(signal transducer and activator of transcription 5,STAT5)、Janus激酶2(Janus kinase 2,JAK2)、mTOR、4E-结合蛋白1(4E-binding protein 1,4EBP1)和S6K1等信号通路元件促进细胞增殖,提高了细胞活力和β-酪蛋白的合成;进一步研究表明,抑制JAK2和mTOR信号通路降低了Met-Met引起的BMECs活力增加和乳蛋白合成[17]。另有研究发现,Met-Met可以通过激活磷酸肌醇3-激酶(phosphatidylinositide 3-kinase,PI3K)-AKT信号通路促进乳腺发育(提高42%)和泌乳过程(增加84%)[25]。本试验结果同以上研究结果一致。
4 结 论
① BMECs接种于Transwell小室培养6 d后形成细胞层,建立细胞屏障。BMECs结合Transwell小室进行极化培养,上室代表腺泡腔,下室代表血液侧,比传统的贴壁培养更接近乳腺上皮细胞的生理状态,能保障乳腺上皮细胞物质吸收和乳汁分泌的方向性,便于更准确地研究小肽在BMECs中的摄取机理。
② Transwell下室和上室培养液中的Met-Met均可被BMECs吸收用于乳蛋白的合成,PepT2在Met-Met的摄取过程中均发挥作用,提示血液和腺泡腔中的小肽均可被乳腺上皮细胞PepT2吸收或重吸收并用于乳蛋白的合成。
③ Transwell下室培养液中的Met-Met通过激活mTOR和AKT信号通路促进乳蛋白的合成。
