不同时间高氧对大鼠肺泡Ⅱ型上皮细胞能量代谢的影响
2023-10-15黄蓉蓉瞿珊珊郭鸿陈苏衡杨传奇张俊妹李玉兰
黄蓉蓉 瞿珊珊 郭鸿 陈苏衡 杨传奇 张俊妹 李玉兰

摘要:目的 探討不同时间高浓度氧对肺泡Ⅱ型上皮细胞线粒体能量代谢的影响。方法 将大鼠RLE-6TN细胞分为对照组(21% O2常规培养4 h)、高氧1、2、3、4 h组(95% O2分别培养1、2、3、4 h)。采用荧光素酶化学发光法检测各组细胞的三磷酸腺苷(ATP)含量,采用微量法检测线粒体呼吸链复合体V活性,荧光探针JC-1检测细胞线粒体膜电位,实时荧光定量PCR法检测线粒体呼吸链复合体 Ⅰ、Ⅲ、Ⅳ、Ⅴ的核心亚基NADH脱氢酶亚基1(ND1)、细胞色素b(Cytb)、细胞色素C氧化酶亚基I(COXI)、ATP酶6(ATPase6)mRNA的表达水平。结果 与对照组比较,高氧1、2、3、4 h组细胞线粒体呼吸链复合体核心亚基ND1(q=24.800,P<0.001;q=13.650,P<0.001;q=9.869,P<0.001;q=20.700,P<0.001)、COXI(q=16.750,P<0.001;q=10.120,P<0.001;q=8.476,P<0.001;q=14.060,P<0.001)及ATPase6 mRNA(q=22.770,P<0.001;q=15.540,P<0.001;q=12.870,P<0.001;q=18.160,P<0.001)表达水平均显著降低;且高氧1、4 h组细胞ATPase活性受到抑制(q=9.435,P<0.001;q=11.230,P<0.001),ATP含量降低(q=5.615,P=0.007;q=5.029,P=0.005);而高氧2、3 h组细胞ATPase活性(q=0.156,P=0.914;q=3.197,P=0.116)及ATP含量(q=0.859,P=0.557;q=1.273,P=0.652)差异无统计学意义。各组细胞线粒体膜电位之间差异无统计学意义(F=0.303,P=0.869)。结论 短时间高氧会抑制呼吸链复合体核心亚基表达并降低ATPase活性,导致肺泡Ⅱ型上皮细胞能量代谢障碍。
关键词:高氧;线粒体;肺泡Ⅱ型上皮细胞;能量代谢
中图分类号: R614.2+7 文献标志码: A 文章编号:1000-503X(2023)01-0009-07
DOI:10.3881/j.issn.1000-503X.15096
Excess Oxygen Supply for Different Time Periods Affect Energy Metabolism in Rat Alveolar Epithelial Type Ⅱ Cells
HUANG Rongrong1,QU Shanshan1,GUO Hong1,CHEN Suheng1,YANG Chuanqi1,ZHANG Junmei1,LI Yulan2
1The First School of Clinical Medical,Lanzhou University,Lanzhou 730000,China
2Department of Anesthesiology,the First Hospital of Lanzhou University,Lanzhou 730000,China
Corresponding author:LI Yulan Tel:13519625065,E-mail:jasm@sina.com
ABSTRACT:Objective To observe the effect of excess oxygen supply for different time periods on the mitochondrial energy metabolism in alveolar epithelial type Ⅱ cells.Methods Rat RLE-6TN cells were assigned into a control group (21% O2 for 4 h) and excess oxygen supply groups (95% O2 for 1,2,3,and 4 h,res-pectively).The content of adenosine triphosphate (ATP),the activity of mitochondrial respiratory chain complex V,and the mitochondrial membrane potential were determined by luciferase assay,micro-assay,and fluorescent probe JC-1,respectively.Real-time fluorescence quantitative PCR was employed to determine the mRNA levels of NADH dehydrogenase subunit 1 (ND1),cytochrome b (Cytb),cytochrome C oxidase subunit I (COXI),and adenosine triphosphatase 6 (ATPase6) in the core subunits of mitochondrial respiratory chain complexes Ⅰ,Ⅲ,Ⅳ,and Ⅴ,respectively.Results Compared with the control group,excess oxygen supply for 1,2,3,and 4 h down-regulated the mRNA levels of ND1 (q=24.800,P<0.001;q=13.650,P<0.001;q=9.869,P<0.001;q=20.700,P<0.001),COXI (q=16.750,P<0.001;q=10.120,P<0.001;q=8.476,P<0.001;q=14.060,P<0.001),and ATPase6 (q=22.770,P<0.001;q=15.540,P<0.001;q=12.870,P<0.001;q=18.160,P<0.001).Moreover,excess oxygen supply for 1 h and 4 h decreased the ATPase activity (q=9.435,P<0.001;q=11.230,P<0.001) and ATP content (q=5.615,P=0.007;q=5.029,P=0.005).The excess oxygen supply for 2 h and 3 h did not cause significant changes in ATPase activity (q=0.156,P=0.914;q=3.197,P=0.116) and ATP content (q=0.859,P=0.557;q=1.273,P=0.652).There was no significant difference in mitochondrial membrane potential among the groups (F=0.303,P=0.869).Conclusion Short-term excess oxygen supply down-regulates the expression of the core subunits of mitochondrial respiratory chain complexes and reduces the activity of ATPase,leading to the energy metabolism disorder of alveolar epithelial type Ⅱ cells.
Key words:excess oxygen supply;mitochondria;alveolar epithelial type Ⅱ cell;energy metabolism
Acta Acad Med Sin,2023,45(1):9-15
在全身麻醉过程中,患者高氧血症的发生率可达83%[1]。相关研究表明,长时间暴露于超生理水平氧分压下会导致肺组织的氧化应激损伤[2-4]。肺泡Ⅱ型上皮细胞(alveolar epithelial type Ⅱ cell,AEC Ⅱ)是高氧介导肺损伤的关键靶点[5],同时也是AEC Ⅰ的祖细胞[6],在肺发育和损伤修复过程中具有重要作用[7]。线粒体是细胞能量代谢的核心,AEC Ⅱ能量代谢异常可能影响其合成、修复功能,参与肺组织损伤的病理过程。有研究发现高氧4 h后小鼠肺泡上皮细胞呼吸链复合体酶活性及氧化磷酸化水平降低,三磷酸腺苷(adenosine triphosphate,ATP)合成减少[8];高氧6 h后肺血管内皮细胞线粒体结构紊乱[9]。但Farrow等[10]研究发现,在95%的高氧条件下,肺血管内皮细胞线粒体基质内活性氧在15 min内显著增加,30 min时达到最大[10],可见线粒体对高氧非常敏感,而高氧4 h内是否影响AEC Ⅱ 的能量代谢尚不清楚。因此,本研究体外培养大鼠AEC Ⅱ 建立高氧细胞模型,检测4 h内不同时间点细胞线粒体呼吸链复合体和能量代谢变化趋势,探究高氧肺损伤的形成机制。
材料和方法
材料 细胞株RLE-6TN购自北京北纳创联生物技术研究院,为永生化大鼠AEC Ⅱ。RPMI-1640培养基、胎牛血清、链霉素、青霉素、0.25%胰酶均购自上海逍鹏生物科技有限公司;MolPure Cell/Tissue Total RNA试剂盒购自翌圣生物科技(上海)股份有限公司;实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)试剂盒购自南京诺唯赞生物科技股份有限公司;线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(JC-1)、线粒体呼吸链复合体Ⅴ活性检测试剂盒均购自北京索莱宝科技有限公司;ATP检测试剂盒购自上海碧云天生物科技有限公司。
细胞培养及分组 RLE-6TN细胞用含10%胎牛血清、1%青霉素-链霉素的RPMI-1640培养基,置于37 ℃、5% CO2的常规培养箱中培养,待细胞覆盖培养瓶80%~90%时,用胰酶消化并传代,一般2~3 d传代1次,取对数生长期细胞接种于培养瓶中,培养48 h后采用随机数字表法将细胞分为对照组(21% O2常规培养4 h)、高氧1、2、3、4 h组(95% O2分别培养1、2、3、4 h)。
ATP含量检测 收集各组细胞加入200 μl ATP裂解液,冰上裂解10 min,4 ℃、12 000 g离心5 min取上清液;黑色96孔板中加入100 μl ATP检测液,静止3~5 min后每孔加20 μl样品或标准品,采用多功能酶标仪进行测定,根据标准曲线测定样品中ATP的浓度,最后计算ATP浓度与BCA法检测样品蛋白浓度的比值,以μmol/mg表示。
线粒体呼吸链复合体Ⅴ活性检测 收集各组细胞以800 r/min(r=6 cm)的速率离心3 min,弃掉上清液,随后采用微量法按照线粒体呼吸链复合体Ⅴ活性检测试剂盒说明书测定各组细胞ATP酶(ATP synthase,ATPase)的活性,同时测定各组细胞的蛋白浓度,以消除由于样本中蛋白量的差异而造成的误差。最后根据试剂盒说明书公式计算ATPase的浓度,以U/mg prot表示。
MMP检测 收集各组细胞加入1 ml培养液和1 ml JC-1染色工作液,充分混匀,置于37 ℃细胞培养箱中孵育20 min;吸除上清液,用JC-1染色缓冲液洗涤2次,加入2 ml培养液,在倒置荧光显微镜下观察。MMP较高时,JC-1聚集在线粒体基质中形成聚合物,产生红色荧光;MMP较低时,JC-1不能聚集在线粒体基质中,以单体形式存在,产生绿色荧光。采用Image J分析平均荧光强度,计算红色平均荧光强度/绿色平均荧光强度的比值来反应MMP变化。
qRT-PCR检测 收集各组细胞,采用MolPure Cell/Tissue Total RNA试剂盒提取总RNA并测定浓度,HiScript Ⅱ Q RT SuperMix试剂盒进行反转录,ChamQ Universal SYBR qPCR Master Mix试剂盒进行qRT-PCR测定。以GAPDH作为内参,扩增基因为NADH脱氢酶亚基1(NADH dehydrogenase subunit 1,ND1)、细胞色素b(cytochrome b,Cytb)、细胞色素C氧化酶亚基Ⅰ(cytochrome C oxidase subunit Ⅰ,COXI)、ATPase6。反应程序:95 ℃ 30 s、95 ℃ 5 s和60 ℃ 30 s,40个循环,95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。采用2-ΔΔCt法计算mRNA的相对表达量。qRT-PCR引物序列见表1。
统计学处理 采用GraphPad Prism 9软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用单因素方差分析,方差齐两两比较采用SNK检验。所有实验均独立重复3次。P<0.05为差异有统计学意义。
结 果
细胞内ATP含量 对照组,高氧1、2、3、4 h组细胞ATP含量分别为(0.44±0.02)、(0.37±0.01)、(0.45±0.03)、(0.46±0.03)、(0.38±0.01)μmol/mg,差異有统计学意义(F=11.170,P=0.001)。与对照组比较,高氧1、4 h组细胞ATP含量明显降低(q=5.615,P=0.007;q=5.029,P=0.005),而2、3 h组细胞ATP含量差异无统计学意义(q=0.859,P=0.557;q=1.273,P=0.652);与高氧1 h组比较,高氧2、3 h组细胞ATP含量明显升高(q=6.474,P=0.005;q=6.888,P=0.005),而4 h组细胞ATP含量差异无统计学意义(q=0.586,P=0.687);与高氧4 h组比较,高氧2、3 h组细胞ATP含量明显升高(q=5.888, P=0.005;q=6.302,P=0.006)。
线粒体呼吸链复合体Ⅴ活性 对照组,高氧1、2、3、4 h组细胞ATPase活性分别为(148.10±7.36)、(109.40±10.57)、(148.70±4.16)、(135.00±8.32)、(102.00±1.32)U/mg prot,差异有统计学意义(F=28.240,P<0.001)。与对照组比较,高氧1、4 h组细胞ATPase活性明显降低(q=9.435,P<0.001;q=11.230,P<0.001),而2、3 h组细胞ATPase活性差异无统计学意义(q=0.156,P=0.914;q=3.197,P=0.116);与高氧1 h组比较,高氧2、3 h组细胞ATP含量明显升高(q=11.230,P<0.001;q=9.591,P=0.001),而高氧4 h组细胞ATP含量差异无统计学意义(q=1.793,P=0.234);与高氧4 h组比较,高氧2、3 h组细胞ATPase活性明显升高(q=11.380,P<0.001;q=8.032,P<0.001)。
荧光探针检测MMP变化 荧光显微镜观察结果显示,对照组及高氧1、2、3、4 h组细胞平均荧光强度比值分别为4.320±0.641、4.149±1.023、4.371±0.599、4.585±0.397、4.649±0.260,差异无统计学意义(F=0.303,P=0.869)(图1)。
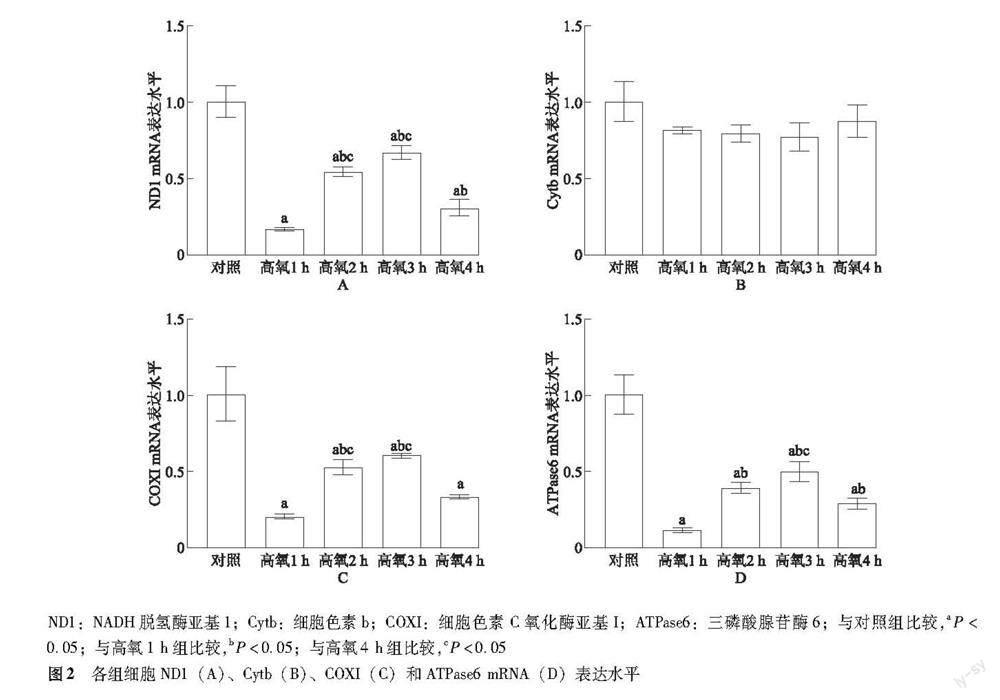
ND1、Cytb、COXI和ATPase6的mRNA表达 对照组及高氧1、2、3、4 h组细胞ND1(F=93.650,P<0.001)、COXI(F=41.080,P<0.001)和ATPase6 mRNA(F=73.420,P<0.001)表达水平差异有统计学意义,而Cytb mRNA表达水平差异无统计学意义(F=3.280,P=0.058)。与对照组比较,高氧1、2、3、4 h组细胞ND1(q=24.800,P<0.001;q=13.65,P<0.001;q=9.869,P<0.001;q=20.700,P<0.001)、COXI(q=16.750,P<0.001;q=10.120,P<0.001;q=8.476,P<0.001;q=14.060,P<0.001)及ATPase6 mRNA(q=22.770,P<0.001;q=15.540,P<0.001;q=12.870,P<0.001;q=18.160,P<0.001)表达水平明显降低;与高氧1 h组比较,高氧2、3 h组细胞ND1(q=11.160,P<0.001;q=14.940,P<0.001)、COXI(q=6.625,P=0.002;q=8.273,P=0.001)和ATPase6 mRNA(q=7.225,P=0.001;q=9.897,P<0.001)表达水平明显升高,高氧4 h组ND1(q=4.107,P=0.016)、ATPase6 mRNA(q=4.612,P=0.009)表达水平明显升高,而COXI mRNA表达水平差异无统计学意义(q=2.688,P=0.087);与高氧4 h组比较,高氧2、3 h组细胞ND1(q=7.052,P<0.001;q=10.830,P<0.001)、COXI(q=3.938,P=0.019;q=5.585,P=0.007)及高氧3 h组ATPase6 mRNA(q=5.285,P=0.010)表达水平明显增高,而高氧2 h组ATPase6 mRNA表达水平差异无统计学意义(q=2.613,P=0.094)(图2)。
讨 论
长时间高氧暴露会导致多器官损伤,尤其是肺损伤[11]。高氧性肺损伤的机制非常复杂,至今尚未完全清楚。Garcia等[8]研究表明,高氧4 h会引起线粒体动力学、能量代谢等功能紊乱,但是4 h以内高氧是否会影响线粒体功能尚不清楚。本研究基于外科常规手术时间[12-14]、既往研究[15-16]及预实验制备了高氧RLE-6TN细胞模型,探究4 h内的高氧暴露对AEC Ⅱ能量代谢的影响,结果显示高氧1 h AEC Ⅱ线粒体呼吸链复合体核心亚基ND1、COXI、ATPase6 mRNA表达水平明显降低,细胞总ATP合成急剧减少,ATPase活性降低;高氧持续2~3 h线粒体功能和酶活性代偿性增高;高氧4 h細胞ATP含量又进一步下降,能量合成障碍,表明短时间高氧可抑制AEC Ⅱ的能量代谢,参与高氧肺损伤的发生。
线粒体呼吸链是细胞合成ATP的主要结构,ATP合成体系由2个电子载体(辅酶Q和Cytc)及位于线粒体内膜上的复合体Ⅰ~Ⅴ组成,其中复合体Ⅰ、Ⅲ、Ⅳ具有质子泵功能,传递电子的同时驱动质子从线粒体基质跨过内膜进入膜间隙,同时形成MMP。质子通过线粒体复合体Ⅴ(ATPase)时驱动二磷酸腺苷与Pi结合并释放ATP。由线粒体DNA编码的13条多肽中包括线粒体呼吸链复合体Ⅰ、Ⅲ、Ⅳ、Ⅴ上的核心亚基ND1、Cytb、COXI和ATPase6[17-18],是组成线粒体呼吸链复合体的主要成分,在电子传递及线粒体氧化磷酸化偶联过程中起着重要作用,一旦受损可破坏呼吸链复合体的结构,从而导致氧化磷酸化解偶联及ATP合成障碍[17]。动物实验发现,暴露于高氧的大鼠肺泡细胞线粒体耗氧量减少,复合体 Ⅰ 和 Ⅱ 的活性分别降低77%和63%,ATP合成减少[19-20];同样,细胞实验也显示高氧降低了小鼠肺泡上皮细胞(MLE-12)对底物的利用率,抑制呼吸链复合体Ⅰ、Ⅱ和Ⅳ功能,导致氧化磷酸化水平降低及ATP合成减少[8,21],提示线粒体氧化磷酸化在高氧状态下受到显著抑制。本研究结果发现,AEC Ⅱ细胞在高氧4 h以内能量代谢呈双向改变:高氧1 h能量代谢出现显著“顿抑”现象,2~3 h有代偿性增高,4 h再次出现降低;同时,ATPase活性和线粒体呼吸链复合体Ⅰ、Ⅳ、Ⅴ的核心亚基ND1、COXI、ATPase6 mRNA表达水平与ATP含量变化趋势一致。由此可知短时间高氧暴露可引起线粒体能量代谢障碍,从而参与高氧肺损伤的病理过程。
然而,本研究中呼吸链复合体Ⅲ核心亚基Cytb的表达及MMP在高氧4 h内均未发生明显的变化,这与Garcia等[8]及Resseguie等[22]研究结果一致。Cytb表达可能与细胞类型、高氧暴露的时间及对氧化应激刺激的敏感性不同有关。MMP是反映细胞内线粒体功能状态的重要指标之一,是线粒体进行氧化磷酸化、产生ATP的先决条件。Audi等[23]将大鼠暴露于95%的高氧48 h后发现肺组织线粒体发生去极化,即MMP降低;同样Zhu等[24]发现高氧24 h显著降低了人肺泡上皮细胞MMP。而本研究中MMP表达没有明显变化,这可能是因为短时间高氧只影响了细胞的氧化磷酸化,并未对线粒体结构造成广泛损伤[8],或是线粒体在呼吸链损伤的状态下通过糖酵解产生ATP来维持MMP[25]。
Garcia等[8]在探究高氧4 h对MLE-12细胞线粒体功能的影响时发现,在总的氧化磷酸化水平降低、ATP生成减少的同时,线粒体内、外膜融合蛋白转录增加,而线粒体分裂蛋白未发生改变,从而导致线粒体质量增加。线粒体代谢学与动力学关系密切,已有研究证实线粒体融合是对线粒体代谢失调的保护性反应[26]。本研究中高氧2~3 h代偿性增高的原因及机制是否与线粒体动力学有关,还需进一步探究。
AEC Ⅱ功能呈能量依赖性,AEC Ⅱ内线粒体数量是Ⅰ型细胞的31倍,线粒体体积是其他肺组织细胞的3倍[27]。高氧引起的炎症反应和氧化应激可诱导线粒体DNA突变或缺失[28],线粒体呼吸链酶活性降低,引起AEC Ⅱ 能量代谢失衡,从而造成肺表面活性物質分泌不足,AEC Ⅱ 分化、修复 Ⅰ 型细胞能力受损[29-30]。因此,高氧诱导线粒体功能障碍引起的AEC Ⅱ能量代谢紊乱,可能是造成高氧肺损伤的原因之一。
综上,本研究结果表明,短时间高氧虽然会出现损伤后代偿效应,但代偿后仍会导致线粒体呼吸链复合体核心亚基ND1、COXI及ATPase6的表达降低及线粒体ATPase的活性被抑制,进而干扰AEC Ⅱ 能量代谢,参与高氧肺损伤的病理过程。但本研究未进一步探究线粒体动力学及其与能量代谢之间的关系,未来还需要对高氧肺损伤时线粒体功能相关表型和机制的变化进行深入分析。
参 考 文 献
[1]Suzuki S,Eastwood GM,Peck L,et al.Current oxygen management in mechanically ventilated patients:a prospective observational cohort study[J].J Crit Care,2013,28(5):647-654.DOI:10.1016/j.jcrc.2013.03.010.
[2]Vento M,Moro M,Escrig R,et al.Preterm resuscitation with low oxygen causes less oxidative stress,inflammation,and chronic lung disease[J].Pediatrics,2009,124(3):e439-e449.DOI:10.1542/peds.2009-0434.
[3]Saugstad OD.Is oxygen more toxic than currently believed[J].Pediatrics,2001,108(5):1203-1205.DOI:10.1542/peds.108.5.1203.
[4]Nardiello C,Miíková I,Silva DM,et al.Standardisation of oxygen exposure in the development of mouse models for bronchopulmonary dysplasia[J].Dis Model Mech,2017,10(2):185-196.DOI:10.1242/dmm.027086.
[5]Lee HS,Kim CK.Effect of recombinant IL-10 on cultured fetal rat alveolar type Ⅱ cells exposed to 65%-hyperoxia[J].Respir Res,2011,12(1):68.DOI:10.1186/1465-9921-12-68.
[6]Sun T,Huang Z,Zhang H,et al.TAZ is required for lung alveolar epithelial cell differentiation after injury[J].JCI Insight,2019,5(14):e128674.DOI:10.1172/jci.insight.128674.
[7]Ruaro B,Salton F,Braga L,et al.The history and mystery of alveolar epithelial type Ⅱ cells:focus on their physiologic and pathologic role in lung[J].Int J Mol Sci,2021,22(5):2566.DOI:10.3390/ijms22052566.
[8]Garcia D,Carr JF,Chan F,et al.Short exposure to hyperoxia causes cultured lung epithelial cell mitochondrial dysregulation and alveolar simplification in mice[J].Pediatr Res,2021,90(1):58.DOI:10.1038/s41390-020-01224-5.
[9]Ma C,Beyer AM,Durand M,et al.Hyperoxia causes mitochondrial fragmentation in pulmonary endothelial cells by increasing expression of pro-fission proteins[J].Arterioscler Thromb Vasc Biol,2018,38(3):622-635.DOI:10.1161/ATVBAHA.117.310605.
[10]Farrow KN,Lee KJ,Perez M,et al.Brief hyperoxia increases mitochondrial oxidation and increases phosphodiesterase 5 activity in fetal pulmonary artery smooth muscle cells[J].Antioxid Redox Signal,2012,17(3):460-470.DOI:10.1089/ars.2011.4184.
[11]Zou D,Li J,Fan Q,et al.Reactive oxygen and nitrogen species induce cell apoptosis via a mitochondria-dependent pathway in hyperoxia lung injury[J].J Cell Biochem,2019,120(4):4837-4850.DOI:10.1002/jcb.27382.
[12]Yang Y,Zhang X,Li B,et al.Robot-assisted esophagectomy (RAE) versus conventional minimally invasive esophagectomy (MIE) for resectable esophageal squamous cell carcinoma:protocol for a multicenter prospective randomized controlled trial (RAMIE trial,robot-assisted minimally invasive esophagectomy)[J].BMC Cancer,2019,19(1):608.DOI:10.1186/s12885-019-5799-6.
[13]Cirocchi R,Kwan SH,Popivanov G,et al.Routine drain or no drain after laparoscopic cholecystectomy for acute cholecystitis[J].Surgeon,2021,19(3):167-174.DOI:10.1016/j.surge.2020.04.011.
[14]Wang Z,Chen J,Su K,et al.Abdominal drainage versus no drainage post-gastrectomy for gastric cancer[J].Cochrane Database Syst Rev,2015(5):CD008788.DOI:10.1002/14651858.CD008788.pub3.
[15]Wang XX,Sha XL,Li YL,et al.Lung injury induced by short-term mechanical ventilation with hyperoxia and its mitigation by deferoxamine in rats[J].BMC Anesthesiol,2020,20 (1):188.DOI:10.1186/s12871-020-01089-5.
[16]Kim MJ,Ryu JC,Kwon Y,et al.Dual oxidase 2 in lung epithelia is essential for hyperoxia-induced acute lung injury in mice[J].Antioxid Redox Signal,2014,21(13):1803-1818.DOI:10.1089/ars.2013.5677.
[17]Zhang Y,Liang X,Guan J,et al.Carbon tetrachloride ind-uced mitochondrial division,respiratory chain damage,abnormal intracellular [H+] and apoptosis are due to the act-ivation of 5-HT degradation system in hepatocytes[J].Toxicol Appl Pharmacol,2022,439:115929.DOI:10.1016/j.taap.2022.115929.
[18]Sousa JS,DImprima E,Vonck J.Mitochondrial respiratory chain complexes[J].Subcell Biochem,2018,87:167-227.DOI:10.1007/978-981-10-7757-9_7.
[19]Ratner V,Starkov A,Matsiukevich D,et al.Mitochondrial dysfunction contributes to alveolar developmental arrest in hyperoxia-exposed mice [J].Am J Respir Cell Mol Biol,2009,40(5):511-518.DOI:10.1165/rcmb.2008-0341RC.
[20]Beyer AM,Toro LEN,Hughes WE,et al.Autophagy,TERT,and mitochondrial dysfunction in hyperoxia [J].Am J Physiol Heart Circ Physiol,2021,321(5):H985.DOI:10.1152/ajpheart.00166.2021.
[21]Das KC.Hyperoxia decreases glycolytic capacity,glycolytic reserve and oxidative phosphorylation in MLE-12 cells and inhibits complex I and Ⅱ function,but not complex IV in isolated mouse lung mitochondria [J].PLoS One,2013,8(9):e73358.DOI:10.1371/journal.pone.0073358.
[22]Resseguie EA,Brookes PS,OReilly MA.SMG-1 kinase attenuates mitochondrial ROS production but not cell respiration deficits during hyperoxia[J].Exp Lung Res,2017,43(6-7):229-239.DOI:10.1080/01902148.2017.1339143.
[23]Audi SH,Ganesh S,Taheri P,et al.Depolarized mitochondrial membrane potential and protection with duroquinone in isolated perfused lungs from rats exposed to hyperoxia[J].J Appl Physiol,2022,132(2):346-356.DOI:10.1152/japplphysiol.00565.2021.
[24]Zhu X,Wang F,Lei X,et al.Resveratrol alleviates alveolar epithelial cell injury induced by hyperoxia by reducing apoptosis and mitochondrial dysfunction [J].Exp Biol Med (Maywood),2021,246(5):596-606.DOI:10.1177/1535370220975106.
[25]Vasan K,Clutter M,Fernandez Dunne S,et al.Genes involved in maintaining mitochondrial membrane potential upon electron transport chain disruption[J].Front Cell Dev Biol,2022,10:781558.DOI:10.3389/fcell.2022.781558.
[26]Yao CH,Wang R,Wang Y,et al.Mitochondrial fusion supports increased oxidative phosphorylation during cell proliferation[J].Elife,2019,8:e41351.DOI:10.7554/eLife.41351.
[27]Xue FY,Xin YZ,Qing C,et al.Effects of hyperoxia on mitochondrial homeostasis:are mitochondria the hub for bronchopulmonary dysplasia[J].Front Cell Dev Biol,2021,9:642717.DOI:10.3389/fcell.2021.642717.
[28]Kandasamy J,Rezonzew G,Jilling T,et al.Mitochondrial DNA variation modulates alveolar development in newborn mice exposed to hyperoxia[J].Am J Physiol Lung Cell Mol Physiol,2019,317(6):L740-L747.DOI:10.1152/ajplung.00220.2019.
[29]Boros LG,Torday JS,Paul Lee WN,et al.Oxygen-induced metabolic changes and transdifferentiation in immature fetal rat lung lipofibroblasts[J].Mol Genet Metab,2002,77(3):230-236.DOI:10.1016/s1096-7192(02)00140-3.
[30]Zhao H,Dennery PA,Yao H.Metabolic reprogramming in the pathogenesis of chronic lung diseases,including BPD,COPD,and pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2018,314(4):L544-L554.DOI:10.1152/ajplung.00521.2017.
(收稿日期:2022-05-06)
