轻中度抑郁症静息态fMRI低频振幅与血清炎症因子相关性研究
2023-10-10马跃何家恺郭春蕾孙继飞鲁新宇罗屹高山山陈庆燕张樟进荣培晶方继良刘勇
马跃,何家恺,郭春蕾,孙继飞,鲁新宇,罗屹,高山山,陈庆燕,张樟进,荣培晶,方继良*,刘勇*
0 前言
抑郁症(major depressive disorder, MDD)是一种由多基因及环境因素交互影响、共同作用的精神疾病,以显著而持久的心境低落、快感缺乏、思维迟钝等为主要临床表现,往往具有较高的发病率、复发率以及自杀率[1-2]。新冠疫情后,全球抑郁障碍的患病人口约为3.22 亿人,占世界人口比例的4.4%[3],17 项汉密尔顿抑郁量表(17-item Hamilton Rating Scale for Depression Scale, HAMD-17)用于评估患者抑郁程度,可将MDD患者分为重度抑郁与轻中度抑郁(mild to moderate depression, MMD)[4]。目前对于MDD的病理生理学机制尚未完全阐明,包括“神经递质假说”“下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal, HPA)异常”“神经可塑性下降”“炎症”“大脑结构和功能变化”和“遗传易感性”等[5-10]。其中“免疫-炎症”假说是MDD 发病机制中的一个重要因素。1991年由SMITH等[11]提出,MDD 患者机体存在免疫炎症状态,可诱发、加重抑郁症状。相关研究也发现当压力、应激产生时,促炎性细胞因子分泌增加,抗炎性细胞因子水平降低,导致免疫系统被过度激活,进而引起神经内分泌以及免疫系统功能紊乱,加重或诱导MDD 的形成[12]。既往研究主要关注外周促炎细胞因子水平异常与MDD之间的关系,发现白细胞介素6(interleukin 6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、C-反应蛋白(C-reactive protein, CRP)水平显著升高[13-14]。 高 敏 C 反 应 蛋 白(high-sensitivity C-reactive protein, HsCRP)>3已被用于定义为炎症性抑郁症亚组的分型要求[15-16]。近年来,随着神经成像分析技术的发展,MDD 最为突出的脑功能变化与情绪相关的高级皮层、皮层下多个脑区功能异常有关。促炎细胞因子可进入大脑与神经回路相互作用,增加MDD的风险,并涉及许多神经生物学过程,包括神经调节剂效应、神经递质样效应等[17-19]。GUO等[20]研究发现伴有自杀意念的MDD 患者灰质体积和IL-6 水平改变相关,而参与中枢神经炎症反应的小胶质细胞活化后主要分布在奖赏、认知、凸显等功能相关的前额叶及前扣带回、基底节等脑区[21]。以上研究均提示MDD 患者大脑结构和功能异常与其外周血炎症标志物浓度存在联系,表明外周炎症因子与大脑结构和功能变化有关[22-24]。但目前对于深入探讨MDD患者脑功能层面与炎症细胞因子浓度相关的研究较少。
静 息 态 功 能MRI(resting state functional MRI, rs-fMRI)作为一种具有无创、精确等优点的新兴技术,被广泛应用于探讨MDD的神经生物学机制[25]。低频振幅(amplitude of low frequency fluctuation,ALFF)[26]可以反映人脑血氧水平依赖(blood oxygen level dependent, BOLD)信号振动幅度的变化,有助于理解中枢神经系统自发功能活动。本研究将基于MDD炎症假说和脑功能变化作为结合点,以ALFF指标为切入点,与外周炎症细胞因子、临床量表进行相关性分析,探索轻中度MDD患者血液外周炎症因子水平和脑功能异常改变的复杂相互作用关系。
1 材料与方法
1.1 一般资料
回顾性分析2020 年1 月至2021 年10 月在中国中医科学院广安门医院和西南医科大学附属中医医院精神科被诊断为轻中度MDD 的患者病例,作为MMD 组。健康者来源于广告招募,作为健康对照(healthy controls, HC)组。最终本研究共纳入48例MMD患者病例及51例HC,且两组满足性别、年龄及受教育程度相对匹配。本研究严格遵守《赫尔辛基宣言》,经过中国中医科学院广安门医院、西南医科大学附属中医医院伦理委员会批准(伦理号:2019-250-KY、YJ-KY2019052),已在中国临床试验注册中心注册(注册号:ChiCTR2000029109),且所有受试者在纳入前均签署知情同意书。
1.2 诊断标准
按照精神障碍诊断与统计手册第五版(the Diagnostic and Statistical Manual of Mental Disorders-Ⅴ, DSM-Ⅴ)的诊断标准进行。诊断是由两名资深精神科医师进行。以心境低落为主,并至少有下列4项:(1)兴趣丧失、无愉快感;(2)精力减退或疲乏感;(3)精神运动性迟滞或激越;(4)自我评价过低、自责,或有内疚感;(5)联想困难或自觉思考能力下降;(6)反复出现想死的念头或有自杀、自伤行为;(7)睡眠障碍,如失眠、早醒或睡眠过多;(8)食欲降低或体质量明显减轻;(9)性欲减退。病程持续时间要达到两周以上[27]。
1.3 纳排标准
MMD 组纳入标准:(1)所有患者符合DSM-Ⅴ的抑郁症标准(包括轻度、中度);(2)年龄在18~70 岁之间;(3)轻度、中度MDD,7 分<HAMD-17 评分≤24 分;(4)右利手;(5)自杀严重程度评定量表所有回答均为“否”或评分<3 分;(6)能够或经沟通能够理解评估量表的内容,签署知情同意书者。
健康组纳入标准:(1)HAMD-17评分≤7分;(2)右利手;(3)无精神疾病发作史;(4)年龄在18~70岁之间,健康组性别、年龄及受教育程度与MMD组相对匹配。
排除标准:(1)患有严重的神经系统疾病及心、脑、肾等躯体疾病者;(2)有药物、毒品或酒精等滥用史;(3)有自杀风险疾病患者;(4)孕妇及哺乳期妇女者。
1.4 方法
1.4.1 量表评估
本研究所有患者及健康者纳入时均接受HAMD-17、14 项汉密尔顿焦虑量表(14-items Hamilton Anxiety Rating Scale, HAMA-14)。依据HAMD-17评估抑郁程度,HAMD 包括17 个条目,总分>24 分为重度抑郁,17 分<总分≤24 分为中度抑郁,7 分<总分≤17 分为轻度抑郁。依据HAMA-14 评估焦虑程度[4],分别对躯体性焦虑和精神性焦虑两部分进行评估,涵盖了躯体、情绪、行为的相关问题等14个方面,将各项评分相加为总分值,总分≥29 分为严重焦虑,21 分≤总分<29 分判定为有明显焦虑;14 分≤总分<21 分为有焦虑;7 分≤总分<14 分为可能有焦虑[28]。
1.4.2 炎症因子
受试者于晨起采集空腹静脉血,离心获得血清,血清学指标主要包括外周血血清肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、白介素6(interleukin 6, IL-6)、白介素2(interleukin 2,IL-2)、HsCRP。
1.4.3 影像图像数据采集
本研究所有受试者均在中国中医科学院广安门医院、西南医科大学附属中医医院放射科Magneton Skyra 3.0 T 磁共振扫描仪(德国西门子)上进行数据采集。扫描前告知受试者扫描过程中保持清醒,避免主动思维活动。扫描过程中受试者需使用耳塞并佩戴降噪耳机,用头罩以固定头部,平卧于检查床上。BOLD 序列扫描参数:TE 30 ms,TR 2000 ms,层间隔0.6 mm,层厚3.5 mm,32层,FOV 224 mm×224 mm,翻转角90°,矩阵64×64,扫描时间6 min 46 s。高清结构像扫描参数:TE 2.98 ms,TR 2530 ms,层间距1.0 mm,层厚1.0 mm,128 层,FOV 256 mm×256 mm,翻转角7°,矩阵256×192,扫描时间6 min 3 s。
1.4.4 影像图像数据处理
采用基于Matlab2020a 平台的DPARSF 5.0 工具包对BOLD 数据进行预处理:(1)先将数据从DICOM 转换为NIFTI 格式;(2)为防止数据不稳定,去除前10 个时间点;(3)进行时间层校正及头动校正(去除在任意方向头动大于2.0 mm 及2.0°的患者);(4)空间标准化,将被试经过非线性转换到MNI 空间,重采样为3 mm×3 mm×3 mm的空间分辨率;(5)去线性漂移;(6)将头动、脑脊液信号、白质信号进行线性回归;(7)平滑核为6 mm 进行空间平滑。此外,为了排除头动对试验结果的影响,我们计算了两组被试的头动参数,使用双样本t检验检查这两组被试是否具有显著性差异。
ALFF数据分析方法:经预处理后,使用DPARSF对ALFF进行计算分析,最后以0.01~0.10 Hz进行带通滤波,去除呼吸、心跳等生理信号产生的噪声,对此波段的磁共振信号进行傅里叶变换,将频域功率谱峰下面积进行开方,代表该频段振荡的幅度,即ALFF[29],并进行z值标准化,获得zALFF 用于统计。ALFF 反映神经元自发活动水平高低,ALFF 值的异常表明相应脑区可能存在功能缺陷。
1.5 统计学方法
人口统计学资料及临床资料采用SPSS 23.0进行分析,正态性检验后,符合正态分布的计量资料用均数±标准差表示,用两独立样本t检验进行比较,非正态分布的计量资料用中位数(四分位数间距)[M(IQR)]表示,计数资料比较采用卡方检验。P<0.05 为差异有统计学意义。
图像数据采用DPABI 软件进行分析,分别提取2 组预处理后的数据进行统计分析,以性别、年龄、受教育程度及头动参数作为协变量,结果采用高斯随机场(Gaussian random field, GRF)校正,簇水平P<0.05、体素水平P<0.001,双侧检验,团块体素大于>20,生成相应的ALFF(抑郁组-健康组)差异脑区图,两组ALFF 两样本t检验的阳性结果提值后得到的ALFF 值分别与炎症因子、临床量表进行相关性分析,相关性分析采用Spearman秩相关进行,以相关系数(r)<4 为相关性弱,4≤r≤7 为相关性一般,r>7 为相关性强,对结果进行Bonferroni 校正,以显著性水平在0.05/3≈0.017时为差异有统计学意义。
2 结果
2.1 MMD组与HC组组间临床特征结果比较
两组在年龄、性别及受教育程度、头动方面差异均无统计学意义(P均>0.05),MMD 组在HAMD-17、HAMA-14 评分上明显高于健康组,差异具有统计学意义(P<0.05),MMD 组IL-2、IL-6、TNF-α、HsCRP 水平均高于HC组(P均<0.05),见表1。
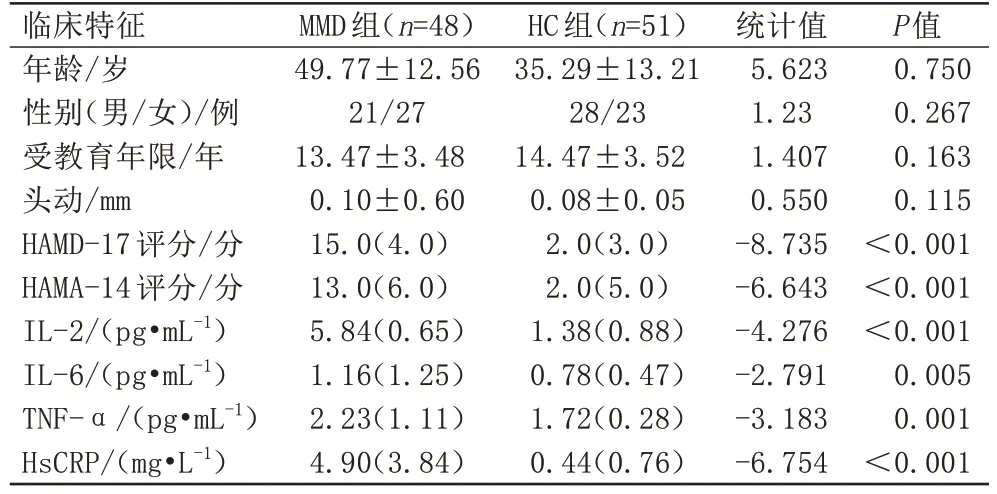
表1 MMD组与HC组组间临床特征结果比较Tab.1 Comparison of the results of clinical characteristics between the MMD and HC groups
2.2 MMD组与HC组组间脑影像ALFF结果
以年龄、性别、受教育年限作为协变量,两样本t检验统计后得到ALFF 值差异脑区(GRF 校正,簇水平P<0.05、体素水平P<0.001),见表2、图1。

图1 MMD组与HC组两样本t检验显著的脑区图。图中蓝色团块表示与HC组相比,MMD组ALFF降低的脑区(右侧颞极、左侧三角部额下回、右侧背外侧额上回),图中黄色团块表示与HC组相比,MMD组ALFF升高的脑区(左侧颞下回)。色条颜色由蓝色到黄色表示ALFF值由低到高的程度。MMD:轻中度抑郁症;HC:健康对照;ALFF:低频振幅。Fig.1 Significant brain regions in the two-sample t-test between the MMD and HC groups.The blue clusters in the figure represent brain regions with decreased ALFF in the MMD group compared to the HC group (right temporal pole, left triangular part of the inferior frontal gyrus,and right dorsolateral superior frontal gyrus).The yellow cluster in the figure represents brain regions with increased ALFF in the MMD group compared to the HC group (left middle temporal gyrus).The color bar ranging from blue to yellow indicates the extent of ALFF values from low to high.MMD: mild to moderate depression; HC: healthy control; ALFF:amplitude of low-frequency fluctuation.

表2 MMD组与HC组两样本t检验显著的脑区Tab.2 Significant brain regions in the two-sample t-test between the MMD and the HC groups
研究发现,与HC 组相比,MMD 组在左侧颞下回(Temporal_Inf_L)ALFF 值升高,在右侧颞极(Temporal_Pole_Sup_R)、左侧三角部额下回(Frontal_Inf_Tri_L)、右侧背外侧额上回(Frontal_Sup_R)ALFF值减低。
2.3 相关性分析
通过Bonferroni 校正后,Spearman 秩相关分析显示,左侧颞下回与HAMD-17、HAMA-14评分、HsCRP水平 呈 正 相 关(r=0.591,P<0.001;r=0.549,P<0.001;r=0.479,P<0.001);右侧背外侧额上回与TNF-α 呈负相关(r=-0.285,P=0.004),HsCRP 水平与HAMD-17、HAMA-14 评 分 呈 正 相 关(r=0.723,P<0.001;r=0.667,P<0.001),见图2。

图2 相关性矩阵图(2A)和MMD组右侧背外侧额上回和左侧颞下回ALFF 值 与TNF-α、HsCRP 散 点 图(2B)。*表示P<0.017,具有相关性,数值为r 值;MMD:轻中度抑郁症;ALFF:低频振幅;TNF-α:血清肿瘤坏死因子α;HsCRP:高敏C 反应蛋白;HAMD-17:汉密尔顿抑郁量表17 项;HAMA-14:汉密尔顿焦虑量表14 项;IL-2:白介素2;IL-6:白介素6;Frontal_Sup_R:右侧背外侧额上回;Temporal_Inf_L:左侧颞下回;Temporal_Inf_L:左侧颞下回;Temporal_Pole_Sup_R:右侧颞极; Frontal_Inf_Tri_L:左侧三角部额下回。Fig.2 The correlation matrix plot (2A) and scatter plots of ALFF values in the right dorsolateral superior frontal gyrus and left middle temporal gyrus with TNF,HsCRP (2B).* indicates a significant correlation with P<0.017, and the values represent the correlation coefficient (r).MMD: mild to moderate depression; ALFF:amplitude of low-frequency fluctuation; TNF-α: tumor necrosis factor-alpha; HsCRP: high-sensitivity C-reactive protein; HAMD-17: the 17-item Hamilton Depression Rating Scale; HAMA-14: the 14-item Hamilton Anxiety Rating Scale; IL-6: interleukin-6; IL-2: interleukin-2; Frontal_Sup_R: the right dorsolateral superior frontal gyrus; Temporal_Inf_L: the left middle temporal gyrus; Temporal_Pole_Sup_R: the right temporal pole; Frontal_Inf_Tri_L: the left triangular part of the inferior frontal gyrus.
3 讨论
本研究以MMD患者为研究对象,应用静息态fMRI的ALFF 方法,对MMD 的脑功能神经自发性活动与血清炎症因子进行相关性研究。这是第一项采用本方法进行探索MMD 患者血液外周炎症因子水平和脑功能异常改变的复杂相互作用的研究。研究发现MMD组存在IL-2、IL-6、TNF-α、HsCRP 水平升高,在边缘叶、默认模式网络(default mode network, DMN)等脑网络中ALFF存在差异,其中左侧颞下回、右侧背外侧额上回与HsCRP、TNF-α水平具有相关性,是外周炎症相关的异常脑区。
3.1 外周炎症因子在MMD 的免疫调节中发挥重要作用
MDD是以情绪低落、兴趣下降、精力减退为核心症状,同时伴有记忆力下降、睡眠障碍等一系列症状的精神障碍性疾病,尚未有明确的发病机制和生物标志物。目前免疫炎症假说的关注度最高,长期的免疫异常可增加MDD 的风险,且炎症假说与多个单胺假说、HPA 轴异常假说等多个经典假说之间存在联系[30],一些血清生物学标志物与抑郁障碍高度相关,例如HsCRP、TNF-α、IL-6、IL-2[31]。炎症因子与大脑结构和功能异常也存在易感性,如前扣带皮层、前额叶皮层、海马体和岛叶等脑区,表明炎症过程可能影响脑活动[32]。本研究显示MMD 患者的外周血中HsCRP、TNF-α、IL-6、IL-2 显著高于HC 组,且相关分析显示HsCRP 水平与HAMD-17、HAMA-14 评分呈正相关,与大部分研究的结果一致[33]。提示MMD患者存在一定程度的炎症反应激活,而血清HsCRP水平的变化与抑郁程度呈正相关。HsCRP水平能够精确且客观地反映患者的抑郁程度[34-35],表现为在炎症反应下会急剧升高,在遭受不良情绪时亦会显著增高,并在一定程度上反映机体对损伤刺激时的应答程度。TNF-α、IL-6、IL-2属于促炎性细胞因子,是炎症反应启动的关键细胞因子。IL6 通常被认为是“致抑郁”的依据,可下调神经递质多巴胺的水平,改变前额叶的突触传递[36-37]。TNF-α调节神经元兴奋性传递、神经炎症过程来影响抑郁,还能够调节小胶质细胞中的五羟色胺受体活性影响中枢神经系统的神经递质水平,参与抑郁的发生发展[17]。IL-2主要由T淋巴细胞产生,可通过海马影响学习和情绪记忆[38]。因此,HsCRP、TNF-α、IL-6、IL-2 在抑郁障碍的免疫调节中可能发挥着重要作用。
3.2 外周炎症因子水平潜在影响多个脑区功能
本研究发现,左侧颞下回神经元自发活动水平增高,右侧颞极、三角部额下回、背外侧额上回神经元自发活动水平下降可能是MMD 出现情绪抑郁的关键脑区。颞叶不仅参与听觉信息处理,还参与个人经历的回忆,对情绪及记忆等高级神经活动发挥着重要的调节作用[39-40]。颞下回属于DMN 的重要节点,在行为、认知、情绪调节等方面起着综合作用。BITSCH 等[41]和WAGNER 等[42]发现与健康者相比,MMD 患者的颞下回ALFF值高。YANG等[43]研究表明首发抑郁患者颞下回ALFF 信号增高,均与本研究结果一致。相关性分析发现MMD 患者左侧颞下回的自主神经活动增强,与HAMD-17、HAMA-14评分、HsCRP水平呈正相关,结合既往研究结果,我们认为MMD 的情绪和行为异常可能与颞叶功能亢进有关,颞叶功能亢进与HsCRP 水平升高、MMD 的情绪低落直接相关。前额叶负责自上而下调节情绪及注意力,在情感活动中起重要作用,其功能异常与MMD 的反刍思维、过度关注自我、负面刺激密切相关[44-45]。相关性分析发现,患者TNF-α的值越低,右侧背外侧额上回的脑功能活动越高,MMD 患者脑功能改变的物质基础与神经炎症异常介导有关。额下回三角部、背外侧额上回位于内侧前额叶,其中额中回是边缘神经环路重要组成部分,且神经影像学的研究指出,MMD 的发生与边缘系统功能和结构异常有关,主要表现为背外侧额上回、额中回皮层活性降低[46-47],与本研究结果一致。因此,研究认为HsCRP、TNF-α等外周炎症因子可干扰边缘系统以及DMN 相关的神经元活动,这些区域与MMD的病理生理密切相关。
3.3 本研究的不足
本研究存在如下不足之处:(1)样本量相对较小,量表选择过于单一;(2)本次研究仅报告了一个脑影像指标,未来将加入局部一致性、功能连接等指标评估疾病与相应脑区之间的情况;(3)炎症因子受各种因素的影响,存在不稳定性,未来需要进一步大样本的临床研究,多组学、多模态分析抑郁症的炎症水平。以上不足将会在下一步研究中进一步完善,以提高本研究的科学价值。
4 结论
综上所述,本研究发现MMD患者存在免疫炎症因子IL-2、IL-6、TNF-α、HsCRP 水平升高,采用ALFF 分析方法发现MMD 较HC 组存在差异脑区,主要在边缘叶、DMN 等脑网络,其中左侧颞下回、右侧背外侧额上回是外周炎症相关的异常脑区。研究认为MMD 脑功能、炎症因子和临床症状存在明显的相关性,这可能是炎症状态可增高抑郁风险、诱发、加重抑郁病程的神经病理机制更为复杂的原因。本项研究为MMD 的病理生理与治疗提供了新的思路和证据。在未来的研究中我们将进一步扩大样本量,采用更为严格的统计效力以提高本研究的科学价值。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:刘勇、方继良设计本研究的方案,对稿件重要的智力内容进行了修改,其中方继良获得了国家自然科学基金和中国中医科学院科技创新工程项目的资助;马跃起草和撰写稿件,获取、分析或解释本研究的数据;何家恺、郭春蕾、孙继飞、罗屹、高山山、陈庆燕、鲁新宇、张樟进、荣培晶获取、分析或解释本研究的数据,对稿件重要的智力内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
