山羊FATP2基因的克隆及对前体脂肪细胞脂质沉积的影响
2023-10-09唐崟梅李海洋林亚秋朱江江
唐崟梅,李 琪,李海洋,林亚秋,王 永,向 华,黄 炼*,朱江江*
(1.西南民族大学 青藏高原动物遗传资源保护与利用四川省/教育部重点实验室,成都 610207;2.西南民族大学青藏高原研究院,成都 610207)
随着物质水平的提高和膳食结构的改善,人们对畜肉类的需求也愈加多样。山羊肉较牛肉的肉质要细嫩,较猪肉的脂肪、胆固醇含量更少,因其肉营养价值高及独特的风味更加受青睐,于是居民对羊肉品质有进一步的要求[1]。而山羊肌内脂肪含量与肉质及口感密切相关,深入研究其肌内脂肪沉积的分子机制,对改善山羊肉质具有重要意义[2]。
脂肪酸转运蛋白家族(fatty acid transport proteins, FATPs)对脂肪酸代谢具有调节作用,对肌内脂肪沉积具有重要作用[3]。FATPs又称为溶质运载蛋白家族27(solute carrier family 27, SLC27),是1994年由Schaffer和Lodish[4]在小鼠的3T3-L1脂肪细胞中发现,在山羊上有6个脂肪酸转运蛋白成员(FATP1-FATP6)[5]。而其中,脂肪酸转运蛋白2(fatty acid transport protein 2, FATP2)又称为溶质运载蛋白家族成员2(solute carrier family 27,member 2, SLC27A2),对长链脂肪酸酯化为甘油三酯至关重要:在合成代谢途径中,它作为极长链的酰基-CoA合成酶的作用是必需的[6-7];同时FATP2也可以发挥脂肪酸转运的作用,从而介导细胞对长链和超长链脂肪酸的吸收[8]。
目前发现,FATP2有两个剪接变异体为FATP2a和FATP2b,分别定位于细胞膜和过氧化物酶体,且这两种剪接变异体都参与了外源脂肪酸的摄取和转运[9]。Veglia等[10]发现,多形核髓系抑制细胞的FATP2可通过介导花生四烯酸摄取参与前列腺素E2合成,引起细胞脂肪蓄积;在小鼠免疫抑制细胞中靶向FATP2可以阻断脂质的积累。Chen等[11]证明了敲低FATP2基因可抑制非小细胞肺癌脂质沉积。Adeshakin等[12]利用药物阻断骨髓源性抑制细胞中FATP2基因的表达,减少了其脂质积累。Ran等[13]利用穿心莲内酯处理LO2细胞后FATP2的表达降低导致细胞内脂滴减少,过表达FATP2后消弱了由于穿心莲内酯造成的脂肪酸摄取减少。Perez等[14]通过建立FATP2基因缺失小鼠模型,发现FATP2基因缺失小鼠相比于正常小鼠体重减轻,血清甘油三酯降低,饮食中脂肪酸吸收减弱。由此可见,FATP2基因在脂质代谢中发挥着重要作用。在以往的研究中,Uchiyama等[15]于1996年克隆了编码大鼠SLC27A2基因的cDNA;王涛[16]于2005年分离克隆了猪SLC27A2基因,并将其作为影响酮体和生长性状的候选基因进行研究;然而FATP2基因在山羊肌内前体脂肪细胞脂质沉积中的作用未见报道。
Hausman等[17]于1984年初次从仔猪半腱肌中分离出肌内前体脂肪细胞,为家畜肌内脂质沉积调控提供了极大的参考意义。2018年,Xiong等[18]从简州大耳羊背最长肌中利用胶原酶消化酶分离了肌内前体脂肪细胞,为解析山羊肌内脂肪沉积的调控机理提供了研究基础。本试验以简州大耳羊为研究对象,克隆FATP2基因序列,探讨其在不同分化时期及不同组织中的表达水平,利用生物信息学等方法预测其功能,并进一步用RNA干扰技术在山羊肌内前体脂肪细胞中初步验证其功能。这些结果将为进一步揭示FATP2在调控山羊肌内脂肪形成中的作用奠定基础。
1 材料与方法
1.1 试验材料
试验于2022年在西南民族大学青藏高原研究院完成。从四川省简阳市大哥大牧业有限公司随机选取12只健康的10月龄简州大耳羊公羊,在清晨于实验室空腹屠宰,并用DEPC水洗净之后,立即采集心、肝、脾、肺、肾、背最长肌、大肠(盲肠)及小肠(回肠)组织样本,洗净分装后冻存至液氮罐中。
主要试剂:反转录试剂盒、Trizol试剂来自Thermo公司,DH5α感受态细胞、DNA回收试剂盒、DNA聚合酶来自北京天根生化科技有限公司,pMD-19 T Vector来自TaKaRa公司,2×5 Super PCR Mix来自北京擎科新业生物技术有限公司,组织细胞甘油三酯酶法测定试剂盒来自北京普利莱基因有限公司,II型胶原酶来自Sigma公司,Si-RNA 来自上海吉玛制药技术有限公司,Taq Pro Universal SYBR qPCR Master Mix来自南京诺唯赞生物有限公司。
1.2 试验方法
1.2.1 山羊FATP2基因克隆与生物信息学分析 使用Trizol法提取总RNA,根据反转录试剂盒说明书获得cDNA,选择GenBank中已公布的山羊FATP2预测基因(XM_005 685 790.3)作为参考序列,利用Primer 5设计FATP2基因特异性引物(上游引物:5′-TCCTTCTGCCAGAGATCCC-3′,下游引物:5′-AAAATAACACCCTGCCTCTAA-3′)。采用Touchdown PCR法进行扩增,扩增体系为:10×PCR Buffer (Mg2+free) 2 μL,MgCl2(25 mmol·L-1) 3.2 μL,LA Taq (5 U·μL-1) 0.3 μL,cDNA 1.5 μL,上、下游引物各1 μL,ddH2O 11 μL,共20 μL。反应条件为94 ℃ 4 min;94 ℃ 30 s,66 ℃ 30 s,72 ℃ 2 min 10 s,15个循环;52 ℃ 30 s,15个循环;72 ℃ 10 min。整个体系中从第二次循环开始,每个循环降1 ℃。PCR产物用10 g·L-1的琼脂糖凝胶电泳检测,使用胶回收试剂盒回收目的片段,构建pClone007载体后转化DH5α感受态细胞,挑取阳性菌落进行PCR鉴定(与基因克隆PCR条件相同),送至成都擎科生物技术有限公司进行测序。
获得目的基因序列后,使用NCBI中Blast程序对不同物种的FATP2基因序列进行比对,使用在线软件对FATP2基因进行生物信息学分析(表1)。

表1 在线分析软件及内容Table 1 Online analysis softwares and contents
1.2.2 山羊原代肌内前体脂肪细胞分离、培养与传代 山羊原代肌内前体脂肪细胞分离培养采用实验室建立的培养方法[19]。将2日龄简州大耳羊(n=2)饥饿1 d,用新洁尔灭清洗3次,75%酒精擦拭后,颈动脉放血处死,在无菌细胞间采集背最长肌组织,PBS清洗3次,按1∶1混合后,在超净工作台修剪后加入II型胶原酶,37 ℃消化1 h,每隔5 min轻轻振荡1次。加入等体积含有10%胎牛血清的完全培养基终止消化,经过200目筛网过滤后将滤液分装到离心管中,2 000 r·min-1离心5 min。弃上清,加入红细胞裂解液吹散沉淀,静置5 min,再次离心弃上清,加入完全培养基(含10%胎牛血清和1%青链霉素的DMEM/F-12的培养基)重悬沉淀,吸取适量重悬液接种于60 mm培养皿中,即获得原代肌内前体脂肪细胞。将其置于37 ℃,50 mL·L-1CO2培养箱内培养,融合度达到80%开始传代,将细胞传至F3代,接种于六孔板,生长达80%时进行转染试验。
1.2.3 细胞转染 参照 Li-pofectamine®3000 试剂盒说明书进行转染。本试验以转入SI-FATP2作为试验组,转入SI-NC作为对照组。转染前弃掉完全培养液,PBS清洗3次,每孔加入900 μL Opti饥饿处理4 h。吸取88 μL Opit与6 μL lip3000、6 μLSI-FATP2配置预混液,静置15 min后转入细胞,放入37 ℃、50 mL·L-1CO2培养箱内培养,6 h后更换终浓度为含50 μmol·L-1油酸的完全培养基48 h后收集细胞[16]。干扰序列由上海吉玛制药技术有限公司合成(SI-FATP2序列:S: GAAGGCAAUAUUGGAUUUATT,A : UAAAUCCAAUAUUGCCUUCTT;SI-NC序列:S:UUCUCCGAACGUGUCACGUTT,A:ACGUGACAC-GUUCGGAGAATT)。
1.2.4 细胞总RNA提取及RT-qPCR 使用Trizol法提取收集细胞的总RNA,利用紫外分光光度计检测总RNA浓度及 OD260 nm/OD280 nm,按照反转录试剂盒说明书反转录cDNA,稀释2倍,存放于-20 ℃备用。利用PrimerPremier 5.0软件设计定量引物(表2),干扰FATP2后检测脂质代谢相关基因的表达,UXT基因作为试验的内参基因。RT-qPCR反应体系:cDNA稀释液1 μL,上、下游引物各0.2 μL,荧光染料(Taq Pro Universal SYBR qPCR Master Mix)5 μL,ddH2O 3.6 μL。RT-qPCR程序:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。每个待测样本设3个生物学重复和3个技术重复。
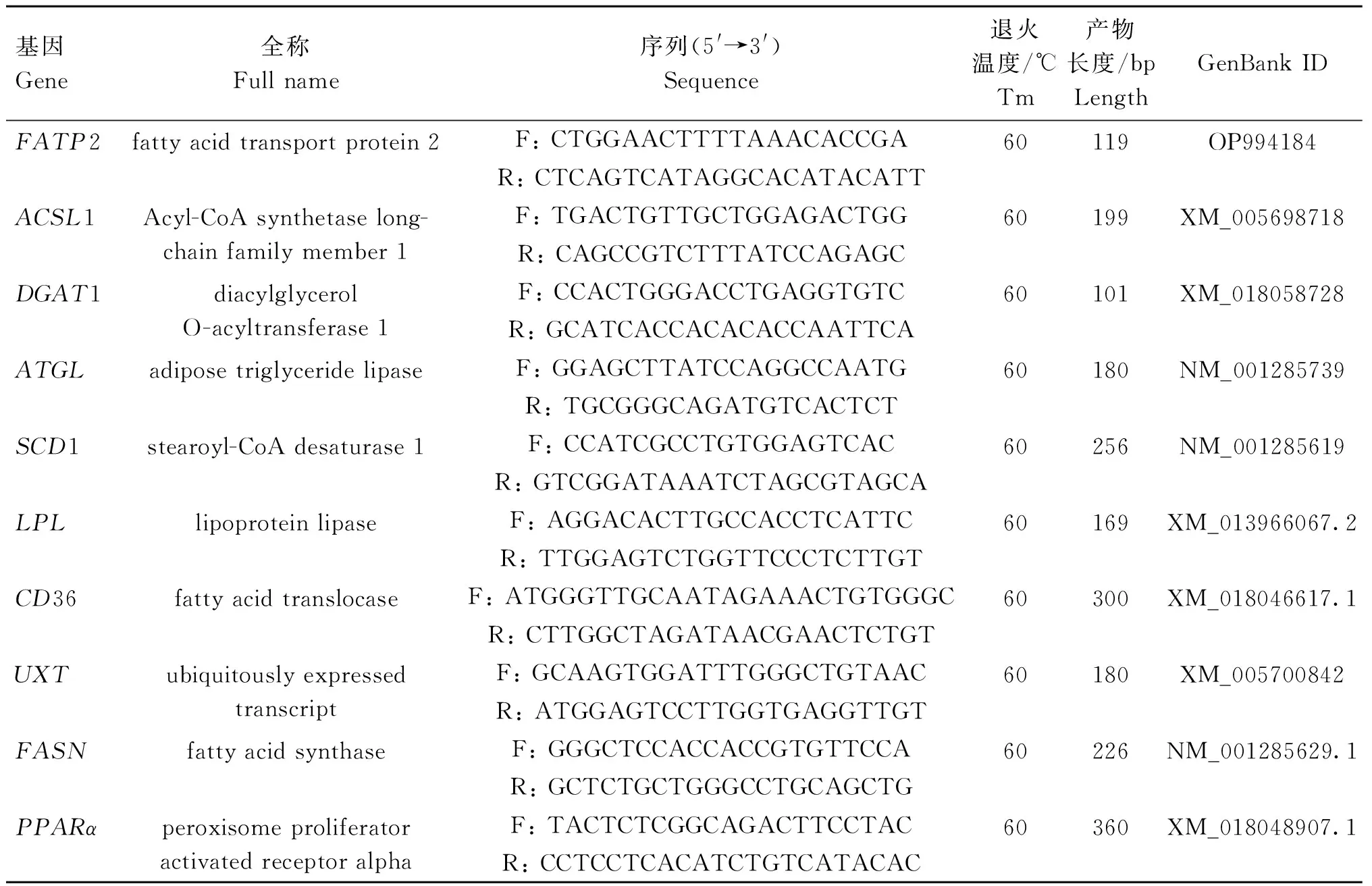
表2 RT-qPCR引物信息Table 2 Primers information for RT-qPCR
1.2.5 Bodipy染色和甘油三酯含量测定 利用Bodipy染色法观察干扰FATP2后山羊肌内前体脂肪细胞脂滴生成的变化情况。肌内前体脂肪细胞接种于六孔板,干扰FATP2 2 d后弃去培养基,PBS清洗3次,10%甲醛固定30 min,吸弃甲醛,PBS清洗3次,加入1 mL Bodipy工作液(浓度为1 mg·mL-1的Bodipy储存液,用PBS按照1∶500稀释即为工作液)避光孵育30 min,弃去Bodipy工作液后使用PBS清洗数次,加入1 mL DAPI工作液(与Bodipy工作液制备方法相同)避光孵育10 min,弃去DAPI工作液后用PBS清洗数次于显微镜下观察并拍照。按照甘油三酯测定试剂盒的说明书进行操作[20],使用酶标仪测定在波长为550 nm处的吸光度。
1.2.6 数据统计与分析 实时荧光定量PCR以泛表达转录子(ubiquitously express transcript,UXT)为内参基因,使用2-△△Ct法进行分析,其中△△Ct=[(Ctgene-CtUXT)]试验组-[(Ctgene-CtUXT)]对照组。本研究中所有的结果数据用“平均值±标准误(Mean±SEM)”表示,显著性检验使用Graphpad prism 8.0软件中的One-way ANOVA(and nonparametric or mixed)分析,P<0.05表示差异显著,P<0.01表示差异极显著;利用Graphpad prism 8.0绘图,试验设置3个生物学重复,3个技术重复。
2 结 果
2.1 山羊FATP2基因克隆与生物信息学分析
本试验以简州大耳羊肝脏和肾脏组织cDNA为模板,通过RT-PCR扩增得到山羊FATP2基因序列2 335 bp,其中CDS区1 863 bp,5′UTR 188 bp,3′UTR 284 bp,编码621个氨基酸(图1a)。将FATP2基因氨基酸序列与其他各物种氨基酸相似性对比,氨基酸相似性如图1b,山羊与绵羊的相似性最高为99.03%,其次是牛和水牛,分别为95.97%和95.65%,与黑猩猩、虎鲸、猫、人和雪貂的相似性分别是85.16%、85.97%、87.10%、85.48%、84.03%。采用Mega5.0软件构建系统进化树,结果如图1c所示,山羊FATP2与绵羊的亲缘度最高,其次为牛、猪、猫、人、非洲野驴、小鼠、褐家鼠。根据山羊FATP2蛋白序列对其进行蛋白理化性质分析,预测其蛋白分子式为C3184H4974N856O892S25,分子量为70.319 22 ku,理论等电点为8.72,体外半衰期为30 h,脂溶系数为93.52,不稳定系数为37.91,为稳定型蛋白。使用NetPhos 3.1 Server在线软件对FATP2蛋白磷酸化位点进行分析,如图2a所示,山羊FATP2蛋白具有Serine(丝氨酸)、Threonine(苏氨酸)、Tyrosine(酪氨酸)磷酸化位点,共49个磷酸化位点。应用ProtScale在线工具分析山羊FATP2蛋白的疏水性/亲水性,由该蛋白的理化性质和图2d推测,山羊FATP2蛋白为亲水性蛋白,信号肽预测分析结果显示(图2b),山羊FATP2蛋白含有Sec信号肽(Sec/SPI),可能属于分泌型蛋白。跨膜结构预测显示(图2c),山羊FATP2蛋白具有3个跨膜结构。FATP2蛋白二级结构预测显示,该蛋白含有α-螺旋38.39%,β折叠7.90%,无规则卷曲33.71%。不同物种FATP2蛋白三级结构预测显示(图3a),山羊和绵羊的三级结构相似,与牛、人的三级结构略显不同。山羊FATP2蛋白相互作用预测分析结果显示(图3b),FATP2蛋白可能与ECH1、AGXT、EHHADH、ACOX3、DAO、ECL2等蛋白存在相互作用。
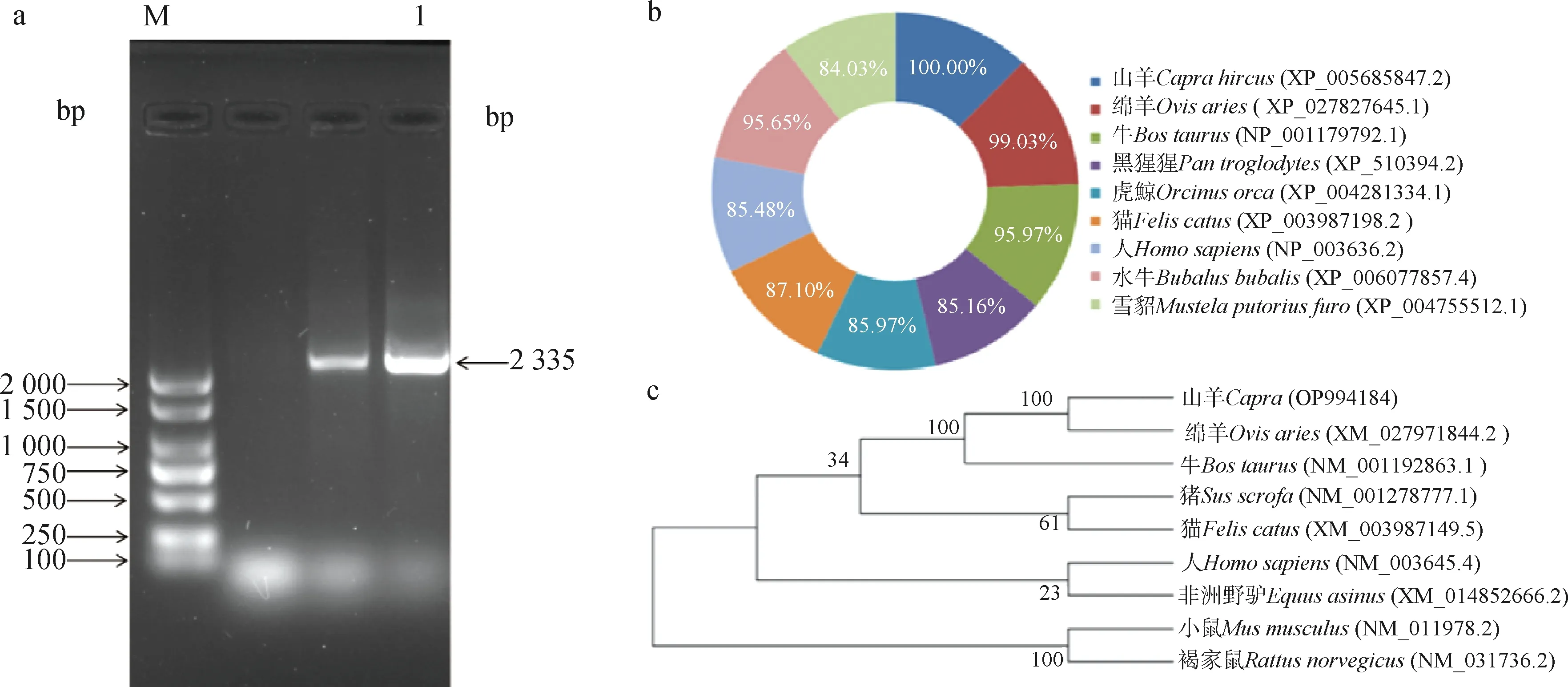
a. FATP2基因目的片段扩增(M. DNA相对分子质量标准;1. FATP2基因扩增产物);b. FATP2氨基酸相似分析;c. FATP2系统进化树分析a. Amplication of target fragment of FATP2 gene(M. DNA marker;1. FATP2 gene amplification product); b. FATP2 amino acid similarity analysis; c. FATP2 phylogenetic tree analysis图1 山羊FATP2序列扩增、不同物种FATP2蛋白相似性分析及进化树分析Fig.1 Amplication of target fragment of FATP2 gene, FATP2 protein similarity analysis in different species and evolutionary tree analysis

a. FATP2磷酸化位点预测分析;b. FATP2信号肽预测分析;c. FATP2跨膜结构预测分析;d. 亲水性/疏水性分析a. Analysis of FATP2 phosphorylation site prediction; b. Analysis of FATP2 signal peptide prediction; c. Analysis of FATP2 transmembrane structure prediction; d. Hydrophilicity/hydrophobicity analysis图2 山羊FATP2蛋白序列分析Fig.2 FATP2 protein sequence analysis of goat
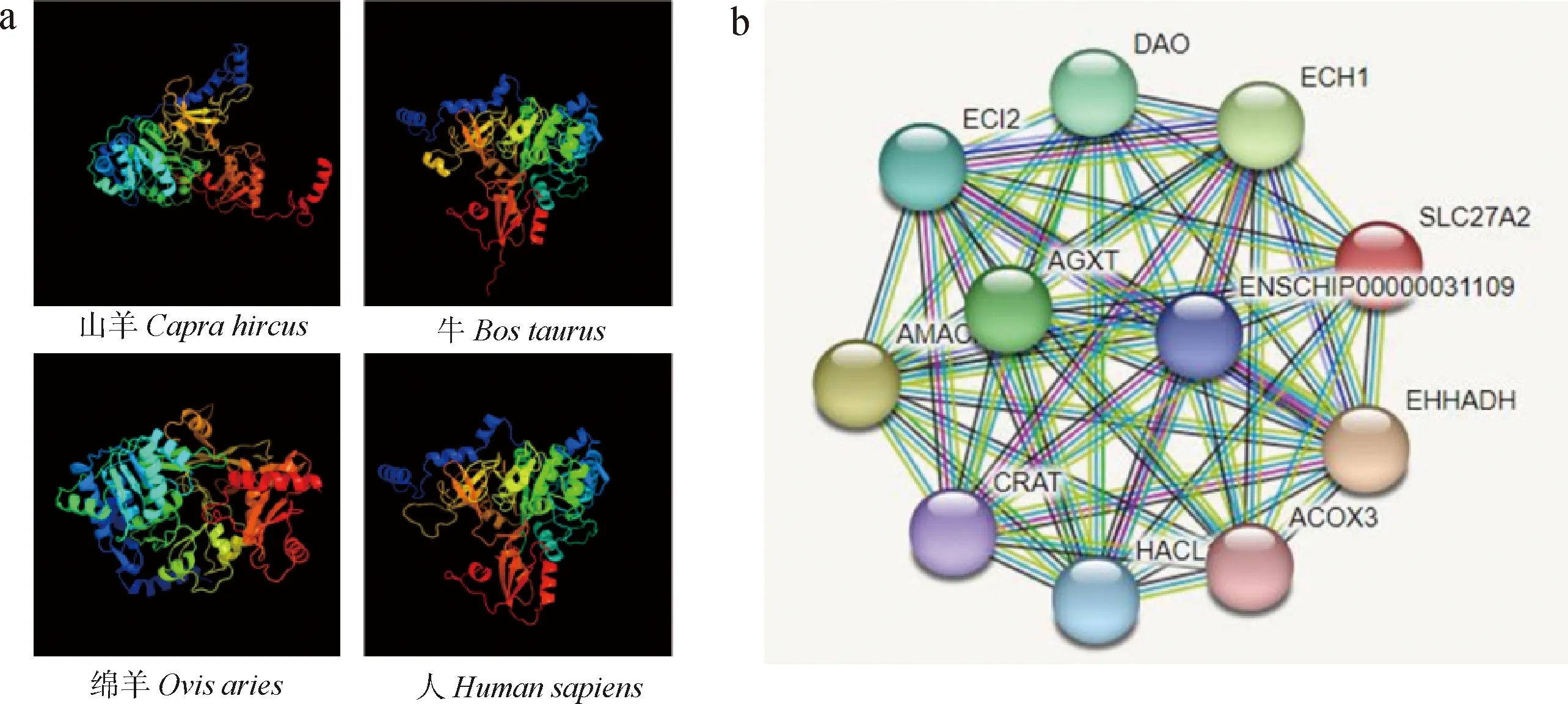
a. 不同物种FATP2蛋白的三级结构预测;b. 山羊FATP2蛋白相互作用蛋白预测分析a. Prediction of tertiary structure of FATP2 proteins from different species; b. Prediction of FATP2 protein-interacting proteins in goats图3 山羊FATP2蛋白的三级结构预测及互作蛋白分析Fig.3 Tertiary structure prediction and interacting protein analysis of goat FATP2 protein
2.2 山羊FATP2基因组织表达及时序表达
以UXT为内参基因[17],利用RT-qPCR技术检测FATP2基因在山羊不同组织中mRNA表达谱,结果显示(图4a),山羊FATP2基因在心、肝、脾、肺、肾、背最长肌、大肠、小肠组织中均有表达,且在肝脏中表达量最高,肾脏次之,在心脏中表达最低(P<0.01)。利用RT-qPCR技术检测FATP2基因在山羊肌内前体脂肪细胞不同分化时期(第0、2、4、6、8天)表达水平,结果显示(图4b),山羊FATP2基因的表达水平在肌内前体脂肪细胞分化过程中稍微下降后逐渐升高,至分化第6天达到最高水平,随后表达量下降。
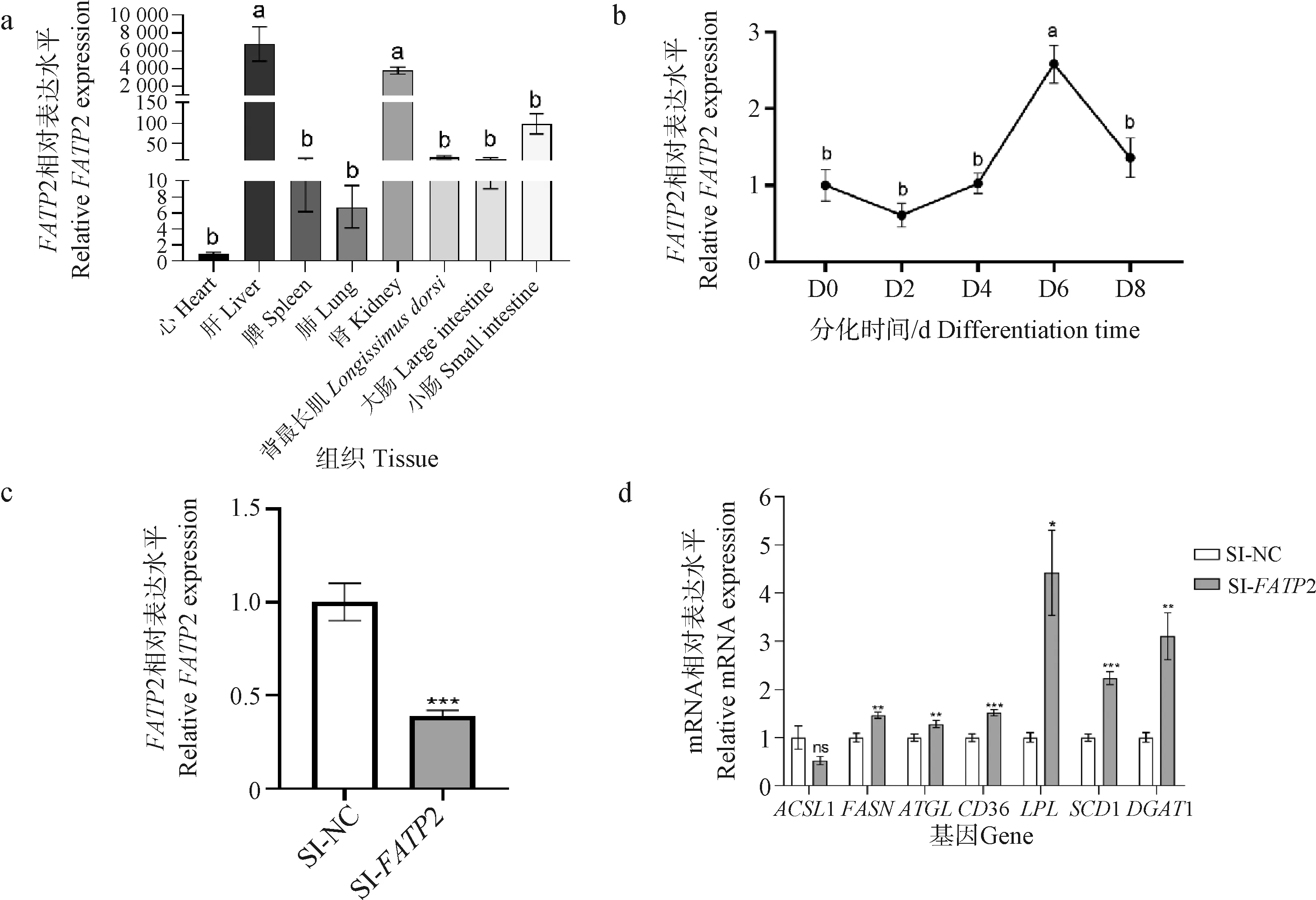
a. 以心组织的表达水平为参照,肩标不同字母表示差异显著(P<0.05); 肩标相同字母代表差异不显著(P>0.05);b.以0 h表达水平为参照,肩标不同字母表示差异显著(P<0.05); 肩标相同字母代表差异不显著(P>0.05);c. FATP2干扰效率检测;d. 干扰FATP2基因对脂代谢相关基因表达的影响。*.P<0.05, **.P<0.01,***.P<0.001a. The expression level in heart tissue was used as reference,values with different letter superscripts mean significant difference(P<0.05); While values with the same letter superscipts mean no significant difference(P>0.05); b. The expression level at 0 h was used as reference,values with different letter superscripts mean significant difference(P<0.05); While values with the same letter superscipts mean no significant difference(P>0.05); c. FATP2 gene interference efficiency detection;d. Effect of interfering with FATP2 gene on the expression of genes related to lipid metabolism. *.P<0.05, **.P<0.01, ***.P<0.001图4 FATP2基因时序、组织表达及干扰后对脂代谢基因表达的影响Fig.4 FATP2 gene timing, tissues expression and effects on the expression of lipid metabolism genes after interfering with FATP2
2.3 FATP2干扰对山羊肌内前体脂肪细胞脂代谢的影响
SI-FATP2转染至山羊肌内前体脂肪细胞并诱导48 h后,收集细胞,利用RT-qPCR技术检测FATP2干扰效率,结果显示(图4c),与SI-NC组相比SI-FATP2组的FATP2基因表达量下降58%(P<0.01)。
在山羊肌内前体脂肪细胞中干扰FATP2基因后,利用RT-qPCR技术检测脂质代谢相关基因表达水平,结果显示(图4d):干扰FATP2基因后脂代谢相关基因FASN(P<0.01),ATGL(P<0.01),CD36(P<0.01),LPL(P<0.05),SCD1(P<0.01),DGAT1(P<0.01)的表达显著上升,ACSL1基因的表达无显著变化(P>0.05)。
Bodipy染色(图5a)结果显示,SI-FATP2组相比SI-NC组,脂滴聚集明显减少,且量化后的脂滴含量极显著下降(图5b,P<0.01)。甘油三酯测定结果(图5c)显示,SI-FATP2组相比SI-NC组,甘油三酯含量显著降低(P<0.05)。
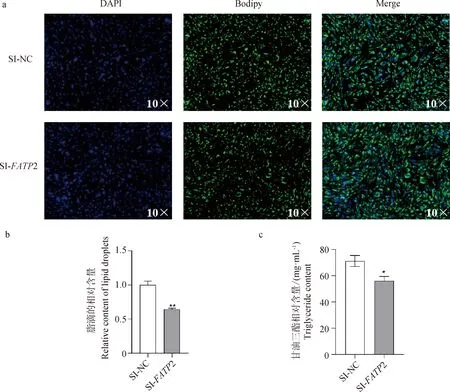
a.对照组(SI-NC)及干扰FATP2组 (SI-FATP2) Bodipy染色;b.以Image-pro plus 6.0 量化脂滴;c.以GPO-Trinder酶反应法检测甘油三酯含量; *.P<0.05, **.P<0.01a. Bodipy staining of control group (SI-NC) and interfering FATP2 group (SI-FATP2); b. Quantification of lipid droplets by Image-pro plus 6.0; c. Triglyceride content detected by GPO-Trinder enzyme reaction; *.P<0.05, **.P<0.01图5 干扰FATP2后对山羊肌内前体脂肪细胞脂质沉积的影响Fig.5 Effects interfering with FATP2 on lipid deposition in goat intramuscular precursor adipocytes
3 讨 论
肌内脂肪的沉积包括脂肪合成、脂肪降解以及脂肪酸转运,可从细胞水平、激素水平以及整体水平进行调控,多种信号通路、调节网络和转录因子都参与调控[21]。众多转录因子协调作用调控肌内前体脂肪细胞的增殖与分化,其中,过氧化物酶体增殖体激活受体(peroxisome proliferators-activated receptors,PPARs)是此过程的关键调控因子[22-23]。FATP2作为脂肪酸转运蛋白,受到PPARα的调控[24-25],调节脂肪酸代谢,在甘油三酯的合成以及肌内脂肪的沉积中发挥着重要作用。在山羊中,FATP2基因对肌内前体脂肪细胞脂质调控的作用仍未知,为解析FATP2基因对山羊肌内前体脂肪细胞脂质沉积的作用,本试验克隆了FATP2基因,通过生物信息学发现FATP2基因具有Sec/SPI信号肽,将有助于介导对蛋白的转运[26],此外,FATP2还具有49个磷酸化修饰位点,将有助于蛋白的翻译后修饰及细胞信号转导[27]。将山羊FATP2氨基酸序列与其他物种比对,结果表明,山羊与绵羊、牛的相似性较高,说明其在不同物种间的保守性较高;系统进化树结构表明,山羊FATP2与绵羊、牛有较高亲缘关系;对三级结构预测发现,不同物种间结构相似,因此推测FATP2在不同物种间可能发挥着相似的作用,但其功能还需要后期的研究验证。
脂肪细胞的增殖分化对于肌内脂肪沉积至关重要,为了进一步研究FATP2对脂质沉积的作用,本研究利用q-PCR检测了FATP2在不同组织中的表达和分化不同阶段时序的表达。结果表明,FATP2在山羊肝脏表达量最高,其次为肾脏,在心、脾、肺、背最长肌、大肠、小肠中都有表达。Hirsch等[28]的研究发现,FATP2在脂肪组织、肝脏、心脏、肾脏中有表达,本研究发现FATP2在大肠和小肠中也有表达,而大肠和小肠作为脂肪酸吸收的场所,FATP2的表达与其脂肪酸转运的功能相符合。Heinzer等[29]对小鼠的研究发现,FATP2基因在肝脏和肾脏中的表达水平最高,本试验结果与其一致。在当前研究中,人们发现FATP2在II型糖尿病、肾脏纤维化和肿瘤等由脂质不平衡所引起的疾病中发挥着重要调节作用[30],肝脏与肾脏作为脂代谢旺盛的器官,FATP2的高表达与其对脂质平衡的调节作用相符。Feng等[31]通过转录组和基因组富集分析发现,MAPK途径是调控FATP2的主要下游信号途径。MAPK信号通路参与肌内前体脂肪细胞的增殖与分化过程,且研究表明激活MAPK通路可抑制脂质代谢相关蛋白的表达水平[32],FATP2缺乏在肝癌细胞中可增加多不饱和脂质和脂质过氧化反应,导致肿瘤细胞的增殖[33]。因此推测,FATP2基因在脂肪细胞的增殖分化过程中发挥着作用,但其发挥的具体作用还需要进一步研究验证。通过分析FATP2基因的时序表达,发现FATP2基因的表达量在分化过程中先升高后下降,且在脂肪分化第6天表达量最高,随后下降,由此推测FATP2在不同分化时期发挥不同的作用,但具体的作用及其作用机制还有待后续研究。
研究发现,FATP2的表达由Foxa1和PPARα控制[34],本研究利用RT-qPCR技术检测脂质代谢相关基因表达水平的结果显示,干扰FATP2基因,PPARα基因及其相关的基因CD36、SCD1表达量显著升高,与以往的研究结果[35]一致,表明干扰FATP2基因后激活了脂肪酸氧化途径。另有研究证明,FATP2的表达增加与富含甘油三酯的脂滴的积累和转移的促进有关[10];研究发现,在老年黑色素瘤患者与年轻患者中,老年患者黑色素瘤细胞中FATP2表达上调,抑制FATP2表达则抑制其脂质积累[7],本研究结果表明,干扰FATP2基因后,甘油三酯及脂滴的量显著降低,与他们的试验结果一致。干扰FATP2基因后,FASN、DGAT1及SCD1等与脂质合成相关基因的表达显著上升。研究表明,FASN是脂肪酸合成酶,催化脂肪酸合成从而促进脂质合成[36];杨昌恒等[37]研究表明,DGAT1是甘油三酯合成的关键酶,过表达DGAT1可促进脂质沉积;而SCD1作为硬脂酰辅酶A去饱和酶1可促进脂肪酸生成[38]。然后,FATP2表达水平的降低也同时抑制了ACSL1基因的表达,推测可能限制了机体对脂肪酸的利用,从而抑制了由脂生成相关基因表达的上调所带来的脂质沉积效应。同时,干扰FATP2基因后ATGL和LPL等与脂质分解相关基因的表达也显著上升,ATGL与LPL都是脂质代谢的关键酶,AGTL促进甘油三酯水解[39],而LPL促进脂肪酸氧化[40]。综上所述,推测FATP2干扰后主要通过促进脂解途径从而最终抑制脂质沉积,然而FATP2在山羊肌内前体脂肪细胞脂质沉积中的作用仍需要进一步研究。
4 结 论
本研究克隆获得山羊FATP2基因序列全长2 335 bp,其中CDS区1 863 bp,5′UTR 188 bp,3′UTR 284 bp,编码621个氨基酸。干扰FATP2基因可能通过促进脂解相关基因的表达从而抑制山羊前体脂肪细胞脂质沉积。这些结果将为进一步阐明FATP2在山羊肌内脂肪沉积过程中的作用机制提供理论参考。
