老山芹多糖的分离纯化、结构表征及体外降糖活性研究
2023-10-09羡荣华蒲铎文樊梓鸾于承媛刘永旭季子琦刘荣
羡荣华,蒲铎文,樊梓鸾,2,于承媛,刘永旭,季子琦,刘荣,2*
1(东北林业大学 林学院,黑龙江 哈尔滨,150040)2(黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨,150040)
老山芹(Heraclenmdissectum),学名东北牛防风,系伞形科牛防风属多年生草本植物,主要分布于中东北部林区、华北、俄罗斯等地。老山芹作为一种东北优质的含有丰富营养价值的药食两用山野菜,被认为是山林野菜中的“绿色黄金”[1]。已从老山芹中分离得到多种生物活性成分,包括多糖、黄酮、香豆素、皂苷等[2]。目前,对老山芹的研究主要集中在种植和栽培领域[3],对其化学成分和生物活性的报道较少。
植物多糖是一类重要的天然活性产物,具有广泛的生物活性,如降血糖、抗氧化、抗肿瘤、抗炎、调节免疫、调节肠道菌群等[4]。天然多糖因其良好的生物活性、生物降解性、生物相容性和无毒性,成为目前国内外研究的焦点[5]。有研究表明老山芹中多糖含量可达到10%以上[6],然而关于老山芹多糖(Heraclenmdissectumpolysaccharides, HDP)结构和生物活性的进一步研究尚未见报道。
人体内的α-淀粉酶和α-葡萄糖苷酶是糖代谢的关键酶,某些植物多糖通过抑制酶活性、减少葡萄糖吸收、增加葡萄糖代谢且增加胰岛素的敏感性,近而发挥调节糖代谢的作用[7]。因此,通过抑制α-淀粉酶和α-葡萄糖苷酶的活性可以明显延缓葡萄糖向血糖的转化,达到降低血糖的效果[8]。本研究通过对老山芹分离纯化、结构表征及体外降糖活性进行研究,为老山芹多糖进一步研究及开发提供依据。
1 材料与方法
1.1 材料与试剂
老山芹,黑龙江省嫩江农场;DEAE-cellulose 52、Sephadex G-100、纤维素酶、果胶酶、α-葡萄糖苷酶、α-淀粉酶、对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,PNPG),上海源叶生物科技有限公司;单糖标准品、溴化钾,阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
ELx800 NB型酶标仪,美国Bio Tek公司;RE-52旋转蒸发器,上海亚荣生化仪器厂;Thermo ICS5000离子色谱系统、Nicolet IS5型傅里叶变换红外光谱仪,美国赛默飞世尔科技公司;JSM-7500F型冷场发射扫描电子显微镜,日本电子株式会社(JEOL);X射线衍射(X-ray diffraction,XRD)仪,荷兰Panalytical公司;STA449F5型同步热分析仪,德国耐驰。
1.3 实验方法
1.3.1 HDP的提取
老山芹去除根部后,置于60 ℃烘箱烘干后粉碎备用。取10 g老山芹粉,加入400 mL超纯水,pH值调节至5,50 ℃的水浴酶解[纤维素酶和果胶酶2%(质量分数),质量比1:1]1 h,微波功率450 W加热12 min。离心浓缩,加入4倍体积的无水乙醇,醇沉24 h。利用Sevag法[V(氯仿):V(正丁醇)=4:1]脱蛋白,离心去除沉淀,重复多次至无白色沉淀,透析72 h后冻干得HDP。
1.3.2 HDP的分离纯化
取100 mg HDP溶于10 mL超纯水,0.45 μm的水系滤膜过滤。用装好的离子交换柱进行线性梯度洗脱,洗脱液为0、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液,洗脱速率为1 mL/min,洗脱时间为4 min/管。采用苯酚-硫酸法[9]测定每管洗脱液的总糖含量,根据洗脱体积和OD值大小绘制洗脱曲线。收集不同组分浓缩、透析、冷冻干燥。根据结果筛选出超纯水溶液的洗脱组分进行SephadexG-100柱洗脱,流速为0.4 mL/min,收集单一组分,浓缩冷冻干燥得HDP-1组分。
1.3.3 多糖分子质量测定
参照ZHU等[10]的方法采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定。
1.3.4 多糖的单糖组成分析
参照ZHANG等[11]的方法采用离子色谱法测定。
1.3.5 多糖紫外-可见光光谱(ultraviolet-visible spectroscopy,UV-VIS)和傅立叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
可见分光光度计对纯化多糖的纯度进行鉴定,配制质量浓度为1 mg/mL的溶液,在波长为200~400 nm进行紫外光谱扫描,检测是否含有蛋白质。
称取2 mg干燥的多糖样品和200 mg溴化钾,混匀后研磨至细,压成薄片后检测。以溴化钾为空白对照,在波数为4 000~500 cm-1进行红外光谱扫描。
1.3.6 刚果红试验
根据XU等[12]的方法对多糖是否具有三股螺旋结构进行测定。
1.3.7 扫描电镜分析
用导电胶将多糖粘在样品台上,在真空喷镀仪内喷上金膜,扫描电子显微镜下观察样品表面形态。
1.3.8 XRD衍射分析
采用X射线衍射,衍射条件为:Cuk α衍射,管压35 kV,管流100 mA,角度10°~70°,角度梯度0.02°。
1.3.9 多糖热重分析
称取样品5 mg,放置坩埚中,使用热重分析仪对其热稳定性进行测试。
1.3.10 老山芹多糖的体外降血糖活性测定
参考文献[13]的方法进行修改测定。
α-淀粉酶抑制:将10 μL的α-淀粉酶(1 U/mL)溶液与20 μL多糖溶液混合,37 ℃下反应15 min。加500 μL的淀粉溶液(1%,质量分数),反应10 min,加入600 μL的DNS试剂,沸水浴加热15 min。冷却后,在540 nm处测定吸光度,阿卡波糖作对照。抑制率计算如公式(1)所示:
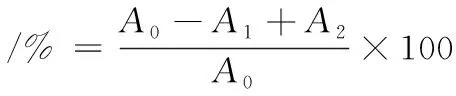
(1)
式中:A1,实验组吸光值;A2,背景组吸光值;A0,对照组吸光值。
α-葡萄糖苷酶抑制:40 μL α-葡萄糖苷酶溶液(0.2 U/mL)添加到20 μL的样品溶液中,37 ℃条件下,反应20 min后加入50 μL PBS(0.2 mol/L,pH值为6.9),40 μL PNPG(0.251 mg/mL),37 ℃条件下,反应20 min。加入140 μL Na2CO3溶液(2 mol/L)终止反应,405 nm下测定吸光度,阿卡波糖作对照,计算同公式(1)。
2 结果与分析
2.1 HDP的提取、分离和纯化
经过提取、脱蛋白、透析冻干后得到的HDP,提取得率为10.28%。HDP经DEAE-cellulose 52离子交换柱分离,分别在水洗脱与梯度盐洗脱部分得到4个峰,如图1所示,分别命名为HDP-1、HDP-2、HDP-3、HDP-4。各组分所得多糖比率分别为84.27%、8.96%、4.72%、2.05%。由于HDP-2、HDP-3、HDP-4的峰值和峰面积较小即含量比较少,因此选取HDP-1为下一步分离对象,经Sephadex G-100凝胶柱纯化,得到单一对称的单峰组分,透析后浓缩冻干得纯化多糖样品HDP-1。苯酚-硫酸法测得的HDP-1总糖含量为83.27%。
分别对分子量100 kDa、30 kDa、10 kDa超滤膜超滤所得截留液以及滤过液进行蛋白质含量测定,结果显示,10 kDa和30 kDa超滤膜对蛋白质的脱除率分别为70.81%和77.62%,100 kDa超滤膜对蛋白质的脱除率最高,达82.21%。随着超滤膜分子量的增大,蛋白质去除率提高。这是由于实验中用于超滤的灵芝子实体多糖溶液是经过纤维素酶和蛋白酶复合酶解灵芝子实体所得,因此较其他提取方法所得粗多糖溶液,酶解液中含有相对较多的游离小分子蛋白质。
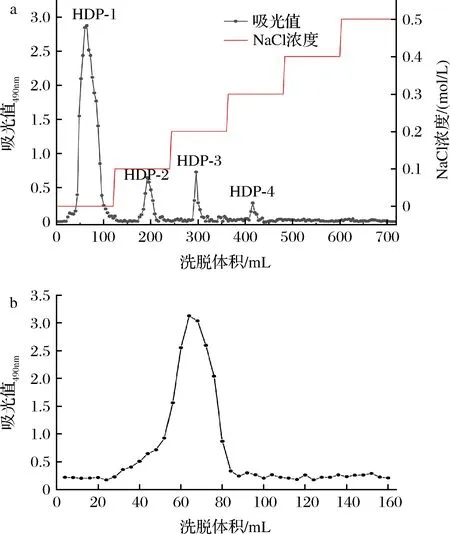
a-DEAE-52 纤维素柱色谱法洗脱曲线;b-SephadexG-100 柱层析的洗脱曲线图1 DEAE-52 纤维素柱色谱法洗脱曲线和SephadexG-100柱层析的洗脱曲线Fig.1 Elution curves of polysaccharides by 52 cellulose column chromatography and SephadexG-100 column chromatography
2.2 多糖分子质量测定
如图2所示,HDP-1的出峰时间为17.142 min,存在单一对称峰,多分散系数为1.202,表明HDP-1经分离纯化后为均一多糖。通过糖分子质量标准曲线y=-0.413 2x+11.13计算,HDP-1的平均分子质量分别为11.141 kDa。HDP-1属于低分子质量多糖,可能是由于提取时,酶的作用以及高温的影响破坏了多糖的分子链,降解多糖使其分子间氢键断裂从而导致多糖分子质量的降低[14]。有研究表明受提取方式的影响,一些多糖分子质量降低时,可能会使其水溶性增加,生物活性增强[15]。
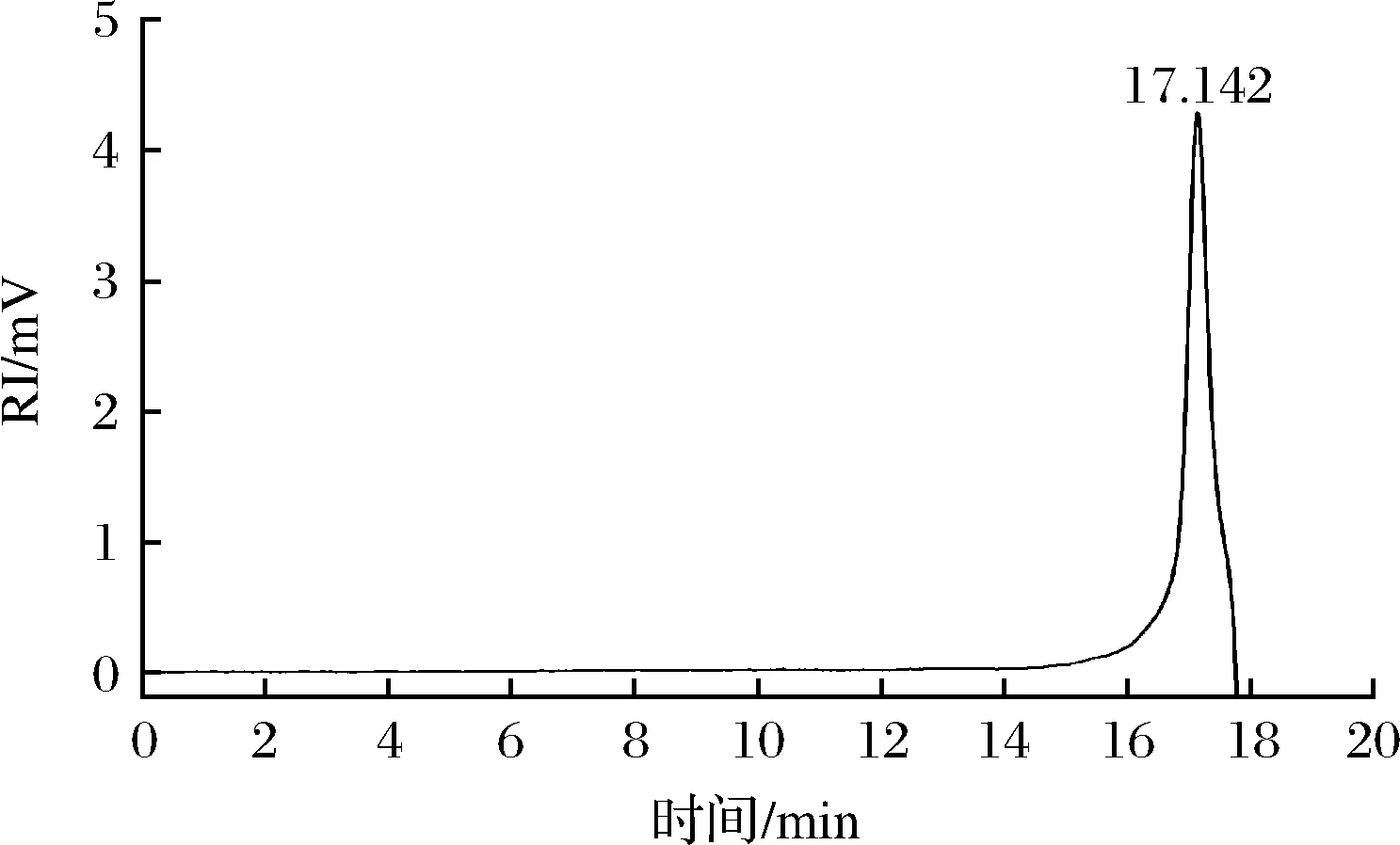
图2 HDP-1的分子质量分布Fig.2 HPGPC profile of molecular weight distribution of HDP-1
2.3 单糖组成分析
由图3可知,HDP-1由葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖、木糖、半乳糖醛酸、葡萄糖醛酸组成,摩尔比为5.96:1.95:1:1.03:1.02:0.29:0.31:0.12。由于HDP未有报道,与老山芹同属的伞形科白芷多糖的研究表明[16],白芷多糖由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖等7种单糖组成,摩尔组成比例为1.19:1.19:0.765:1:8.08:3.34,与本文分离纯化得到的单糖种类及占比类似,葡萄糖和半乳糖占比最高。
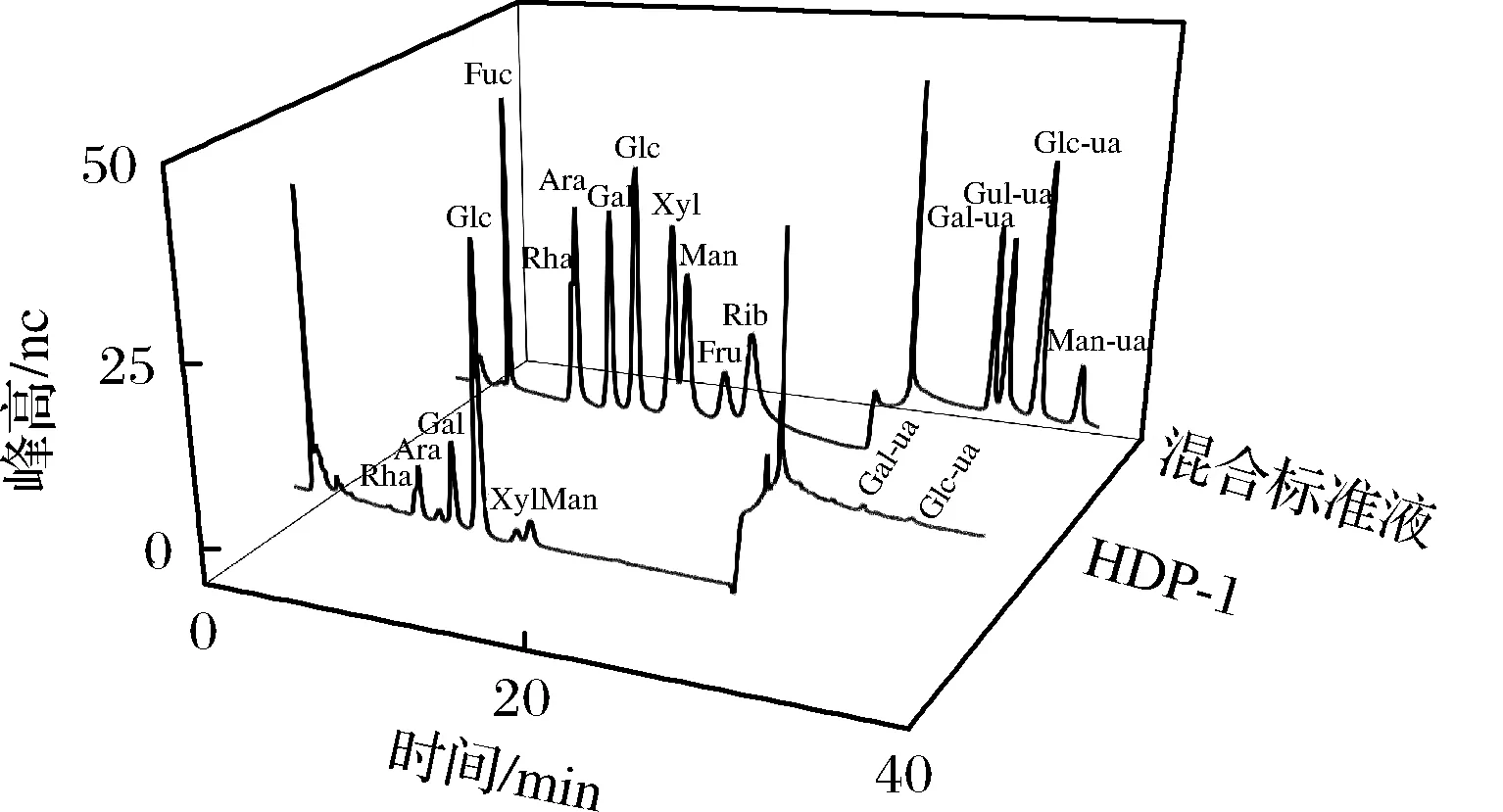
图3 单糖标准品和HDP-1单糖组成的离子色谱图Fig.3 Ion chromatogram of standards and HPD-1注:Fuc:岩藻糖;Rha:鼠李糖;Ara:阿拉伯糖;Gal:半乳糖;Glc:葡萄糖;Xyl:木糖;Man:甘露糖;Fru:果糖;Rib:核糖;Gal-ua:半乳糖醛酸;Gul-ua:古罗糖醛酸;Glc-ua:葡萄糖醛酸;Man-ua:甘露糖醛酸。
2.4 多糖紫外可见光谱和红外光谱分析
紫外可见光谱结果见图4-a,HDP-1在260 nm和280 nm波长处均无明显特征吸收,说明多糖中不含有蛋白质和核酸[17]。
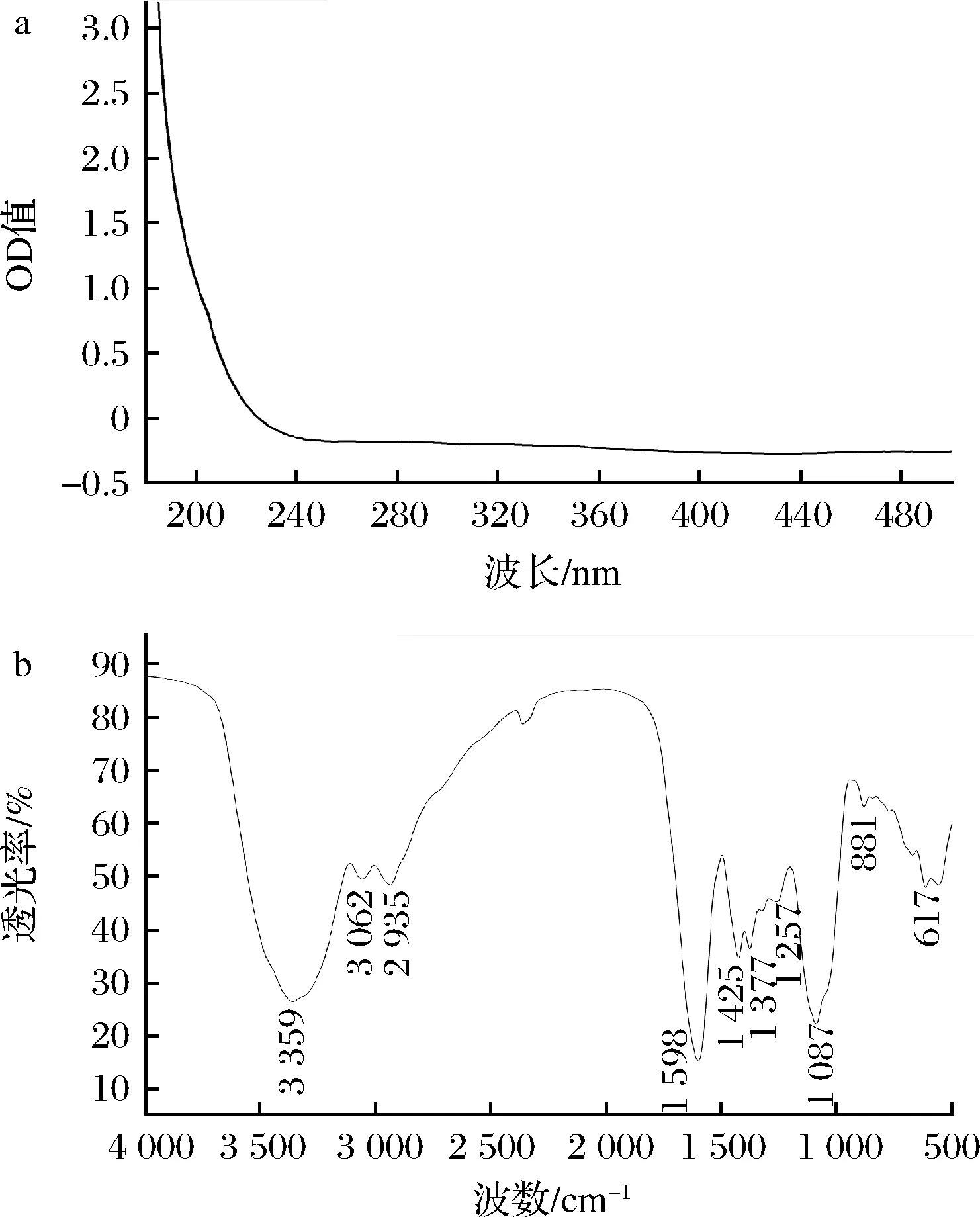
a-HDP-1紫外-可见光光谱分析;b-HDP-1红外光谱分析图4 HDP-1 的紫外-可见光光谱和红外光谱分析Fig.4 UV spectra and FI-IR spectra of HDP-1

2.5 刚果红试验
如图5所示,在NaOH作用下,HDP-1与刚果红络合物没有红移现象,表明HDP-1不具备三螺旋结构[21]。多糖的三螺旋结构与分子质量及单糖组成有关,小分子质量的多糖一般为单股螺旋结构,且杂多糖一般不会形成三螺旋结构[22]。这与前文分子质量及单糖组成得到的结论相互验证。
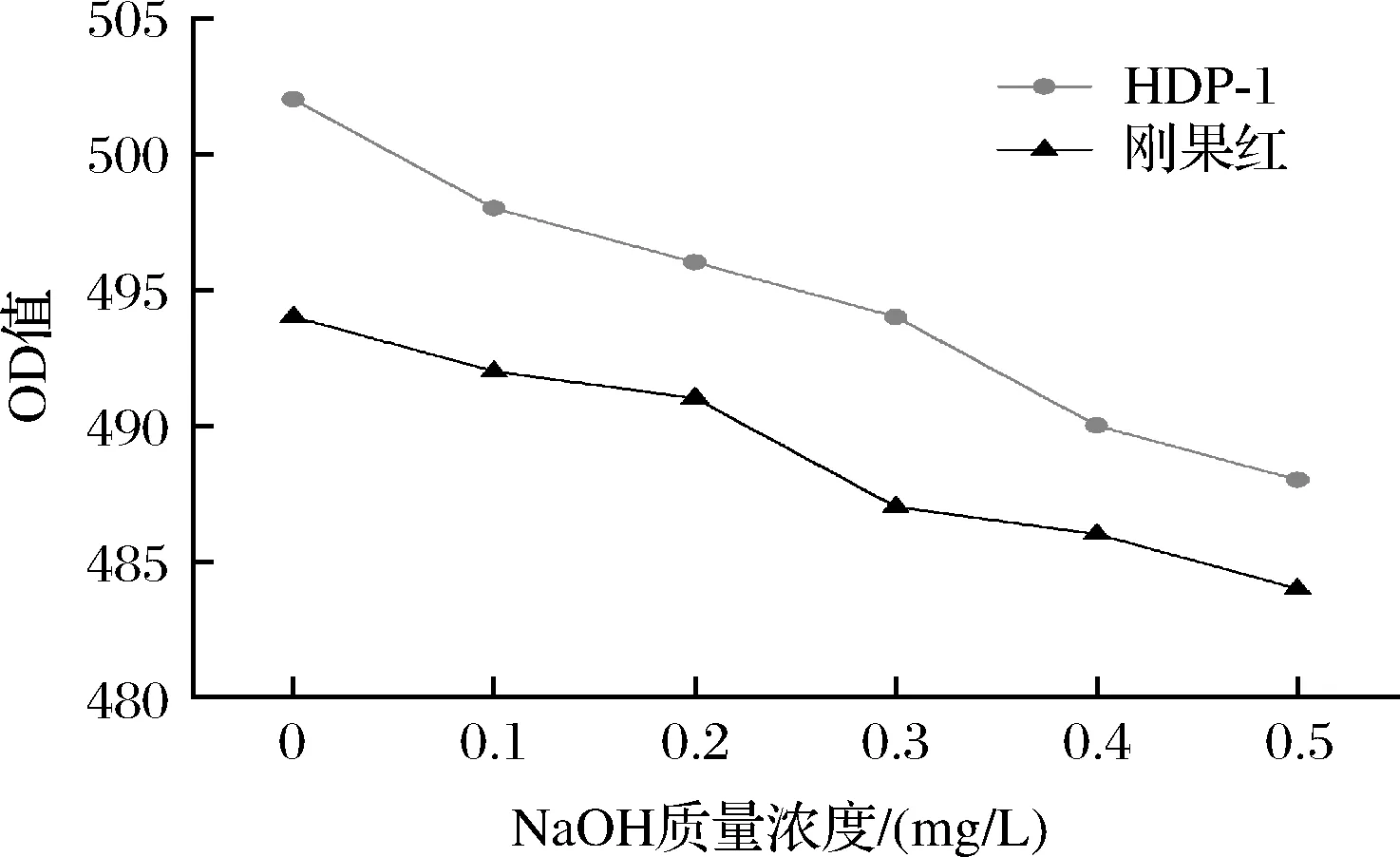
图5 HDP-1刚果红实验结果Fig.5 Results of Congo red with HDP-1
2.6 扫描电镜分析
图6为分别使用不同放大倍数的HDP-1的表观形貌。从图中可以看出在低倍镜下多糖表面粗糙呈片状,内部成分复杂聚集,HDP-1组分纯度高,未见杂质;在高倍镜下可以看到有细小不均匀的颗粒排列紧凑,相互堆积为表面较为紧实的结构,中心有贯穿的孔洞。多糖粗糙的表面结构使其更易与水结合,提高其溶解性[23]。多糖组分中单糖组成的差异也可能对多糖表面粗糙程度产生影响[24]。而其多孔结构可能是微波的热效应短时间升高其内部温度,使结构变得膨胀所导致。

图6 HDP-1的扫描电镜图Fig.6 SEM image of HDP-1
2.7 XRD衍射分析
多糖的结晶结构直接影响物理性质,包括溶解度、溶胀度、黏度或不透明性[25]。通过测定XRD图谱(图7),显示在20°左右,HDP-1有一个较为明显的大小不同的衍射峰,其峰形圆钝,峰强度较低,因此HDP-1结晶度较低,主要以非定型的结晶态存在。曾凡珂等[26]报道的荸荠皮多糖的XRD图谱衍射峰主要集中在2θ为20°~30°,峰形与HDP接近,结晶程度低,溶解性和生物利用度较好。
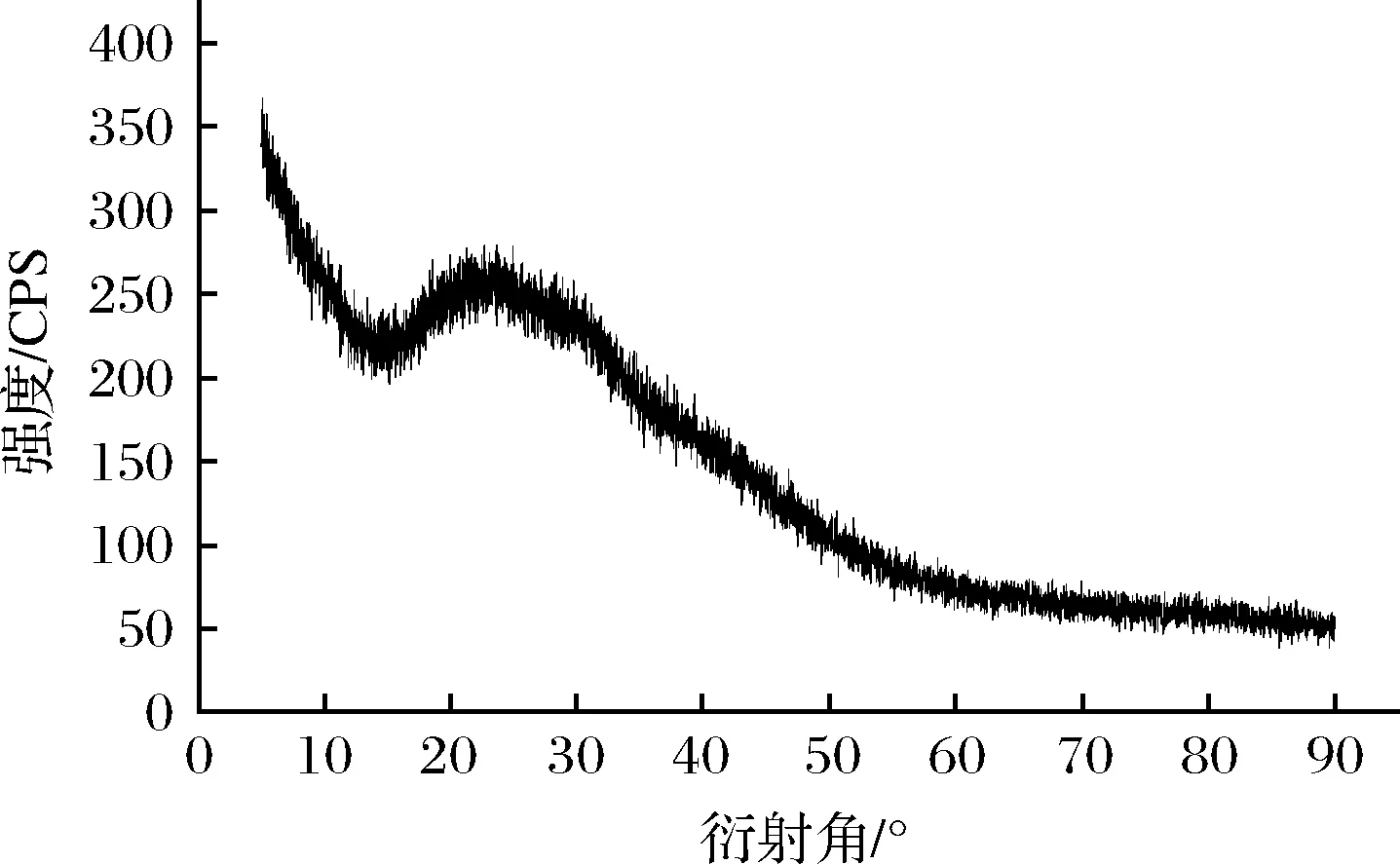
图7 HDP-1的X射线衍射图Fig.7 XRD patterns of HDP-1
2.8 多糖热重分析
由TG曲线(当前温度下样品质量与初始质量之比)和DTG曲线(将TG曲线上的各点相对于时间坐标进行一次微分)分析结果(图8)可知,HDP-1组分在20~240 ℃失重16.79%,在这个阶段,在81.93 ℃处有一个明显的热损失峰值,同时在202.55 ℃处开始出现一个较平缓的吸热峰,推测是多糖分子脱水引起的,这与前文的红外光谱结果中分析的HDP-1在1 598 cm-1处有结合水特征吸收峰的结果一致;HDP-1组分在240~600 ℃失重29.54%,在281.21 ℃时有吸收峰,并陡然增强,这可能是多糖化学降解和热分解造成的吸热峰,包括糖环的脱水和解聚以及水和二氧化碳的形成[27]。根据上述实验结果可以发现,HDP-1有着较好的热稳定性。
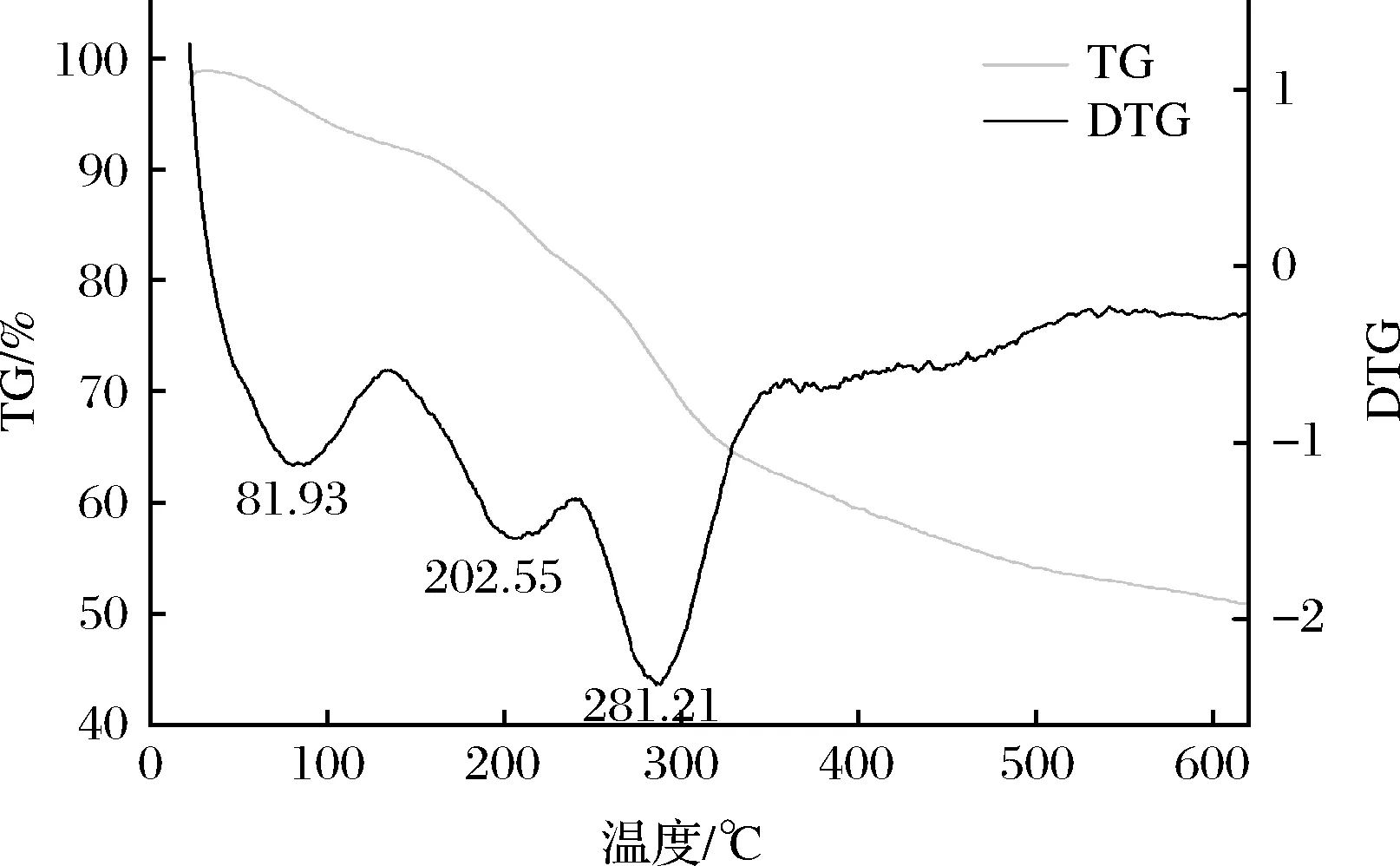
图8 HDP-1热重分析图Fig.8 Thermogravimetric analysis of OPS
2.9 体外降血糖活性测定
如图9所示,HDP对α-淀粉酶和α-葡萄糖苷酶的抑制作用呈剂量依赖性,均低于阳性对照组(阿卡波糖)的抑制能力。由图9-a可知,当质量浓度为1.25 mg/mL时,HDP-1对α-淀粉酶的抑制率为62.11%;当质量浓度为10 mg/mL,抑制率达到88.73%。由图9-b可知,HDP-1抑制α-葡萄糖苷酶的作用稍弱于α-淀粉酶。当质量浓度为10 mg/mL时,HDP-1对α-葡萄糖苷酶抑制率为73.25%。当质量浓度为15 mg/mL时,抑制率达90.95%。经回归方程计算HDP-1对α-淀粉酶和α-葡萄糖苷酶IC50值分别为0.765和3.288 mg/mL,以上数据证明老山芹多糖对α-淀粉酶、α-葡萄糖苷酶有较强的抑制能力。
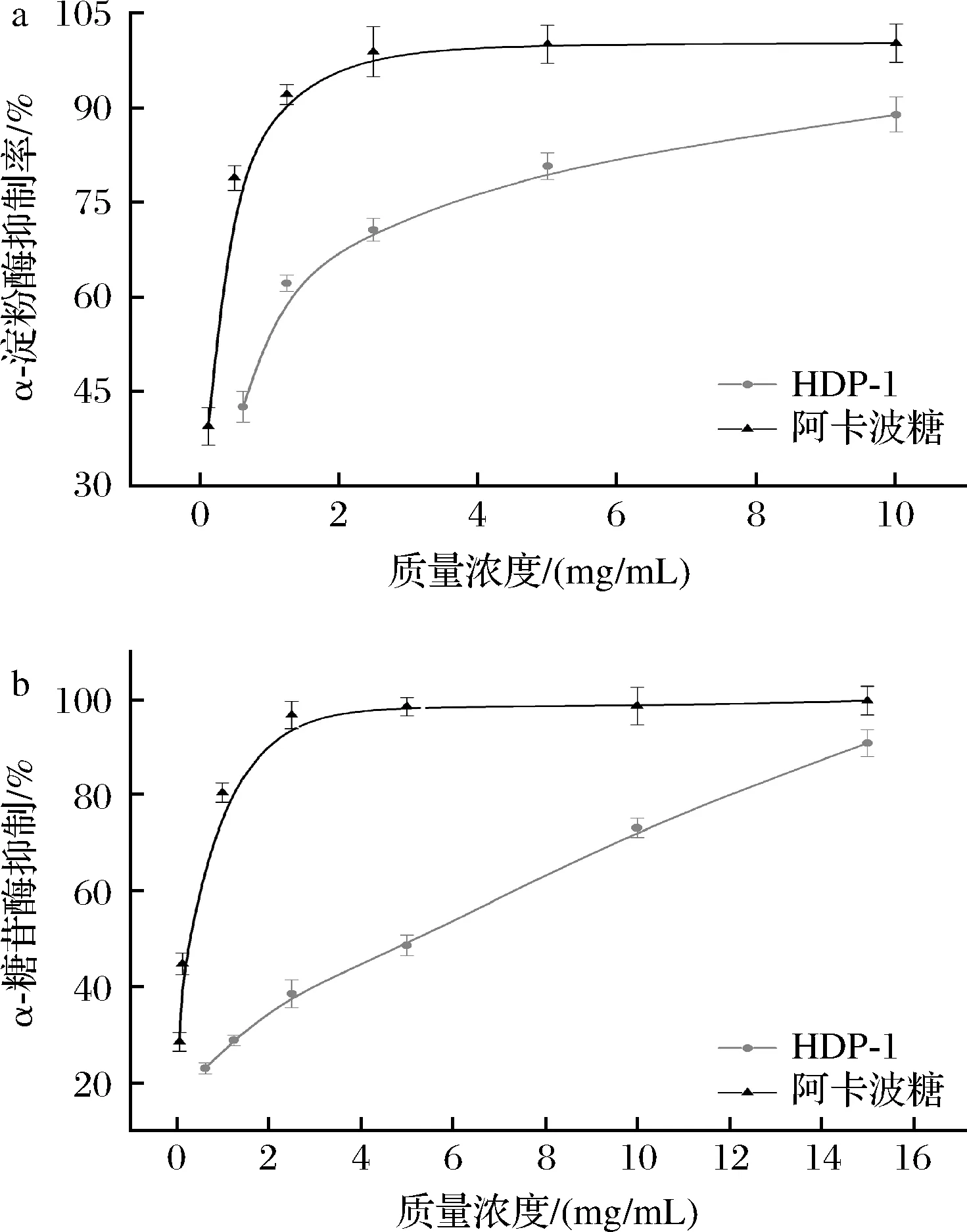
a-α-淀粉酶抑制作用;b-α-葡萄糖苷酶抑制作用图9 老山芹多糖对α-淀粉酶和α-葡萄糖苷酶抑制作用Fig.9 α-amylase activity α-glucosidase activity of HDP-1
研究表明,葡萄糖和半乳糖含量高的多糖具有较强的抑制α-淀粉酶和α-葡萄糖苷酶的活性[28]。分子质量、单糖组成、空间构象等因素均会影响多糖的生物活性。大部分具有降血糖活性的多糖都具有葡萄糖、半乳糖、阿拉伯糖和木糖,还有少部分具有半乳糖醛酸、鼠李糖和岩藻糖,多糖中个别单糖的存在或缺失会影响其降血糖活性[29]。因此,HDP-1其单糖组成种类丰富可能是决定其有良好降血糖活性的原因。此外,低分子质量的多糖通过抑制肠道内碳水化合物的降解进而抑制α-淀粉酶和α-葡萄糖苷酶活性[30]。因此,推测HDP-1的良好降血糖活性可能也与其分子质量较低有关。
3 结论
采用微波辅助酶法提取得到老山粗多糖HDP,经DEAE-cellulose 52和Sephadex G-100柱分离纯化得到组分HDP-1。结果表明,HDP-1是一种相对分子质量为11.141 kDa的均一多糖,总糖含量为83.27%,不含核酸和蛋白质。单糖组成分析表明HDP-1是由葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖、木糖、半乳糖醛酸、葡萄糖醛酸组成的杂多糖,摩尔比为5.96:1.95:1:1.03:1.02:0.29:0.31:0.12。HDP-1具有多糖的特征吸收基团,主要以β构型的吡喃糖苷存在且不具有三螺旋结构。扫描电镜下HDP-1呈球状或柱状的结构。XRD衍射光谱及热重分析结果显示,HDP-1主要以非定型的结晶状态存在且具有较好的热稳定性。HDP-1对α-淀粉酶和α-葡萄糖苷酶的半数抑制浓度(IC50值)为0.765、3.288 mg/mL,具有较好的体外降糖活性,证明了老山芹多糖的潜在药理价值。
本研究为进一步探讨老山芹多糖降血糖活性与结构的关系提供数据支持,同时也为天然植物多糖在医药和功能食品中的应用提供理论依据。
