云南晾晒烟中小分子的荧光光谱及显微成像
2023-10-08李惠杰谢富兰李干鹏张丽珠
翦 驰,李 卫,李惠杰,曾 伟,谢富兰,李干鹏,张丽珠
(民族药资源化学教育部重点实验室,云南民族大学 民族医药学院,云南 昆明 650504)
烟草是双子叶植物纲,管状花目,茄科,烟草属,一年生或有限多年生草本植物,其主要用于生产烟草制品[1].烟草中通常含有黄酮类、苯丙素类、生物碱类等成分,部分成分具有抗氧化活性、抗烟草花叶病毒活性等生理活性[2].目前,烟草研究主要有香味成分[3-5]、苦味成分[6]、甜味成分,比较试验[7],含量测定等,均在各方面极大丰富了烟草资源的开发利用及其深入研究.将荧光分析与烟草资源研究结合是一种重要的烟草研究策略,学者们运用该策略进行了一些有益的尝试:荧光动态自动检测烟叶病斑性状[8]、烟草叶片和原生质体的线粒体荧光标记[9]等.因此,烟草内源性荧光小分子的探索与研究极具潜在价值.
晾晒烟是指在阴凉通风处晾制或利用阳光调制而成的烟叶[10].基于云南独特的地理气候条件及丰富的晾晒烟资源,实验选取了具有云南特色的地方晾晒烟作为研究对象,以荧光分析为手段,研究了云南地方晾晒烟中的荧光小分子性能.云南晾晒烟是云南地区的特有种属,为研究其化学成分的相关性能,通过对云南晾晒烟进行成分分离纯化,得到了具有较强荧光的化合物QND 和YD.通过测试烟草提取物中荧光小分子QND 和YD 的光谱性能和细胞成像,发现两个小分子对pH 动态变化展示出荧光响应,探讨了云南地方晾晒烟中的荧光小分子对于细胞荧光成像的可行性,为晾晒烟成分微环境的动态监测,晾晒烟化学和药理研究,特别是烟叶成分的细胞显微成像以及pH 微环境变化的监测,提供了一种可行性的建议和理论依据.
1 材料与方法
1.1 材料、试剂和仪器(1)材料:Sephadex LH-20凝胶(美国GE 公司);蒽(阿拉丁);Hela 细胞;娃哈哈纯净水;甲醇;无水乙醇;氢氧化钠;B-R 缓冲液;PBS;DMEM 培养基;FBS(胎牛血清);1%青霉素和链霉素;DMSO;等.辅助试剂均为市售分析纯,如无特殊说明均未进一步纯化.
黄花烟草茎叶于2019 年3 月采自云南省曲靖市会泽县,经云南中医药大学杨礼攀副教授鉴定为黄花烟草的干燥茎叶.植物标本号为:NT201903HZ-02,保存在云南民族大学民族药资源化学教育部重点实验室标本室.
(2)仪器:核磁共振波谱仪(400M,德国Brucker);半制备液相色谱仪(安捷伦),液相质谱仪(UPLC-Q-LOF-MS),荧光分光光度计(安捷伦),紫外-可见分光光度计(安捷伦),pH 计(雷磁PHS-3C),万分之一天平(OHAUS),酶标仪(赛默飞),Leica 共聚焦激光显微镜(TCS SP8).
1.2 实验方法储备液配制:准确称量化合物样品,于溶剂(无水乙醇)中配制成0.1 mol/L 化合物储备液,存于冰箱待用.三维荧光光谱及pH 影响测试:分别在10 mL 容量瓶中加入化合物母液,调节pH,纯净水定容,摇匀,浓度10 μmol/L,扫描三维荧光光谱,激发狭缝宽度为5 nm,发射狭缝宽度为2.5 nm.荧光量子产率测试:在容量瓶中分别加入QND 或者YD 乙醇溶液和罗丹明B 溶液,摇匀,扫描吸收光谱和荧光光谱,计算荧光量子产率.
细胞毒性与成像:将Hela 细胞培养在DMEM培养基中,培养时添加1%链霉素和青霉素,10%FBS,5% CO2,37 ℃恒温箱中培养24 h,待细胞贴壁后进行细胞实验.细胞毒性采用0~50 μmol/L QND(YD)溶液处理细胞,分别在24 h 观察细胞状态.细胞成像将10 μmol/L QND(YD)加至含贴壁细胞的DMEM 培养基中,培养1 h,用PBS 洗涤两次后,共聚焦显微镜获取图像.
2 结果与讨论
2.1 化合物分离及结构鉴定晾晒烟烟叶32 kg粉碎,用300 L 95%乙醇回流提取3 次(每次5 h),得总提取物5.35 kg.将晾晒烟浸膏过400 目(0.038 5 mm)滤网,滤液(干质量4.38 kg)经60 L AB-8 大孔吸附树脂,用95%乙醇(4BV)进行洗脱(1.85 kg).再经CHP-20P MCI 柱色谱,用30%乙醇(3BV)进行洗脱,得组分563 g.
称取30%乙醇洗脱组分(550 g),经硅胶柱色谱(0.054~0.038 5 mm,300~400 目)以二氯甲烷进行洗脱,洗脱液浓缩后经过反复薄层色谱分析鉴别后合并,最终得到Fr.A 流分.Fr.A(13.8 g)经CHP-20PMCI 柱色谱,用80%甲醇(3BV)进行洗脱,得到样品组分(Fr.A4).Fr.A 4(6.62 g)通过Sephadex-LH-20 进行分离纯化,流动相为甲醇,TLC 反复鉴别并合并后,得到次级组分(Fr.A 4.3、Fr.A4.4).Fr.A 4.3(2.12 g) 经半制备型HPLC [甲醇-水 (体积比65∶35),3 mL/min] 分离得到化合物QND(16.9 mg,tR=8.32 min).Fr.A 4.4 经半制备型HPLC [甲醇-水 (体积比70∶30),3 mL/min]分离得到化合物YD(6.5 mg,tR=13.23 min).化合物分离及结构鉴定主要基于实验室前期工作基础,相关数据与文献[11]保持一致.
化合物2-甲基喹啉(QND)和化合物3-羧酸吲哚(YD)结构如图1 所示,核磁及质谱信息如支撑材料附件图S1、S2 所示.
化合物QND:无色油状液体,易溶于CH3OH.分子式:C10H9N,HR-ESI-MSm/z: 144.083 2[M+H]+.1H NMR (400 MHz,CH3OH-d4)δH:7.92~7.80(2H,m,H-4,9),7.61(1H,dd,J=8.2,1.5 Hz,H-6),7.54(1H,ddd,J=8.5,6.9,1.5Hz,H-8),7.33(1H,ddd,J=8.1,6.9,1.2 Hz,H-7),7.08(1H,d,J=8.4 Hz,H-3),2.52(3H,s,CH3).13C NMR (100 MHz,CH3OH-d4)δC:160.0(C-2),148.1(C-10),137.9(C-4),130.7(C-8),128.7(C-9),128.2(C-6),127.7(C-7),126.9(C-5),123.0(C-3),24.6(—CH3).
化合物YD:浅棕色固体,易溶于CH3OH,分子式:C9H7O2N,HR-ESI-MSm/z: 162.066 3 [M+H]+.1H NMR (400 MHz,CD3OD)δH:8.08 (1H,ddd,J=7.9,2.2,0.9 Hz,H-7),7.95(1H,s,H-2),7.43 (1H,ddd,J=7.3,2.0,0.9 Hz,H-4),7.18 (2H,m,H-5,H-6).13C NMR (100 MHz,CD3OD)δC:169.5 (—COOH),138.2 (C-7a),133.3 (C-2),127.5 (C-4a),123.5(C-5),122.2 (C-6),122.0 (C-7),112.8 (C-4),108.7 (C-3).
以上数据与文献报道对照基本一致[12-13],故鉴定化合物分别为quinaldine、indol-3-carboxylicacid.
2.2 三维荧光图谱三维荧光光谱法可同时提供更多被测物质的信息,本实验采用了三维荧光法测试了化合物QND 和YD 的三维荧光图,如图2 所示.从图2(b)中可以看出,QND 在405 nm 处有一组较强发射峰,λexi分别位于240、310 nm 处,具有较大的斯托克斯位移,对于细胞内成像具有干扰较小的优势,因此在实验中选择310 nm 为整个实验的激发波长.图2(e)中YD 在325 nm 附近有一组较为明显的荧光峰,相应激发波长为220 nm 和280 nm,为获得最大发射波长值,在实验中选择了275 nm 为化合物YD 的激发波长.图2(c)和图2(d)分别是两个化合物在强碱和强酸条件下的图谱,在此条件下,化合物通常呈离子状态,不发射荧光[14].通过研究两个化合物酸碱性的三维荧光图谱,为实现在弱酸性、中性和弱碱性条件下的细胞荧光显微成像提供前提条件.
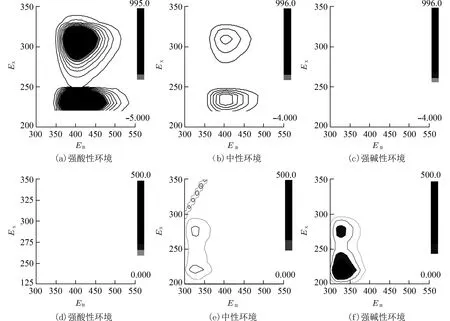
图2 化合物QND 和YD 三维荧光图谱(等高线:50)Fig.2 3D fluorescence spectrum of QND and YD
2.3 pH 对荧光光谱的影响图3 和图4 显示了化合物QND 和YD 受pH 变化影响的二维图,通过在不同pH 环境下的三维光谱比较分析,在酸性条件下的QND 荧光发射较强,随着pH 值的增大,荧光明显减弱最终消失.与QND 的pH 响应相反,在酸性条件下的YD 荧光猝灭,随着pH 值的增大,荧光明显增强.QND 和YD 的电离常数如表1 所示.

表1 质子电离常数测定结果Tab.1 Results of proton ionization constant determination

图3 不同pH 条件下QND 的荧光光谱及荧光强度Fig.3 Fluorescence spectrum and intensity of QND at different pH
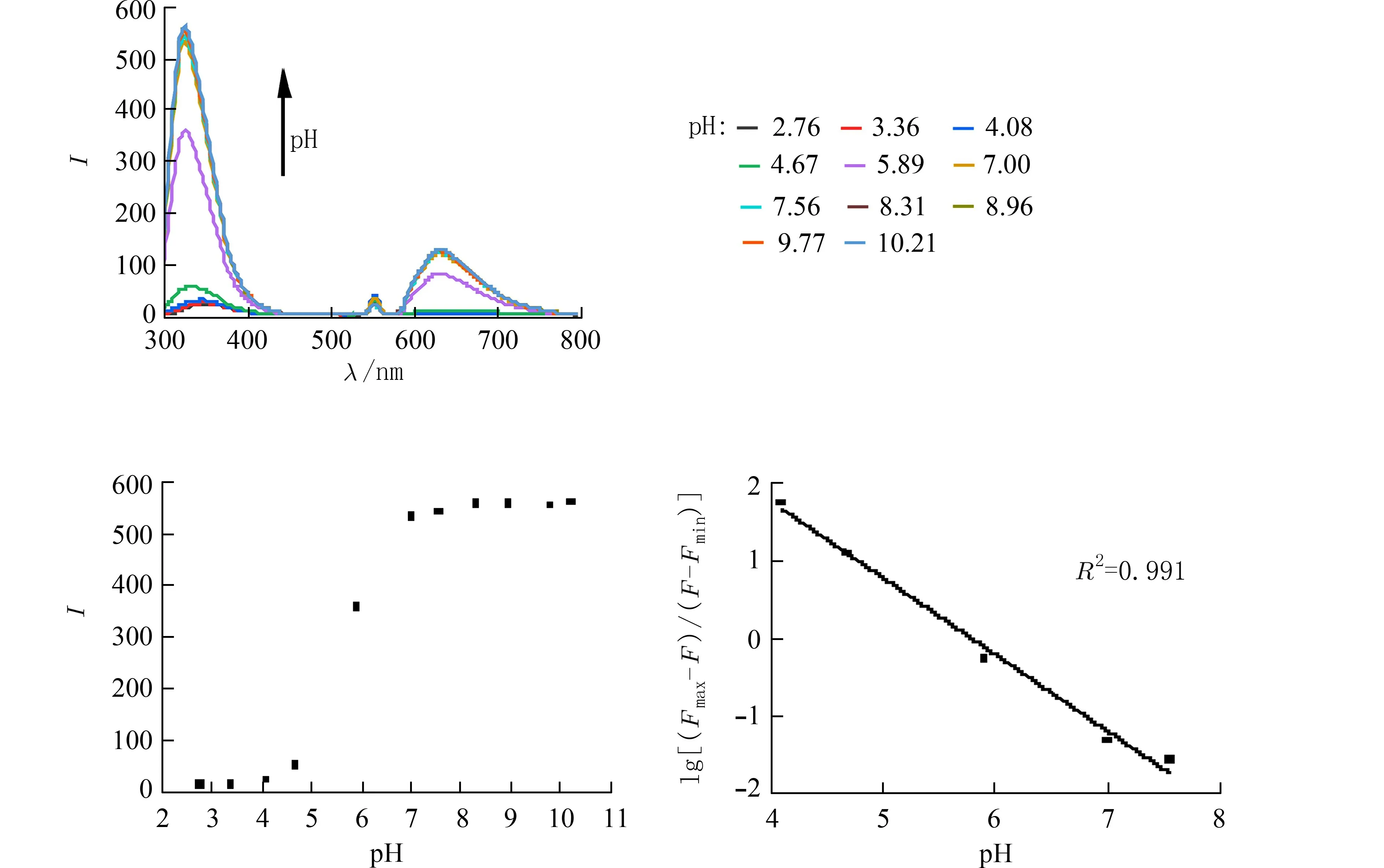
图4 不同pH 条件下YD 的荧光光谱及荧光强度Fig.4 Fluorescence spectrum and intensity of YD at different pH
QND 随pH 改变的荧光光谱谱图如图3 所示.在酸性环境中,荧光较强,且随pH 值的增加,荧光减弱.以405 nm 处的荧光强度为例,pH 从7.82 降低至2.61,荧光强度增强95 倍.在碱性环境中,荧光基本猝灭.
pH 变化对YD 的荧光影响如图4 所示,随着pH 的增加,荧光强度升高.当pH<3.36 时,荧光强度极低.在pH 3.36~7.56 区间,随pH 增加,荧光强度逐渐升高.当pH>8.31 时,荧光强度达到最大之后不再变化.在pH 2.76~4.67 区间内,发射波长由350 nm 蓝移至336 nm,当pH>5.89 后,发射波长不再变化,保持在326 nm.pH 从2.76 升高至10.21,荧光强度增强40 倍.化合物QND 和YD 对环境pH 的响应可能是由于分子的ICT 效应引起[13-15].
2.4 荧光量子产率的测定本文还测定了化合物QND 和YD 的荧光量子产率,选取罗丹明B 在乙醇中的量子产率为0.89 为参比进行测定.如表2所示,通过公式,我们计算了两种化合物在纯有机相乙醇中的荧光量子产率,得到QND 量子产率为0.17,YD 量子产率为0.12,此结果具有一定的参考价值,两种物质均为较强荧光化合物,为进一步进行细胞的荧光显微成像提供了条件.

表2 荧光量子产率Tab.2 Fluorescence quantum yield
2.5 生物学测试
2.5.1 细胞毒性 为评价烟叶中的两种小分子在pH 条件下的细胞成像能力,采用CCK8 法进行了化合物QND 和YD 的细胞毒性实验,图5(a)为使用0~50 μmol/L 范围内不同梯度的QND 分别处理Hela 细胞24 h 后,酶标仪测量吸光度计算得到的细胞存活率,图5(b)为0~50 μmol/L 范围内不同梯度的YD 分别处理Hela 细胞24 h 后计算的细胞存活率.从图5 可以看出,在0~50 μmol/L 的QND 和YD 处理Hela 细胞24 h 后,仍然有90%以上的细胞存活率.因此,QND 具有较低的细胞毒性,对细胞损伤较小,可以进行细胞成像.

图5 不同浓度QND 和YD 的细胞毒性Fig.5 Cytotoxicity of QND and YD at different concentration
2.5.2 细胞成像 为探究细胞内成像效果,将化合物QND 和YD 进行了细胞共聚焦荧光成像,选用Hela 细胞对其进行染色成像,QND 和YD 浓度均为10 μmol/L,染色1 h 后观察成像结果,图6(a)~(c)为QND 细胞成像实验,图6(d)~(f)为YD 细胞成像实验.如图6 所示,(a)、(d)为细胞的明场照片,(b)、(e)为细胞在绿光通道下的荧光显微成像,而(c)、(f)则为细胞明场与激光条件下叠加后的细胞成像图片.从图6 中可以看出,含有化合物的细胞在明场中变化不大,但是在荧光条件下可以发出蓝色荧光,而且荧光主要出现在细胞质中,与化合物YD 相比,化合物QND 的荧光要更强一些,这与QND 和YD 的荧光量子产率相一致.细胞成像实验表明,QND 和YD 可以成功应用于Hela 细胞荧光成像,具备监测细胞内环境pH 变化的潜力.

图6 QND 和YD 染色Hela 细胞Fig.6 Images of Hela cells loaded with QND and YD respectively
3 总结
实验以云南地方晾晒烟为原料,通过提取分离,得到了两种对于pH 响应良好的荧光小分子QND和YD.随着pH 的变化,荧光显示出明显的强度变化,QND 在酸性条件下显示出强烈荧光,而YD 在碱性条件下显示出强烈荧光.通过荧光量子产率的测试,QND 和YD 均为强荧光小分子.同时在QND 和YD 浓度梯度为0~50 μmol/L 的条件下进行了细胞毒性测试,当孵育细胞24 h 后,细胞仍有较高的存活率,表明两种小分子均有较好的生物相容性.同时,两种小分子均成功应用于Hela 细胞荧光显微成像.因此,两种小分子对于pH 环境的此种荧光响应为机体病理条件下pH 微环境的动态变化监测,生物医学的研究和应用提供了实验基础,为烟草植物的研究提供了一种新的研究思路,具有良好的研究应用前景.
