一种手性β-氨基膦酸酯的合成方法研究
2023-10-08杨丽娟钏永明李宏利
张 鹏,杨丽娟,钏永明,李宏利
(云南民族大学 化学与环境学院,云南 昆明 650500)
有机磷化合物在生化研究中具有相当重要的地位,因其具有良好的生物活性而被广泛的应用在医学研究中[1-4].氨基磷酸及其衍生物在有机磷化合物中也是一类具有吸引力的化合物[5-7],天然存在的氨基酸和肽、蛋白质以及酶的单元结构对于生命化学的重要意义不言而喻,因此合成类似结构的化合物以及研究其化学与生物性质具有相当重要的意义[8].氨基膦酸可作为氨基酸电子等排体或作为天然产物的生物等效类似物,β-氨基磷酸作为β-氨基酸的电子等排体在抗菌性[9-10]、催化抗体[11]以及抗HIV 药物[12-13]中具有广泛的应用.
已经报道的合成β-氨基磷酸的方法主要有金属催化、仿生合成和有机催化.例如,使用有机染料和光作为催化剂的亚磷酸酯和胺之间的交叉脱氢偶联反应,将可见光与有机染料结合用于合成氨基磷酸酯[14].α-氨基酸衍生的内酯与手性双官能方酰胺有机催化剂可实现由靛红衍生的酮亚胺的高度立体选择性Mannich 反应,从而以中等至良好的收率(40%~95%)提供具有邻位四级立体中心的α,β-二氨基酸衍生物[15].从α-酰胺基砜原位产生的磷酸甘氨酸席夫碱与N-Boc-亚胺的催化对映选择性Mannich 反应获得旋光性α,β-二氨基膦酸衍生物[16].使用相转移催化剂催化的Mannich 反应已经成功用于β-氨基膦酸及其衍生物的合成中.使用结构合适的膦酸酯与α-氨基砜在相转移催化剂的作用下,可以实现β-氨基膦酸酯衍生物的合成.在前期的研究中,我们已经报道了一种通过相转移催化的 (1-重氮基-2-氧代丙基) 膦酸二甲酯 (Ohira-Bestmann 试剂) 与α-氨基砜的Mannich 反应制备β-氨基膦酸衍生物的方法[17-18],该方法能高收率地获得β-氨基膦酸,但是产物为外消旋体.基于前面的研究内容,我们设计拟使用手性的相转移催化剂来催化该反应,以期待能获得具有对映选择性的β-氨基磷酸酯衍生物.以天然的金鸡纳生物碱奎宁和辛克宁为原料,合成了4 个手性相转移催化剂,并通过对反应条件的优化,拟开发出一条制备手性β-氨基磷酸酯的路线.
1 实验部分
1.1 试剂与仪器Bruker Amazon SLKF0203G003离子阱质谱(MS)仪,瑞士布鲁克公司;Bruker Avance 400 MHz 核磁共振仪,TMS 内标;X-5 显微熔点测定仪,北京泰克仪器有限公司;GA354 薄层硅胶板,0.054~0.077 mm(200~300 目)柱层析硅胶,青岛海洋化工厂.
对甲氧基苯甲醛、羰基二叔丁酯、对甲基苯磺酸钠、奎宁、辛克宁,购于Acros、Fluka、Aldrich、阿拉丁等试剂公司,未纯化;氨水、四氢呋喃、甲酸、甲醇、甲苯、乙酸乙酯、氢氧化钠、氯化钠、无水硫酸钠均为市售分析纯试剂;实验中需要用的无水溶剂均按标准方法干燥;氨基甲酸叔丁酯为自制.
1.2 实验方法
1.2.1 催化剂的合成 以奎宁和辛可宁为原料,与2-硝基溴苄和2-三氟甲基溴苄反应制备4 个手性相转移催化剂,其结构如图1 所示.

图1 金鸡纳碱衍生的相转移催化剂Fig.1 Cinchonadine-derived phase transfer catalyst
(1)催化剂A 和B 的合成方法:以B 为例,取奎宁(0.649 g,2 mmol)和2-三氟甲基溴苄(0.717 g,3 mmol)溶解于10 mLV(甲苯)∶V(THF)=1∶1 溶液中(THF 为四氢呋喃),于80 ℃下反应24 h.反应完毕后,减压除去溶剂,柱层析(CHCl3/CH3OH)后得到催化剂B(0.96 g,收率85%).合成路线见图2.
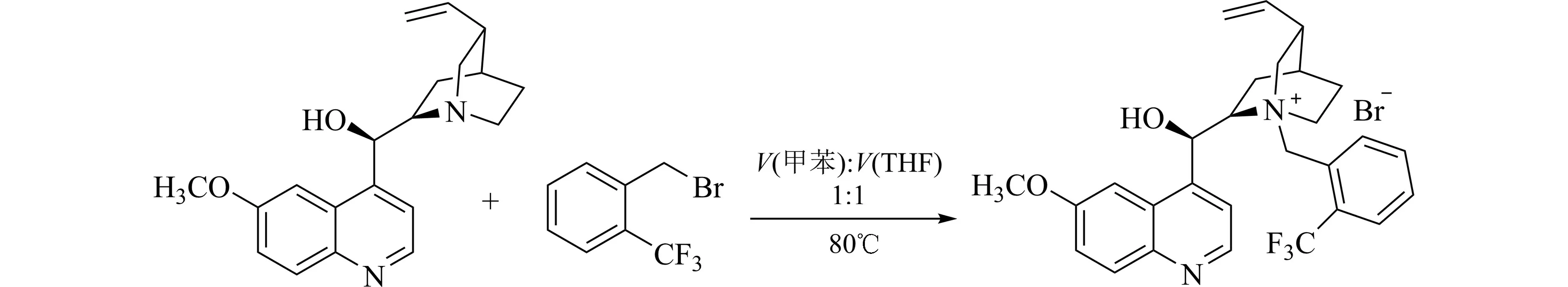
图2 奎宁衍生的相转移催化剂合成方法Fig.2 Synthesis of quinine-derived phase transfer catalysts
(2)催化剂C 和D 合成方法:以D 为例,取辛可宁(0.59 g,2 mmol)和2-三氟甲基溴苄(0.62 g,2.6 mmol)溶解于10 mLV(THF)∶V(C2H5OH)∶V(CHCl3)=3∶2.5∶1 溶液中,于100 ℃下反应过夜,反应完毕后,减压除去溶剂,柱层析(CHCl3/CH3OH)后得到催化剂D(0.75 g,收率72%).合成路线见图3.
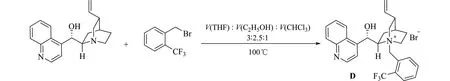
图3 辛可宁衍生的相转移催化剂合成方法Fig.3 Synthesis method of cinchonine-derived phase transfer catalyst
1.2.2 Ohira-Bestmann 试剂的合成 合成路线见图4.取α-氯代丙酮(8.8 mL,0.11 mol)和亚磷酸三甲酯(12.4 g,0.1 mol)溶解于60 mL 丙酮和50 mL乙腈的混合溶液中,加入KI(18.3 g,0.11 mol),在室温下搅拌反应6 h,再于50 ℃下反应4 h.反应完成后过滤除去固体,滤液减压除去溶剂,柱层析得到1a(13.2 g,收率80%).

图4 Ohira-Bestmann 试剂的合成方法Fig.4 Synthesis of Ohira-Bestmann reagent
取NaH(0.85 g,21.2 mmol,60%)加入到20 mL无水苯和4 mL 无水THF 的混和溶液中,冰水浴冷却,缓慢地滴加含有1a(1.767 g,10.6 mmol)无水苯溶液4 mL,在0 ℃下搅拌反应1 h;再加入对乙酰氨基苯磺酰基叠氮(2.81 g,11.7 mmol),移去冰水浴,搅拌反应,TLC 监测反应至1a 消耗完毕.反应混合物用硅藻土抽滤,滤液减压浓缩后柱层析(PE/EtAcO)得到Ohira-Bestmann 试剂2a(1.6 g,收率80%).
采用上述相同的方法,可以分别以85%和75%的收率得到化合物1b 和2b.
1.2.3 催化反应操作 取化合物3(59 mg,0.15 mmol)和相转移催化剂D(7.9 mg,0.015 mmol)于反应试管内,分别加入2 mL 甲苯和0.25 mL 10% NaOH 溶液,在-40 ℃下搅拌5 min 后,加入化合物1a(30 mg,0.15 mmol),在-40 ℃下搅拌反应,TLC 监测至1a 消失,加入20 mL 乙酸乙酯和2 mL水稀释反应体系,分液,有机相用饱和NaCl 溶液洗涤,无水Na2SO4干燥,脱溶剂后柱层析 [V(PE):V(EtAcO)=2:1~1:1] 得到化合物4a(52 mg,收率90%).产物的对映选择性通过含有手性固定相色谱柱的HPLC 测定.产物的绝对构型通过与已报道文献的液相保留时间对照确定[19].反应式见图5.
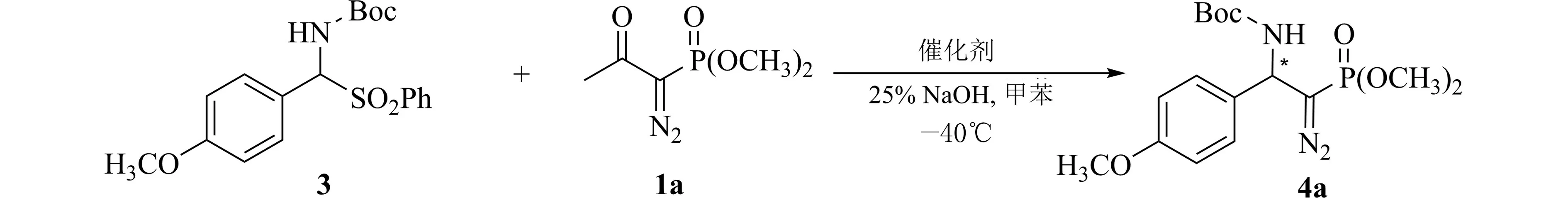
图5 催化反应式Fig.5 Formula of catalytic reaction
1.2.4 化合物的结构表征 催化剂A.m.p.179.1~181.5 ℃,αD20=-110.1 (c=0.5,CHCl3);1H NMR(300 MHz,CDCl3)δ: 8.78 (d,J=4.5 Hz,1H),8.51 (d,J=7.5 Hz,1H),8.11 (t,J=9.3 Hz,1H),8.04 (d,J=9.2 Hz,1H),7.85 (dd,J=13.4,5.9 Hz,2H),7.73 (t,J=7.7 Hz,1H),7.38 (dt,J=11.6,5.7 Hz,1H),7.07(t,J=9.5 Hz,1H),6.69 (q,J=6.7 Hz,2H),6.60 (d,J=12.5 Hz,1H),5.63~5.41 (m,2H),5.17~4.87 (m,3H),4.03 (s,3H),3.87~3.66 (m,1H),3.39~3.04 (m,3H),2.69 (d,J=29.1 Hz,3H),2.47~2.17 (m,2H),1.87 (t,J=10.4 Hz,1H),1.45 (t,J=11.9 Hz,1H);13C NMR (75 MHz,CDCl3)δ: 158.44,150.35,147.59,144.02,142.74,137.74,135.97,134.93,132.33 (d,J=16.9 Hz),126.20,125.42,122.20,121.45,120.70,118.11,99.65,71.81,63.50,60.51,59.36,55.85,52.15,37.84,26.12,24.81,21.68;HRMS: [M+Na]+,m/z=562.131 2 (计算),562.131 0 (实测).
催化剂B.m.p.153.1~155.5 ℃,αD20=-124(c=1.0,CHCl3);1H NMR (300 MHz,CDCl3)δ: 8.81(d,J=4.5 Hz,1H),8.43 (d,J=7.6 Hz,1H),8.07 (d,J=9.2 Hz,1H),7.91~7.74 (m,3H),7.69 (t,J=7.6 Hz,1H),7.42 (dd,J=9.2,2.4 Hz,1H),7.15~7.01(m,2H),6.78 (t,J=12.5 Hz,1H),6.70 (d,J=6.9 Hz,1H),5.58 (ddd,J=17.1,10.4,6.8 Hz,1H),5.36 (t,J=11.4 Hz,1H),5.03 (dd,J=22.3,13.8 Hz,2H),4.68 (t,J=12.7 Hz,1H),3.98 (s,3H),3.70 (dd,J=10.5,5.6 Hz,1H),3.46~3.26 (m,1H),3.16 (t,J=11.6 Hz,1H),3.06~2.91 (m,1H),2.73~2.39 (m,3H),2.29 (d,J=13.5 Hz,1H),2.05 (d,J=11.5 Hz,1H),1.90 (t,J=10.3 Hz,1H),1.51 (dd,J=13.1,11.2 Hz,1H);13C NMR (75 MHz,CDCl3)δ: 158.43,147.74,144.31,142.87,137.23,135.97,133.22,132.47,131.37,127.85,125.58,124.95,121.73,120.95,118.07,100.08,72.84,63.41,61.83,60.83,55.67,52.26,37.85,26.24,25.02,21.92;HRMS: [M+Na]+,m/z=585.133 5 (计算),585.133 0 (实测).
催化剂C.m.p.177.8~178.4 ℃,αD20=+231(c=0.41,CH3OH);1H NMR (300 MHz,MeOD)δ:8.95 (d,J=4.6 Hz,1H),8.41 (d,J=7.7 Hz,1H),8.25(t,J=7.9 Hz,1H),8.13 (t,J=6.9 Hz,2H),8.00~7.79 (m,6H),6.66 (s,1H),6.03 (ddd,J=17.4,10.4,7.2 Hz,1H),5.87 (t,J=12.0 Hz,1H),5.43 (t,J=12.1 Hz,1H),5.25 (dd,J=13.8,8.5 Hz,2H),4.89 (d,J=15.5 Hz,1H),4.44 (t,J=9.3 Hz,1H),4.16 (t,J=9.4 Hz,1H),4.02 (d,J=4.2 Hz,1H),3.33 (dd,J=14.5,6.3 Hz,2H),3.20 (dd,J=20.4,9.3 Hz,1H),2.64 (dd,J=16.8,8.3 Hz,1H),2.53~2.38 (m,1H),2.04~1.76(m,4H);13C NMR (75 MHz,MeOD)δ: 151.41,149.70,147.28,146.00,136.78,136.17,133.56,132.20,129.86,128.86,127.85,126.09,124.68,123.08,121.36,119.79,116.70,68.20,65.66,57.74 56.81,55.39,37.60,26.70,23.33,20.94;HRMS:[M+Na]+,m/z=532.120 6 (计算),532.120 1 (实测).
催化剂D.m.p.173.3~177.3 ℃,αD20=+116.5(c=0.4,CHCl3);1H NMR (300 MHz,CDCl3)δ: 8.78(d,J=4.5 Hz,1H),8.40 (dd,J=13.3,7.9 Hz,2H),7.87 (d,J=4.4 Hz,1H),7.82 (d,J=7.8 Hz,1H),7.67~7.50 (m,3H),7.41~7.30 (m,2H),6.68 (s,1H),6.55 (s,1H),5.20 (dd,J=17.2,13.9 Hz,2H),4.67 (s,1H),4.58~4.44 (m,1H),4.32 (t,J=9.1 Hz,1H),3.15(t,J=11.3 Hz,1H),2.90~2.61 (m,1H),2.46 (d,J=17.3 Hz,2H),2.38 (dd,J=16.5,8.5 Hz,1H),2.28~2.10 (m,1H),1.87~1.65 (m,3H);13C NMR(75 MHz,CDCl3)δ: 149.65,147.35,145.08,137.66,135.43,132.65,131.66,131.31,130.90,129.43 (d,J=14.9 Hz),127.86 (d,J=12.3 Hz),125.87,125.20,124.17 (d,J=12.5 Hz),122.21,119.95,118.11,67.74,65.88,57.85,56.49,55.48,38.06,29.77,26.84,24.0,21.85;HRMS: [M+Na]+,m/z=555.122 9 (计算),555.122 3 (实测).
化合物2a.1H NMR (300 MHz,CDCl3)δ: 3.88(s,3H),3.84 (s,3H),2.28 (s,3H);13C NMR (75 MHz,CDCl3)δ: 189.63 (s),53.53 (d,J=5.6 Hz),27.08 (s);HRMS: [M+Na]+,m/z=215.019 2 (计算),215.018 5(实测).
化合物2b.1H NMR (300 MHz,CDCl3)δ:4.32~3.98 (m,4H),2.23 (s,3H),1.32 (dt,J=14.1,7.1 Hz,6H);13C NMR (75 MHz,CDCl3)δ: 190.23 (s),63.43 (d,J=5.5 Hz),27.21 (s),16.13 (d,J=6.8 Hz);HRMS: [M+Na]+,m/z=243.050 5 (计算),243.050 1(实测).
化合物4a.1H NMR (300 MHz,CDCl3)δ: 7.25(d,J=8.8 Hz,2H),6.85 (d,J=12.7 Hz,2H),5.36 (s,1H),3.76 (s,3H),3.71 (d,J=11.8 Hz,3H),3.65~3.53 (m,3H),1.43 (d,J=14.7 Hz,9H);13C NMR (75 MHz,CDCl3)δ: 159.51,154.32,131.10,129.02,127.53,114.21,113.91,111.43,80.04,55.31,53.04,52.26,28.15.HRMS: [M+Na]+,m/z=408.129 5(计算),408.129 1 (实测);HPLC 分析条件: Daicel Chiralpak OD-H 柱,V(己烷)∶V(异丙醇)=90∶10,流速 0.5 mL/min,λ=220 nm,tmajor=15.9 min,tminor=13.5 min,(R) 立体异构体:ee=58%.
化合物4b.1H NMR (300 MHz,CDCl3)δ:7.37~7.19 (m,2H),6.95~6.77 (m,2H),5.48 (dd,J=18.0,8.5 Hz,1H),4.24~3.86 (m,4H),3.80 (d,J=8.0 Hz,3H),1.56~1.36 (m,9H),1.35~1.12 (m,6H);13C NMR (75 MHz,CDCl3)δ: 159.29,154.68,131.31,128.96,127.49,114.13,80.06,62.69,61.91,55.28,28.14,16.07;HRMS: [M+Na]+,m/z=436.160 8 (计算),436.160 2 (实测);HPLC 分析条件: Daicel Chiralpak OD-H 柱,V(己烷)∶V(异丙醇)=90∶10,流速0.5 mL/min,λ=220 nm,tmajor=12.2 min,tminor=10.0 min,(R) 立体异构体:ee=23%.
2 结果与讨论
2.1 催化剂的初筛以对甲氧基苯甲醛衍生的α-氨基砜3 和Ohira-Bestmann 试剂2a 的Mannich 反应为模板反应(图5),对4 个金鸡纳碱衍生的相转移催化剂进行筛选,结果见表1.

表1 催化剂结构对催化反应的影响aTab.1 The influence of the structure of the catalyst on the catalytic reaction
相同条件下,4 个金鸡纳碱衍生的手性相转移催化剂都表现出了较好的活性,Mannich 反应的产物收率为76%~90%.与预想的相符,手性的相转移催化剂在催化Mannich 反应时,都具有一定的对映选择性(ee:18%~50%).相比较而言,辛克宁衍生的相转移催化剂催化效果比奎宁衍生的相转移催化剂效果要好.辛克宁与2-三氟甲基溴苄制备的相转移催化剂D 的对映选择性最高(ee:50%).辛克宁和奎宁衍生的催化剂催化反应所得产物的构型相反.
2.2 催化反应条件的优选以催化剂D 为催化剂,α-氨基砜3 和Ohira-Bestmann 试剂1a 的Mannich反应为模板反应(图5),分别对反应条件(碱、反应溶剂及用量)进行筛选,结果见表2.

表2 不同反应条件对反应的影响Tab.2 The effect of different reaction conditions on the reaction
在相同的甲苯用量下,0.25 mL 10% KOH 溶液催化反应的速率明显得到提高,但相应目标产物收率和对映选择性却降低了(表2,序号2).可能的原因是Ohira-Bestmann 试剂在强碱性条件下容易分解,强碱性条件使原料α-氨基砜分解变质,从而导致产物收率降低.随着碱用量降低,催化反应的速率也有所降低.使用0.25 mL 10% LiOH 溶液同样能催化该反应,Mannich 反应产物的收率和对映选择性与使用10% NaOH 为碱的效果相当.而使用K2CO3和K3PO4的饱和溶液为碱时(表2,序号4、5),只得到了微量的产物,说明了反应在较弱的碱性条件下无法进行.当LiOH 的用量降低时,催化反应速率逐渐降低,要在足够的时间下才能获得满意的收率,而反应产物的对映选择性则稍有增加(表2,序号7、8).使用0.25 mL 6% LiOH 水溶液为碱,增大甲苯的用量体积至3 mL,催化反应的活性得到保持,反应产物的对映选择性达到了60%,相同条件下,增大6% LiOH 的量至0.5 mL,反应速率得到了提高,产物的对映选择性也得到保持(表2,序号10、11).从表2 的优化结果可知,该反应在0.25 mL 6% LiOH 为碱、3 mL 甲苯作溶剂、-40 ℃的反应条件下,催化反应的收率和对映选择性较为理想,β-氨基膦酸酯的收率达到90%,ee值达到60%.
3 结论
综上所述,本文研究了4 种金鸡纳碱衍生的手性相转移催化剂催化的(2-氧代丙基)膦酸二异丙酯与α-氨基砜合成手性氨基膦酸酯的Mannich 反应.通过条件筛选,确定了-40 ℃,以D 为催化剂,甲苯为溶剂,6% LiOH 水溶剂为碱的最佳反应条件.在该催化条件下手性β-氨基膦酸酯的对映选择性最高可到达60%.通过该催化剂对(2-氧代丙基)膦酸二异丙酯与α-氨基砜的Mannich 反应,提供了一个有效制备手性β-氨基膦酸酯衍生物的方法.该反应的底物适应性及反应机理还在进一步研究中.
