C株猪瘟病毒NS3蛋白抗原表位分析及分段表达活性检测
2023-10-08丁国伟李甜甜魏荣荣王设市
丁国伟,李甜甜,徐 萍,魏荣荣,李 琛,王设市,潘 晨,范 娟
(扬州市扬州优邦生物药品有限公司,江苏扬州 225008)
猪瘟是一种由猪瘟病毒感染引起的传染病,给全球范围内的养猪行业造成了严重的经济损失[1]。猪瘟病毒主要编码12种蛋白,其中病毒增殖所必需的非结构蛋白之一就是NS3蛋白[2-3],且该蛋白高度保守。机体感染猪瘟病毒后可检测到NS3抗体[4]。猪瘟病毒感染猪后引起发热,体温升高,出血坏死等典型症状[5],具有非常高的发病率,混合感染引起的死亡率也很高。属于1类传染病,目前尚缺乏很好的治疗方法,一旦发病立即采取扑杀措施,是养猪业所面临的难题[6]。
NS3蛋白是由NS2-3蛋白进一步加工而成,其编码基因长达2 049 bp,具有多种酶活性,该蛋白功能比较多[7]。并且NS3的生物学特征和基因序列在不同毒株之间没有显著差异。大量研究证明,该蛋白免疫活性高,可以刺激机体使机体产生高水平的针对该蛋白的特异性抗体。由于NS3所诱导产生的抗体的保护性未得到验证,因此,虽然不适合用于制备疫苗,但是可以通过检测NS3的抗体来对猪瘟进行诊断。因此,在CSFV的检测与诊断方面,研制抗NS3蛋白的诊断试剂盒将受到关注。笔者使用原核表达系统pET-28a对NS3的基因片段进行了分割连接,然后进行表达和纯化,获得具有免疫活性的截短蛋白,为今后猪瘟病毒的鉴别诊断等提供材料。
1 材料与方法
1.1 菌株及载体该研究使用的经典猪瘟毒株为经典C株,表达载体为pET-28a,表达菌株为BL21(DE3),均为实验室保存。
1.2 主要试剂分子生物学试剂主要有:2×TaqMaster Mix、DEPC(焦碳酸乙二酯)、T4连接酶、Trizol LS resgent(Invitrogen)、EasyScript One-Step RT-PCR SuperMix、HindIII、BamHI、SalI和DNA Marker、Agarose Gel DNA Extraction Kit、PCR clean up kit、IPTG、RNaseA和X-gal等。
1.3 方法
1.3.1病毒cDNA的获得。通过Trizol方法提取猪瘟病毒RNA,并根据北京全式金生物技术的逆转录试剂盒的说明对RNA进行逆转录,并在-20 ℃下保存备用。
1.3.2NS3全基因测序分析。参考GenBank中比对CSFV的NS3全基因序列,设计1对引物NS3-F、NS3 -R;将cDNA送至生物技术公司进行测序。然后用DNAStar软件中的Protean分析NS3蛋白的二级结构、亲水性、表面可及性、可塑性和抗原表位进行分析[8]。
1.3.3引物设计与合成及目的基因的获得。在分析CSFV C株的NS3基因及蛋白序列后,截获第1段,即a段第1~212位氨基酸、b段第189~389位氨基酸以及c段第390~591位氨基酸;并设计相应引物NS3a-F/R、NS3b-F/R和NS3c-F/R,在起始端加上BamH I酶切位点,在终止端加上Sal I酶切位点,送至生物公司进行合成,引物使用浓度为20 μmol/L,于-20 ℃冻存备用,上述引物可以分别扩增出a、b、c 3段基因片段,a段位于1~212位氨基酸,b段位于189~389位氨基酸,c段位于390~591位氨基酸,大小分别为645、609和615 bp(图1)。a、b、c 3段基因引物设计为NS3a-F:CGCGGATCCATGGGCAGGGGGCCCGCTGTTTG;NS3a-R:ACGCGTCGACTTACTTCACCATCTCCGTCAAGTCCGTG;NS3b-F:CGCGGATCCATGGGCAAACCAACCAAGCTCATG;NS3b-R:ACGC-GTCGACTTAGGCAATGTCCAAGTAATCTGAACCTAAG;NS3c-F:CGCGGATCCATGGGCGGACTGAAGATACCAGTAG;NS3c-R:ACGCGTCGACTTACATTATATTTTTTACTGCTACCGGCAAC。
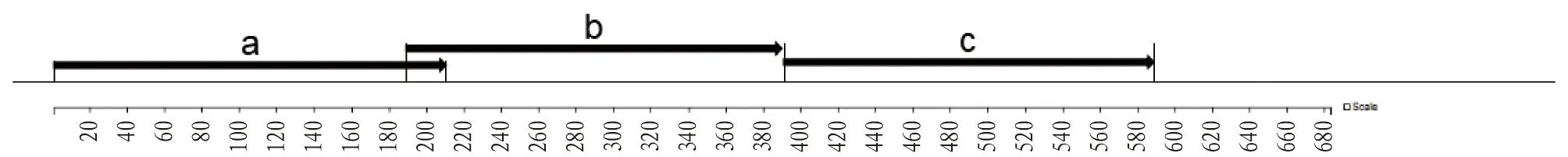
图1 NS3氨基酸分析与截取Fig.1 NS3 amino acid analysis and interception
1.3.4DNA片段的纯化回收及连接转化。 将目的条带切胶后进行回收纯化,纯化后测定浓度并建立20 μL的双酶切体系,将目的基因与pET-28a用BamH I和Sal I分别于37 ℃酶切2~3 h;限制酶消化后,按照Axygen试剂盒的说明书纯化;然后建立20 μL连接体系进行4 ℃过夜连接;将连接产物转化到受体菌中,并且静置培养后,挑取阳性菌落培养并用于PCR鉴定。
1.4 重组质粒的PCR鉴定和测序用小提质粒试剂盒提取pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c重组质粒。通过PCR鉴定上述重组质粒,并通过测序进一步验证。
1.5 重组蛋白的表达及纯化
1.5.1蛋白的诱导表达。将鉴定及测序正确的重组质粒pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c转化至表达菌株,用终浓度为1.0 mmol/L IPTG,37 ℃ 220 r/min摇床诱导表达4 h,同时,设置空载体对照组。通过离心收集细胞,重悬,并通过超声波裂解仪裂解5 min,并离心5 min取上清液,用于蛋白质电泳分析。
1.5.2NS3b目的蛋白的大量表达及纯化。将10 mL母液加入800 mL 抗Kana LB液体培养基中诱导表达5 h或过夜表达,离心收集菌体,对表达的重组蛋白CSFV-His-NS3b参照HisTrap HP组氨酸标记亲和层析柱说明书进行Ni柱纯化,具体方法如下:①用Ni柱上样缓冲液将菌体洗2次,100 mL 重悬,超声波裂解仪裂解10 min,悬液变得清透,蛋白可溶,离心并收集上清液;②用0.45 μm滤器将上述收集的上清进行过滤除杂;③用超纯水清洗Ni柱后,用Ni柱上样缓冲液平衡Ni柱;④上样,并收集样品备用;⑤上样完成后用Ni柱上样平衡缓冲液进行平衡,而后用含10 mmol/L咪唑除杂液进行除杂,每步留样备用;⑥最后用洗脱液洗脱Ni柱结合的蛋白,收集保存样品;⑦洗脱后用Ni柱上样缓冲液平衡Ni柱,之后以0.01 mol/L NaOH洗柱,再以 20%乙醇过柱,4 ℃保存。使用BCA蛋白浓度测定试剂盒及ELISA 2种方法,测得蛋白浓度约为5 mg/mL。
1.6 免疫原的分析鉴定
1.6.1SDS-PAGE分析鉴定。SDS-PAGE电泳前蛋白预处理:取40 μL纯化后的CSFV-His-NS3重组蛋白加入10 μL 5×SDS-PAGE上样缓冲液,混匀,金属浴95 ℃ 7 min,冰浴5 min,12 000 r/min离心5 min,4 ℃保存备用。
SDS-PAGE电泳:将2玻璃板固定于加样器上;按照试剂盒A盒配制12%分离胶5 mL;20 min后弃去超纯水并用滤纸吸净;再按照B盒说明书配制5%浓缩胶2 mL;将浓缩胶加入玻璃板中,迅速准确插入梳子,固化30 min;然后拔出梳子,每孔加入10 μL样品。在开始时以240 V电压跑胶30 min,直到溴酚蓝距下缘0.5 cm时停止电泳。胶块切2块,一块用于Western-blot鉴定,另一块用考马斯亮蓝进行染色,水平摇床染色30 min,而后脱色摇床脱色观察并拍照。
1.6.2Western-blot分析鉴定。SDS-PAGE电泳后的凝胶用去离子水冲洗1次,切割硝酸纤维素膜和滤纸,其大小与胶块相同,浸入转移缓冲液中5 min;转印装置安装顺序按黑色面板为负极,白色面板为正极放入,标记硝酸纤维素薄膜的正负极,玻璃棒除去各层之间的残留气泡,并在转移装置中以240 V转移1.5 h。
转移结束后,通过预染标准分子量标记观察效果,洗涤后封闭2 h;一抗采用猪阳性血清,4 ℃过夜;二抗采用辣根过氧化物酶(HRP)标记的小鼠抗猪IgG(1∶2 000稀释),37 ℃摇床100 r/min,2 h;最后以新鲜的TMB着色溶液,在避光的环境下进行显色。
2 结果与分析
2.1 NS3基因测序通过测序测得NS3基因为2 046 bp大小,与理论大小一致。
2.2 NS3蛋白分析结果
2.2.1NS3二级结构。
2.2.1.1NS3全蛋白α螺旋结构。NS3全蛋白1~682的α螺旋结构在3~25、45~49、96~102、122~125、130~137、205~215、240~249、256~268、276~292、306~347、365~403、469~480、489~496、498~503、530~536、559~595、632~642、647~659和671~682位氨基酸残基,共285个氨基酸,共占整个序列42%。其中,a段1~212位氨基酸,α螺旋结构在5~29、47~51、98~104、132~139、154~164和207~215,共65个氨基酸,共占30%;b段189~389位氨基酸,α螺旋结构在19~29、54~63、70~82、90~106、120~161和179~204,共119个氨基酸,共占58%;c段390~591位氨基酸,α螺旋结构在7~16、2~34、82~93、102~109、111~116、143~149和172~205,共92个氨基酸,共占44%。
2.2.1.2NS3全蛋白β折叠结构。NS3全蛋白的β折叠结构在37~44、58~61、65~73、77~91、114~121、124~126、142~147、176~184、193~202、210~217、222~229、250~256、262~269、292~296、301~305、346~352、356~362、402~407、437~444、446~455、456~468、484~489、493~499、508~513、536~553、609~617、669~673和678~682位氨基酸残基,共218个氨基酸,占该段氨基酸序列32.0%。a段β折叠结构在39~46、60~63、67~75、79~93、116~123、126~128、144~149、178~186和195~204,共72个氨基酸,占该段序列34%;b段β折叠结构在6~16、24~31、36~43、64~70、76~83、106~110、115~119、160~166和170~176,共66个氨基酸,共占32.4%;c段β折叠结构在15~20、50~57、59~68、69~81、97~102、106~112、121~126和149~166,共74个氨基酸,占该段氨基酸序列36.1%。
2.2.1.3NS3全蛋白β转角结构。NS3全蛋白β转角结构共224个氨基酸,分布较均匀紧凑,共占整个氨基酸序列32.8%。a段β转角结构,共92个氨基酸,占该段序列42.8%;b段β转角结构共48个氨基酸,占该段序列32.4%;c段β转角结构共72个氨基酸,占该段序列35.1%。
2.2.1.4NS3全蛋白无规则卷曲结构。NS3全蛋白无规则卷曲在30~31、34~36、53~55、94~97、128~129、150~151、172~173、203~204、218~220、229~232、271~173、305~306、353~354、362~366、434~435、595~597、618~621、663~666和668~670,共55个氨基酸,共占整个氨基酸序列8.1%。a段20位氨基酸,占该段序列9.3%;b段22位氨基酸,占该段序列10.8%;c段5位氨基酸,占该段序列2.4%。
2.2.2NS3蛋白亲水性。NS3全蛋白亲水性结构在501~506、512~521、527~570、605~609、624~629和649~652位氨基酸残基,共34个氨基酸,共占整个序列5%。a段亲水结构共116个氨基酸,占该段序列54.5%;b段亲水结构共103个氨基酸,占该段序列51%;c段亲水结构共104个氨基酸,占该段序列51.3%。
2.2.3NS3蛋白表面可及性。NS3全蛋白表面可及性结构在9~15、32~38、92~100、183、191、233~237、266、272、305~308、361~366、396~399、415~436、501~507、512~521、527~530、605~609、624~629和649~652位氨基酸残基,共102个氨基酸,共占整个序列15%。a段表面可及性在11~16、35~39、94~102和185~193,共29个氨基酸,占该段氨基酸序列13.5%;b段表面可及性在2~6、47~51、59~63、80~86、119~122和176~181,共32个氨基酸,占该段氨基酸序列15.7%;c段表面可及性在44~49、114~120、125~135、140~143和166~177,共33个氨基酸,占该段氨基酸序列16.1%。
2.2.4NS3蛋白可塑性。NS3全蛋白可塑性区域在8~17、31~38、43~55、62~67、75~76、82~86、91~102、104~113、126~131、137~142、148~152、158~164、171~176、179~193、196~208、212~223、229~240、244~249、269~273、282~289、305~308、328~331、353~377、376~385、396~400、407~409、417~427、431~437、442~446、456~463、469~477、481~483、490~492、499~528、542~552、562~564、581~582、596~600、607~610、616~628、635~644、649~653和664~678位氨基酸残基,共352个氨基酸,共占整个序列52%。其中,a段125个氨基酸,占该段序列58.1%,b段91个氨基酸,占该段序列44.6%;c段150个氨基酸,占该段序列73.1%。
2.2.5NS3蛋白B细胞抗原表位。`NS3全蛋白B细胞抗原表位在393~401、407~412、414~427、431~439、454~459、470~484、490~495、500~530、537~547、549~558、560~566、581~585、594~600、605~608、616~631、636~643、649~655和660~679位氨基酸残基,共191个氨基酸,共占整个氨基酸序列28%,其中,a段153个氨基酸,占该段序列71.2%,b段125个氨基酸,占该段序列61.3%,c段134个氨基酸,占该段序列65.4%。
2.2.6NS3蛋白T细胞抗原表位。NS3全蛋白T细胞抗原表位在2~12、13~14、16~20、21~25、27~32、34~56、81~94、99~106、110~113、137~142、158~164、174~185、192~224、234~251、252~271、305~315、332~351、390~397、412~425、434~444、463~487、488~508、513~515、533~557、580~589、602~606、610~617、634~643和664~666位氨基酸残基,共343个氨基酸,共占整个序列的51%。其中,a段105个氨基酸,占该段48.8%;b段92个氨基酸,占该段45.0%;c段115个氨基酸,占该段56.0%(图2~5)。

图2 NS3蛋白二级结构和抗原表位预测Fig.2 Prediction of protein secondary structure and epitope of NS3 protein

图3 NS3蛋白a段二级结构和抗原表位预测Fig.3 Prediction of the protein secondary structure and epitope of NS3 protein segment a

图4 NS3蛋白b段二级结构和抗原表位预测Fig.4 Prediction of the protein secondary structure and epitope of NS3 protein segment b

图5 NS3蛋白c段二级结构和抗原表位预测Fig.5 Prediction of the protein secondary structure and epitope of NS3 protein segment c
2.3 NS3a、NS3b和NS3c基因的扩增将NS3a、NS3b和NS3c基因PCR扩增,分别得到645、609与615 bp的条带(图6),与理论大小一致。
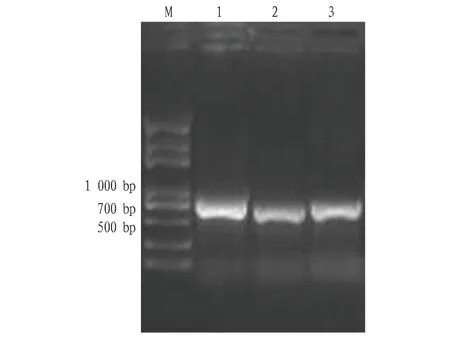
注:M.DL 5 000 DNA ladder marker;1.PCR扩增 NS3a基因;2.PCR扩增 NS3b基因;3.PCR扩增 NS3c基因。Note:M.DL 5 000 DNA ladder marker;1. PCR amplification of NS3a gene;2. PCR amplification of NS3b gene;3. PCR amplification of NS3c gene.图6 NS3基因的PCR扩增结果Fig.6 PCR amplification results of NS3 gene
2.4 重组质粒pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c PCR鉴定pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c重组质粒用通用引物T7-P/T进行PCR鉴定,结果与理论大小一致(图7),且测序结果正确。

注:M.DL 5 000 DNA ladder marker;1.pET-28a-NS3a质粒;2.pET-28a-NS3b质粒;3.pET-28a-NS3c质粒;4.pET-28a空载体。Note:M. DL 5 000 DNA ladder marker; 1. PET-28a-NS3a plasmid;2.pET-28a-NS3b plasmid;3.pET-28a-NS3c plasmid;4. pET-28a empty carrier.图7 重组质粒pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c基因的PCR鉴定结果Fig.7 PCR identification results of recombinant plasmids pET-28a-NS3a, pET-28a-NS3b, and pET-28a-NS3c genes
2.5 NS3a、NS3b和NS3c蛋白表达结果将含pET-28a-NS3a、pET-28a-NS3b与pET-28a-NS3c重组质粒的BL21重组表达菌株进行诱导表达,表达产物经煮沸变性离心后SDS-PAGE分析,其中,a段表达量很低且不可溶,b段在27 kD处出现明显的目的条带,c段未出现表达条带。a段、b段与预期大小符合,同时设置pET-28a空载体组为对照(图8)。

注:M.蛋白预染 marker;1.pET-28a空载体;2.pET-28a-NS3a质粒;3.pET-28a-NS3b质粒;4.pET-28a-NS3c质粒;红框为目的条带。Note:M.Protein pre staining marker;1. PET-28a empty carrier;2. PET-28a-NS3a plasmid;3. PET-28a-NS3b plasmid;4. PET-28a-NS3c plasmid;The red box refers to the destination strip.图8 NS3a、NS3b、NS3c蛋白表达Fig.8 Protein expression of NS3a、NS3b、NS3c
2.6 重组蛋白CSFV-His-NS3b的纯化与活性验证纯化与活性验证结果见图9。

注:M.蛋白预染 marker;1. pET-28a空载体对照;2. CSFV-His-NS3b重组蛋白;红框为目的条带。Note:M. Protein pre staining marker;1. PET-28a empty carrier control;2. CSFV His NS3b recombinant protein;the red box refers to the destination strip.图9 纯化CSFV-His-NS3b重组蛋白的SDS-PAGE分析Fig.9 SDS-PAGE analysis of purified CSFV-His NS3b recombinant protein
2.7 重组蛋白ELISA浓度测定通过EDXX ELISA试剂盒定量检测CSFV-His-NS3b重组蛋白,测定蛋白浓度约5 mg/mL,SDS-PAGE分析结果见图10。
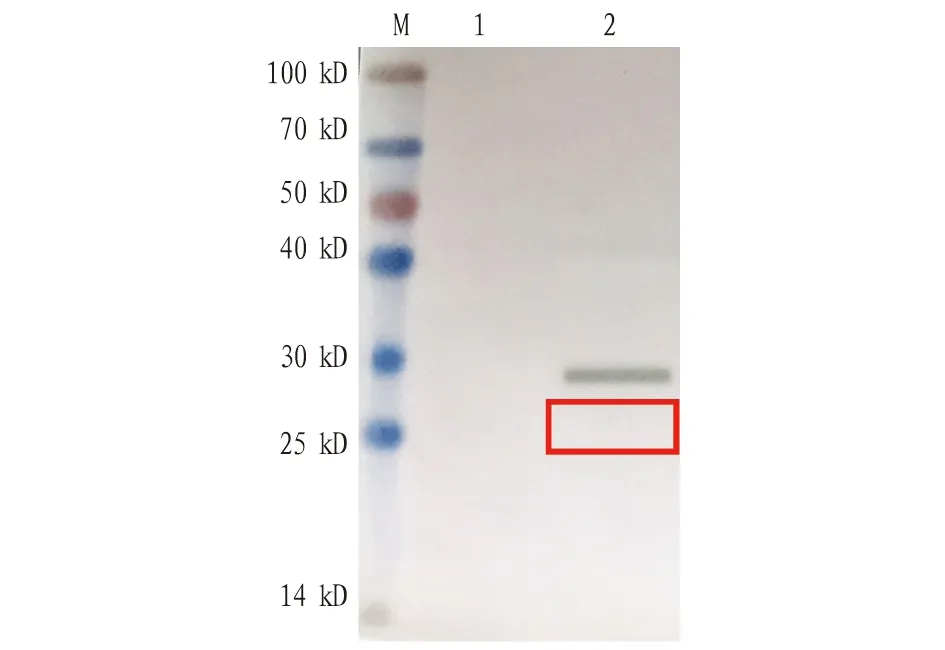
注:M.蛋白预染 marker;1.pET-28a空载体对照;2.CSFV-His-NS3b重组蛋白;红框为目的条带。Note:M. Protein pre-staining marker;1.pET-28a empty carrier control;2. CSFV-His-NS3b recombinant protein;the red box refers to the destination strip.图10 纯化CSFV-His-NS3b重组蛋白的SDS-PAGE分析Fig.10 SDS-PAGE analysis of purified CSFV-His-NS3b recombinant protein
3 讨论与分析
近年来,猪瘟病毒已经对全球养猪业造成了重大危害,并且该病毒可与其他病原包括PCV2、PRRSV等发生混合感染[9],使病情加重,因此,及时有效地诊断可以有效避免继发感染带来的经济损失,而猪瘟的诊断也一直被作为重点研究对象[10]。NS3蛋白在机体内能诱导NS3特异性抗体产生,且NS3抗体能够用于区分自然感染和疫苗毒,因此,NS3蛋白在猪瘟的鉴别诊断中具有重要作用。
NS3蛋白全基因比较长,而小分子的蛋白更容易表达,因此,笔者对NS3蛋白的亲水性、抗原表位等功能活性区域进行了分析。二级结构中的α螺旋主要位于205~423位氨基酸,说明该段的稳定性比较好;β折叠在37~540位氨基酸均匀分布;β转角在32~175分布比较紧凑,在270~673较分散;无规则卷曲主要分布在30~436,由于无规则卷曲β转角在蛋白中的位置,使其成为原表位的可能性较大;亲水性分析显示分布较均匀,没有明显波动;B细胞表位分析分布于1~277位和415~682位氨基酸,T细胞表位分析主要位于173~560位氨基酸。选取了a、b、c 3段预测序列进行分段表达。分割后的结构域和抗原表位百分比相比全长有所增加,3段的抗原表位分布相差不大,均可选为候选抗原蛋白,但是预测结果仅可作为参考,最终确定需要进一步进行实际表达来验证。
原核表达这一技术已经非常成熟也易于纯化,笔者选择使用pET-28a原核表达系统进行表达。其中只有b段区域能够表达,a段、c段没有检测到表达,且b段可大量表达且可溶性较好,表达条件不苛刻,无需摸索,且无需复可以直接进行Ni柱纯化。纯化后的蛋白经SDS-PAGE电泳显示条带单一无杂带,可见所获得的蛋白纯度非常高。用抗猪CSFV阳性血清进行Western-blot试验,结果出现单一的特异性条带,大小符合实际大小,用BCA蛋白检测试剂盒以及ELISA方法均测得蛋白浓度可达5 mg/mL,说明该重组蛋白不仅表达量高,其特异性和免疫活性也非常高。
综上所述,b段相较于a、c段能够很好地表达,推测可能与其稳定性有关,因为α螺旋集中分布在205~423位氨基酸,并且α螺旋对蛋白的稳定性具有重要作用[11]。该研究进行的蛋白结构分析及所构建的蛋白表对进一步研究猪瘟病毒的致病机理、诊断试剂盒和疫苗的研究与开发等具有重要意义。
