含硒杂环的电化学合成、分析及表征综合实验设计
2023-10-07张震王世龙刘珊珊李文佐何涛李家柱
张震,王世龙,刘珊珊,李文佐,何涛,李家柱
烟台大学化学化工学院,山东 烟台 264005
电化学合成技术是一种绿色的化学合成手段,其通过调节电流或电极电势控制电子转移,实现化合物的氧化和还原。该过程使用可持续的电流作为“氧化剂”,避免了一些有毒或有害的化学氧化剂的使用,具有绿色、经济、可持续的优势,该技术的快速发展为合成结构多样且复杂的有机分子提供了新的发展机遇[1]。目前在本科实践教学环节,虽然许多高校开设了电化学实验[2-5],但将其作为合成手段应用于化合物制备的案例仍然缺乏[6]。将电化学合成引入到实践教学,可以使学生打破传统化学试剂氧化的反应思路,直观感受电化学合成的魅力,对于提升学生的绿色化学意识,具有重要指导意义[7]。
含硒杂环是一类重要的有机化合物,广泛存在于医药、农药及有机材料分子中,例如部分含硒杂环结构可以作为抗菌、抗病毒、抗癌的药物,在生物及医学领域具有重要的应用价值[8]。因此,探索快速高效的含硒杂环合成方法具有重要的研究意义。目前,化学合成工作者已开发了多种合成方法,其中电化学合成策略因具有绿色、经济、可持续的优势,拥有更广阔的应用前景。近年来,该研究领域发展迅速并取得丰硕的研究成果[9]。基于“科研反哺教学”的育人理念,将这些前沿研究成果转化为大学实践教学内容,不仅可以让学生了解前沿研究进展,拓展知识范围,还为培养新时代化学合成领域的应用型人才提供实践支撑[10,11]。
笔者结合团队的研究方向,将最新的科研成果转化为一个电化学合成含硒杂环的创新型综合实验[12],并对反应过程进行电化学分析,对产物进行结构表征。据笔者了解,目前本科的化学综合实验主要以多个单一学科的基础实验累积为主,缺少在一个实验中运用多学科知识,系统开展实验技能训练的实践案例,这对学生的创新和实践能力培养极为不利[13,14]。本实验融合多学科知识,涉及有机合成化学、电化学、分析化学等,可以很好地提升学生多学科知识的运用能力。此外,本实验注重化学实验的系统性,通过底物的制备→电化学合成与分析→化合物的波谱表征→晶体的培养解析等环节,使学生了解前沿的有机硒化学合成过程,并对化学合成操作、过程分析和结构解析等技能进行系统性训练,从而更好地培养学生的化学综合能力。
1 实验目的
(1) 学习电化学合成的基本原理与实验操作,了解自由基关环反应过程;
(2) 学习有机硒化合物的熔点测定、核磁和高分辨质谱检测等表征分析方法;
(3) 学习单晶培养的基本知识和实验操作,了解单晶解析的理论知识;
(4) 掌握胺的烃化反应原理和实验操作,掌握柱层析的基本操作;
(5) 了解电化学合成策略作为绿色合成技术的优势及应用前景,提升绿色化学意识。
2 实验原理
有机硒杂环化合物是一类重要的化学分子,在药物、农用化学品、有机材料以及催化等领域有着广泛的应用。目前已报道的研究多集中在构建五元或六元环的含硒杂环结构[15]。本实验中,采用绿色的电化学手段,创新性地构建有机硒七元环结构。具体思路如下:以二烯和苯硒醚为底物,通电后在室温条件下完成有机硒七元杂环的快速合成(图1),该反应避免了传统化学氧化剂的使用,反应条件更加绿色、温和。反应调控方便,通过调节电流、电压可改变氧化能力和反应程度,可操作性强,便于教学实施。
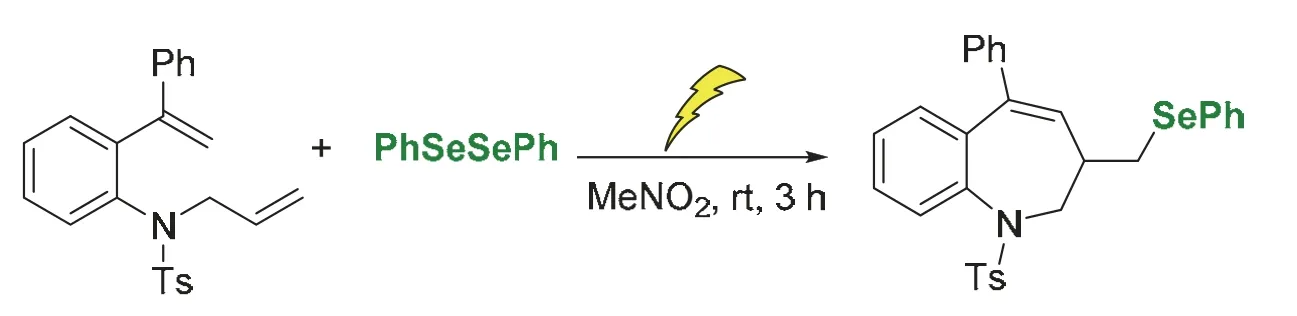
图1 电化学合成有机硒七元杂环
具体反应机理如下:
在阳极上,二苯基二硒醚被氧化失去电子生成苯硒正离子,苯硒正离子与二烯底物中位阻较小的双键反应,生成硒鎓离子。硒鎓离子中间体受到分子内另一双键上电子的进攻,形成七元环苄基碳正离子,该中间体在阴极得电子,发生电解氢的过程,生成氢气和七元有机硒化合物,完成电化学循环(图2)。
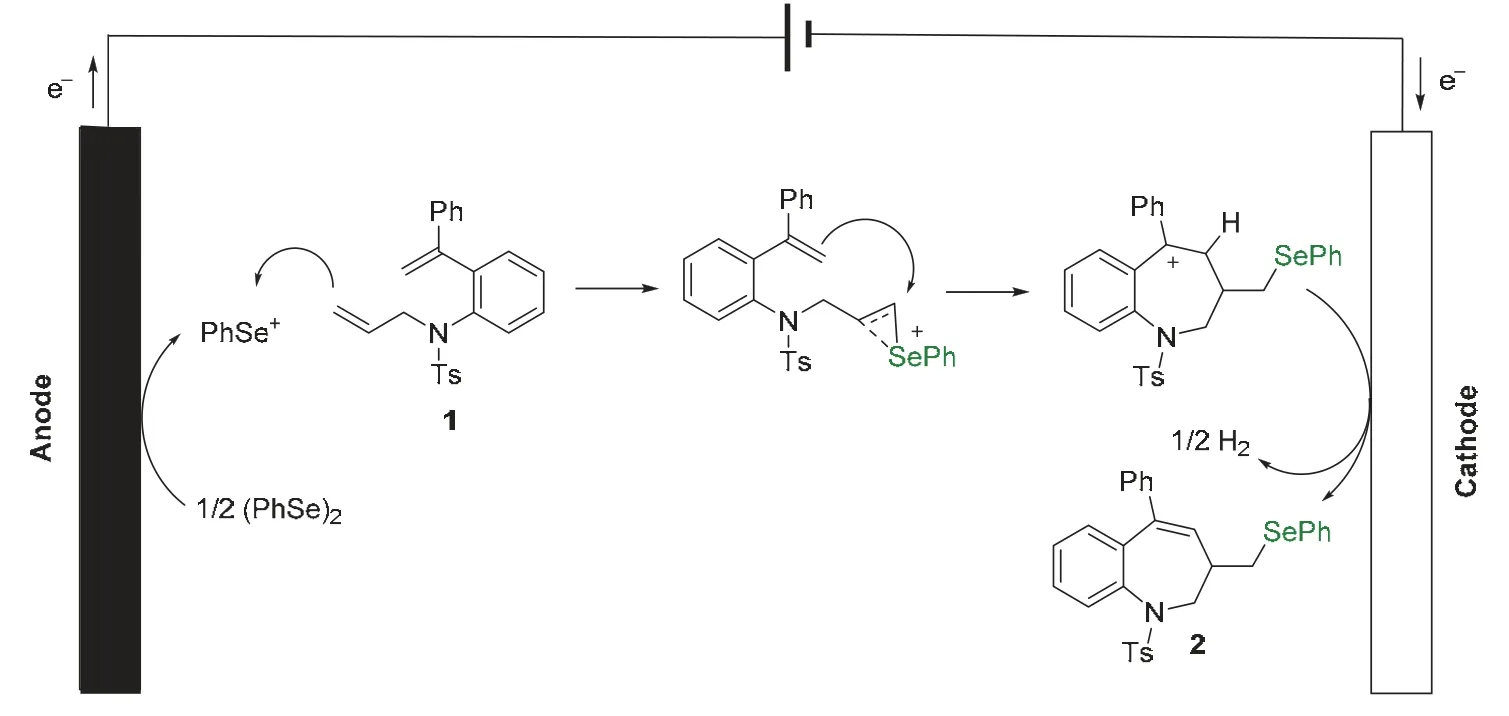
图2 推测的电化学反应机理
3 仪器试剂
3.1 仪器
碳棒电极(120 mm)、铂片电极(15 mm × 15 mm × 0.2 mm)、20 mL Y型管、圆底烧瓶等常用玻璃仪器、GF254薄层色谱硅胶板、电子分析天平、HSPY-1000-002直流稳压电源、X-6数显熔点测定仪、磁力搅拌器、旋转蒸发仪、SHZ-D (III)循环水式真空泵、手提式紫外灯、核磁共振仪(德国Bruker 500Mz)、电化学工作站(上海辰华仪器有限公司,CHI660D)、X射线单晶衍射仪(德国Bruker D8 QUEST ECO)、高分辨质谱仪(美国Waters Xevo G2-XS)。
3.2 试剂
2-(1-苯基乙烯基)-对甲苯磺酰基苯胺(S1)、3-溴丙烯、碳酸钾、乙腈、硝基甲烷、石油醚、乙酸乙酯、二氯甲烷、四丁基六氟磷酸铵、吡啶、二苯基二硒醚、无水硫酸钠,上述试剂均购自安徽泽升科技有限公司,分析纯。200-300目柱层析硅胶购自烟台康汇生物科技有限公司。
4 实验步骤
4.1 二烯底物的制备
取100 mL圆底烧瓶,分别加入中间体S1 (3 mmol,1.05 g)、碳酸钾(3.6 mmol,495 mg)、乙腈(30 mL)和3-溴丙烯(6 mmol,720 mg)。将反应体系在油浴80 °C搅拌2 h。反应完成后,将反应体系过滤,收集滤液,真空浓缩。将残余物通过硅胶柱色谱法纯化(洗脱液为V石油醚:VEtOAc= 20 : 1-10 : 1),得到白色固体产物1 (1.06 g,收率91%,见图3)。
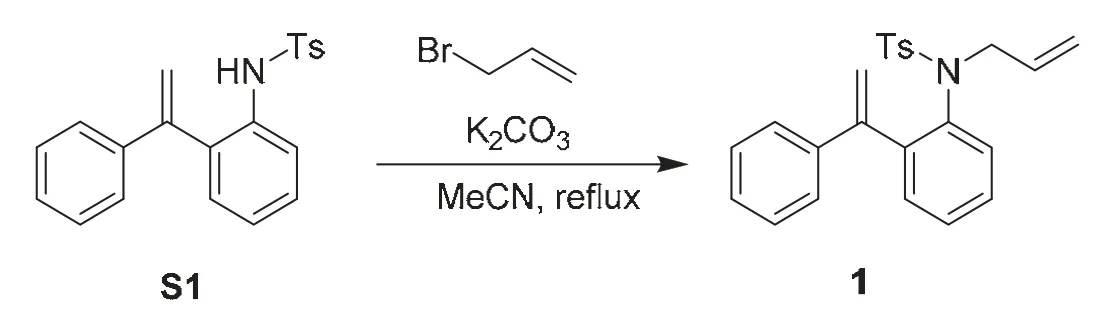
图3 二烯底物的合成路线
4.2 电极的选用与处理
在电极选用时,主要考虑以下几个因素:1) 所选电极不能与电解液或溶剂发生反应;2) 所研究的电化学反应不会因电极自身发生的反应而受到影响;3) 电极表面要光滑、均一,面积可根据反应的摩尔量适当改变,对于金属片电极,反应时最好将溶剂浸没电极。常用的“惰性”固态电极包括非金属电极(碳棒、石墨电极、碳玻璃电极等)和金属电极(铂、金、银电极等),本实验中选用的是碳棒作为正极和铂片电极作为负极,为保证实验的可重复性,电极在使用前需要进行预处理,铂片电极金属表面需要用抛光粉(Al2O3)打磨,然后用去离子水冲洗表面并放入超声水浴中清洗3-5 min,若清洗不彻底,可重复上述操作。
4.3 电化学合成有机硒七元杂环
反应方程式如图4所示,将二烯底物1 (0.5 mmol,195 mg)、二苯基二硒醚(0.35 mmol,110 mg)与四丁基四氟磷酸铵(0.5 mmol,164 mg)加入Y型试管中,用5 mL硝基甲烷溶解,支口上塞上橡胶塞,插入氮气球,上口插入碳电极和铂电极,反应装置如图5所示(一台电源可以平行串联5组实验),设定电流I= 5 mA,室温下通电3-5 h。采用薄层层析法(TLC)跟踪反应进程(图6),反应完全后,真空浓缩溶剂,将残余物通过硅胶柱色谱法纯化(洗脱液为V石油醚:VEtOAc= 10 : 1),得到白色固体产物2(209 mg,收率76%)。
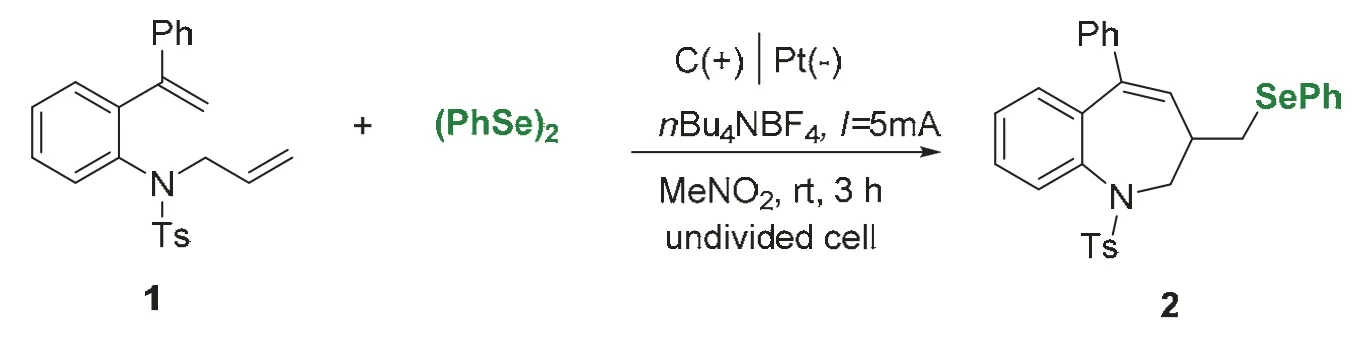
图4 电化学合成条件和方程式

图5 电化学反应装置
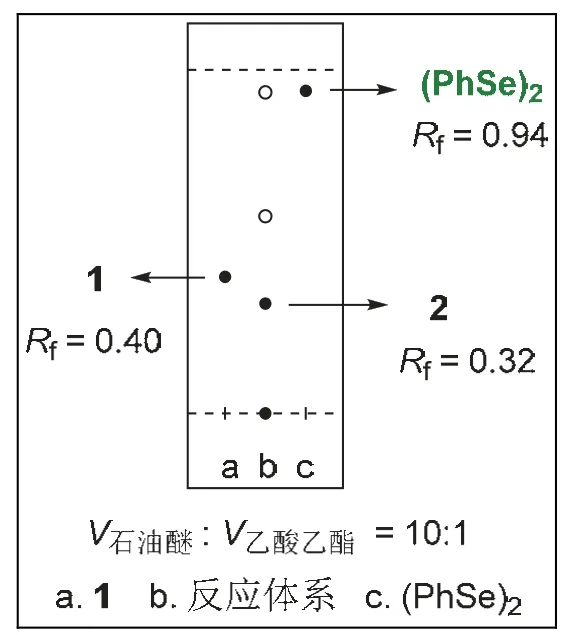
图6 TLC监测反应进程
5 结果与讨论
5.1 含硒七元环产物的结构表征
5.1.1 熔点测定
学生将自己小组分离的产物进行熔点测定,并与文献报道的数据进行比较,检验产品的纯度,对测定值进行记录和分析。
5.1.2 核磁表征
制备的含硒七元环化合物将分别进行1H NMR、13C NMR和77Se NMR核磁表征,数据分析如下:
1H NMR数据分析:如图7所示,1H NMR (500 MHz, CDCl3)δ7.53 (d,J= 7.8 Hz, 1H),7.50-7.39(m, 4H),7.28 (t,J= 7.6 Hz, 1H),7.26-7.18 (m, 5H),7.15 (t,J= 7.4 Hz, 2H),6.91 (d,J= 7.8 Hz, 3H),6.82 (d,J= 7.3 Hz, 2H),5.98 (s, 1H),4.33 (s, 1H),4.05 (s, 1H),2.97 (qd,J= 12.1, 6.6 Hz, 2H),2.71(s, 1H),2.18 (s, 3H)。其中2.18 (s, 3H)为对甲苯磺酰基中甲基的特征位移,2.71 (s, 1H)为叔碳氢的特征位移。2.97 (qd,J= 12.1, 6.6 Hz, 2H)为与氮原子相连亚甲基的特征位移。4.33 (s, 1H)和4.05 (s, 1H)为硒原子相连亚甲基的特征位移;5.98 (s, 1H)为双键氢的特征位移;其余为苯环氢的位移。
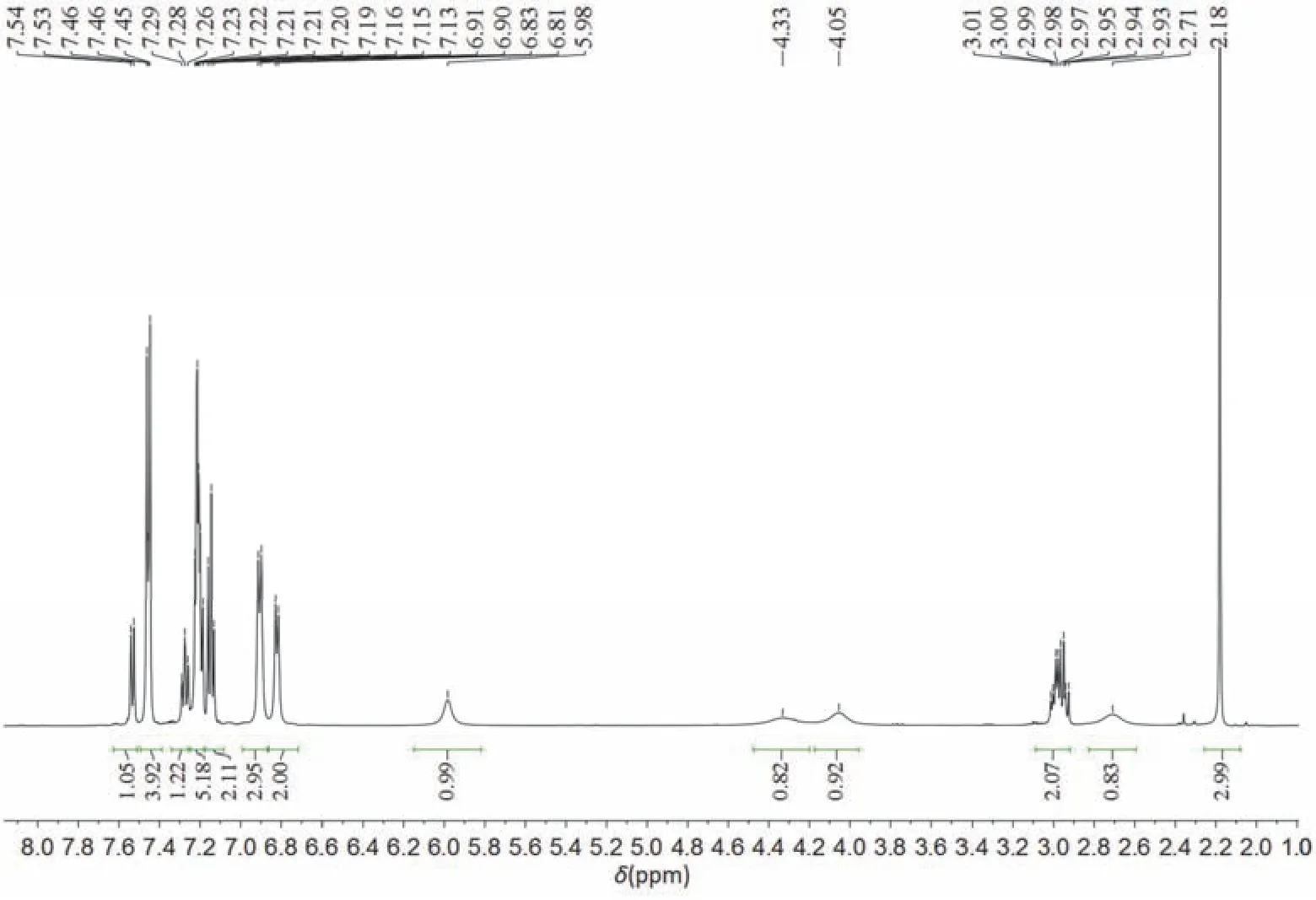
图7 含硒七元环的核磁共振氢谱图
13C NMR数据分析:如图8所示,13C NMR (126 MHz, CDCl3)δ142.9,141.8,139.7,137.7,133.3,131.2,130.5,129.8,129.3,129.2,128.4,128.1,127.9,127.8,127.4,63.3,38.4,29.9,21.4。其中21.4和29.9分别为对甲苯磺酰基中甲基碳和叔碳的特征位移,38.4和63.3为氮原子和硒原子相连碳的特征位移。127.4-142.9为苯环和双键碳的特征位移,由于原子之间的叠加和屏蔽效应导致出峰数量减少,峰强度低,学生可以结合波谱知识和具体结构分析。
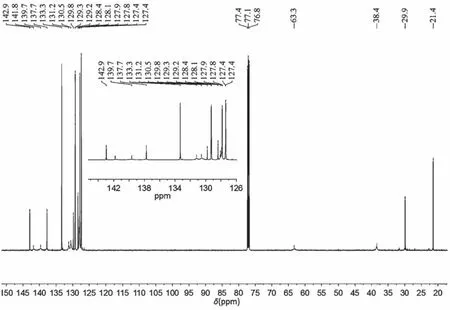
图8 含硒七元环的核磁共振碳谱图
77Se NMR数据分析:考虑到硒原子有77Se同位素,还将进行77Se NMR核磁表征。如图9所示,77Se NMR数据如下:77Se NMR (76 MHz, CDCl3)δ280.1。

图9 含硒七元环的核磁共振硒谱图
5.1.3 高分辨质谱表征
含硒七元环化合物2的高分辨质谱图谱如图10所示,HRMS (ESI)m/z:[M + H]+理论计算值为546.1001;实际测定值为546.1003,在误差允许范围内。硒原子有多个同位素峰79Se、77Se、75Se,在质谱图上可以清晰地看到544.1008,542.0958的特征峰,进一步表明合成的目标化合物中含有硒原子。

图10 含硒七元环的高分辨质谱图
5.2 电化学分析
循环伏安法采用三电极电池(烧杯型电池)在室温下进行。工作电极是稳定的玻璃碳电极,对电极是铂丝电极。参比电极是浸没在饱和KCl水溶液中的Ag/AgCl电极,并通过盐桥与反应分离。实验中,将5 mL含有0.05 mol·L-1nBu4NPF6的MeNO2加入电池中。在0.02 mol·L-1浓度下进行二烯底物1、PhSeSePh、二烯底物1和PhSeSePh混合的循环伏安测定。扫描速率为0.1 V·s-1,范围为-2.0 - 2.0 V。
如图11所示,通过与空白对照,二烯底物1在2.0 V (vs. Ag/AgCl)范围内并未出现氧化峰,而PhSeSePh分别在0.085 V (vs. Ag/AgCl)和0.705 V (vs. Ag/AgCl)出现两个氧化峰,这表明二苯基二硒化物经历了两次氧化,并在阳极相对于二烯底物优先被氧化。因此,可以得出结论由于两底物氧化电位的差异保证了电化学转化顺利进行。

图11 循环伏安
5.3 硒化七元环产物的单晶培养和X射线单晶衍射
取三支15 mL试管,清洗干净后,分别加入20 mg产物,并依次用二氯甲烷(8 mL)、乙酸乙酯(8 mL)、丙酮(8 mL)进行溶解,如图12a所示,试管用纸巾密封,橡皮筋缠绕,在纸巾上扎几个小孔,放置于通风橱,静置3-5天,待溶剂缓慢挥发后,观察单晶析出情况。通过三种溶剂的对比,可以看到溶剂类型和挥发速度会影响单晶的析出效果。实验结果表明,当丙酮做溶剂时,单晶析出效果较好,管壁可以清晰看到均匀的片状晶体(图12c),推测主要原因是丙酮的沸点介于二者之间,挥发速度适中,利于该晶体的析出。将析出较好的单晶进行X射线衍射,数据解析后,可以观察到分子中七元环结构,硒原子与环的连接方式及各原子的空间分布。

图12 单晶的培养和解析
6 教学实施及效果
本实验主要针对拥有一定知识储备的高年级学生开设。实验总学时设置为16学时,分两次完成,一般3-5名学生为一组。前10个学时主要进行底物和含硒杂环的制备,单晶的培养;后6个学时进行表征和分析实验,其中核磁、质谱表征及电化学分析实验,各小组可以穿插交替进行。分析表征实验结束后,要求学生及时跟踪反馈的实验数据,所有数据由各小组成员自行处理和分析,形成实验报告。通过该实验,学生不仅可以训练常规有机合成操作,巩固胺类化合物烃化反应、氧化环化反应、波谱解析等理论知识,还可以学习电化学相关知识和实验操作等内容。在单晶培养实验中,除学习晶体学知识外,由于单晶培养充满了不确定性,学生期待性强,有助于提升实验学习的积极性。
为了使学生更深入地学习和思考该实验,可以设置以下思考题供学生预习和讨论:
(1) 部分同学分离出来的产物,其熔点测定值会比文献报道的数据偏低或偏高,试分析造成该现象的原因有哪些?
(2) 结合波谱分析知识,试解释产物在13C NMR表征时,为什么芳环区峰数目较少且信号较弱?
(3) 电化学合成中能否采用恒定电压的方法进行?会对反应产生哪些影响?
(4) 在单晶培养过程中,为什么二氯甲烷和乙酸乙酯做溶剂单晶析出效果较差?溶剂的类型和挥发速度对晶体的生长有哪些影响?
7 结语
该实验基于“科研反哺教学”的育人理念,将最新的科研成果转化为可用于实践教学的综合化学实验。通过底物的制备→电化学合成与分析→化合物的波谱表征→晶体的培养解析等环节,对学生的合成操作、过程分析和结构解析等技能进行系统训练,为学生进行化学科学研究奠定良好的基础。实验内容打破传统外加化学氧化剂的反应思路,采用更加绿色环保的电化学合成策略,一方面学生可以学习电化学知识,训练电化学实验操作,另一方面有助于提升学生的绿色化学意识,激发实验学习兴趣。实验中还引入了硒元素,合成的含硒杂环分子具有潜在的生物活性,可以促使学生更深入地了解“长寿元素”硒。总之,该实验具有较好的前沿性和综合性,适用于高年级本科生的实践教学。
