芍药胼胝质合成酶基因家族鉴定及PlCalS5功能分析
2023-09-27贺丹尤啸龙何松林张明星张佼蕊华超王政刘艺平
贺丹,尤啸龙,何松林,张明星,张佼蕊,华超,王政,刘艺平
芍药胼胝质合成酶基因家族鉴定及功能分析

1河南农业大学风景园林与艺术学院,郑州 450002;2河南科技学院园艺园林学院,河南新乡 453003
【目的】CalS家族在调控植物胼胝质合成方面具有重要作用,鉴定芍药CalS家族成员,并进行生物信息学和表达模式分析,为芍药属远缘杂交不亲和研究提供依据。【方法】通过荧光显微镜观察自交、杂交柱头内花粉管生长过程及花粉萌发情况;测定柱头所含胼胝质、内源脱落酸含量(ABA)以及-1,3-葡聚糖酶活性;分段克隆8个并进行序列分析;使用Expasy、MEME、TBtools、MEGA 7.0等软件和在线工具预测PlCalS家族成员蛋白质基本理化性质、保守基序并构建系统发育进化树;利用qRT-PCR技术检测8个在自交24 h、杂交24 h、杂交36 h的相对表达水平;对CalS5进行多序列比对并构建系统进化树,分析响应不同浓度ABA处理的表达特征。【结果】花粉管荧光显微观察发现杂交柱头内发生较为严重的胼胝质堵塞从而影响花粉管的正常生长及花粉的萌发。测定柱头内胼胝质含量发现多数时期自交柱头均低于同时期杂交柱头的含量,柱头内-1,3-葡聚糖酶活性、ABA含量变化均具有一定的规律性。通过对结构域的完整性分析鉴定芍药PlCalS基因家族成员,后经同源性比对分析命名8个,均含有15个保守基序且在PlCalS基因家族中的分布类似。多物种系统进化关系表明,CalS家族可分为3个分支,PlCalS家族仅分布在2个分支,其中与牡丹、拟南芥和番茄的亲缘关系较近。生物信息学分析结果表明8个家族成员编码1 745—1 951个氨基酸,原子总数为28 583—31 870个,等电点为7.99—9.13。对转录组FPKM值的分析表明,PlCalS家族成员在相同时期杂交处理中有较高表达,相同处理情况下在杂交36 h时高表达;荧光定量PCR表明,8个基因的相对表达量在自交24 h时均低于杂交24 h和杂交36 h。经两个浓度的ABA处理,发现对高浓度的ABA更为敏感。【结论】芍药CalS家族有8个基因成员且具有较高的保守性,8个家族成员对芍药胼胝质的生成起重要调控作用;大部分时期在杂交柱头的表达量高于自交柱头,可能参与胼胝质异常沉积的过程;芍药杂交柱头异源花粉的刺激可能会增强某个ABA合成途径,ABA可能通过正调控胼胝质基因诱导胼胝质的积累,从而抑制花粉的萌发与花粉管的伸长,影响授粉亲和性。
芍药属;远缘杂交不亲和;CalS基因家族;表达分析
0 引言
【研究意义】芍药()与牡丹()同为芍药科芍药属,其花大色艳、花型丰富,具有很高的观赏价值和药用价值[1-2]。我国芍药属种质资源丰富,利用其丰富的种质资源进行组内及组间杂交育种是改良芍药性状、培育新品种的主要途径[3-4]。芍药与牡丹的远缘杂交后代称为伊藤杂种,其植株花色丰富、生长旺盛、花期长、抗性强,茎干挺拔适合做切花,人们对其展开了大量的育种工作[5-7]。但是目前能够被市场认可的伊藤杂种仅仅有数十个,主要原因是组间远缘杂交存在严重的不亲和现象[8-9]。因此,阐明芍药属组间远缘杂交不亲和的机理,寻找克服不亲和的方法是提高芍药属育种效率的关键。【前人研究进展】芍药属远缘杂交不亲和的主要原因是花粉-柱头无法正常识别,主要表现为授粉后,柱头和花粉管中产生大量的胼胝质阻碍花粉管生长,最终导致受精失败[10-12]。在百合、杜鹃等观赏植物中也发现了这种现象[13-14]。花粉管的生长与许多因素有关,细胞壁在促进花粉管完整性方面起重要作用[15]。胼胝质是一种-1,3-葡聚多糖,存在于高等植物的细胞壁中,参与花粉外壁形成、花粉发育及花粉管生长[16-17]。在花粉管生长过程中,胼胝质若出现异常沉积,花粉管顶端就会形成胼胝质塞,阻碍花粉管顶端正常极性生长的胞吐与胞吞作用,导致花粉管生长停止[18-19]。亲和花粉管与不亲和的花粉管相比,亲和的花粉管细胞壁较薄,染色分布均匀,胼胝质栓塞有规律地均匀分离,而不亲和的花粉管壁变厚,染色非常明亮,胼胝质栓塞沉积[20]。胼胝质合成酶(callose synthase,CalS)又称葡聚糖合成酶类似物(glucan syinthase like,GSL),是控制胼胝质合成的关键酶类。目前在拟南芥中鉴定出了12个胼胝质合成酶基因,其中、、、和共5个基因参与小孢子和配子发生,从而影响花粉发育[21-22]。编码一种直接影响花粉管胼胝质的花粉特异性蛋白,在花粉形成过程中主要参与了胼胝质壁的合成,将敲除或者过表达,都会导致花粉活力和育性下降[23-24]。在梨花粉管生长中,可以适度促进花粉管生长,并在实现受精过程中发挥重要作用,从而推测在控制梨花粉管中胼胝质合成中起着关键作用[17]。在玫瑰的远缘杂交研究中,克隆得到了一个,通过生物信息学分析初步推测很可能参与调控了玫瑰的远缘杂交不亲和性[25]。同时胼胝质的沉积与降解会受到脱落酸(abscisic acid)、乙烯(ethylene)等激素的调控[26-27]。‘锦橙’启动子中存在有脱落酸响应元件,经ABA处理后该元件会结合ABA诱导的表达,从而促进胼胝质的生成[28]。【本研究切入点】芍药远缘杂交不亲和的相关研究已有报道,但是对于其不亲和的分子机制,特别是胼胝质的产生与沉积及其基因家族的功能还有待研究。【拟解决的关键问题】本研究以芍药自交亲和与杂交不亲和关键时期[29]的柱头转录组数据(NCBI登录号:PRJNA592882)为基础,通过生物信息学进行芍药CalS基因家族成员的鉴定与克隆,并进行表达分析。同时探究ABA对表达的调控,为解决芍药属远缘杂交不亲和提供理论与技术依据。
1 材料与方法
1.1 材料
试验材料种植在河南省优质花卉蔬菜种苗工程研究中心,2021年5月以芍药品种‘粉玉奴’为母本,牡丹品种‘凤丹白’为父本,进行‘粉玉奴’自交及‘粉玉奴’ב凤丹白’杂交试验。于授粉后2、4、6、8、10、12、24和36 h取自交及杂交组合的柱头,液氮速冻后于-80 ℃超低温冰箱保存,每个时间段重复采样3次。
1.2 花粉管荧光显微观察与生理指标测定
授粉后8个时间段采集的自交与杂交的柱头,经FAA固定液固定后使用荧光显微镜在紫外光源下观察花粉管生长及花粉黏附与萌发情况,具体方法参考贺丹[29]。
使用植物胼胝质ELISA检测试剂盒(上海酶联生物公司)测定胼胝质含量;使用-1,3-葡聚糖酶(-1,3-GA)活性检测试剂盒(索莱宝)测定-1,3-葡聚糖酶活性;采用酶联免疫法(ELISA)测定脱落酸(ABA)含量,方法参照试剂盒操作说明书,所有测定重复3次。
1.3 芍药PlCalS的鉴定及命名
以拟南芥CalS家族的蛋白质序列作为参考序列,与牡丹基因组数据库、芍药转录组数据在TBtools软件进行同源比对,筛选出含有FKS1和-1,3-葡聚糖合成酶结构域的序列,经NCBI Blast去除重复序列后,结合CCD在线网站(https://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)对候选基因序列进行二次筛选,确定符合条件的序列结构完整,根据它们是否具有相应的保守结构域,最终确定芍药转录组中CalS基因家族成员的数量。根据分析结果,以基因功能为参照进行序列命名。
1.4 芍药PlCalS的克隆
以芍药‘粉玉奴’自交、芍药‘粉玉奴’与牡丹‘凤丹白’杂交柱头转录组数据与其他物种序列为基础,使用Primer 5软件设计扩增引物(表1)。由于PlCalS基因家族编码区较长,全长扩增难以一次完成且成功与T载体进行链接,因此,以芍药‘粉玉奴’自交24 h柱头的RNA反转录得到的cDNA为模板,对8条的CDS序列分段进行PCR扩增。PCR反应体系和反应程序参照贺丹等[30]。将所得产物电泳纯化,经检测符合要求后存于-20 ℃冰箱。
1.5 芍药PlCalS生物信息分析
利用ExPASy数据库(https://web.expasy.org/ protparam/)中的在线网页ProtParam(https://web. expasy.org/protparam/)、TMHMM(http://www.cbs.dtu. dk/services/TMHMM/)和(http://www.detaibio.com/ tools/signal-peptide.html)分析氨基酸序列的理化性质、跨膜结构和信号肽信息;在线网站MEME(https://meme-suite.org/meme/)预测PlCalS家族蛋白序列保守结构域;MEGA 7.0软件构建系统进化树。
1.6 芍药PlCalS表达分析
采用CTAB法分别提取自交24 h、杂交24、36 h柱头的RNA,反转录为cDNA后用于实时荧光定量PCR,荧光引物设计如表2所示。使用TB Green® Premix Ex Taq™ II(Tli RNaseH Plus)试剂盒(Takara,日本),过程按照试剂盒说明书进行,反应体系、扩增程序及数据处理参照贺丹等[31]。
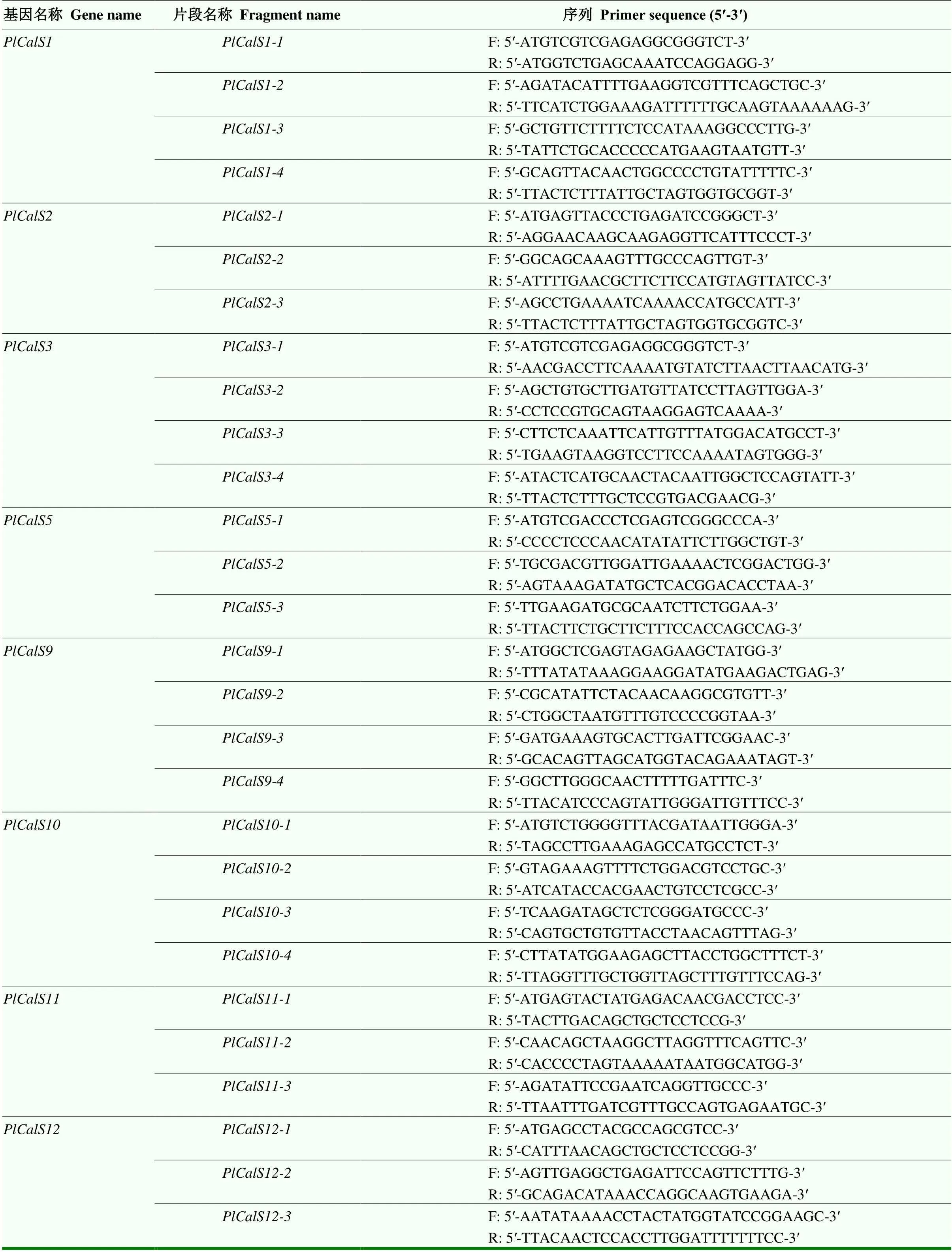
表1 分段扩增引物

表2 荧光定量引物序列
1.7 PlCalS5生物信息分析
使用MEGA7.0构建系统进化树,Bootstrap值设置为1 000。在NCBI数据库中的Blastp搜索同源序列,用DNAMAN 8.0软件对编码蛋白的氨基酸序列进行翻译并分析PlCalS5氨基酸序列与其他物种CalS5氨基酸序列的同源性。
1.8 不同浓度ABA处理下PlCalS5表达情况分析
取30株芍药‘粉玉奴’实生苗的60片成熟叶,用打孔器在避开主脉的叶片区域打下7 mm直径的圆叶片,混合后随机装入锥形瓶中,分别加入无菌水、脱落酸(10 μmol·L-1、100 μmol·L-1)摇晃使叶片浸没,之后封口,分别于处理2、4、6、8、10、12、24和36 h后进行取样,每个时期不同处理均取3份样品(0.2 g左右)过液氮速冻后放置于-80 ℃冰箱备用。提取RNA后进行反转录,稀释后用于qRT-PCR检测,引物设计如表2所示。以同时期无菌水处理为对照组,采用2-∆∆CT法计算植株经ABA处理后的相对表达量。使用Excel软件统计数据并绘图,用IMB SPSS statistics 20进行检验(=0.05)。
2 结果
2.1 花粉管生长情况观察及生理指标的测定
授粉后2—12 h,自交雌蕊中的花粉管汇集呈明显的花粉管束(图1);杂交雌蕊中大量花粉管扭曲、缠绕,并伴有胼胝质堆积(图2)。授粉后24和36 h,自交雌蕊中花粉管继续伸长生长(图1-G、H);杂交雌蕊萌发的花粉管中胼胝质堆积严重(图2-G、H)。
授粉后自交柱头的胼胝质含量整体呈现先上升后下降的趋势(图3),在授粉后4 h达到最大值,36 h下降到最低值。杂交柱头的胼胝质含量整体呈上升趋势,在6 h后稍微下降,随后升高,在24 h达到最高值。同时间段对比自交与杂交的胼胝质含量发现,前期自交高于杂交,在4 h后杂交胼胝质含量上升较快,显著高于自交。
授粉后自交柱头的‑1,3-葡聚酶含量整体呈上升趋势,在授粉后24 h达到最大值。杂交柱头的‑1,3-葡聚酶含量整体也呈上升趋势,在8 h后略微下降,随后升高,在24 h达到最高值。同时间段自交与杂交的‑1,3-葡聚酶含量对比发现,前期差异不大,6 h后,杂交‑1,3-葡聚酶含量上升较快,显著高于自交(图4)。
授粉后自交柱头ABA含量整体呈现先上升后下降再上升的趋势,在授粉后12 h达到最高值。杂交柱头的ABA含量整体呈上升趋势,在10 h时有所下降,随后升高,在24 h达到最高值。同时间段对比自交和杂交ABA含量发现,前期自交与杂交相差不显著,在24 h后杂交ABA含量上升,显著高于自交(图5)。
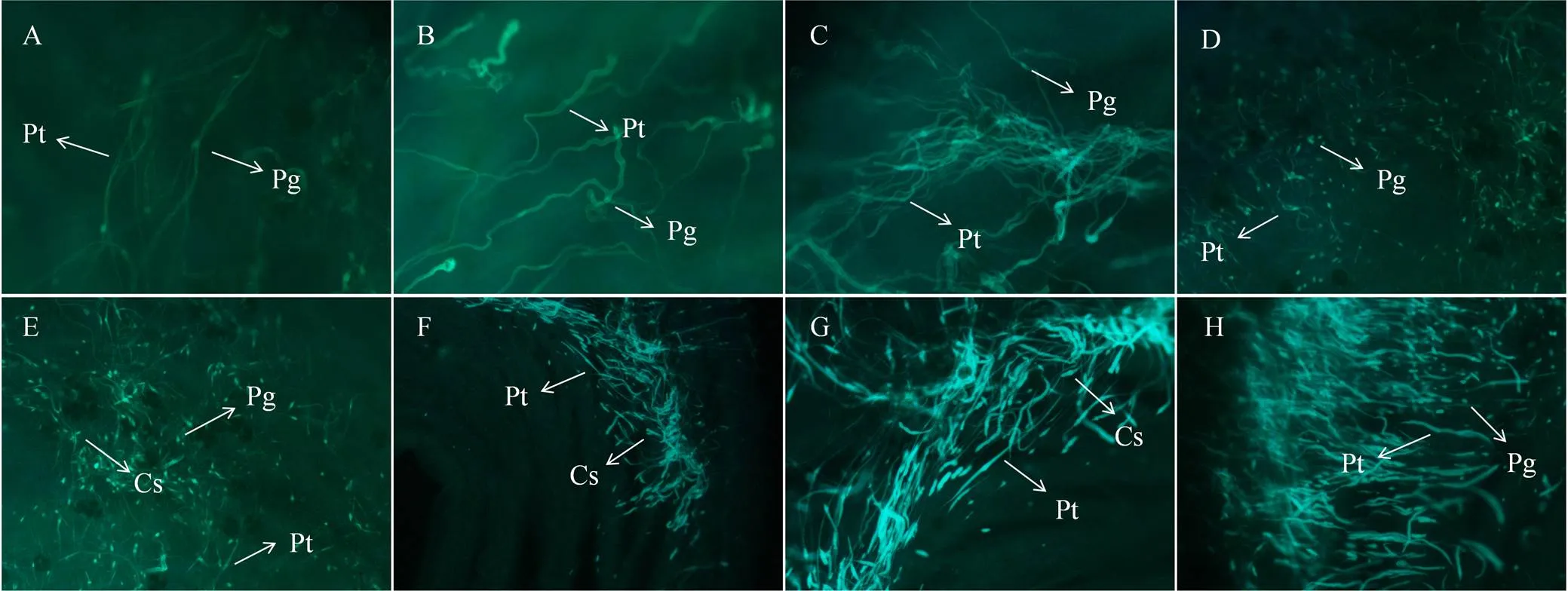
Pg:花粉粒;Cs:胼胝质;Pt:花粉管。A:2 h;B:4 h;C:6 h;D:8 h;E:10 h;F:12 h;G:24 h;H:36 h。下同
2.2 芍药PlCalS的鉴定
从芍药柱头转录组数据库中筛选得到8条编码胼胝质合成酶基因的序列,根据分析结果将8条芍药命名为、(GeneBank登录号为:OM988002、OM988003、OM988004、OM988005、OM988006、OM988007、OM988008、OM988009)。对基因的表达量聚类分析,发现这8个基因在9个样品中均显示表达差异(图6),自交24 h与杂交24 h相比,该家族基因在杂交柱头中的表达量高于自交柱头;杂交24 h与杂交36 h相比,该家族基因的表达量随时间延长而增高,其中上调表达趋势较为明显。
2.3 芍药PlCalS克隆与序列分析
从芍药柱头转录组数据库中筛选得到、的基因序列,设计引物进行验证。经回收、连接、转化、测序,结果表明、的开放阅读框分别为5 841、5 238、5 856、5 748、5 733、5 712、5 349和5 343 bp。
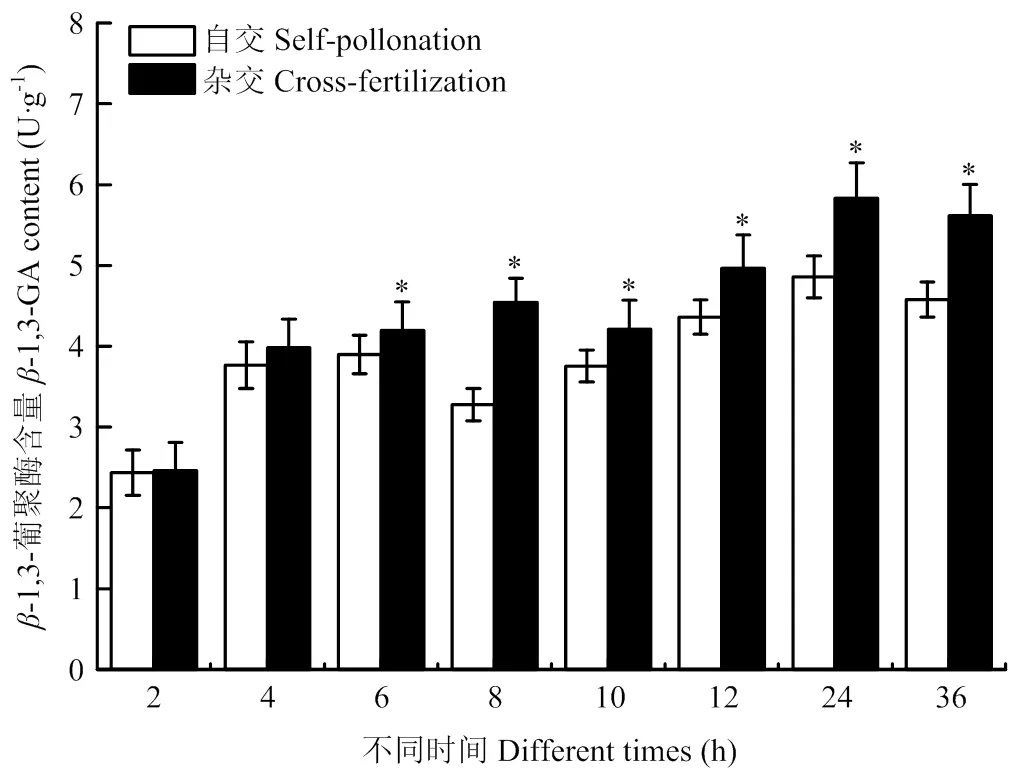
图4 柱头授粉后β‑1,3-葡聚酶含量变化
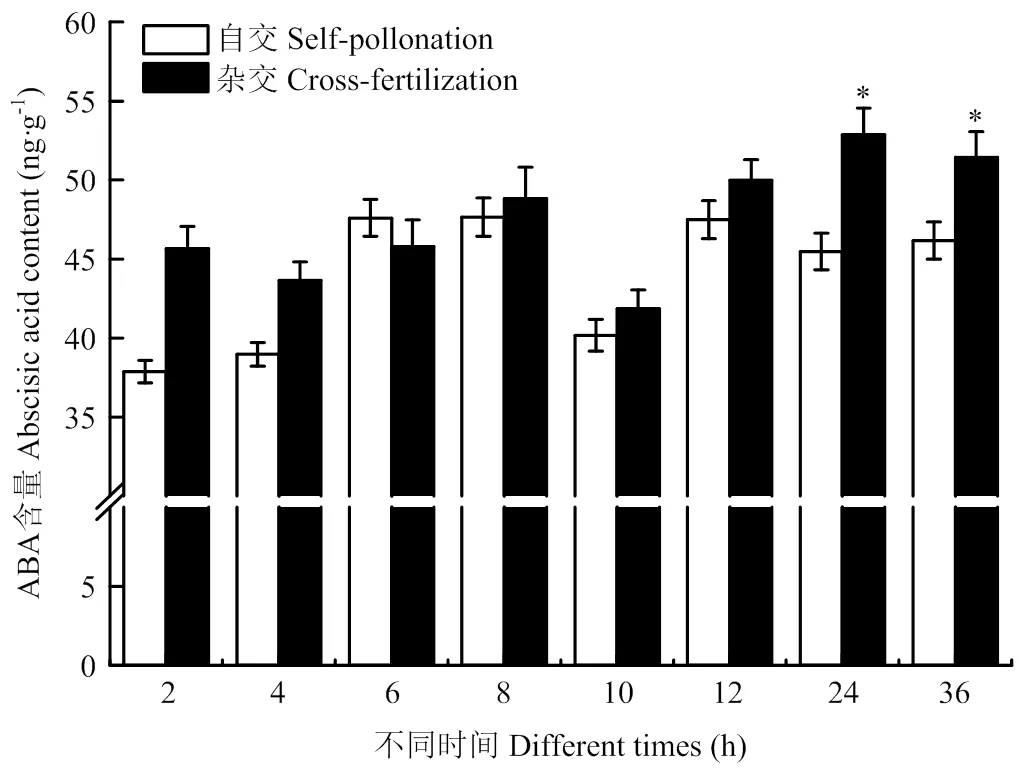
图5 柱头授粉后ABA含量变化
2.4 芍药PlCalS的生物信息学分析
2.4.1 编码蛋白的理化性质 经克隆验证8条芍药PlCalS家族基因编码蛋白1 780—1 951 aa,原子总数和等电点范围分别为28 583()—31 870()、7.99()—9.13(),其不稳定性系数在36.40()—42.27(),除外,其他均为亲水性蛋白。这8条均存在跨膜区,但没有信号肽切割位点(表3)。8个PlCalS蛋白都定位于内质网。
2.4.2 蛋白结构 利用SMART网站对PlCalS家族进行注释,发现PlCalS家族较为保守,所有成员含有相同的Motif 1—15;8个都包含Glucan_synthase结构域和FKS1结构域,只有、和含有Vta1结构域(图7)。
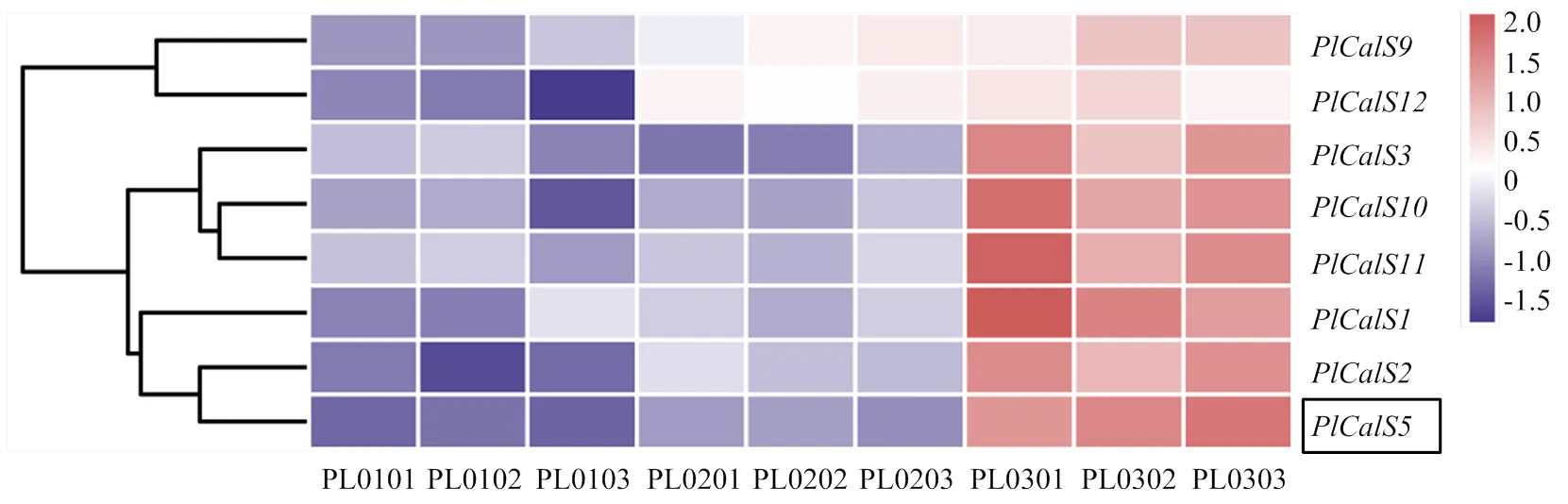
PL0101、PL0102、PL0103分别为自交24 h芍药柱头测序样品的3个生物学重复;PL0201、PL0202、PL0203为杂交24 h柱头的3个重复;PL0301、PL0302、PL0303为杂交36 h的3个生物学重复

表3 PlCalS家族基因编码蛋白的理化性质
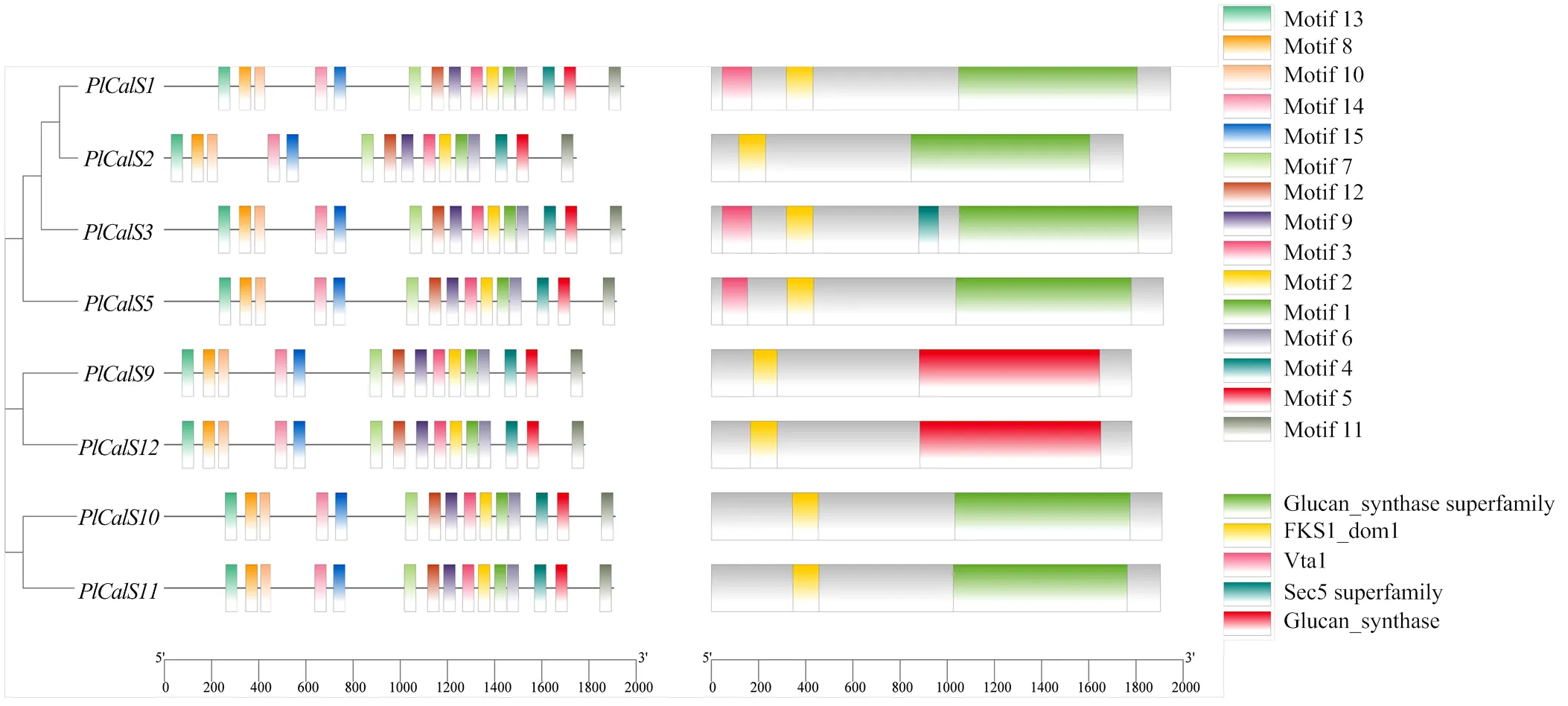
图7 芍药PlCalS蛋白的保守Motif分析
2.4.3 进化分析 CalS家族系统进化树由36条序列组成,其中芍药、牡丹、葡萄均为8条,拟南芥12条。牡丹、拟南芥和葡萄在3个分支均有出现,芍药只出现在两个分支中。其中、、与的亲缘关系较近(图8)。
2.5 芍药PlCalS在不同柱头不同时期的表达分析
除外,其余7个基因在3个时期杂交处理的相对表达量均高于自交时期;其中、、、在相同时期时,自交柱头的相对表达量低于杂交柱头;在相同的杂交柱头中,基因的相对表达量随时间变长而增高(图9)。
2.6 PlCalS5的生物信息学
在NCBI比对出与芍药PlCalS5蛋白序列相似度排名前九的植物,并下载9个物种的CalS5蛋白序列,从牡丹基因组中筛出牡丹PsCalS5的蛋白序列,多序列比对结果如图10所示。表明芍药PlCalS5与牡丹PsCalS5蛋白质的相似度最高,且各序列之间差异性不大,推断它们的功能相似或接近。MEME在线软件共鉴定出3个相同的保守结构区域。
在NCBI中下载葡萄、番瓜、黄瓜、麻花、山茶、山荆子、白栎、苹果和河岸葡萄9个物种的CalS5蛋白序列,从牡丹基因组中筛出牡丹PsCalS5的蛋白序列,以11个物种的CalS5蛋白序列构建系统发育进化树(图11)。结果表明芍药PlCalS5与牡丹PsCalS5亲缘关系最近。
2.7 不同浓度ABA处理下的PlCalS5表达
经过ABA两个浓度(10和100 μmol·L-1)处理后,的相对表达量如图12所示,除了2和4 h外,在6、8、10和12 h处理中,的表达量均高于同时期的对照处理。而在24和36 h,对ABA的处理敏感,在10 μmol·L-1浓度的ABA处理中分别达到同期对照的3.4倍与5.4倍(图12-A),在100 μmol·L-1浓度的ABA处理中分别达到同期对照的4.5倍与12.0倍(图12-B)。
3 讨论
3.1 花粉管荧光显微观察与生理指标分析
胼胝质在植物生长发育中发挥着重要作用,参与了植物的胞间连丝和筛孔调控、花粉发育、维管分化、胞质分裂过程中的细胞板形成等过程[32-33]。胼胝质的异常沉积会导致花粉管出现生长缓慢、扭曲缠绕、生长无方向性等现象[10],‑1,3-葡聚糖酶具有降解胼胝质的功能[34-35]。本研究在芍药自交与杂交的花粉管萌发荧光观察中发现,杂交雌蕊花粉管相对于自交会伴有胼胝质的沉积而使花粉管堵塞、扭曲、缠绕,在其他观赏植物中也有类似现象[36-37]。授粉后,发现4 h时胼胝质及‑1,3-葡聚糖酶含量随时间的延长而升高,这可能是由于授粉后花粉的萌发生长中需要大量的胼胝质形成花粉管壁。随胼胝质含量的升高,‑1,3-葡聚糖酶含量也升高,使胼胝质的含量处于合适的范围以促进花粉壁的形成[38];4 h后自交柱头内胼胝质和‑1,3-葡聚糖酶的含量变化趋于平稳,而杂交柱头胼胝质含量开始增加且显著高于自交,这可能是杂交不亲和柱头内胼胝质含量的快速增加影响花粉管的正常生长,需要降解部分胼胝质来促进花粉管的正常生长,因此会导致‑1,3-葡聚糖酶含量增加,但‑1,3-葡聚糖酶的增加速度低于胼胝质合成的速度,所以未能降解过多的胼胝质,使胼胝质在花粉管中异常沉积。
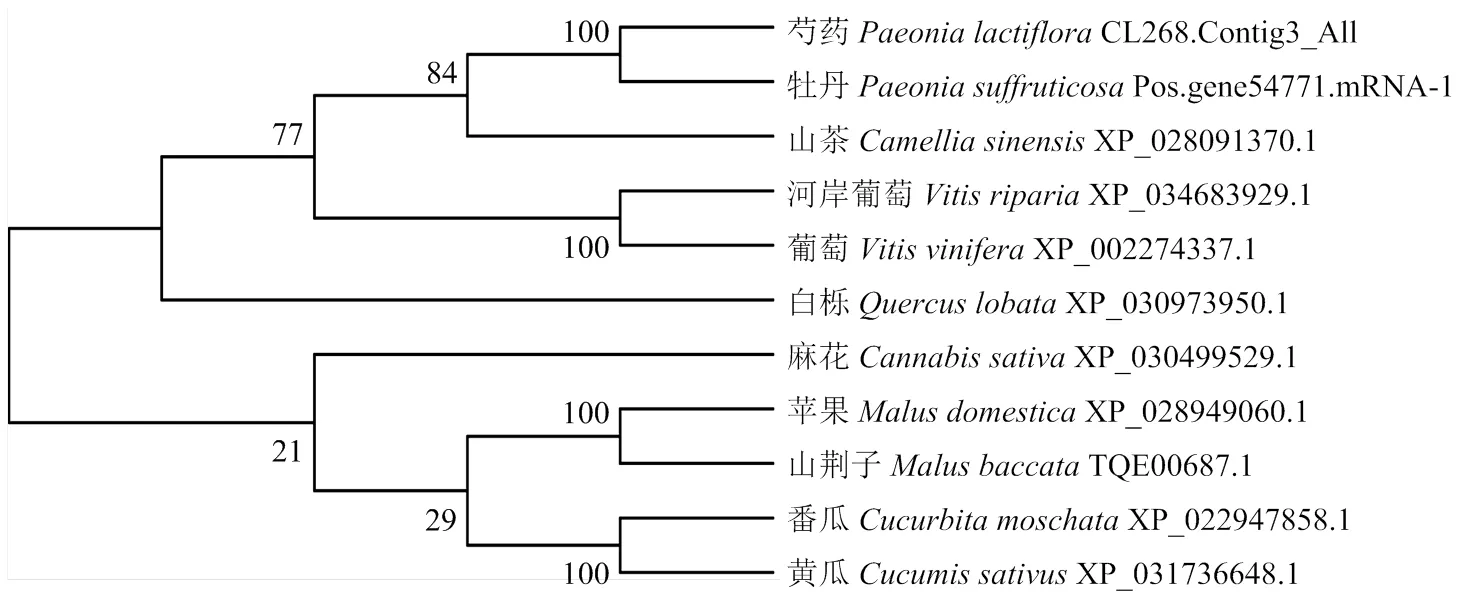
图11 芍药PlCalS5与其他物种CalS5系统进化树

A: 10 μmol·L-1ABA; B: 100 μmol·L-1ABA
3.2 芍药PlCalS的基因序列及表达模式分析
CalS家族基因在植物中参与许多重要的生理过程,已在许多物种中被鉴定[22,39]。本研究在芍药柱头转录组中鉴定并命名了8个,其编码的蛋白质氨基酸残基数为1 745—1 951 aa,与玉米中编码的蛋白质大小类似[40]。对牡丹、拟南芥、葡萄和芍药的CalS蛋白进行系统发育分析,发现该基因家族可分为3个分支,其中、、与亲缘关系较近。拟南芥在花粉管伸长过程中参与了胼胝质屏障和花粉管壁的形成[41],与位于同一分支且同源性较高,推测也可能参与芍药柱头花粉管的生长。作为胼胝质合成的关键基因,基因编码一个具有多个跨膜结构的大蛋白,通常包括Vta1、FKS1和Glucan_synthase三个结构域[22]。Motif结构分析表明该家族成员较为保守,8个成员包含-1,3-葡聚糖合成酶结构域和FKS1结构域这两个典型的保守结构域,只有、和含有Vta1结构域,推测CalS基因家族可能在进化中变化较少且功能稳定。胼胝质合成酶基因通过调节胼胝质沉积在植物生长发育过程中起着关键作用[42]。大部分会调控花药中胼胝质的沉积,以促进花粉的正常发育[40]。本研究发现,筛选出的8个在杂交组合不同时期的基因表达量均高于自交组合(除外),可能增加了胼胝质的合成,从而使杂交柱头中出现胼胝质堆积,影响了花粉管的生长。
不同植物中的作用不同,但参与胼胝质合成的功能是保守的[43-44]。目前关于的功能已在多个物种中有所研究,拟南芥中花粉壁发育的四分体时期需要大量胼胝质的合成,突变后会破坏雄性减数分裂过程中胼胝质的沉积,导致无法形成正常的花粉壁[38,45];水稻中的在合成小孢子的胼胝壁、调节花粉活力和决定雄性育性方面起着至关重要的作用[39];梨中的会通过控制胼胝质的合成来维持花粉管的正常生长[17]。编码一种直接影响花粉管胼胝质的花粉特异性蛋白,调控花粉发育阶段到花粉管伸长阶段的胼胝质合成[46],是芍药中唯一与同源的基因,且具有合适的蛋白定位,因此推测在芍药远缘杂交不亲和的胼胝质沉积中起了重要作用。在杂交后24 h表达量较高,同时在这个时期,花粉管中产生了大量的胼胝质,由此推测的高表达造成胼胝质大量沉积,使花粉管生长堵塞、扭曲、缠绕。
3.3 ABA调控胼胝质基因诱导胼胝质的沉积
ABA也会通过信号通路调控胼胝质的沉积与降解[47]。Liu等[48]发现ABA可诱导作物胼胝质合成酶活性增加,同时抑制-1,3-葡聚糖酶水平,促进胼胝质沉积。ABA不仅通过影响胼胝质合成酶基因的表达调控胼胝质的沉积,还会影响授粉亲和性。笔者前期研究发现杂交柱头ABA的含量显著高于自交柱头,并且高含量的ABA会抑制柱头上花粉的萌发,从而抑制花粉管的生长以影响授粉亲和性[30],本研究施用不同浓度ABA处理后,发现对高浓度ABA更为敏感,且发现杂交柱头ABA含量处于高水平,由此推测在芍药的杂交柱头中,异源花粉的刺激可能会增强某个ABA合成途径,ABA可能通过正调控胼胝质基因诱导胼胝质的沉积,从而抑制花粉的萌发与花粉管的伸长,以进一步影响授粉的亲和性。
4 结论
从芍药柱头转录组中共鉴定出8个PlCalS基因家族成员,均含有完整FKS1及-1,3-葡聚糖合成酶保守结构域,系统进化分析将PlCalS聚类在2个亚族。芍药PlCalS家族成员的蛋白保守基元类似,且具有较高的保守性。8个基因在自交和杂交的不同处理中均出现差异表达,其中在杂交处理中的表达量较自交处理显著上调,可能与杂交不亲和性有关。在不同浓度的ABA诱导下,对高浓度的ABA表现得更为敏感,其可能通过正调控胼胝质基因从而诱导胼胝质的沉积,影响授粉的亲和性,参与杂交不亲和过程。
[1] JI X T, YUAN Y P, BAI Z Z, WANG M L, NIU L X, SUN D Y. PlZFP mediates the combinatorial interactions of abscisic acid with gibberellin and ethylene during flower senescence in cut herbaceous peony. Postharvest Biology and Technology, 2023, 195: 112130.
[2] ZHANG C J, SHEN J J, WANG C, WANG Z Y, GUO L L, HOU X G. Characterization ofduring flower development in early- and late-flowering tree peonies cultivars. Plant Signaling & Behavior, 2022, 17(1): 2120303.
[3] 万映伶, 朱梦婷, 刘爱青, 金亦佳, 刘燕. 中国观赏芍药表型多样性解析与资源评价. 中国农业科学, 2022, 55(18): 3629-3639. doi: 10.3864/j.issn.0578-1752.2022.18.012.
WAN Y L, ZHU M T, LIU A Q, JIN Y J, LIU Y. Phenotypic diversity analysis of Chinese ornamental herbaceous peonies and its germplasm resource evaluation. Scientia Agricultura Sinica, 2022, 55(18): 3629-3639. doi: 10.3864/j.issn.0578-1752.2022.18.012. (in Chinese)
[4] 王慧娟, 符真珠, 李艳敏, 蒋卉, 高杰, 张和臣. 观赏芍药杂交育种研究进展. 北方园艺, 2021(16): 144-149.
WANG H J, FU Z Z, LI Y M, JIANG H, GAO J, ZHANG H C. Research progress on the crossbreeding of ornamental herbaceous peony. Northern Horticulture, 2021(16): 144-149. (in Chinese)
[5] 郝津藜, 董晓晓, 袁涛. 四种药剂柱头处理对芍药属远缘杂交授粉结实率的影响. 中国农业大学学报, 2019, 24(1): 40-45.
HAO J L, DONG X X, YUAN T. Effects of four stigma treatments on the seed-setting rate ofdistant hybridization. Journal of China Agricultural University, 2019, 24(1): 40-45. (in Chinese)
[6] YANG Y, SUN M, LI S S, CHEN Q H, TEIXEIRA DA SILVA J A, WANG A J, YU X N, WANG L S. Germplasm resources and genetic breeding of: a systematic review. Horticulture Research, 2020, 7: 107.
[7] 梁长安, 王二强, 韩鲲, 王若晗, 卢林. 简述伊藤杂种的来源及与牡丹的异同点和应用. 现代园艺, 2022, 45(7): 65-67.
LIANG C A, WANG E Q, HAN K, WANG R H, LU L. The origin of ITO hybrid, its similarities and differences with peony and its application are briefly described. Xiandai Horticulture, 2022, 45(7): 65-67. (in Chinese)
[8] 刘建鑫, 于晓南. 芍药与牡丹远缘杂交花粉萌发与花粉管生长行为观察. 北京林业大学学报, 2016, 38(9): 80-86.
LIU J X, YU X N. Ultrastructural investigations ofpollen activation and pollen tube growth after intersectional hybridization. Journal of Beijing Forestry University, 2016, 38(9): 80-86. (in Chinese)
[9] 马翔龙, 吴敬需, 刘少华. 伊藤牡丹发展现状与展望. 中国花卉园艺, 2018(16): 28-31.
MA X L, WU J X, LIU S H. Development status and prospect of Ito peony. China Flowers & Horticulture, 2018(16): 28-31. (in Chinese)
[10] 律春燕, 王雁, 朱向涛, 李艳华. 黄牡丹与芍药组间杂交花粉与柱头识别的解剖学研究. 西北植物学报, 2009, 29(10):1988-1994.
LÜ C Y, WANG Y, ZHU X T, LI Y H. Anatomical studies on pollen-stigma interaction in intersectional cross ofand. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(10):1988-1994. (in Chinese)
[11] 王雪玲. 芍药牡丹组间远缘杂交及‘凤丹’胚培养研究[D]. 郑州: 河南农业大学, 2014.
WANG X L. Study on distant hybridization betweenandand embryo culture of' Fengdan'[D]. Zhengzhou: Henan Agricultural University, 2014. (in Chinese)
[12] 张佼蕊, 贺丹, 何松林, 谢栋博, 李朝梅, 王政, 刘艺平. 芍药PlSPL3基因的克隆与表达分析. 江苏农业学报, 2020, 36(6): 1537-1542.
ZHANG J R, HE D, HE S L, XIE D B, LI C M, WANG Z, LIU Y P. Cloning and expression analysis of PlSPL3 gene from. Jiangsu Journal of Agricultural Sciences, 2020, 36(6): 1537-1542. (in Chinese)
[13] 王冲, 贺卫丽, 张伟, 雷家军. 亚洲百合与东方百合远缘杂交花粉管生长荧光观察及胚培养. 北方园艺, 2018(10): 88-96.
WANG C, HE W L, ZHANG W, LEI J J. Fluorescence observation of pollen tube growth and embryo culture from distant hybridization between Asiatic and oriental lily cultivars. Northern Horticulture, 2018(10): 88-96. (in Chinese)
[14] 解玮佳, 宋杰, 唐路瑶, 彭绿春, 李世峰, 王继华. 高山杜鹃‘XXL’与蓝果杜鹃的杂交亲和性. 分子植物育种, 2023, 21(2): 582-588.
XIE W J, SONG J, TANG L Y, PENG L C, LI S F, WANG J H. Cross compatibility of the cross between’XXL’and R. cyanocarpum. Molecular Plant Breeding, 2023, 21(2): 582-588. (in Chinese)
[15] KOU X B, CAO P, HE Q K, WANG P, ZHANG S L, WU J Y. PbrROP1/2-elicited imbalance of cellulose deposition is mediated by a CrRLK1L-ROPGEF module in the pollen tube of. Horticulture Research, 2022, 9: uhab034.
[16] SEALE M. Callose deposition during pollen development. Plant Physiology, 2020, 184(2): 564-565.
[17] CAO P, TANG C, WU X, QIAN M, LV S Z, GAO H R, QIAO X, CHEN G D, WANG P, ZHANG S L, WU J Y. PbrCalS5, a callose synthase protein, is involved in pollen tube growth in. Planta, 2022, 256(2): 22.
[18] 于晓艳, 邢树堂, 赵兰勇. 玫瑰与月季种间杂交障碍原因分析. 中国农业科学, 2014, 47(15): 3112-3120. doi: 10.38648.issn.0578-1752. 2014.15.021.
YU X Y, XING S T, ZHAO L Y. Analysis on the barriers of interspecific hybridization BetweenandRosa hybrid. Scientia Agricultura Sinica, 2014, 47(15): 3112-3120. doi: 10.38648. issn.0578-1752.2014.15.021. (in Chinese)
[19] ÇETINBAŞ-GENÇ A, CAI G, DEL DUCA S, VARDAR F, ÜNAL M. The effect of putrescine on pollen performance in hazelnut (L.). Scientia Horticulturae, 2020, 261: 108971.
[20] GÓMEZ J F, TALLE B, WILSON Z A. Anther and pollen development: A conserved developmental pathway. Journal of Integrative Plant Biology, 2015, 57(11): 876-891.
[21] XU T, ZHANG C, ZHOU Q, YANG Z N. Pollen wall pattern in. Science Bulletin, 2016, 61(11): 832-837.
[22] ZÁVESKÁ DRÁBKOVÁ L, HONYS D. Evolutionary history of callose synthases in terrestrial plants with emphasis on proteins involved in male gametophyte development. PLoS One, 2017, 12(11): e0187331.
[23] DONG X Y, HONG Z L, SIVARAMAKRISHNAN M, MAHFOUZ M, VERMA D P S. Callose synthase (CalS5) is required for exine formation during microgametogenesis and for pollen viability in. The Plant Journal, 2005, 42(3): 315-328.
[24] ABERCROMBIE J, O’MEARA B, MOFFATT A, WILLIAMS J. Developmental evolution of flowering plant pollen tube cell walls: callose synthase (CalS) gene expression patterns. EvoDevo, 2011, 2(1): 14.
[25] 康希泉, 亓帅, 臧德奎, 郑林, 徐宗大, 邢树堂, 于晓艳. 玫瑰-l,3-葡聚糖合成酶基因()克隆与生物信息学分析. 山东林业科技, 2019, 49(2): 8-11, 22.
KANG X Q, QI S, ZANG D K, ZHENG L, XU Z D, XING S T, YU X Y. Cloning and bioinformatics analysis ofβ-1, 3-glucan synthase gene (). Journal of Shandong Forestry Science and Technology, 2019, 49(2): 8-11, 22. (in Chinese)
[26] WU S W, KUMAR R, ISWANTO A B B, KIM J Y. Callose balancing at plasmodesmata. Journal of Experimental Botany, 2018, 69(22): 5325-5339.
[27] DONG X Y, HONG Z L, CHATTERJEE J, KIM S, VERMA D P S. Expression of callose synthase genes and its connection with Npr1 signaling pathway during pathogen infection. Planta, 2008, 229(1): 87-98.
[28] 张庆雯, 祁静静, 谢宇, 谢竹, 彭蕴, 李强, 彭爱红, 邹修平, 何永睿, 陈善春, 姚利晓. 黄龙病菌胁迫下‘锦橙’表达和胼胝质沉积的初步分析. 园艺学报, 2021, 48(2): 276-288.
ZHANG Q W, QI J J, XIE Y, XIE Z, PENG Y, LI Q, PENG A H, ZOU X P, HE Y R, CHEN S C, YAO L X. Preliminary analysis ofand callose deposition ininfected with candidatus. Acta Horticulturae Sinica, 2021, 48(2): 276-288. (in Chinese)
[29] 贺丹, 王雪玲, 高晓峰, 吕博雅, 刘艺平, 何松林. 牡丹芍药远缘杂交亲和性. 东北林业大学学报, 2014, 42(7): 65-68.
HE D, WANG X L, GAO X F, LÜ B Y, LIU Y P, HE S L. Intergeneric cross-compatibility between peonies. Journal of Northeast Forestry University, 2014, 42(7): 65-68. (in Chinese)
[30] 贺丹, 曹健康, 何松林, 张明星, 华超, 张佼蕊, 刘艺平. 芍药远缘杂交不亲和基因的克隆及表达分析. 河南农业大学学报, 2021, 55(6): 1074-1080, 1096.
HE D, CAO J K, HE S L, ZHANG M X, HUA C, ZHANG J R, LIU Y P. Cloning and expression analysis of distant hybridization incompatibilitygene from. Journal of Henan Agricultural University, 2021, 55(6): 1074-1080, 1096. (in Chinese)
[31] 贺丹, 张佼蕊, 何松林, 刘红利, 王政, 刘艺平. 芍药属远缘杂交不亲和基因克隆及表达分析. 华北农学报, 2020, 35(6): 81-89.
HE D, ZHANG J R, HE S L, LIU H L, WANG Z, LIU Y P. Cloning and expression analysis of distant hybridization incompatibilitygene from. Acta Agriculturae Boreali-Sinica, 2020, 35(6): 81-89. (in Chinese)
[32] CHEN X Y, KIM J Y. Callose synthesis in higher plants. Plant Signaling & Behavior, 2009, 4(6): 489-492.
[33] AMSBURY S, KIRK P, BENITEZ-ALFONSO Y. Emerging models on the regulation of intercellular transport by plasmodesmata- associated callose. Journal of Experimental Botany, 2018, 69(1): 105-115.
[34] FAN Y J, LIN S S, LI T T, SHI F J, SHAN G Y, ZENG F C. The plasmodesmata-located β-1, 3-glucanase enzyme PdBG4 regulates trichomes growth in. Cells, 2022, 11(18): 2856.
[35] PERROT T, PAULY M, RAMÍREZ V. Emerging roles of β-glucanases in plant development and adaptative responses. Plants, 2022, 11(9): 1119.
[36] 冯琪, 王鑫, 田琳, 赵艺璇, 张家培, 刘冬云. 鼠尾草属植物杂交亲和性探究. 河北师范大学学报(自然科学版), 2020, 44(3): 260-266.
FENG Q, WANG X, TIAN L, ZHAO Y X, ZHANG J P, LIU D Y. Study on the cross-compatibility ofL. Journal of Hebei Normal University (Natural Science), 2020, 44(3): 260-266. (in Chinese)
[37] 李辛雷, 陈发棣, 赵宏波. 菊属植物远缘杂交亲和性研究. 园艺学报, 2008, 35(2): 257-262.
LI X L, CHEN F D, ZHAO H B. Compatibility of interspecific cross ingenus. Acta Horticulturae Sinica, 2008, 35(2): 257-262. (in Chinese)
[38] KANAOKA M M, SHIMIZU K K, XIE B, URBAN S, FREEMAN M, HONG Z L, OKADA K. KOMPEITO, an atypicalrhomboid-related gene, is required for callose accumulation and pollen wall development. International Journal of Molecular Sciences, 2022, 23(11): 5959.
[39] SHI X, SUN X H, ZHANG Z G, FENG D, ZHANG Q, HAN L D, WU J X, LU T G. GLUCAN SYNTHASE-LIKE 5 (GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice. Plant and Cell Physiology, 2015, 56(3): 497-509.
[40] NIU Q K, ZHANG P, SU S, JIANG B, LIU X W, LI C, YU T, YI H Y, TANG J, CAO M J. Characterization and expression analyses of callose synthase enzyme (cals) family genes in maize (L.). Biochemical Genetics, 2022, 60(1): 351-369.
[41] XIE B, WANG X M, HONG Z L. Precocious pollen germination inplants with altered callose deposition during microsporogenesis. Planta, 2010, 231(4): 809-823.
[42] MBIZA N I T, HU Z W, ZHANG H R, ZHANG Y, LUO X C, WANG Y X, WANG Y, LIU T, LI J P, WANG X P, ZHANG J M, YU Y H. GhCalS5 is involved in cotton response to aphid attack through mediating callose formation. Frontiers in Plant Science, 2022, 13: 892630.
[43] SLEWINSKI T L, BAKER R F, STUBERT A, BRAUN D M. Tie- dyed2 encodes a callose synthase that functions in vein development and affects symplastic trafficking within the phloem of maize leaves. Plant Physiology, 2012, 160(3): 1540-1550.
[44] YANG J, TIAN L, SUN M X, HUANG X Y, ZHU J, GUAN Y F, JIA Q S, YANG Z N. AUXIN RESPONSE FACTOR17 is essential for pollen wall pattern formation in. Plant Physiology, 2013, 162(2): 720-731.
[45] MA X F, WU Y, ZHANG G F. Formation pattern and regulatory mechanisms of pollen wall in. Journal of Plant Physiology, 2021, 260: 153388.
[46] XIA Z H, WEN B X, SHAO J, ZHANG T C, HU M M, LIN L, ZHENG Y P, SHI Z X, DONG X L, SONG J J, LI Y S, WU Y J, YUAN Y F, WU J Y, CHEN Q X, CHEN J Q. The transcription factor PbrbZIP52 positively affects pear pollen tube longevity by promoting callose synthesis. Plant Physiology, 2023, 191(3): 1734-1750.
[47] 张庆雯, 王兆昊, 祁静静, 谢宇, 雷天刚, 何永睿, 陈善春, 姚利晓. 植物胼胝质合成酶研究进展. 园艺学报, 2021, 48(4): 661-675.
ZHANG Q W, WANG Z H, QI J J, XIE Y, LEI T G, HE Y R, CHEN S C, YAO L X. The advances of callose synthase in plant. Acta Horticulturae Sinica, 2021, 48(4): 661-675. (in Chinese)
[48] LIU J L, DU H T, DING X, ZHOU Y D, XIE P F, WU J C. Mechanisms of callose deposition in rice regulated by exogenous abscisic acid and its involvement in rice resistance toStål (Hemiptera: Delphacidae). Pest Management Science, 2017, 73(12): 2559-2568.
Identification of Callose Synthetase Gene Family and Functional Analysis of
HE Dan1,2, YOU XiaoLong1, HE SongLin1,2, ZHANG MingXing1, ZHANG JiaoRui1, HUA Chao1, WANG Zheng1, LIU YiPing1
1College of Landscape Architecture and Art, Henan Agricultural University, Zhengzhou 450002;2College of Horticulture Landscape Architecture, Henan Institute of Science and Technology, Xinxiang 453003, Henan
【Objective】 The CalS family plays an important role in regulating callose synthesis in plants. In this study, the members of the CalS family were identified and their bioinformatics and expression patterns were analyzed, which provided an evidence for distant cross incompatibility of(). 【Method】The pollen germination and tube growth in self- and cross-pollinated stigma were observed by fluorescence microscope. The callose content, endogenous Abscisic acid (ABA) content and-1,3-glucanase activity in stigma were measured. Eight members of the CalS family were cloned, and Expasy, MEME, TBtools, MEGA 7.0 and so on were used to predict the basic physicochemical properties and conserved motifs of proteins of thefamily members and to construct a phylogenetic evolutionary tree. The expression of eightin stigma at 24 h of self-pollination, 24 h of cross-pollination and 36 h of cross-pollination were analyzed by quantitative real-time polymerase chain reaction (qRT-PCR). Multiple sequence alignment ofwas performed, a phylogenetic tree was constructed, and the expression characteristics of【Result】Fluorescence microscopic observation of pollen tube showed that callose plugging occurred in the stigma of hybrid, which restricted the pollen germination and tube growth. Callose content in cross-pollinated stigma was found to be higher in most periods than that in self-pollinated stigma. Then, the callose activity of-1,3-glucose and ABA content in stigma with different pollination affinity showed regular differences. The members of thefamily ofwere identified and named by integrity analysis of the structural domains and sequence matching, and 15 conserved motifs with stable distribution in thefamily were encoded by every eight genes. Multi-species phylogenetic relationships showed that thefamily could be divided into three branches, with thefamily distributed in only two branches, of whichwas more closely related to,and. The bioinformatics analysis showed that the eight family members encoded 1 745-1 951 amino acids, with a total number of 28 583-31 870 atoms and isoelectric points of 7.99-9.13. The analysis of the FPKM values in transcriptome showed that thePlCalS family members were highly expressed in the same period of hybridization and at 36 h of hybridization under the same treatment. qRT-PCR showed that the relative expression levels of 8 genes at 24 h of self-pollination were lower than those at 24 h and 36 h of cross-pollination. In addition, thegene was found to be more sensitive to high ABA treatment. 【Conclusion】 There were eight gene members in the CalS family of, which played an important role in regulating the callose formation of. The expression level of thegene in cross-pollinated stigma was higher than that in self-pollinated stigma in most periods, which might be involved in callose abnormal deposition. Heterologous pollen stimulation to the stigma ofcould enhance a certain ABA synthesis pathway. ABA induced callose deposition by positively regulating the expression of callose synthesis genes, thus inhibiting pollen germination and tube elongation, and finally affecting pollination compatibility.
; distant hybridization incompatibility; CalS gene family; gene expression analyses

10.3864/j.issn.0578-1752.2023.16.011
2023-01-09;
2023-04-27
国家自然科学基金(31600568,31870698)、河南省自然科学基金(232300420006)、河南省高等学校重点科研项目(23A220001)
贺丹,E-mail:dandan990111@163.com。通信作者何松林,E-mail:hsl213@yeah.net
(责任编辑 赵伶俐)
