基于网络药理学和分子对接技术研究黄芩治疗糖尿病脑病的作用
2023-09-19高书春杜卓琦马世平邓雪阳
高书春,杜卓琦,马世平,邓雪阳
(中国药科大学,江苏 南京 211198)
糖尿病是一种常见的代谢疾病,受遗传和环境因素等影响,发病率逐年增高[1]。糖尿病脑病是指糖尿病导致的中枢神经系统病变,这种使大脑在结构、神经生理及认知功能等方面发生病理改变是糖尿病最常见的并发症之一[2]。阿尔茨海默病是一种慢性神经退行性疾病,以记忆缺失逐渐进展为痴呆特征的神经退行性疾病[3]。糖尿病作为认知功能障碍的独立危险因素之一,与阿尔茨海默病关系密切[4]。目前糖尿病脑病的治疗仍以控制血糖为主,然而疗效有限,而西药治疗可能会导致低血糖,诱发或加重神经病变[5]。
糖尿病属中医学“消渴症” 范畴[6-7],阿尔茨海默病属“呆病”[7],无论是糖尿病还是阿尔茨海默病,其病因繁多,病情表现反复,暂无根治办法,因此探索中药多成分、多靶点的治疗机制就显得尤为重要。黄芩具有清热燥湿、泻火解毒、止血、安胎的功效,可用于糖尿病的治疗[8],因此认为黄芩治疗糖尿病脑病具有临床应用价值。网络药理学以网络为基础,结合药理学并涉及多层次、多方向的数据分析,在分子、细胞、生物过程及通路等方面解析药物与疾病靶点之间多成分、多靶点、多通路的结果,这也与中医药的整体观相同[9]。
1 材料与方法
1.1 黄芩活性成分筛选 通过中药系统药理学数据库与分析平台 (TCMSP,https://tcmspw.com/tcmsp.php)[10]检索黄芩的化学成分,根据黄芩ADME 性质,以口服生物利用度 (oral bioavailability,OB) ≥30%,类药性 (druglikeness,DL) ≥0.18 进行筛选[11],然后获得其相关靶点蛋白,并根据相关文献及PharmMapper 库(http://lilabecust.cn/pharmmapper/index.html)、SwissTargetPrediction库(http://swisstargetprediction.ch/) 进行补充,并筛选符合糖尿病和阿尔茨海默病的靶点。利用UniProt 库(https://www.uniprot.org/)、DrugBank 库(https://go.drugbank.com/) 查询靶点蛋白对应的基因名,将黄芩活性化合物对应的靶点蛋白进行统一规范。
1.2 糖尿病和阿尔茨海默病靶点筛选 在OMIM 库(https://www.omim.org/)、GeneCards 库 (https://www.genecards.org/)、Therapeutic Target Database (http://db.idrblab.net/ttd/) 及DrugBank库 (https://go.drugbank.com/) 中,以“diabetes mellitus” 为关键词检索糖尿病的潜在靶点,以“Alzheimer’s disease” 为关键词检索阿尔茨海默病的潜在靶点,依据潜在靶点与疾病的高相关性以及后续的网络分析,对所得靶点按relevance score 值等由大到小,以4 倍中位数为阈值进行筛选[12],合并糖尿病和阿尔茨海默病的疾病靶点。
1.3 构建黄芩活性成分-靶点网络 将靶点与黄芩活性成分导入Cytoscape3.7.2 软件(https://cytoscape.org/) 构建“活性成分-靶点” 网络。
1.4 构建黄芩-糖尿病-阿尔茨海默病靶点的PPI 网络 将黄芩、糖尿病和阿尔茨海默病的靶点导入VENNY2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)在线绘制韦恩图,得到交集靶点,并将交集靶点上传至STRING11.0 (https://string-db.org/),得到蛋白质互作网络 (protein-protein interaction networks,PPI),并将该PPI 网络信息保存为TSV 文件,导入Cytoscape3.7.2 中详细绘制PPI 互作网络并进行网络拓扑分析,根据degree 值筛选关键靶点[13]。
1.5 GO 功能与KEGG 通路富集分析 将黄芩-糖尿病-阿尔茨海默病交集靶点上传至Metascape 库[14](http://www.metascape.org/gp/index.html#/main/step1) 中进行基因本体(gene ontology,GO) 与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG) 富集分析,获得KEGG 通路结果及GO 富集分析中分子功能(molecular functions,MF)、细胞组成(cellular components,CC)、生物过程 (biological processes,BP)[15],用GraphPad Prism 7 软件进行可视化。
1.6 构建黄芩成分-疾病靶点-通路网络 将上述得到的核心通路和交集靶点、药物成分导入到Cytoscape3.7.2 软件中,构建“药物-成分-疾病靶点-通路” 网络图,利用内部工具Network Analyzer 对黄芩活性成分及交集靶点进行拓扑学分析。
1.7 分子对接 利用TCMSP 获得主要活性成分的mol2 结构,在PDB (http://www.rcsb.org/) 数据库中检索核心靶点的三维结构,利用Auto Dock Tools 1.5.6 软件对蛋白3D 结构进行去水、加氢并计算电荷,保存为pdbqt 格式;同法将活性成分的mol2 结构转为pdbqt 格式。最后用Auto Dock Tools 1.5.6 软件进行分子对接,并用Pymol 2.4.1 进行可视化。
2 结果
2.1 黄芩活性成分的筛选及成分-靶点网络的构建 经过检索TCMSP 库,筛选获得黄芩活性成分36 种,进一步查询对应靶点,去重后获得黄芩重要的活性成分22 种,见表1,其中仅黄芩中存在的成分为黄芩新素、黄芩黄酮Ⅱ、红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮、5,7,2,5-四羟基-8,6-二甲氧基黄酮,而2,6,2',4'-四羟基-6'-甲氧基查尔酮因未查到靶点信息而舍去。筛选得到作用靶点146 个。黄芩成分-靶点网络中有节点164 个,见图1。
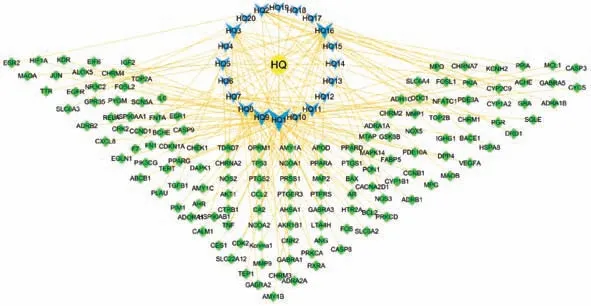
图1 黄芩化合物-靶点网络图

表1 黄芩活性成分的基本信息
2.2 糖尿病和阿尔茨海默病靶点的获取 糖尿病靶点主要来自于GeneCards 库,获得靶点6 134 个,其Relevance Score 值的4 倍中位数为7.9,score>7.9 的靶点有1 299 个,再与OMIM 等库合并,去重后获得1 125 个糖尿病潜在靶点;同理获得阿尔茨海默病靶点9 553 个,score>5.06 的靶点有2 391 个,合并去重后获得1 144 个糖尿病潜在靶点。
2.3 黄芩-糖尿病-阿尔茨海默病靶点的PPI 网络构建 将上述获得的146 个黄芩靶点,1 125 个糖尿病靶点,1 144个阿尔茨海默病靶点导入Venny2.1 绘制Venn 图,见图2。

图2 黄芩、糖尿病、阿尔茨海默病靶点交集Venn 图
将交集靶点上传至STRING 11.0 (因为存在1 个游离靶点,故实际得到的PPI 网络中靶点为60 个) 进行处理,接着导入Cytoscape 3.7.2 软件中详细绘制PPI 互作网络,见图3。STRING 数据分析可知节点数60 个,边数630 条,平均节点度值20.7,预测的边数248。在Cytoscape 中用内部工具NetworkAnalyzer 进行拓扑学分析,筛选度值前二十的靶点 (degree >28),分别为AKT1、IL-6、VEGFA、TNF、CASP3 JUN、TP53、FOS、EGFR、HSP90AA1、PTGS2、MMP9、NOS3、ESR1、CYCS、FN1、MAPK14、PPARG、CXCL8、CCL2。

图3 黄芩、糖尿病、阿尔茨海默病交集靶点的PPI 网络
2.4 核心靶点的GO 功能与KEGG 通路富集分析 将黄芩、糖尿病、阿尔茨海默病交集靶点经Metascape 库分析后,得到KEGG 通路258 条,GO 富集分析中分子功能(MF) 101条、细胞组成(CC) 76 条、生物过程(BP) 1 413 条。根据P值筛选得到KEGG 通路排名前二十的通路,见图4,主要涉及AGE-RAGE 信号介导的糖尿病并发症通路(AGERAGE signaling pathway in diabetic complications)、IL-17 信号通路(IL-17 signaling pathway)、MAPK 信号通路(MAPK signaling pathway)、TNF 信号通路(TNF signaling pathway)、磷脂酰肌醇3 激酶-蛋白激酶B 信号通路 (PI3K-Akt signaling pathway)、C 型凝集素受体信号通路(C-type lectin receptor signaling pathway)、胰岛素抵抗通路 (insulin resistance) 等。

图4 交集靶点KEGG 通路富集分析
GO 富集分析中,MF 主要涉及核受体活性 (nuclear receptor activity)、转录辅激活因子结合 (transcription coactivator binding)、类固醇激素受体 (steroid hormone receptor activity)、蛋白质结构域特异性结合(protein domain specific binding)、脂质结合(lipid binding) 等,见图5A。CC 主要涉及囊腔(vesicle lumen)、分泌颗粒腔(secretory granule lumen)、胞质泡腔(cytoplasmic vesicle lumen)、膜微区(membrane microdomain)、膜区(membrane region)、受体复合物(receptor complex) 等,见图5B。BP 主要涉及脂多糖的反应(response to lipopolysaccharide)、活性氧代谢过程(reactive oxygen species metabolic process)、细胞对脂质的反应 (cellular response to lipid)、氧化应激反应(response to oxidative stress)、心血管系统发育(cardiovascular system development)、MAPK 级联的调节(regulation of MAPK cascade)、跨膜受体蛋白酪氨酸激酶信号通路 (transmembrane receptor protein tyrosine kinase signaling pathway) 等,见图5C。

图5 交集靶点GO 功能富集分析
2.5 黄芩成分-疾病靶点-通路网络构建 经Cytoscape3.7.2软件构建“药物成分-疾病靶点-通路” 网络图,见图6。经分析后可知,平均度值为7,度值靠前的成分主要是汉黄芩素、黄芩素、β-谷甾醇、金合欢素、降穿心莲黄酮、红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮等,其中红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮等为黄芩中独有的成分。度值靠前的靶点主要是AKT1、IL-6、JUN、MAPK14、FOS、TNF、PRKCA、VEGFA 等。

图6 黄芩成分-疾病靶点-通路网络
2.6 分子对接验证 将汉黄芩素、金合欢素、黄芩素、红花素、二氢奥洛昔林、黄芩黄酮Ⅱ、5,7,2,5-四羟基-8,6-二甲氧基黄酮、降穿心莲黄酮等活性成分与核心靶点VEGFA、AKT1、TNF、MAPK14、IL-6 进行对接,对接结果见表2。由此可知,黄芩是通过多成分、多靶点以不同活性结合,进一步验证了关键活性成分与核心交集靶点的相互作用。部分结果可视化后见图7,其中氢键以虚线显示,结合位点以不同颜色在蛋白质与分子之间显示。
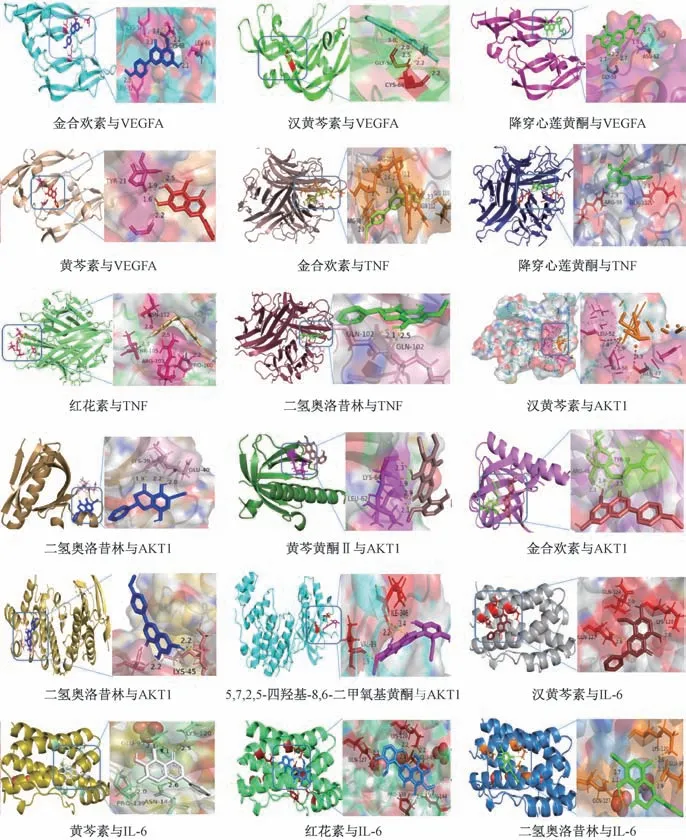
图7 黄芩活性成分与核心靶点的对接
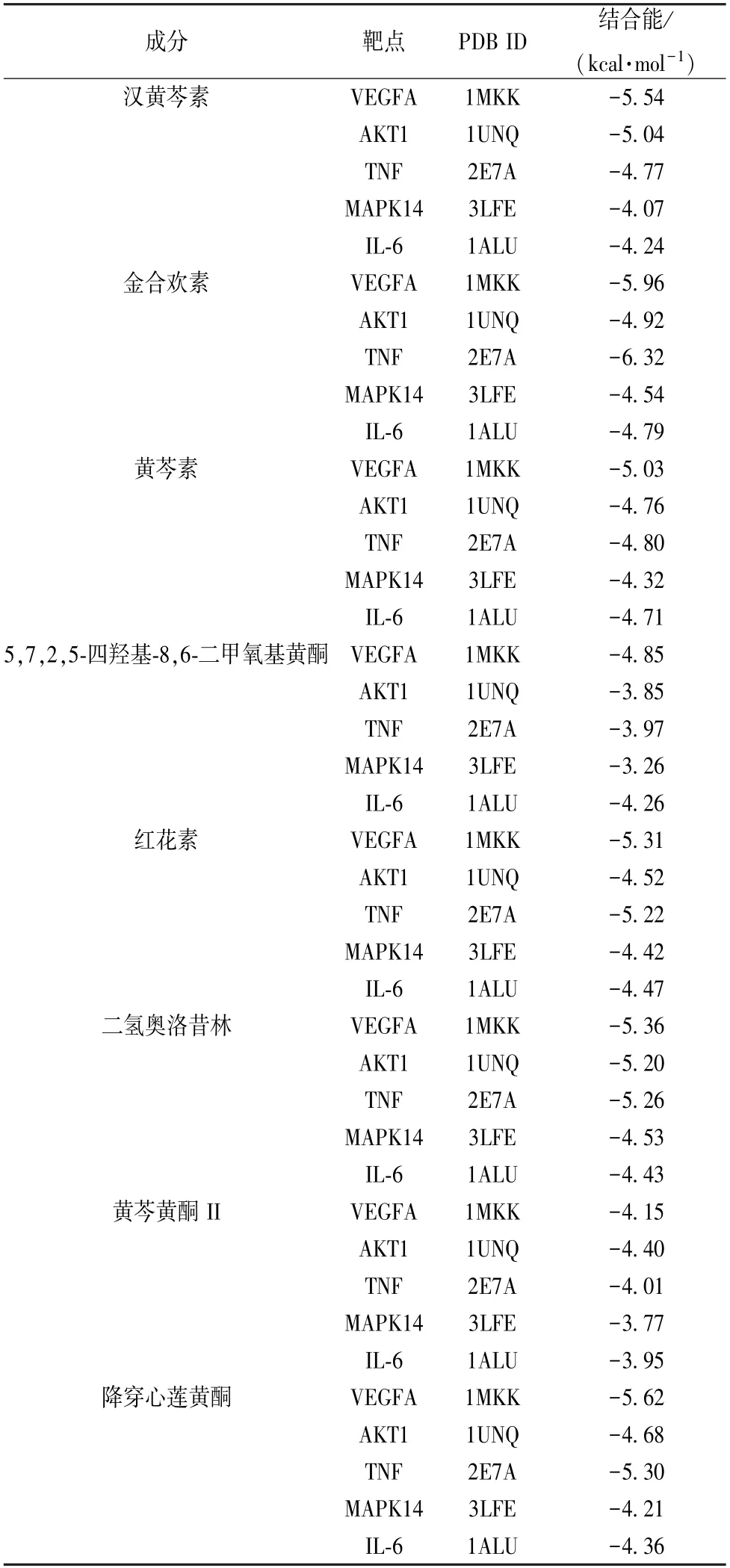
表2 黄芩活性成分与核心靶点的分子对接结果
3 讨论
黄芩性寒,味苦,具有泻火除烦之功效,是历代医家治疗神志病及消渴病的常用中药。课题组前期研究发现黄芩及其活性成分具有显著的神经保护活性,及抗氧化、抗神经细胞凋亡等作用[16-18]。因此,本研究结合网络药理学和分子对接技术系统地探索黄芩治疗糖尿病脑病的分子机制。
本研究对活性成分-靶点的研究中得到仅黄芩中存在的成分为黄芩新素、黄芩黄酮Ⅱ、红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮、5,7,2,5-四羟基-8,6-二甲氧基黄酮、2,6,2',4'-四羟基-6'-甲氧基查尔酮,在相关实验研究中均有报道证实。Guo 等[19]研究发现汉黄芩素能减轻神经炎症,其作用机制与缓解Aβ 蛋白导致的认知功能丧失有关[20]。黄芩素还可抑制小胶质细胞活化,减少炎症,减轻氧化应激和细胞凋亡[21-22]。汉黄芩素可以通过AKT/GLUT4 途径发挥降血糖作用,以改善胰岛素抵抗[23]。目前研究发现红花素提取自黄芩茎叶总黄酮,其可以抑制Aβ 蛋白引起的神经元凋亡,改善胰岛素抵抗[24-26]。崔晓燕等[27]研究发现黄芩提取物在海马和皮质中可促使乙酰胆碱的合成,以此改善阿尔茨海默病表现出的学习记忆障碍。
本研究通过构建活性成分-靶点网络、PPI 网络及疾病-靶点-通路网络,经网络拓扑分析,筛选出一部分重要的靶点,度值靠前的成分主要是汉黄芩素、黄芩素、β-谷甾醇、金合欢素、降穿心莲黄酮、红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮等,其中红花素、二氢奥洛昔林、5,8,2'-三羟基-7-甲氧基黄酮等为黄芩中独有的成分。度值靠前的靶点主要是AKT1、IL-6、JUN、MAPK14、FOS、TNF、PRKCA、VEGFA 等,其在基础研究中均得到验证,说明这些靶点对糖尿病脑病的重要性。在糖尿病中,一方面AKT1 的过表达可促进葡萄糖的吸收,另一方面AKT 可抑制胰高血糖素的分泌,其机制与改善胰岛素抵抗有关[28-29]。在阿尔茨海默病中,AKT1 磷酸化表达的增加被认为与淀粉样蛋白负荷增加有关[30];肿瘤坏死因子和IL-6 在葡萄糖和脂质代谢、心血管功能中起重要作用;IL-6 的升高被认为与炎症、胰岛素抵抗和β 细胞功能障碍的发展有关[31];慢性应激和Aβ 蛋白会破坏小胶质细胞的活性,导致IL-6 进一步释放[32];MAPK14 参与了自噬过程,抑制MAPK14 的活性一定程度上可以缓解病症,也可通过靶向调节MAPK14 表达来减少Aβ 蛋白沉积以减轻病症[33-34]。目前研究发现血管内皮生长因子(VEGF) 的变异与糖尿病、阿尔茨海默病发生的风险增加有关,还可能与其他神经系统疾病有关[35-36]。
本研究通过KEGG 富集通路分析,得出黄芩治疗糖尿病脑病的主要通路涉及AGE-RAGE 信号通路、IL-17 信号通路、MAPK 信号通路、TNF 信号通路、PI3K-Akt 信号通路等。AGE-RAGE 信号通路中AGE 与受体RAGE 结合,诱导促炎性细胞因子、ROS 的产生,影响神经元和神经胶质细胞的活力[37],通过抑制AGE-RAGE 通路和随后的氧化应激、炎症,可以预防糖尿病导致的神经系统病变[38-39]。IL-17 和TNF 信号通路主要是通过诱发炎症级联通路的激活导致糖尿病神经系统病变,现阶段普遍认为通过抑制IL-17 和TNF 可以有效治疗糖尿病及其相关并发症[40-41]。PI3K-Akt信号通路被认为是胰岛素作用的主要介质,在阿尔茨海默病患者脑中已观察到PI3K 亚基表达降低,此外胰岛素可以通过PI3K-Akt 信号通路增强神经元生长,而胰岛素活性的恢复有望成为治疗糖尿病及其并发症认知障碍的靶点[42-43]。
综上所述,本研究通过网络药理学分析得出,黄芩可能通过汉黄芩素、黄芩素、金合欢素、降穿心莲黄酮、红花素、二氢奥洛昔林等多成分,通过多靶点,以AGERAGE、IL-17、TNF、MAPK、PI3K-Akt 及胰岛素抵抗等多种信号通路,影响糖尿病涉及的炎症、氧化应激、胰岛素活性等多种方式,来缓解并发症阿尔茨海默病,并利用分子对接来验证关键活性成分和核心靶点的相互作用。本研究结果为黄芩治疗糖尿病脑病提供了一定的理论指导和方向,但仍需进一步开展相关的药理学实验,进一步验证和阐明黄芩治疗糖尿病脑病的作用机制。
