淫羊藿对庆大霉素诱导急性肾损伤大鼠肾功能的保护作用
2023-09-19王燕萍陈军辉白瑞斌宋平平曹阳洋胡芳弟
王燕萍,陈军辉,白瑞斌,宋平平,曹阳洋,胡芳弟*
(1.兰州大学药学院,甘肃 兰州 730000;2.甘肃省人民医院,甘肃 兰州 730000)
急性肾损伤(acute kidney injury,AKI) 主要表现为肾小球滤过率(glomerular filtration rate,GFR) 迅速下降以及含氮废物的滞留,通常与脓毒症、心血管衰竭、充血性心力衰竭、大型手术、肾脏毒素或尿路梗阻有关。庆大霉素是治疗革兰氏阴性菌引起感染的一种氨基糖苷类抗生素,临床上10%~30% 接受过庆大霉素治疗的患者会产生AKI[1]。庆大霉素诱导肾损伤的具体机制目前尚不完全清楚,但是庆大霉素诱导的肾损伤能产生氧化应激反应,表现为脂质过氧化水平增加,抗氧化酶活性降低等[2],AKI患者的氧化应激反应增加,导致肾功能障碍的发生[3-4];同时,庆大霉素可严重损伤肾组织结构,出现大面积组织坏死,肾小管空泡化,肾小球皱缩,细胞排列疏松,刷状缘不规则等现象[5]。
淫羊藿来源于小檗科植物淫羊藿EpimediumbrevicomuMaxim.、箭叶淫羊藿Epimediumsagittatum(Sieb.et Zucc.)Maxim.、柔毛淫羊藿EpimediumpubescensMaxim.或朝鲜淫羊藿EpimediumkoreanumNakai 的干燥叶[6]。现代药理学研究表明淫羊藿具有增强免疫[7]、抑制肿瘤[8-9]、抗炎[10]、抗骨质疏松[11-13]、抗氧化[14]等多种药理活性。杨舸[15]研究发现,淫羊藿总黄酮可以通过改善氧化应激,减少炎症反应,通过抗凋亡途径来减少顺铂引起的小鼠肾损伤。目前尚未见到与淫羊藿临床及实际应用相关的提取物对庆大霉素引起的AKI 保护作用的报道。淫羊藿作为补益类中药,在临床和日常生活中以中药汤剂和药酒2 种形式使用,因此本实验研究淫羊藿水提取物和70%乙醇提取物对庆大霉素诱导AKI 大鼠的保护作用,并探究淫羊藿发挥肾保护作用的机制。
1 材料
1.1 动物 80 只SPF 级雄性Wistar 大鼠,体质量(220±20) g,由兰州大学实验动物中心提供[实验动物生产许可证号SCXK (甘) 2019-0002],饲养于12 h/12 h 昼夜循环、(25±2) ℃环境,提供充足的饲料和水。上述所有程序均按照世界医学会的道德规范执行,实验方案通过了兰州大学药学院伦理委员会的批准。
1.2 试剂与药物 庆大霉素、4%组织细胞固定液(货号G8170、P1110,北京索莱宝科技有限公司);NO、BUN、UA、Cr、T-SOD、CAT、MDA 检测试剂盒(货号A013-2-1、C013-2-1、C012-2-1、C011-2-1、A001-1-2、A007-2-1、A003-1-2,南京建成生物工程研究所);IL-10 检测试剂盒(批号3947,江苏酶免实业有限公司)。淫羊藿野生品于2019 年5 月初采自甘肃省礼县中坝乡,自然阴干,经甘肃中医药大学附属医院杨锡仓主任药师鉴定为淫羊藿EpimediumbrevicomuMaxim.的干燥叶。
1.3 仪器 肾脏肾小球滤过率监测装置(NIC-Kidney,型号UD0877,德国曼海姆公司);酶标仪(型号infiniteF50,上海博源生科技有限公司)。
2 方法
2.1 淫羊藿水提取物和70%乙醇提取物的制备及黄酮含量测定 取淫羊藿粉末(过3 号筛) 300 g,加入30 倍量水,煎煮提取1 h,同法重复3 次,过滤后合并滤液,减压浓缩后冷冻干燥,得淫羊藿水提取物,得率为19.85%。另取淫羊藿粉末(过3 号筛) 300 g,加入30 倍量70% 乙醇,回流提取1 h,同法重复3 次,过滤后合并滤液,减压浓缩后冷冻干燥,得淫羊藿70% 乙醇提取物,得率为21.45%。淫羊藿中主要有效成分为黄酮类[16],其中朝藿定A、朝藿定B、朝藿定C、淫羊藿苷和宝藿苷I (以下简称5 种黄酮) 的含量较高且具有广泛的活性[17],本实验分别采用紫外分光光度法和HPLC-DAD 法对淫羊藿水提物和淫羊藿70%乙醇提取物中的总黄酮和5 种主要黄酮含量进行测定。
2.2 动物分组、造模和给药 大鼠适应性饲养1 周后,随机分为空白组、模型组和淫羊藿水提取物、70% 乙醇提取物低、中、高剂量组(100、170、300 mg/kg,约为临床等效剂量的1/1.732、1、1.732 倍),淫羊藿各提取物各剂量组灌胃给予相应剂量药物,空白组和模型组灌胃给予生理盐水,连续给药15 d。第6 天开始,除空白组外,其余各组大鼠腹腔注射庆大霉素(100 mg/kg),连续10 d,以诱导建立大鼠AKI 模型。
2.3 取材 最后一次给药,大鼠腹主动脉采血,离心分离血清,保存备用。取肾组织,除去脂肪和结缔组织,在生理盐水中漂洗,取一部分置于4%组织细胞固定液中,固定24 h 后包埋在石蜡中,用于组织学研究;另一部分保存在-80 ℃冰箱中,用于Western blot 检测。
2.4 肾小球滤过率测定 给药结束24 h 后,将大鼠麻醉,剃除耳朵下方上背部的所有毛发以减少对FITC-sinistrin 测量的干扰。光学设备采集基线荧光2 min 后通过尾静脉注射FITC-sinistrin (溶于0.9% 生理盐水,剂量5 mg/100 g,注射量为0.2 mL/100 g),通过微型光学设备NIC-Kidney,对FITC-sinistrin 进行实时监测,测量连续荧光2 h,并使用MPD Lab Ver 1.0RC3 软件分析清除曲线。使用一室模型,计算FITC-sinistrin 的清除半衰期(t1/2),并采用由制造商开发和验证的半经验方程将t1/2值转换为GFR 值[mL/(min·100 g-1)],公式为GFR=31.26/t1/2[18]。
2.5 血清肾功能、氧化应激及炎症因子水平检测 按照相应试剂盒说明书检测血清BUN、UA、Cr、MDA、IL-10、NO 水平和T-SOD、CAT 活性。
2.6 组织病理学分析 将肾组织固定在4%组织细胞固定液中24 h 以上,然后用75%乙醇脱水并包埋在石蜡中,切成4 μm 厚的切片,HE 染色后于光学显微镜下观察。
2.7 Western blot 法检测肾组织Bax、Bcl-2 蛋白表达 用预冷的PBS 冲洗肾组织,取部分肾组织,加入含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液于冰上放置30 min,匀浆后于4 ℃下12 000 r/min 离心5 min,收集上清液,采用BCA 试剂盒测定蛋白浓度,加入上样缓冲液后煮沸5 min进行变性。经电泳、转膜、封闭、孵育一抗二抗后显色发光,分析条带灰度值。
2.8 统计学分析 通过SPSS 19.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,两两比较采用SNK 法。P<0.05 表示差异有统计学意义。
3 结果
3.1 淫羊藿水提取物和70%乙醇提取物中总黄酮和5 种黄酮含量 淫羊藿水提取物和70%乙醇提取物中总黄酮的平均含量分别为35.24%和50.01%。与淫羊藿水提取物比较,淫羊藿70%乙醇提取物中各主要黄酮含量和总黄酮含量均较高,其中朝藿定A、朝藿定C,淫羊藿苷、宝藿苷Ⅰ以及总黄酮的含量差异具有显著性(P<0.01),见表1。
表1 淫羊藿水提取物和70%乙醇提取物中总黄酮和5 种黄酮含量比较(%,±s,n=3)

表1 淫羊藿水提取物和70%乙醇提取物中总黄酮和5 种黄酮含量比较(%,±s,n=3)
注:与淫羊藿水提取物比较,**P<0.01。
提取物朝藿定A朝藿定B朝藿定C淫羊藿苷宝藿苷I总黄酮淫羊藿水提取物1.93±0.303.06±0.667.05±0.2513.05±0.010.48±0.2335.24±4.67淫羊藿70%乙醇提取物2.65±0.63** 3.38±0.0510.35±0.08**20.84±0.89**1.29±0.24**50.01±0.34**
3.2 淫羊藿对肾损伤大鼠肾功能的影响 与空白组比较,模型组大鼠GFR 值降低(P<0.01),血清UA、BUN 和Cr水平升高(P<0.01)。与模型组比较,淫羊藿水提取物各剂量组血清UA、BUN 和Cr 水平降低(P<0.05,P<0.01),淫羊藿水提取物高剂量组GFR 值升高(P<0.01);淫羊藿70%乙醇提取物各剂量组GFR 值升高(P<0.05,P<0.01),Cr 水平降低(P<0.01),UA 和BUN 水平无明显变化(P>0.05),见图1。

图1 淫羊藿对肾损伤大鼠肾功能的影响(±s,n=10)
3.3 淫羊藿对肾损伤大鼠肾组织病理学的影响 与空白组比较,模型组大鼠肾组织病理损伤明显,近曲小管上皮细胞出现不同阶段的变性,除了上皮细胞空泡化和偶尔的脱屑外,还观察到肾小管坏死,间质显示水肿,轻度炎症细胞浸润和外渗红细胞增加;与模型组比较,淫羊藿水提取物和70%乙醇提取物组大鼠肾组织上述损伤得到改善,表现为肾小管坏死、上皮细胞空泡化和外渗红细胞减少,见图2。

图2 各组大鼠肾组织病理HE 染色(×200)
3.4 淫羊藿对肾损伤大鼠血清MDA 水平和SOD、CAT 活性的影响 如图3 所示,与空白组比较,模型组大鼠血清MDA 水平升高(P<0.01),T-SOD、CAT 活性降低(P<0.01);与模型组比较,淫羊藿水提取物和70%乙醇提取物各剂量组SOD、CAT 活性升高(P<0.05,P<0.01),淫羊藿水提取物各剂量组和70%乙醇提取物低剂量组MDA 水平降低(P<0.01)。

图3 淫羊藿对肾损伤大鼠血清MDA 水平和SOD、CAT 活性的影响(±s,n=10)
3.5 淫羊藿对肾损伤大鼠血清NO、IL-10 水平的影响 如图4 所示,与空白组比较,模型组大鼠血清NO 水平升高(P<0.01),IL-10 水平降低(P<0.01);与模型组比较,淫羊藿水提取物和70% 乙醇提取物各剂量组NO 水平降低(P<0.01),IL-10 水平升高(P<0.05,P<0.01)。

图4 淫羊藿对肾损伤大鼠血清NO、IL-10 水平的影响(±s,n=10)
3.6 淫羊藿对肾损伤大鼠肾组织Bax、Bcl-2 蛋白表达的影响 与空白组比较,庆大霉素处理可以升高大鼠的Bax 蛋白表达(P<0.01),降低Bcl-2 蛋白表达(P<0.01)。与模型组比较,损伤大鼠给予淫羊藿水提物和70%乙醇提取物可以降低Bax 蛋白表达(P<0.01),升高Bcl-2 蛋白表达(P<0.05,P<0.01),见图5。
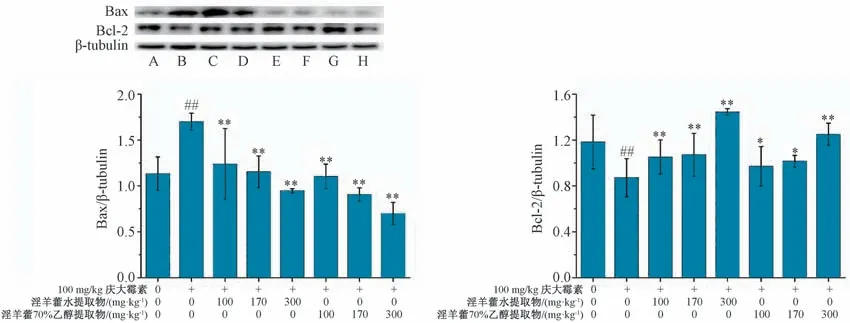
图5 淫羊藿对肾损伤大鼠肾组织Bax、Bcl-2 蛋白表达的影响(±s,n=10)
4 讨论
庆大霉素是氨基糖苷类抗菌药物,因其对革兰阴性菌和肠球菌等感染具有显著的疗效而被广泛应用于临床,但其容易引发肾脏功能的损伤。庆大霉素的肾毒性机制主要有①庆大霉素在近端肾小管上皮细胞积聚后导致上皮细胞缺血或坏死等[19];②庆大霉素可降低GFR,升高血清中Cr和BUN 水平[5]。有研究表明,血清中UA 的增加也会导致肾功能的减退[20]。因此,GFR 水平,血清Cr、BUN 和UA水平均可作为评价肾功能的指标。本实验结果显示,大鼠给予庆大霉素造模后,GFR 降低,而血清Cr、BUN 和UA水平升高,采用淫羊藿水提取物和70%乙醇提取物治疗后,可逆转上述影响,说明淫羊藿水提取物和70%乙醇提取物均具有肾保护的作用。
急性肾损伤的发病与氧化应激反应、炎症反应和线粒体功能等密切相关,氧化应激相关的特征性指标主要包括MDA、T-SOD、CAT 等[21-22]。MDA 是脂质过氧化的产物之一,其水平可以反映脂质过氧化的程度。T-SOD 是生物体内的一种重要抗氧化酶,它可以保护生物体免受超氧阴离子自由基的损害,维持氧自由基的平衡,从而维护细胞和组织的正常功能。CAT 的主要作用是催化过氧化氢(H2O2) 分解为水和氧气,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是氧化应激过程中的关键酶之一。本研究结果显示,模型组大鼠血清MDA 水平升高,T-SOD和CAT 活性降低;给予淫羊藿水提取物和70%乙醇提取物后,MDA 水平降低,T-SOD 和CAT 活性升高。上述研究结果显示,淫羊藿提取物可通过抑制氧化应激而发挥肾保护作用。
研究表明适量的NO 可以扩张肾小球系膜,改善肾小管和肾小球的不良情况。然而,过量的NO 可能会降低肾组织的抗氧化作用,导致肾损伤。降低NO 水平后,肾损伤得到明显改善,功能作用得到提升[23]。本研究结果显示,模型组大鼠血清NO 水平升高;而给予淫羊藿水提取物和70%乙醇提取物干预后,血清NO 水平降低。IL-10 也是反映炎症及氧化应激的重要指标,具有肾保护作用[24]。本研究结果发现,模型组大鼠血清IL-10 水平降低;给予淫羊藿水提取物和70%乙醇提取物后,血清IL-10 水平增加。上述研究结果显示,淫羊藿提取物可抑制庆大霉素导致急性肾损伤大鼠体内的炎症水平,从而发挥肾保护的作用。
Bcl-2 和Bax 蛋白分别是Bcl-2 家族中最有代表性的抑制凋亡和促进凋亡的蛋白,是一对重要的正负调节细胞凋亡的蛋白,编码的Bax 蛋白可与Bcl-2 之间形成二聚体,从而对Bcl-2 蛋白产生抑制。因此,Bcl-2 和Bax 蛋白表达是评价细胞凋亡的关键指标[25-26]。本研究结果发现,模型组大鼠肾组织Bax 蛋白表达升高,Bcl-2 蛋白表达降低;给予淫羊藿水提取物和70%乙醇提取物后,Bax 蛋白表达降低,Bcl-2 蛋白表达升高,说明淫羊藿提取物可通过调节细胞凋亡,从而达到保护肾组织的作用。
综上所述,淫羊藿水提取物和70%乙醇提取物对庆大霉素诱导的急性肾损伤有一定的保护作用,其作用机理可能与抑制氧化应激、炎症和凋亡有关。
