鸢尾苷元通过miR-449a 调控JAK/STAT 信号通路对人牙龈成纤维细胞增殖及凋亡的影响
2023-09-19张梦婕黄联杰
杜 姣,张梦婕,黄联杰
(武汉存济口腔医院综合科,湖北 武汉 430020)
牙周炎是临床常见的一种细菌感染性疾病,其可破坏口腔牙周组织进而影响牙槽骨的吸收,人牙龈成纤维细胞是牙龈的主要组成细胞,牙龈成纤维细胞增殖、凋亡、炎症反应等均可引起牙周炎的发生。研究表明唑来膦酸、柚皮素等可调控牙龈成纤维细胞增殖、凋亡及成骨分化等过程[1-2]。鸢尾苷元是一种异黄酮类化合物,其含有3 个酚羟基与1 个甲氧基,为葛花的有效成分,研究表明其具有抗氧化、炎症等作用[3],但其对牙周炎的治疗效果及可能作用机制尚未阐明。微小RNA (miRNA) 在牙龈成纤维细胞中异常表达,并可能调控炎症反应进而参与牙周炎的发生过程[4]。微小RNA-449a (miR-449a) 在脑缺血再灌注损伤中表达降低,丹酚酸A 通过调节miR-499a/DDK1 抑制炎症反应及细胞凋亡,进而减轻脑缺血再灌注损伤[5]。JAK/STAT 信号通路可介导细胞增殖、分化、凋亡等过程,一旦激活后可明显诱导炎症因子的聚集从而加重细胞损伤[6]。但miR-449a 和JAK/STAT 信号通路是否可介导鸢尾苷元调控牙龈成纤维细胞增殖及凋亡的过程尚未可知。因此,本研究主要探讨鸢尾苷元对牙龈成纤维细胞增殖及凋亡的影响,探究其对miR-449a 表达和JAK/STAT 信号通路的调控作用。
1 材料
1.1 牙龈组织来源 收集2018 年2 月至2019 年8 月于本院诊治的青少年的牙龈组织,拔除智齿时切取少量无炎症牙龈组织,患者共25 例,其中男性15 例,女性10 例;年龄18~25 岁,平均年龄(23.12±3.15) 岁,牙龈组织于-80 ℃超低温冰箱内保存。使用含有青链霉素双抗的PBS洗涤牙龈组织,采用组织块贴壁法进行原代培养[7],得人牙龈成纤维细胞(HGFs)。本研究经本院医学伦理委员会审批通过(批号20180019)。
1.2 药物与试剂 鸢尾苷元(纯度≥98%,批号20191203,成都格利普生物科技有限公司);Lipofectamine2000 (美国Thermo Fisher Scientific 公司);TRIzol 试剂(美国Invitrogen公司);cDNA 合成与实时荧光定量聚合酶链反应(RTqPCR) 试剂[天根生化科技(北京) 有限公司];甲基噻唑基四唑(MTT) 试剂、凋亡检测试剂盒(北京索莱宝科技有限公司);兔抗人细胞周期蛋白1 (Cyclin D1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3 (cleaved caspase-3)抗体(美国Santa Cruz 公司);兔抗人磷酸化Janus 激酶(p-JAK)、磷酸化信号转导子和转录激活子(p-STAT) 抗体、辣根过氧化物酶(HRP) 标记的山羊抗兔二抗(武汉博士德生物工程有限公司)。
2 方法
2.1 分组与给药 取对数生长期HGFs (1×105/mL) 接种于96 孔板,每孔100 μL,分别加入含不同浓度(50、100、200 μmol/L) 鸢尾苷元的培养液培养24 h[8],分别记作鸢尾苷元低、中、高剂量组,同时将正常培养的细胞作为对照组。分别将miR-NC、miR-449a mimics、anti-miR-NC、anti-miR-449a 转染至HGFs,分别记作miR-NC 组、miR-449a 组、anti-miR-NC 组、anti-miR-449a 组。分别将antimiR-NC、anti-miR-449a 转染至HGFs 后加入含200 μmol/L鸢尾苷元的培养液继续培养24 h,分别记作鸢尾苷元+antimiR-NC 组、鸢尾苷元+anti-miR-449a 组。
2.2 MTT 法检测细胞活力 取对数生长期HGFs (1×105/mL) 接种于96 孔板,每孔100 μL,按“2.1” 项下分组处理后继续培养24 h,每孔分别加入MTT 溶液20 μL,继续培养4 h,弃上清后每孔加入DMSO 150 μL,用酶标仪检测各孔吸光度(A) 值,以A值间接表示细胞活力。
2.3 流式细胞术检测细胞凋亡率 收集各组HGFs,加入预冷PBS 洗涤后弃上清,加入500 μL 结合缓冲液重悬细胞后按照凋亡试剂盒检测各组细胞凋亡率。
2.4 RT-qPCR 法检测细胞miR-449a表达 收集各组HGFs,采用TRIzol 法提取细胞总RNA,反转录合成cDNA,以cDNA 为模板进行RT-qPCR 反应,按照试剂盒说明书配置反应体系并设置反应条件,应用罗氏LightCycler480 荧光定量PCR 仪检测miR-449a相对表达量。
2.5 Western blot 法检测细胞Cyclin D1、cleaved caspase-3、p-JAK、p-STAT 蛋白表达 收集各组HGFs,用RIPA 裂解液提取细胞总蛋白,SDS-PAGE 电泳,转膜,封闭2 h,分别孵育一抗(1 ∶1 000) 与二抗(1 ∶5 000),暗室内曝光显影后应用Image J 软件分析各条带灰度值。
2.6 统计学分析 通过SPSS 21.0 软件进行处理,计量资料均符合正态分布,以(±s) 表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
3 结果
3.1 鸢尾苷元对HGFs 细胞增殖、凋亡的影响 与对照组比较,鸢尾苷元各剂量组细胞活力和Cyclin D1 蛋白表达均降低(P<0.05),凋亡率及cleaved caspase-3 蛋白表达均升高(P<0.05),见图1、表1。
表1 鸢尾苷元对HGFs 细胞增殖、凋亡的影响(±s,n=9)
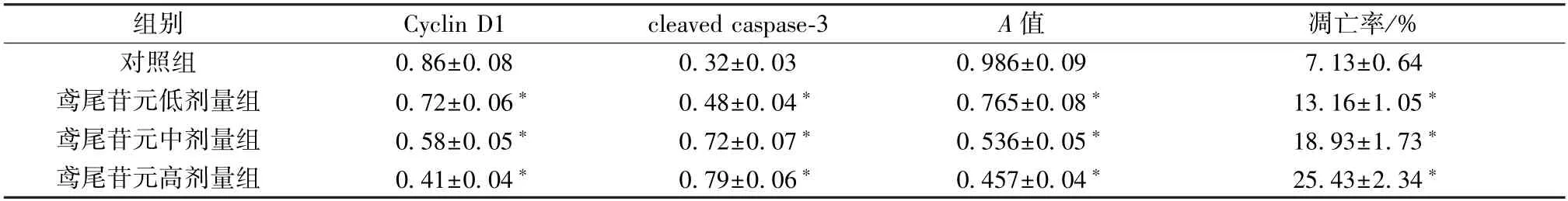
表1 鸢尾苷元对HGFs 细胞增殖、凋亡的影响(±s,n=9)
注:与对照组比较,*P<0.05。
组别Cyclin D1cleaved caspase-3A 值凋亡率/%对照组0.86±0.080.32±0.030.986±0.097.13±0.64鸢尾苷元低剂量组0.72±0.06*0.48±0.04*0.765±0.08*13.16±1.05*鸢尾苷元中剂量组0.58±0.05*0.72±0.07*0.536±0.05*18.93±1.73*鸢尾苷元高剂量组0.41±0.04*0.79±0.06*0.457±0.04*25.43±2.34*

图1 鸢尾苷元对HGFs 细胞凋亡(A) 及Cyclin D1、cleaved caspase-3 蛋白(B) 的影响
3.2 鸢尾苷元对HGFs 中miR-449a表达的影响 与对照组比较,鸢尾苷元各剂量组miR-449a表达升高(P<0.05),见表2。
表2 鸢尾苷元对HGFs 中miR-449a 表达的影响(±s,n=9)

表2 鸢尾苷元对HGFs 中miR-449a 表达的影响(±s,n=9)
注:与对照组比较,*P<0.05。
组别miR-449a对照组1.00±0.11鸢尾苷元低剂量组1.57±0.12*鸢尾苷元中剂量组2.24±0.21*鸢尾苷元高剂量组2.64±0.23*
3.3miR-449a对HGFs 细胞增殖、凋亡的影响 与miR-NC组比较,miR-449a 组细胞活力及Cyclin D1 蛋白表达均降低(P<0.05),凋亡率、miR-449a表达及cleaved caspase-3 蛋白表达均升高 (P<0.05)。与anti-miR-NC 组比较,antimiR-449a 组细胞活力及Cyclin D1 蛋白表达均升高 (P<0.05),凋亡率、miR-449a表达及cleaved caspase-3 蛋白表达均降低(P<0.05),见图2、表3。
表3 miR-449a 对HGFs 细胞增殖、凋亡的影响(±s,n=9)

表3 miR-449a 对HGFs 细胞增殖、凋亡的影响(±s,n=9)
注:与miR-NC 组比较,*P<0.05;与anti-miR-NC 组比较,#P<0.05。
组别miR-449aCyclin D1cleaved caspase-3A 值凋亡率/%miR-NC 组1.00±0.100.88±0.080.33±0.030.991±0.097.23±0.71 miR-449a 组1.85±0.14*0.41±0.04*0.76±0.07*0.506±0.05*20.64±1.82*anti-miR-NC 组1.01±0.090.84±0.070.31±0.020.983±0.087.14±0.62 anti-miR-449a 组0.38±0.03#1.13±0.10#0.08±0.01#1.286±0.11#3.04±0.27#
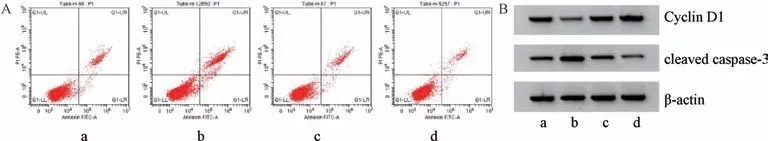
图2 miR-449a 对HGFs 细胞凋亡(A) 及Cyclin D1、cleaved caspase-3 蛋白(B) 的影响
3.4anti-miR-449a逆转鸢尾苷元对HGFs 细胞增殖、凋亡的影响 与鸢尾苷元+anti-miR-NC 组比较,鸢尾苷元+antimiR-449a 组细胞活力及Cyclin D1 蛋白表达均升高 (P<0.05),凋亡率、miR-449a表达及cleaved caspase-3 蛋白表达均降低(P<0.05),见图3、表4。
表4 anti-miR-449a 逆转鸢尾苷元对HGFs 细胞增殖、凋亡的影响(±s,n=9)

表4 anti-miR-449a 逆转鸢尾苷元对HGFs 细胞增殖、凋亡的影响(±s,n=9)
注:与鸢尾苷元+anti-miR-NC 组比较,*P<0.05。
组别miR-449aCyclin D1cleaved caspase-3A 值凋亡率/%鸢尾苷元+anti-miR-NC 组1.00±0.100.43±0.040.81±0.070.447±0.0424.13±2.14鸢尾苷元+anti-miR-449a 组0.40±0.04*0.82±0.08*0.38±0.03*0.861±0.07*11.58±1.24*
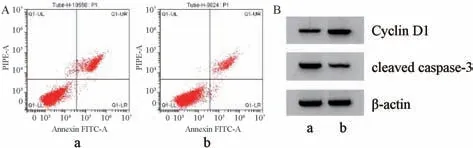
图3 anti-miR-449a 逆转鸢尾苷元对HGFs 细胞凋亡(A) 及Cyclin D1、cleaved caspase-3 蛋白(B) 的影响
3.5miR-449a及鸢尾苷元对HGFs 细胞JAK/STAT 信号通路蛋白表达的影响 与对照组比较,200 μmol/L 鸢尾苷元组p-JAK、p-STAT 蛋白表达降低(P<0.05);与anti-miRNC 组比较,anti-miR-449a 组p-JAK、p-STAT 蛋白表达升高(P<0.05);与鸢尾苷元+anti-miR-NC 组比较,鸢尾苷元+anti-miR-449a 组p-JAK、p-STAT 蛋白表达升高 (P<0.05),见图4、表5。
表5 miR-449a 及鸢尾苷元对HGFs 细胞p-JAK、p-STAT蛋白表达的影响(±s,n=9)
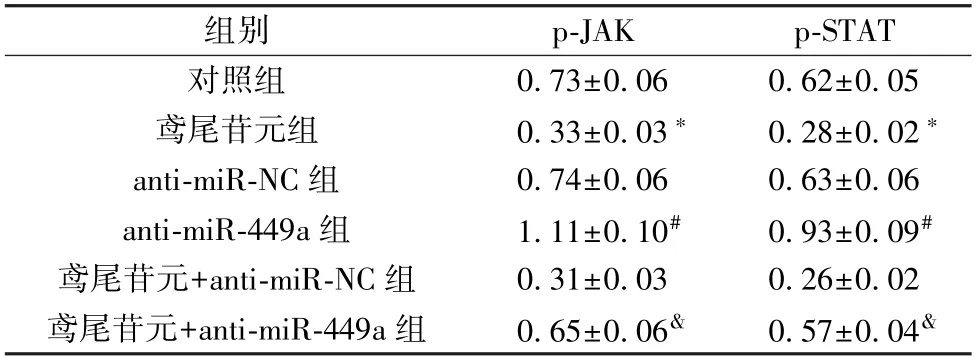
表5 miR-449a 及鸢尾苷元对HGFs 细胞p-JAK、p-STAT蛋白表达的影响(±s,n=9)
注:与对照组比较,*P <0.05;与anti-miR-NC 组比较,#P <0.05;与鸢尾苷元+anti-miR-NC 组比较,&P<0.05。
组别p-JAKp-STAT对照组0.73±0.060.62±0.05鸢尾苷元组0.33±0.03*0.28±0.02*anti-miR-NC 组0.74±0.060.63±0.06 anti-miR-449a 组1.11±0.10#0.93±0.09#鸢尾苷元+anti-miR-NC 组0.31±0.030.26±0.02鸢尾苷元+anti-miR-449a 组0.65±0.06&0.57±0.04&

图4 各组细胞p-JAK、p-STAT 蛋白条带图
4 讨论
牙周炎发病机制尚未完全阐明,牙周组织再生对治疗牙周炎具有重要意义,牙周组织再生、修复等与牙龈成纤维细胞增殖、迁移及分化等密切相关,既往研究显示脂联素、硝苯地平等均可影响牙龈成纤维细胞生物学特性,但关于其具体作用机制尚未阐明[9-10]。miRNA 可能作为牙周炎治疗的潜在靶标[11]。但关于药物与miRNA 在治疗牙周炎中的作用机制也尚未阐明。
鸢尾苷元具有清除氧自由基、降血糖等作用,还可减轻急性心肌梗死小鼠的心肌损伤[12];可抑制血管平滑肌细胞增殖及炎症反应的发生[13];可抑制LPS 诱导的炎症反应从而减轻小鼠急性肺损伤[14]。本研究结果显示,鸢尾苷元可降低细胞活力,提高细胞凋亡率,提示鸢尾苷元可促进牙龈成纤维细胞凋亡。
miR-449a可通过调节高迁移率族框蛋白1 抑制类风湿关节炎成纤维细胞样滑膜细胞增殖、迁移和炎症反应[15];还可调控AREG 减轻脑缺血损伤[16]。本研究结果显示,鸢尾苷元可提高miR-449a表达;miR-449a过表达可降低细胞活力,促进细胞凋亡;而抑制miR-449a表达可提高细胞活力,抑制细胞凋亡,提示miR-449a过表达可抑制牙龈成纤维细胞增殖,诱导细胞凋亡。进一步研究显示,鸢尾苷元与anti-miR-449a共处理后可增强细胞活力,降低细胞凋亡率,提示抑制miR-449a表达可明显逆转鸢尾苷元对HGFs细胞增殖及凋亡的作用。JAK 与细胞膜上的受体结合后发生磷酸化,STAT 与受体结合后在p-JAK 的催化下形成p-STAT,其可促进炎性细胞因子的分泌及生成,进一步促进细胞凋亡[17-19]。本研究结果显示,鸢尾苷元可降低HGFs中p-JAK、p-STAT 蛋白表达;抑制miR-449a表达可促进p-JAK、p-STAT 蛋白表达;且抑制miR-449a表达可逆转鸢尾苷元对p-JAK、p-STAT 蛋白表达的抑制作用,提示鸢尾苷元可能通过调控miR-449a而抑制JAK/STAT 信号通路的活化从而发挥作用。
综上所述,鸢尾苷元可抑制HGFs 细胞增殖,促进细胞凋亡,其作用机制与上调miR-449a表达及抑制JAK/STAT信号通路活化有关,可为进一步阐明牙周炎发病机制奠定实验基础,还可为揭示鸢尾苷元治疗牙周炎的分子机制提供参考。
