泡桐叶化学成分、药理作用研究进展及其质量标志物预测分析
2023-09-19陆玉婷李济顺韩湘云李顺祥
陆玉婷,李济顺,卓 燊,李 娟,杨 涛,韩湘云,李顺祥*
(1.湖南中医药大学药学院,湖南省中药活性物质筛选工程技术研究中心,湖南 长沙 410208;2.广西科技大学医学部,柳州市桂中特色药用资源开发重点实验室,广西 柳州 545005;3.湘西宏成制药有限公司,湖南 吉首 416000)
泡桐叶为玄参科泡桐属植物白花泡桐Paulowniafortunei(Seem.) Hemsl.和毛泡桐P.tomentosa(Thunb.) Steud.的叶[1]。泡桐作为一种生长快速的木本植物,其树皮、根、叶、花、果均可入药,可用于治疗咳嗽,痰痈,上呼吸道感染,支气管肺炎,细菌性痢疾,肠炎等多种病证[2],其以“清热解毒,止血消肿” 之功在民间被广泛使用[3],但在临床报道最多的是以白花泡桐叶为君药的复方桐叶烧伤油。该药原为湘西土家族姚氏研制的秘方药“清润烧伤油”,后被开发为国家中药三类新药 (国药准字Z20063825),对于溃疡创面修复、烧烫伤效果较好[4-5]。目前,泡桐叶大多被用作廉价饲料[6],造成高附加值资源的浪费,严重阻碍了其在医疗行业的高质量发展。随着泡桐作为观赏性植物资源需求量增加,栽培品和杂交品的种类也日益丰富[7],在一定程度上加大了药品市场的质控难度。
泡桐叶作为土家族特色药,收载于2009 年版《湖南省中药材标准》,其质量控制仅以熊果酸这一单一成分作为评价指标[3],不具有专一性[8-9],中药质量标志物 (Qmarker)[10]可部分解决这一问题。本文对泡桐叶植物亲缘归属、化学成分、药物功效进行全面的综述分析,结合生物信息学对泡桐叶的质量标志物(Q-maker) 进行预测,旨在建立更合理的泡桐叶质量控制方法,为进一步明确泡桐叶的药效物质基础,促进中药行业泡桐叶资源的应用提供理论参考。
1 亲缘关系及化学成分
1.1 泡桐属植物的亲缘归属
1.1.1 泡桐属植物分布情况 泡桐在我国分布广泛,部分品种也因具有观赏和用材价值在如日本、韩国、东南亚、欧洲、澳洲等多个国家和地区引种栽培[11]。《中国植物志》[12]收录了Ⅰ~Ⅶ号公认的7 个原始种和2 个毛泡桐变种。其中,部分文献中提到了一种未经承认的泡桐PaulowniacoreanaUyeki[13],该物种于1925 年载入韩国的植物书籍中[14],但是后经证实发现该物种应归属于毛泡桐P.tormentosa(Thunb.) Steud[15]。泡桐属植物的具体归属和分布情况见表1。

表1 泡桐属植物的具体归属和分布情况
1.1.2 泡桐属叶绿体基因组聚类分析树 从NCBI 数据库(https://www.ncbi.nlm.nih.gov/) 下载7 个泡桐属原始种的完整叶绿体基因组序列,以同名异物的外类群油桐Verniciafordii序列作比对,通过邻接法(NJ) 进行序列分析,以Bootstrap (500 次重复) 检验各分支的自展支持率,采用Mega 11.0 软件构建系统发育树并可视化,结果见图1。Bootstrap 支持率均在98%以上,且泡桐属聚为一个单系群,与外类群油桐有明显区分,分析结果较理想。泡桐属内主要分成了A、B 两个主要分支,白花泡桐、毛泡桐、台湾泡桐、楸木泡桐为A 支独立进化;川泡桐、兰考泡桐和南方泡桐为B 支独立进化,说明这2 个分支表现出良好的单系性。其中,白花泡桐与毛泡桐聚为A 分支下的1 个小分支,表明两者遗传距离较近,与文献[1] 报道相符,可作为泡桐叶的来源。

图1 泡桐属聚类分析树
1.2 化学成分 目前从泡桐叶中分离得到65 种成分,其中三萜类13 种、黄酮类6 种、苯丙素类5 种、甾醇类2 种、萜类2 种、脂肪酸6 种、甘油酯类31 种。
1.2.1 三萜类 目前,三萜类化合物熊果酸(1)、齐墩果酸(2) 作为泡桐叶的重要成分,在多种泡桐叶中均有报道[8,16-19]。张德莉等[16]从白花泡桐叶中分离得到10 个三萜类化合物(3~12),同时从毛泡桐叶[17]的乙酸乙酯部位叶也分离得到了4 个化合物(3~5、11)。杨军仁等[18]在光泡桐叶中也发现了山楂酸(11)。郭洪伟等[20]对复方桐叶烧伤油的脂溶性成分分析时,发现白花泡桐叶中还含有1 个开链型三萜类化合物——角鲨烯(13)。详见表2、图2。

图2 泡桐叶中三萜类化合物结构

表2 泡桐叶中三萜类化合物
1.2.2 黄酮类 木犀草素(14)、芹菜素(15) 作为泡桐叶中重要的黄酮类成分,在白花泡桐和毛泡桐中均有报道[17-18,21]。李晓强等[21]从白花泡桐叶的乙酸乙酯部位分离得到1 个香叶基黄酮化合物——mimulone (16)。梁峰涛[22]从白花泡桐叶的石油醚部位分离得2 个香叶基黄酮化合物——diplacone (17)、3'-O-methyldiplacone (18)。张德莉等[17]在毛泡桐叶的乙酸乙酯部位分离得到1 个二氢黄酮化合物——高圣草酚(19)。详见表3、图3。

图3 泡桐叶中黄酮类化合物结构

表3 泡桐叶中黄酮类化合物
1.2.3 苯丙素类 Kim 等[23]从毛泡桐叶水溶性成分中分离得到了4 个苯乙醇苷类化合物(20~23)。Móricz 等[24]通过研究毛泡桐叶中的酚类物质活性,发现了1 个苯丙酸类化合物(24)。详见表4、图4。

图4 泡桐叶中苯丙素类、甾醇类化合物结构
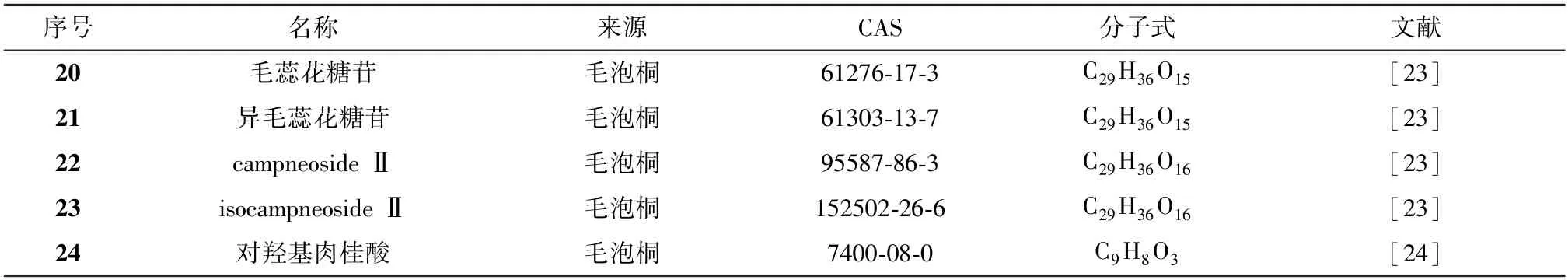
表4 泡桐叶中苯丙素类化合物
1.2.4 其他类 甾醇类化合物β-谷甾醇(25)、胡萝卜苷(26) 普遍存在于泡桐叶中[17-18,22]。Jung 等[25]从毛泡桐中分离出1 个倍半萜内酯类化合物——isoatriplicolide tiglate(27)。Rodríguez-López 等[26]从毛泡桐中发现了1 个具有强抗氧化性的环烯醚萜苷类化合物——桃叶珊瑚苷(28)。Adriani 等[27]从毛泡桐中分离得到1 个泡桐属特征成分——泡桐苷(29)。黄洛华等[28]从白花泡桐叶中分离得到了6个脂肪酸类化合物(30~35)。梁峰涛[22]在白花泡桐叶的石油醚部位发现了1 个新的甘油酯类化合物(36)。Asai等[29]在毛泡桐叶的腺毛分泌物中分离得到30 个甘油酯类化合物(40~69)。近年研究发现,植物中的甘油酯类有促进细胞增殖和免疫调节的作用[30],这类成分应获得更多的关注。详见表5、图5。此外,泡桐叶还具有较高的营养价值,不仅富含多种人体所需的氨基酸[31],还包含Ca、K、P、Mn、Fe 等多种微量元素[32],其中白花泡桐叶的Ca 含量高达19 518.01 mg/kg。
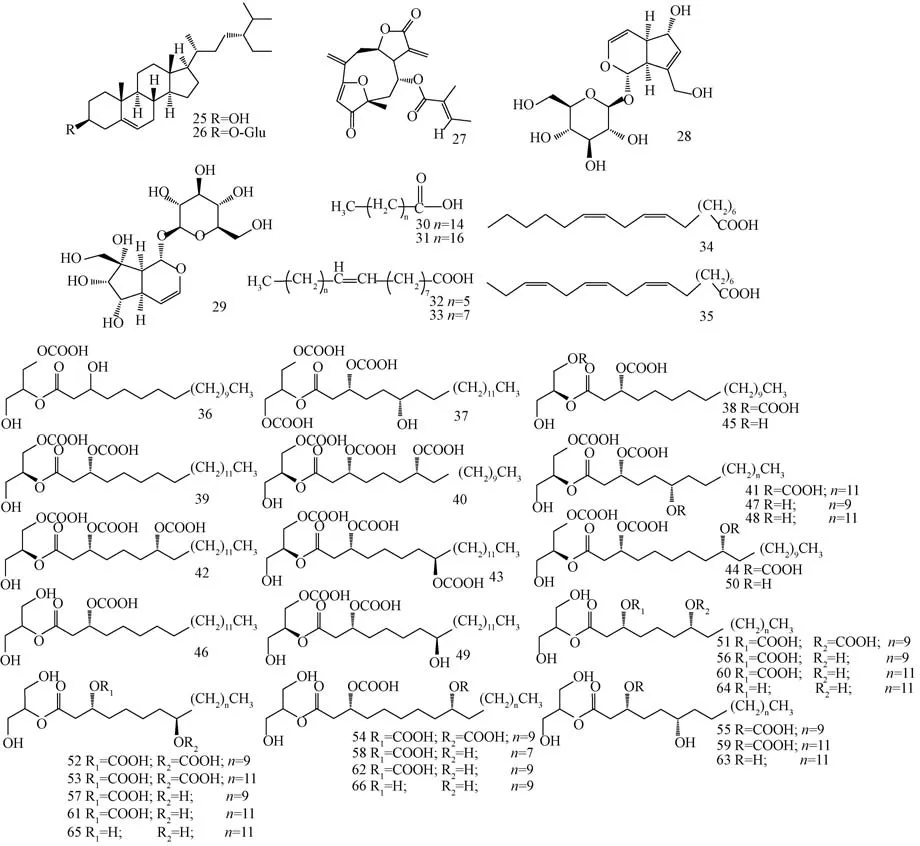
图5 泡桐叶中其他化合物结构

表5 泡桐叶中其他化合物
2 药理作用
2.1 传统功效 据典籍记载,泡桐叶“主恶蚀疮著阴”,可“消肿毒,生发”[33]。追溯和调研泡桐叶的民间药用历史和传统功效以“抗溃疡” “消肿毒” 为主,多为外用,见表6。

表6 泡桐叶的传统药用
2.2 现代药理活性 现代药理研究表明,泡桐叶具有抗溃疡、抗菌、抗炎、抗氧化、细胞保护、抗病毒、抗肿瘤等作用。经过多年的实验验证,已明确泡桐叶中所含的熊果酸[45]、齐墩果酸[46]、木犀草素[47]、芹菜素[48]这4 种成分确实具有上述功效。此外,据文献报道,泡桐叶中的香叶基黄酮和倍半萜类成分也表现出良好的疗效。
2.2.1 抗溃疡 泡桐叶在修复溃疡创面具有良好的效果。复方桐叶烧伤油[49]不仅能抑制皮肤溃疡大鼠的肉芽增生,促进创面愈合,还能降低各项炎症因子水平。Zahran 等[50]发现不同剂量熊果酸在吲哚美辛诱导的大鼠溃疡中在组织病理学评价上展现出剂量依赖性地保护作用。Kang 等[51]研究发现,齐墩果酸能通过恢复Th17/Treg 细胞的平衡并抑制NF-κB 信号通路来改善DSS 诱发的小鼠溃疡性结肠炎。Li等[52-53]研究证实,木犀草素可通过调节SHP-1/STAT3 通路和肠道菌群,缓解大鼠溃疡性结肠炎,同时降低炎症因子水平。Chen 等[54]在使用木犀草素口服治疗糖尿病大鼠皮肤损伤时,发现其不仅能够降低血糖,还能加快受损皮肤愈合。Molina 等[55]发现,芹菜素能促进5-氟尿嘧啶诱导的叙利亚雄性仓鼠口腔溃疡愈合。
2.2.2 抗菌 泡桐叶中黄酮类、酚类化合物具有良好的抗菌效果。Móricz 等[24]发现,脱脂毛泡桐鲜叶中的酚类组分芹菜素、对羟基肉桂酸能够抑制费氏弧菌和枯草芽孢杆菌的活性。Dugan 等[56]发现,泡桐叶提取物的抗菌活性与其酚类物质含量也呈正相关,其抗菌机制可能与其调控膜依赖性细胞过程的能力有关。Navrátilová 等[57]发现,毛泡桐中的diplacone、mimulone 具有良好的抗菌活性,3'-Omethyldiplacone 具有良好的抗利什曼原虫作用,且mimulone还能与苯唑西林协同抗菌[58]。臧爱梅[59]对毛泡桐叶提取物抑菌活性进行研究,发现其醇提物和丙酮提取物对白菜软腐病菌、猕猴桃溃疡病菌、水稻白叶枯病菌、金葡萄球菌等具有抑制效果。
2.2.3 抗炎 泡桐叶中所含的黄酮类化合物在体内、外均有良好的抗炎效果。Ryu 等[60]研究表明,毛泡桐中的diplacone、3'-O-methyldiplacone 具有较强的抗炎活性和抑制中性粒细胞弹性蛋白酶作用,可被开发为一些炎症相关呼吸系统疾病的先导化合物。毛泡桐中的diplacone[61]能通过阻断IκB 的降解来减少促炎因子TNF-α、MCP-1 水平,并对COX/LOX 产生双重抑制作用,具有抗COX-2 活性[62]。Jin等[63]也发现,泡桐中的diplacone 对LPS 诱导RAW264.7 细胞产生NO 有抑制作用,其IC50值为5.02 μmol/L。
2.2.4 抗氧化 泡桐叶提取物的抗氧化活性与叶片中黄酮类及酚类化合物的含量呈高度正相关[56]。Moon 等[64]发现,diplacone 不仅能有效清除自由基和抑制辐射诱导的DNA 链断裂,还能降低2Gy-照射的AHH-1 细胞的活性氧水平和细胞DNA 损伤。Hawrył 等[65]采用DPPH-TLC 法分析泡桐叶的甲醇提取物抗氧化活性,结果发现,澳大利亚的一种白花泡桐与毛泡桐的杂交叶中酚类化合物含量和抗氧化活性较高。Zima 等[66]发现,在多种毛泡桐的黄酮类化合物中,diplacone 表现出最强的自由基清除能力和酪氨酸硝化反应抑制作用。李传厚[67]考察了毛泡桐中的5 种黄酮类化合物的清除DPPH 自由基能力,依次为结果木犀草素、diplacone、芹菜素。高天阳[68]发现,木犀草素、diplacone清除DPPH 自由基能力强于阳性对照抗坏血酸,芹菜素、高圣草酚的DPPH 自由基清除能力相对较弱。
2.2.5 细胞保护 泡桐叶中的倍半萜类、香叶基黄酮类化合物表现出良好的细胞保护作用。Wang 等[69]研究表明,泡桐中的diplacone 在低浓度下对人脐静脉内皮细胞具有增殖活性,但在高浓度下却存在抑制作用,推测可能与未修饰的香叶基侧链有关。Zima 等[66]发现,毛泡桐中的diplacone、mimulone 对四氧嘧啶诱导的小鼠糖尿病细胞具有良好的保护作用。
2.2.6 抗病毒 泡桐叶中所含的几种黄酮类化合物可以在病毒感染的不同阶段发挥作用,特别是在分子水平上抑制病毒生长。Cho 等[70]研究证实,毛泡桐中的 3'-Omethyldiplacone、diplacone、mimulone 这3 种黄酮对SARSCOV 木瓜蛋白酶样蛋白酶具有抑制作用,IC50值在10.4~14.4 μmol/L 之间,而这类蛋白酶在SARS 病毒复制中起关键作用。
2.2.7 抗肿瘤 泡桐叶中所含的倍半萜类和黄酮类化合物均有良好的抑制肿瘤细胞作用。Jung 等[25]研究发现,毛泡桐中的isoatriplicolide tiglate 低浓度可诱导S/G2期细胞周期阻滞,高浓度可诱导caspase 依赖性地凋亡,对乳腺癌细胞和宫颈癌细胞具有时间和剂量依赖性的抗增殖作用。Molanová等[71]考察了毛泡桐中的香叶基黄酮对人单核细胞白血病细胞系THP-1 的抗增殖作用和细胞毒性活性,发现diplacone 具有最强的抗增殖和细胞毒作用,同时伴随引起代谢活性的浓度依赖性降低。高天阳[68]对毛泡桐中的黄酮类化合物进行细胞毒活性筛选,发现diplacone 对人肺癌细胞A549 的抑制作用最强。
2.2.8 其他 刘丽沙等[72]在研究外用涂抹类制剂镇痛作用时,发现复方桐叶烧伤油能明显抑制小鼠扭体反应,提高小鼠的热板痛阈值。Cho 等[73]研究发现,毛泡桐中的3'-O-methyldiplacone、diplacone、mimulone 能同时抑制AChE和BChE,从而达到改善阿尔茨海默氏症的效果。Song等[74]发现,毛泡桐中的3'-O-methyldiplacone、mimulone 对蛋白酪氨酸磷酸酶(PTP1B) 和α-葡萄糖苷酶均有较强的抑制活性,这2 种酶是治疗肥胖和糖尿病的重要靶点。Al-Sagheer 等[31]用毛泡桐叶制成饲料喂养家兔,可达到调节血脂和降低肠道致病菌群的种类和总数的效果。
3 基于化学成分和功效的Q-marker 预测分析
3.1 基于亲缘结合化学成分的可测性的Q-marker 筛选 质量控制的根本目的是控制中药的有效性,因此质量标志物的确定必须与有效性和可测性密切相关。首先,根据泡桐属的亲缘分析可知,白花泡桐叶、毛泡桐叶遗传距离较近,两者共同含有的成分更适合作为Q-marker 的筛选来源。其次,根据质量标志物的定义和要求,Q-maker 预测应考虑化学成分的可测性和有效性。泡桐苷和香叶基黄酮虽然是泡桐的特征性成分,但是目前泡桐苷的活性未被证实,而香叶基黄酮则存在着分布不均、检测方法不确定性等问题,所以暂不适合作为Q-Marker 的筛选对象。从泡桐叶中含有三萜类、黄酮类、苯丙素类等成分中,已报道的可测性成分有熊果酸、齐墩果酸、山楂酸、木犀草素、芹菜素等。邢雅丽等[75]运用HPLC 法分别对泡桐叶中的齐墩果酸、熊果酸含量进行考察,测得白花泡桐叶的齐墩果酸、熊果酸含量3.50、12.51 mg/g,毛泡桐的齐墩果酸、熊果酸含量2.29、7.93 mg/g。另外,李科等[76]通过HPLC 法考察不同产地的木犀草素含量可达25.5 μg/g。故将三萜类和黄酮类化合物作为泡桐叶质量标志物的筛选对象较合理。
3.2 基于药性和药效的Q-marker 筛选 “四气五味” 是中药的基本属性,也是中药的药性理论核心。泡桐叶苦、寒,归心、肝经[1]。苦味中药主要来源于黄酮类、生物碱类、萜类及三萜类化合物[77],而寒性中药里出现频率最高的为黄酮类化合物[78],其次是萜类和挥发油类、甾类、脂肪酸类等化合物。推测黄酮类、三萜类和萜类成分可能为泡桐叶“苦寒” 的来源。
根据传统功效和现代药理学活性研究发现,泡桐叶中的三萜类、黄酮类成分不仅能表现出良好的抗溃疡功效,还具有抗菌、抗炎、抗氧化、细胞保护、抗病毒和抗肿瘤等多种药理活性,推测这些成分可能是泡桐叶在体内发挥药效主要的物质基础,即提示三萜类及黄酮类成分可作为Q-marker 的筛选来源。
4 基于生物信息学的Q-marker 预测分析
4.1 泡桐叶的潜在活性靶点筛选 基于泡桐叶的化学成分和药效分析,将其成分输入TCMSP 平台 (http://lsp.nwu.edu.cn/tcmsp.php),以平台建议的药物筛选条件(OB ≥20%、DL ≥0.1) 进行筛选;再以ETCM 平台(http://www.tcmip.cn/ETCM/) 作为补充,条件为类药性≥0.05,然后将2 个数据库筛选出来的化合物取并集得到候选靶标的活性成分。再结合文献分析,熊果酸为泡桐叶地方标准[3]的质控指标,在泡桐叶中含量较高[75],且具有良好的生物活性[45],故亦将熊果酸纳入活性成分候选库。最终筛选得到2 个三萜类、2 个黄酮类、1 个苯丙素类,1 个甾醇类、4 个脂肪酸类化合物,详见表7。将上述化合物对应的靶点输入Uniprot (http://www.uniprot.org/),以“Human Reviewed” 为限制条件获取靶点对应的基因Symbol,最终得到174 个靶点蛋白。

表7 泡桐叶候选靶标的活性成分
4.2 基于生物信息学与传统功效的Q-marker 预测
4.2.1 泡桐叶活性成分与溃疡性疾病靶点的网络构建 根据泡桐叶的传统药效研究,以 “ulcer” 为关键词检索GeneCards、OMIM、TTD、PharmGkb、DrugBank 数据库获取溃疡性疾病的相关基因,将所查到的所有相关基因合并去除重复值后获得相关靶点2 084 个,见图6,筛选出药物成分与溃疡性疾病的交集靶点105 个,见图7。通过Cytoscape 3.8.0 软件构建药物成分与溃疡性疾病的网络图,见图8。以成分、靶点、疾病的连接情况为参考,熊果酸、木犀草素和芹菜素的交联度最高,油酸的交联度次之。结果显示三萜类化合物熊果酸和黄酮类化合物木犀草素、芹菜素可能是泡桐叶在体内发挥溃疡修复作用的物质基础,该预测结果与泡桐叶的传统功效研究基本吻合,提示熊果酸、木犀草素和芹菜素可作为Q-marker 的来源。

图6 溃疡性疾病的相关基因收集图

图7 “药物成分-疾病” 交集基因

图8 “药物成分-传统功效” 网络
4.2.2 构建PPI 网络 将105 个交集基因导入String 数据库以“Homosapiens” 为条件获取蛋白互作网络,将置信度得分设置为0.400,考察“药物-靶点-疾病” 之间所存在的蛋白互作关系,见图9A。PPI 网络共包含104 个节点,1 610条边,平均节点度为31,平均局部聚类系数为0.739。将结果导入Cytoscape 3.8.0 软件对PPI 网络进行集中性分析和打分,筛选出所有条件都大于中位值的基因,即筛选核心靶点。经过2 次筛选构建子网络,见图9B,得到20 个关键靶点,分别为 VEGFA、HIF1A、CASP3、CCND1、MMP2、FOS、NFKBIA、BCL2L1、AKT1、MMP9、PPARG、JUN、EGFR、ERBB2、TP53、PTGS2、ICAM1、STAT3、IL1B、MYC。结果显示这些关键靶点可能在泡桐叶改善溃疡性疾病方面具有重要意义。

图9 泡桐叶活性成分与溃疡的交集靶点PPI 网络(A) 和核心靶点的子网络(B)
4.2.3 GO、KEGG 富集分析 通过R 软件包“org.Hs.eg.db” 将核心靶点symbol 转化为entrez ID。再使用R 语言对靶点进行GO 和KEGG 富集分析,将富集显著性排名靠前的结果导入Chiplot (https://www.chiplot.online/)在线编辑可视化(P<0.05)。图10A 为GO 注释的结果,包含分子功能 (molecular function,MF)、生物过程(biological process,BP) 和细胞组分(cell component,CC)中富集显著性排名前八的条目,横坐标表示该类别下富集泡桐叶修复溃疡潜在靶点的数量。在生物过程方面,泡桐叶主要涉及辐射反应、光刺激反应、紫外线反应、细胞对非生物刺激的反应等过程;细胞组成方面主要涉及转录调控复合物、RNA 聚合酶Ⅱ转录调控复合物、核膜、膜筏等;分子功能方面主要涉及与DNA 结合转录因子、RNA 聚合酶II-特异性DNA-结合转录因子、蛋白磷酸酶和磷酸酶等分子的结合。图10B 显示了富集排名前二十的KEGG 信号通路,如癌症通路、MAPK 信号通路、TNF 信号通路等。图10C展示的是富集靶点最多的癌症通路(18 个),可见泡桐叶的作用靶点主要富集在抗细胞凋亡,调节细胞增殖以及诱导新生血管形成的通路上,这些信号通路可能与其能修复溃疡密切相关。

图10 泡桐叶修复溃疡的GO (A) 和KEGG (B) 富集分析以及主要作用通路(C)
4.3 基于生物信息学与现代药理学活性的Q-marker 预测 根据泡桐叶的现代药理学活性研究,以 “antibacterial”“anti-inflammatory” “antioxidant” “antiviral” “anti-tumor”“cytoprotection” 为关键词,在GeneCards 数据库中查找相关基因,以“Score≥1” 筛选出成分与靶点的交集基因,见图11。运用Cytoscape 3.8.0 软件构建药物成分与现代药理学活性靶点的网络,获取degree 值导入Chiplot 制作热图并进行聚类分析,见图12。由此可知,泡桐叶中参与抗菌的潜在靶点较少,而抗炎、抗氧化、抗病毒的潜在靶点较多。以成分与作用靶点的交联度为参考,熊果酸、木犀草素和芹菜素因交联度较高聚成一类。结果显示熊果酸、木犀草素、芹菜素可能是泡桐叶发挥药效的主要活性物质,推测这些成分可能是泡桐叶在体内产生抗炎、抗病毒、抗氧化、细胞保护、抗肿瘤等作用的潜在靶点。该预测结果与现代药理活性研究基本吻合,提示熊果酸、木犀草素、芹菜素可作为Q-marker 的来源。
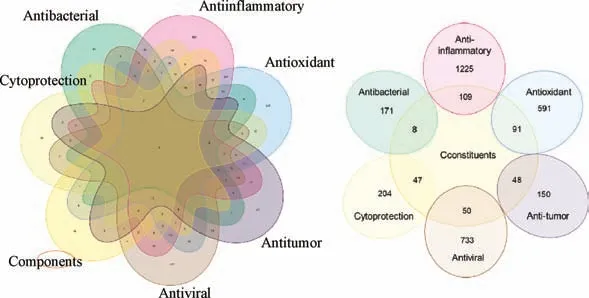
图11 药物成分靶点与现代药理活性靶点的交集基因

图12 “药物成分-活性靶点” 交联度热图
4.4 泡桐叶的传统功效与现代药理活的相关性 溃疡性疾病的发展与内毒素、细菌等进入体内激活异常免疫反应,黏膜屏障受损,菌群失调等方面相关[79],从传统功效和现代药理活性的靶基因交互情况(图13) 可知,泡桐叶表现出的多种现代药理活性与其传统功效存在一定的关联,这与以往的研究一致[80],即中药可通过抗菌、抗氧化、抗炎、细胞保护、抗病毒等方面的作用改善溃疡性疾病。可见泡桐叶的多种现代药理活性与其传统功效相印证,提示所预测的Q-marker 可同时作为传统功效和现代药理活性的筛选来源。
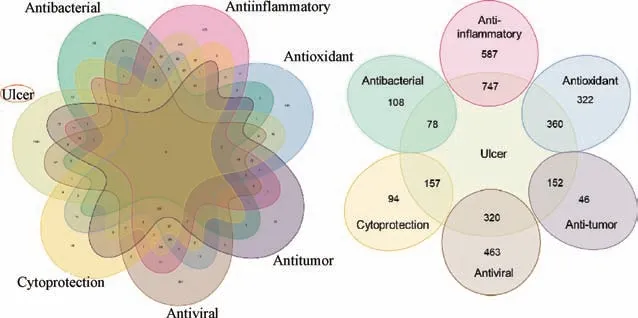
图13 泡桐叶的传统功效与现代药理活性的交集基因
5 结语与展望
为了全面、系统、科学地评价泡桐叶的质量,保证其临床用药的安全性和有效性,本研究基于质量标志物的核心概念,先通过综合分析泡桐叶的亲缘关系、化学成分、传统功效和现代药理活性,初步筛选出候选质量标志物,再结合生物信息学对候选成分进行系统性的预测。结果表明,泡桐叶的多种现代药理活性与其传统功效相印证。熊果酸、木犀草素和芹菜素可能是泡桐叶产生抗溃疡、抗菌、抗炎、抗氧化、细胞保护、抗病毒、抗肿瘤等作用的潜在靶点,而且这些成分可能与泡桐叶修复溃疡创面的良好效果密切相关。泡桐叶的活性成分在靶点和通路层面表现出良好的协同性,靶点所富集的抗细胞凋亡,调节细胞增殖以及诱导新生血管形成等通路可能是泡桐叶改善溃疡性疾病的关键环节。相关研究显示[50,81]熊果酸和黄酮类化合物对溃疡性疾病具有良好的预防、治疗、协同作用,这与本研究的预测结果基本一致。因此,建议将熊果酸、木犀草素、芹菜素作为泡桐叶的Q-marker。
尽管文献分析结合生物信息学预测质量标志物是一种方便、高效的方法,但所预测的结果还需要结合相关动物和细胞实验进行论证,才能进一步明确泡桐叶的药效物质基础。课题组的下一步计划是通过分子对接结合实验,探索药物小分子和大分子受体的具体作用方式和结合构型,深入挖掘泡桐叶修复溃疡创面的机理,筛选出泡桐叶中与靶点结合的先导化合物,阐明分子的活性位点和产生活性的原因,旨在优化泡桐叶原料的质量控制和提取制剂工艺,为临床应用复方桐叶烧伤油治疗溃疡性疾病和创面修复提供理论依据。
此外,虽然黄酮类化合物已被证实具有广泛的药用价值[82],但是对香叶基黄酮类化合物在体内研究则相对较少。目前,对于泡桐叶中的几种香叶基黄酮类化合物的生物活性研究,已经建立了一定的药理学认知基础,后续可对这些有活性的先导化合物进行进一步的结构修饰和开发,让香叶基黄酮类化合物的应用前景更加广阔。
