Leptosphaeria sp. CXY48来源苯并吡喃酮类化合物的研究
2023-09-16张明宇刘晓霖孔祥传鲁欣怡潘国军
张明宇 刘晓霖 孔祥传 毕 静 鲁欣怡 潘国军
山东第一医科大学(山东省医学科学院)生命科学学院,山东 泰安 271016
泰山白首乌,也叫泰山何首乌,是泰安道地药材。目前,对白首乌的研究主要集中在其化学成分和药理作用,如抗肿瘤、抗衰老等方面[1]。但对其根际微生物及其次级代谢产物的研究却鲜有文献报道[2]。
苯并吡喃酮及其衍生物属于有机杂环化合物[3-4],为白色晶体或结晶性的粉末,又称香豆素,广泛分布于药用植物中。由于其种类繁多,结构复杂,其生理功能多样,如抗凝血、抗炎、抗癌症[5]、抗艾滋病毒[6]、抗肿瘤、治疗皮肤病等[7-8],已广泛应用于人们的生活中[9]。此外,香豆素本身也是一种香料,广泛分布于曲霉菌、草木犀、香豆、熏衣草和菊芸香科等植物界[10]。本文从白首乌的根际土壤中分离得到一株真菌Leptosphaeriasp. CXY48,并从其发酵产物中分离得到4 种苯并吡喃酮类化合物,通过光谱和理化性质分析,确定其结构。
如前所述,本文以泰山白首乌根际土壤真菌为研究对象,筛选获得天然菌株Leptosphaeriasp.CXY48(图1),选择最适的培养条件,通过大批发酵获得次级代谢产物,分离获得单体化合物并进行结构鉴定,最后评价其生物活性,为新型抗菌药物先导化合物开发提供新的思路。
图1 实验菌株Leptosphaeria sp. CXY48
1 材料与方法
1.1 实验材料
1.1.1 试剂与仪器,如表1所示。

表1 实验所用试剂与仪器以及厂家信息
1.1.2 样品来源 白首乌根际土壤取自山东省泰山市泰山之上,距地表5 ~ 20 cm的白首乌地下根茎土壤。样本采集时间为2020年3月1日。
1.1.3 培养基类型 分离培养基:PDA 固体培养基,孟加拉红培养基;发酵培养基:ISP2 培养基,真菌1号培养基,真菌2号培养基,真菌3号培养基,马铃薯葡萄糖肉汤(PDB)培养基,大米培养基;分析培养基:LB培养基。
1.1.4 实验菌株 以金黄色葡萄球菌(S.aureusATCC33591) 和 大 肠 埃 希 菌(E.coliATCC25922)进行抑菌活性实验。
1.2 实验方法
1.2.1 样品处理 在无菌环境下,采用倍数稀释法将泰山白首乌根际土壤悬液(1.0 g/L)并稀释成10-1、10-2、10-3和10-4g/L 4 个不同浓度。28 ℃,摇床24 h 后,取100 μL 涂布在PDA 和孟加拉红培养基上,然后在28 ℃下倒置培养。
1.2.2 菌株的分离与纯化 涂布3天后,用接种环将单个菌株挑出,在培养基上分区划线,分离纯化得到单菌落培养基,挑取单菌落3点培养,进一步观察其形态。
1.2.3 菌株排重与筛选 将所分离出的单菌落接种到大米培养基,28 ℃静置发酵25 d,用等量乙酸乙酯萃取,减压浓缩得粗提物,并配制成1.0 g/L 甲醇溶液;根据形态特征、HPLC 指纹图谱分析,排除重复菌株;以环丙沙星0.1 g/L 作为阳性对照,测试次级代谢产物(10 μL)的抗菌活性:以大肠埃希菌和金黄色葡萄球菌为指示菌,在37 ℃培养箱中进行倒置培养一夜后,观察抑菌圈的大小。筛选出5 株对大肠杆菌和金黄色葡萄球菌具有抑菌活性的菌株,并通过指纹图谱分析,确定天才菌株为CXY48。
1.2.4 菌株鉴定 将确认的CXY48菌株在PDA平板上,倒置培养3 ~ 5 d,并测试ITS保守序列。基于基因测序的结果,在GenBank 数据库中进行BLAST比对,查找同源的序列,选择有代表性菌株序列展开分析,构建系统进化树(图2)。CXY48 菌株与Leptosphaeriasp. CPP-4 具有高度的同源性,结合对其形态特征的分析,鉴定CXY48为小球腔菌属。
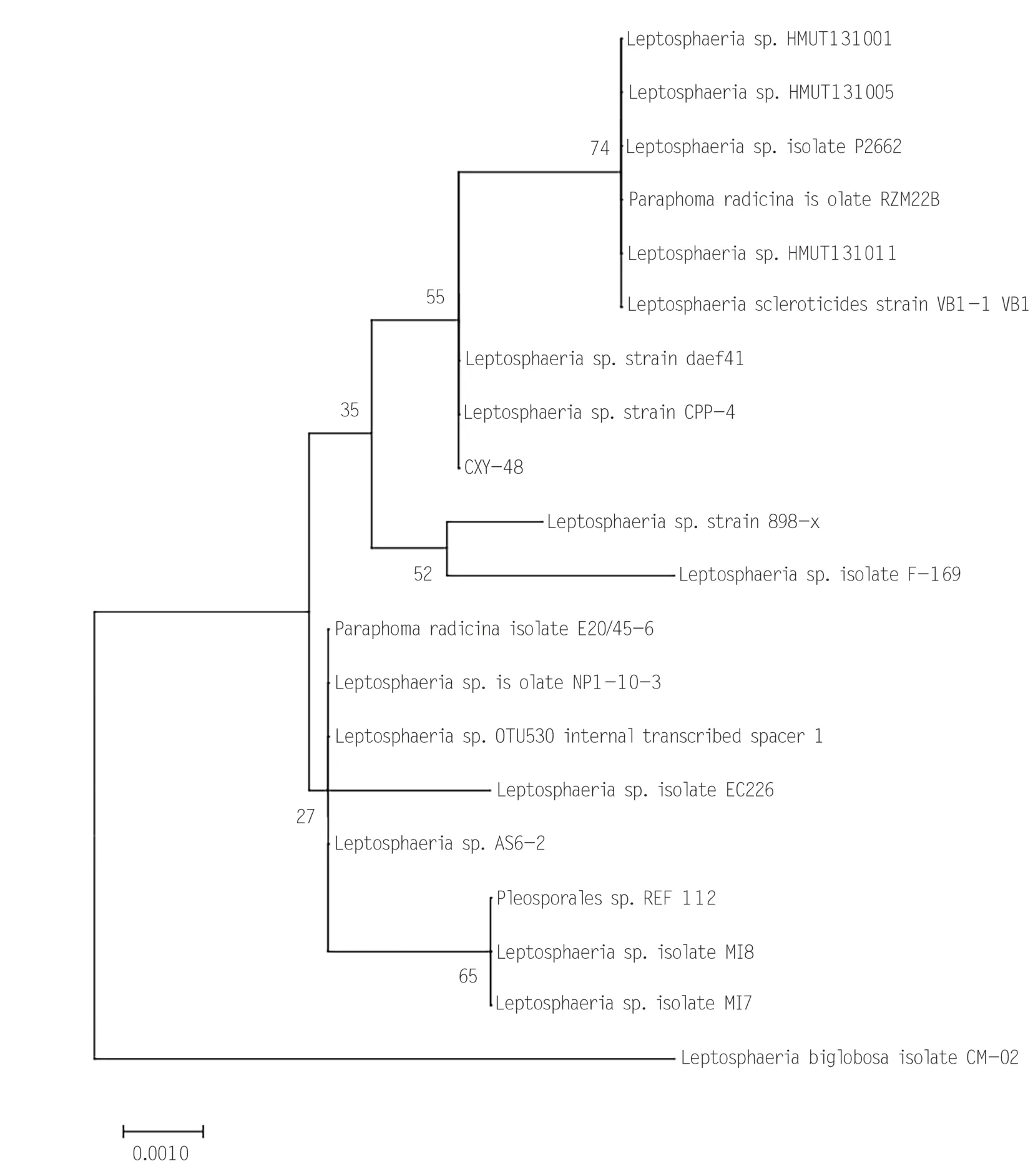
图2 CXY48菌株的系统进化树
1.2.5 培养条件优化与发酵 选取真菌1号、真菌2号、真菌3号、真菌4号、ISP2、PDB和大米培养基进行发酵培养基的筛选,并对培养时间、温度等条件进行优化。试验结果表明,在28 ℃条件下,大米培养基静置发酵30 d最佳。
取-80 ℃冷冻保藏的Leptosphaeriasp. CXY48菌种,无菌条件下,接种于PDA液体培养基中,28 ℃摇床活化培养3 d。将活化好的菌种按照1%的接种量接种到灭完菌的大米培养基,共计140瓶,培养箱中静置发酵30 d。
1.2.6 粗提物的富集 发酵结束后,用等量乙酸乙酯浸泡一夜,反复3次浸提,合并有机相减压浓缩得到粗提物。将粗提物溶于2 L 乙酸乙酯溶解后,将其倒入分液漏斗中,用1/3 体积自来水萃洗以除水溶性杂质,反复3次;乙酸乙酯相减压旋蒸得粗提物,用2 L 90%甲醇水溶液溶解后,加入1/3 体积石油醚进行脱油处理,反复3 次,甲醇水溶液浓缩后,得到最终粗提物。
1.2.7 代谢产物分离纯化 采用减压硅胶柱层析技术,对其进行正、反向极性分段,以活性为导向确定分离的组分,并结合TLC、HPLC、硅胶柱层析和半制备色谱等进行次级代谢产物的分离与纯化,从而获得活性单体化合物。
50 g 粗提物利用减压硅胶柱层以乙酸乙酯:石油醚(v/v)10∶1、8∶1、6∶1、4∶1、2∶1、1∶1 和0∶1 进行阶段梯度洗脱,经过HPLC 分析合并得到5 个馏分(Fr. 1 ~ 5)。在十八烷基硅胶(ODS)中,馏分Fr. 2(15.7105 g)和馏分Fr. 3(21.1076 g)以甲醇:水(10%、20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、100%)梯度洗脱,馏分Fr. 2 得到7 个亚馏分(Fr.2-1 ~ Fr.2-7)。将亚馏分Fr.2-2(2.8467 g)采用HPLC(50% MeCN/H2O, v/v)得到化合物1(tR7.3 min,7.8 mg)和化合物4(tR10.2 min,24.9 mg);馏分Fr.3 得到8 个亚馏分(Fr.3-1 ~ Fr.3-8)。将亚馏分Fr. 3-3 采用HPLC(47% MeOH/H2O, v/v)得到化合物2(tR26 min,29.6 mg)和化合物3(tR27 min,9.2 mg)。
2 结 果
2.1 抑菌活性测试
采用药敏纸片法测定了化合物1 ~ 4 的抗菌活性,以环丙沙星(0.1 g/L)为阳性对照,结果如表1所示。其中,化合物1 和化合物4 对大肠杆菌的最小抑菌浓度(minimum inhibitory concentration, MIC)值为3.89和70 μg/mL,对金黄色葡萄球菌的MIC值分别为187和250 μg/mL,结果如表2所示。

表2 4种化合物抗菌活性评价
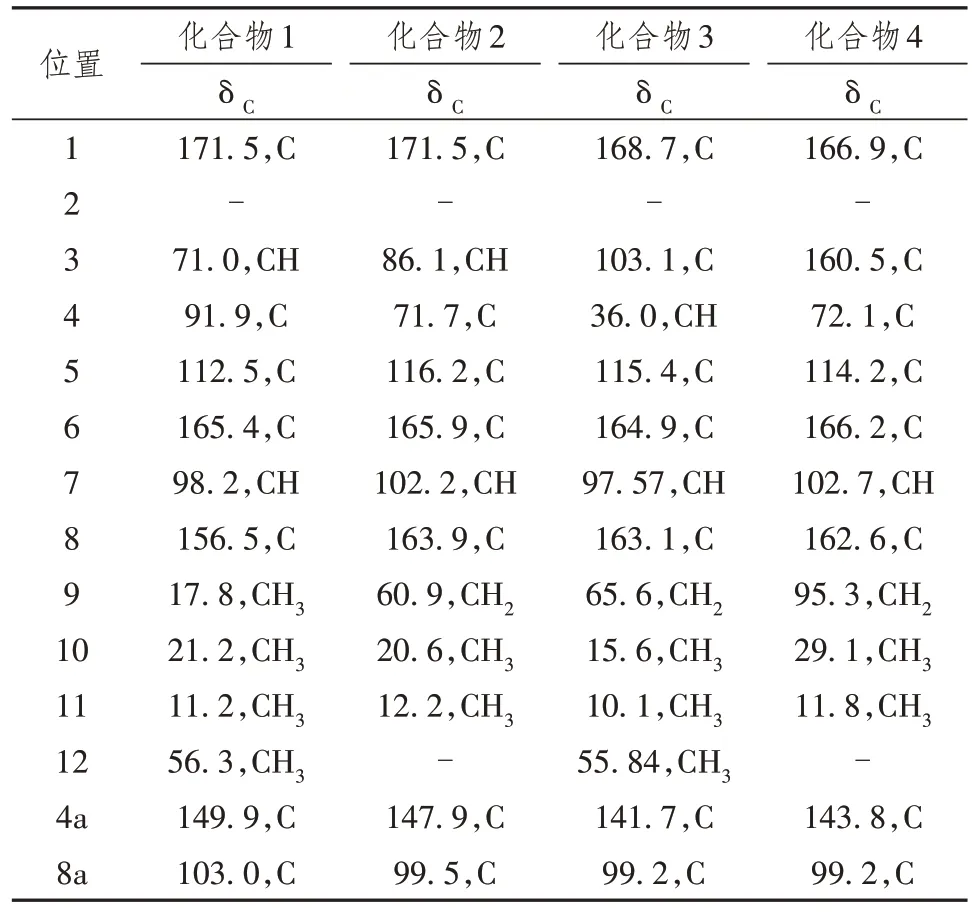
表3 化合物1 ~ 4 13C-NMR(100MHz)在CDCl3中的数据
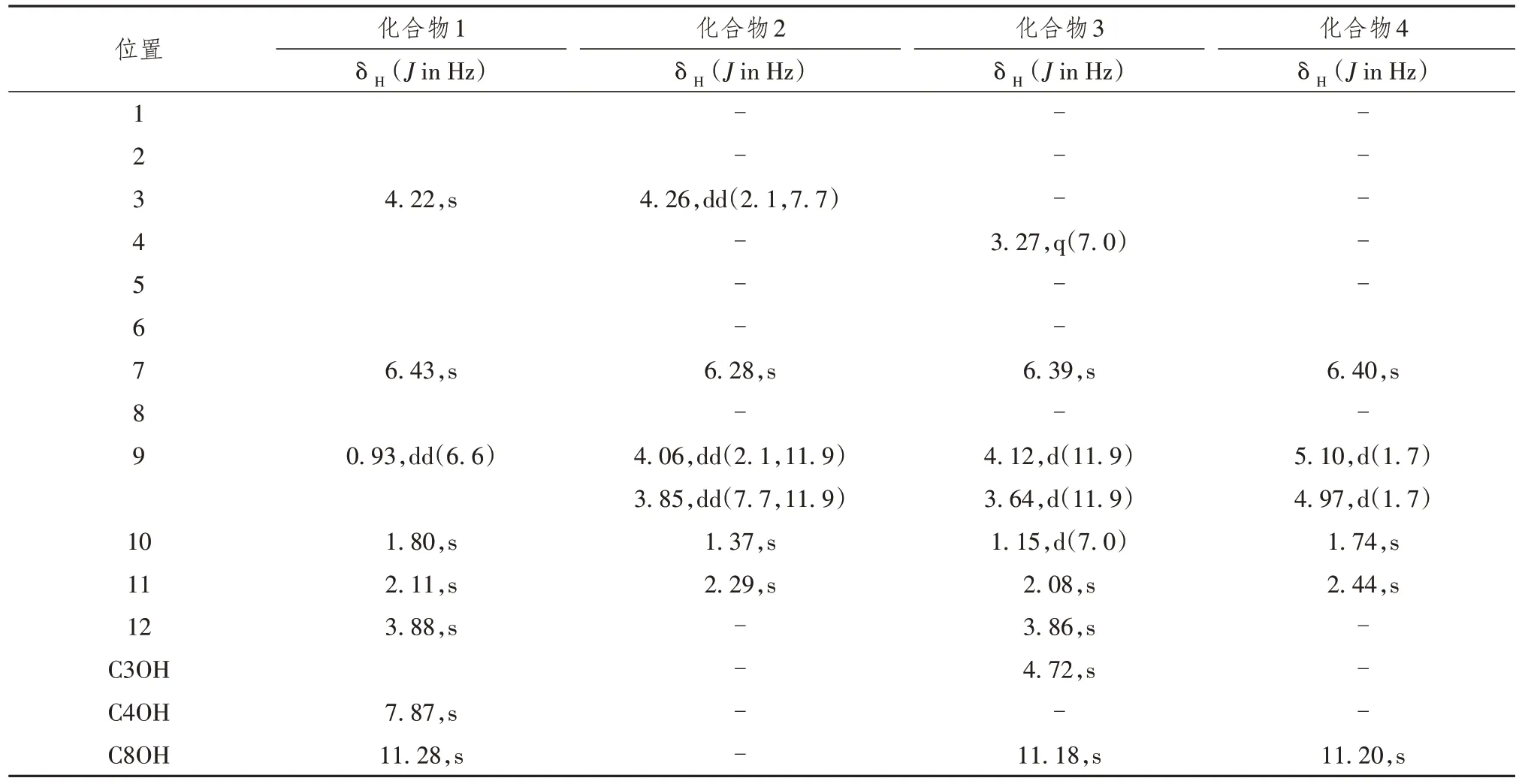
表4 化合物1 ~ 41H NMR(400 MHz)在CDCl3中的数据
2.2 活性代谢产物的结构鉴定
将化合物1 ~ 4 用核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)和质谱(MS)等进行结构解析。
化合物1:淡黄色固体,1H NMR 显示1 个螯合羟基质子(δH11.28),1个羟基质子(δH7.87),1个单态芳香族质子(δH6.43),1个羟甲基质子(δH4.22),1个甲氧基(δH3.88),2个单态甲基(δH2.11, 1.80),1个双态甲基(δH0.93),13C NMR和DEPT 135光谱显示了1个内酯碳基(δ 171.5)、六季(δ 165.4、156.5、149.9、112.2、103.0 和91.9)、2 个甲基(δ 98.2 和71.0)和4 个甲基(δ 56.3、21.2、17.8 和11.2)碳的共振,ESI-MS: m/z 275 [M+Na]+。以上数据和文献中Fusaraisochromanone 2 一致,此化合物被鉴定为Fusaraisochromanone 2[11]。
化合物2:淡黄色固体,1H NMR 显示出2 个伯甲基(δH1.07, 2.07)、1 个甲氧基(δH3.86)、1 个亚甲基(δH3.90, 3.80)、2个次甲基(δH3.29, 4.50)和1个芳香质子(δH6.43)的信号,13C NMR和DEPT光谱显示出13 个碳共振,由3 个甲基(1 个氧化)、1 个氧化亚甲基、3 个次甲基(1 个氧化和1 个芳族)和6个非质子化碳(1个羰基和5个烯属)组成,ESI-MS:m/z 275 [M+Na]+。以上数据和文献中Clearanol Ⅰ一致,此化合物被鉴定为Clearanol I[12]。
化合物3:淡黄色固体,1H NMR显示两组密切相关的信号,比率为5.8∶1,1个芳族甲氧基的存在(δc 56.0; δH3.84),1个单线态芳甲基(δc 9.8; δH2.00),和1个单线态芳香质子(δc 97.0; δH6.45),结合紫外光谱,表明是1个等色酮骨架。1H核磁共振剩余的信号光谱为双峰甲基(δc 16.3; δH1.06)偶联到苄型次甲基(δc 35.0; δH3.28)和1个CH2OH基团(δc 63.6;δH3.64, 3.72),EI-MS: m/z 269.1023 [M+Na]+。以上数据和文献中Banksialactone A一致,此化合物被鉴定为Banksialactone A[13]。
化合物4:淡黄色固体,1H NMR显示1个单态芳香族质子(δH6.40),2个单态甲基(δH2.44, 1.74),1个乙烯基(δH5.10, 4.97),1个酚羟基(δH11.20),13C NMR光谱中,C-6共振出现在166.2 ‰处,表明在该位置有酚官能团,C-9(δc 95.3)表明该位置有1 个烯烃,EI-MS: m/z 237.0773 [M+Na]+。以上数据和文献中(R)-3,4-dihydro-4,6,8-trihydroxy-4,5-dimethyl-3-methyleneisochromen-1-one(1)一致,此化合物被鉴定为(R)-3,4-dihydro-4,6,8-trihydroxy-4,5-dimethyl-3-methyleneisochromen-1-one(1)[14]。
3 结 论
本研究以泰山白首乌根际土壤中筛选出一种富含次级代谢产物且具有良好活性的Leptosphaeriasp. CXY48菌株,采用薄层层析法、HPLC、减压柱层析法和正/反相硅胶等手段,分离纯化,并用质谱、NMR等光谱技术对其进行了结构鉴定和活性评估;目前,共分离鉴定出4个单体化合物,其中2个具有抗菌作用。综上,可推断何首乌根际泥土中埋藏着丰富的真菌资源,是新型活性天然产物的重要泉源,为开发高效低毒的新型药剂提供思路。
利益冲突所有作者均声明不存在利益冲突
