肝癌细胞外泌体鉴定及其对肝细胞的影响
2023-09-13车小红张咏梅
车小红,张咏梅
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,占原发性肝癌的85%~90%。乙型肝炎病毒(hepatitis B virus,HBV)感染被认为是中国HCC 发展的主要危险因素[1~3]。HCC 的发展是一个复杂的多步骤过程,涉及持续的炎症损伤,包括肝细胞坏死和再生[4]。 尽管近年来在成像技术、肝移植、手术切除、射频消融(radiofrequency ablation,RFA)、经导管动脉化学栓塞治疗(transarterial chemoembolization,TACE) 和全身化学治疗等方面都取得了新的突破,但HCC 发病率高、预后差,晚期肝癌患者的治疗选择非常有限,预后率仍然很低,至今没有有效的治疗方法[5]。 目前,HCC 的5 年生存率不超过20%,早期诊断可显著降低HCC 患者的死亡率[6]。 因此,提高HCC 的早期诊断率和探索HCC 形成的具体机制是提高HCC 总生存率的主要方法。
外泌体 (exosomes,Exos) 是直径为50~100 nm细胞外囊泡, 它们含有细胞分泌的许多活性成分,包括脂质、蛋白质、RNA 和DNA[7]。 Exos 通过调节肿瘤细胞之间及肿瘤细胞与非肿瘤细胞之间的信号转导,间接影响肿瘤微环境,是肿瘤发生的重要工具[8]。细胞类型如间充质细胞、免疫细胞和肿瘤细胞可诱导Exos 的释放,这表明Exos 参与了肿瘤的发生、发展、转移、免疫逃逸和耐药[9]。此外,肿瘤来源的Exos 含有大量与癌症相关的血清学标志物,如miRNAs,可用于早期HCC 的检测[10,11]。 多项研究表明外泌体与HCC的发生、发展密切相关,对Exos 的深入研究,可能有助于解释肿瘤的形成和转移过程, 为HCC 的早期诊断和治疗提供新的方法。笔者通过提取并鉴定小鼠肝癌细胞Hepa1-6 来源的Exos(Hepa1-6 Exos),研究AML12 细胞摄取Hepa1-6 Exos 的效率,并探讨Hepa1-6 Exos 对AML12 细胞的影响。
1 材料与方法
1.1 实验材料
Hepa1-6 细胞和AML12 细胞(中国科学院细胞库);溶酶体膜糖蛋白(CD63)、肿瘤易感基因101(tumor susceptibility gene 101,TSG101)、 白蛋白(albumin,ALB)和α1-抗胰蛋白酶(α1-antitrypsin,A1AT)抗体(Abcam 公司,美国)。
1.2 方法
1.2.1 细胞培养
小鼠肝癌细胞Hepa1-6 和小鼠正常肝细胞AML12在含有10%胎牛血清和1%青霉素-链霉素的达氏修正伊氏培养液(Dulbecco’s modified Eagle’s medium,DMEM) 中培养。 细胞每隔1 d 更换新鲜培养液,在37 ℃、体积分数5%CO2培养液中生长。
1.2.2 外泌体提取
Hepa1-6 细胞在无胎牛血清(fetal bovine serum,FBS)培养液中培养24~36 h 后,采用ExoquickTC试剂盒提取Exos。 取上清液500 g 离心10 min 去除细胞,然后在10 000 g 条件下离心20 min,清除残留的细胞碎片。所得上清液经0.4 μm 过滤器过滤后,采用ExoquickTC试剂盒沉淀。 所得样品在磷酸盐缓冲溶液(phosphate buffered solution,PBS) 或DMEM 中重悬,保存在-80°C 条件下。
1.2.3 外泌体鉴定
采用电子显微镜分析Hepa1-6 Exos 的形态。 将纯化的Exos 添加到网格中,用2%醋酸铀酰将Hepa1-6 Exos 染色,于电子显微镜(型号:Tecnai G2 Spirit BioTwin)成像拍片。 分析Hepa1-6 Exos 的粒径分布,将提取的Hepa1-6 Exos 均匀稀释到500 ng/mL(蛋白质质量浓度),采用Nanoplus 分析仪(型号:ZetaVIEW S/N 17-310)检测Hepa1-6 Exos 粒径。
1.2.4 Western blot
使用放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA) 裂解缓冲溶液在4 ℃条件下提取细胞或Hepa1-6 Exos 中的总蛋白, 用Pierce BCA 蛋白测定试剂盒测定蛋白浓度。蛋白质浓缩在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(6 %)上,用SDS-PAGE(12%)分离。 将凝胶转移到硝化纤维素过滤膜上,进行印迹分析。 用3%牛血清ALB 阻断后,膜随后与一抗孵育。 在Tris 缓冲溶液加吐温-20(Tris-buffered saling and tween-20,TBST)中洗涤3次后,与辣根过氧化物酶偶联二抗室温孵育1 h。
二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量实验步骤制备BCA 工作液,按A ∶B=50 ∶1 比例配置工作液,充分混匀;将蛋白质样品加入到各孔中,每孔分别加入BCA 工作液;密封后,于37 ℃静置30 min;室温,用酶标仪检测光密度(optical density,OD)562nm值;制作标准曲线,计算蛋白样品浓度。
1.2.5 外泌体的体外荧光示踪
将纯化的Hepa1-6 Exos (1 μg/μL) 与1 mmol/L的DiI(细胞膜橙红色荧光探针)染料(500 ∶1 体积比)孵育30 min, 用PBS 洗涤后离心去除游离的荧光染料。为了在AML12 细胞中体外示踪Hepa1-6 Exos,将AML12 细胞与标记的Hepa1-6 Exos 孵育3 h,用PBS洗涤3 次,再用4%多聚甲醛溶液固定10 h 后,再用PBS 洗涤2 次,10 min 后再用PBS 洗涤2 次。 细胞核用Hoechst(1 ∶1 000)在37 ℃反染10 min。 实验结束时,用醋酸钠溶液清洗细胞(去除非特异性黏附),并使用共聚焦显微镜观察拍片。
1.2.6 细胞增殖毒性检测
实验分成2 组:对照组(AML12 细胞)和实验组(AML12 细胞+Hepa1-6 Exos)。 将2 组细胞接种至96 孔板,每孔加入1×103个细胞,培养12 h 后,对2组细胞进行处理。 24 h、48 h、72 h 后进行CCK-8 检测,在450 nm 波长测定OD[12]。
1.2.7 细胞凋亡检测
实验分组同1.2.6 所述, 将2 组细胞接种至6 孔板,每孔加入2×105个细胞,培养12 h 后,对2 组细胞进行处理。24 h、48 h、72 h 后用流式细胞仪进行检测。
1.2.8 聚合酶链式反应
使用TRIzol 试剂按制造商说明书指示从2 组细胞中提取总RNA。 然后, 利用PrimeScript 第一链cDNA 合成试剂盒将RNA 反转录为cDNA,用Prime-Script RT master mix 分析mRNA 水平上的相关基因表达。 所有定量聚合酶链式反应 (quantitative polymerase chain reaction,qPCR)至少重复3 次。
甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。 ALB 上游引物序列为5′-TGCTTTTTCCAGGGGTGTGTT-3′, 下游引物序列为5′-TTACTTCCTGCACTAATTTGGCA-3′;A1AT 上游引物序列为5′-AGGGTGGCTTCTAGCCTCTTT-3′, 下游引物序列为5′-CAGTCCGTGTGTACTCTTCCC-3′;GAPDH 上游引物序列为5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物序列为5′-TGTAGACCATGTAGTTGAGGTCA-3′。
RNA 定量: 定量时适量稀释溶于焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)的RNA 样品,紫外分光光度计选择RNA 定量, 检测样品, 读取OD260nm及OD260nm/OD280nm比值。
1.3 统计学方法
利用GraphPad Prism 7.0 进行统计学分析。 数据用平均值± 标准差表示。 两组间比较采用Studentdent’s t 检验,多组间比较采用单因素方差分析。 P <0.05 为差异有统计学意义。
2 结果
2.1 外泌体鉴定
2.1.1 外泌体形态
相关研究报道Exos 为脂质双分子层结构。 实验首先收集了Hepa1-6 Exos,通过透射电子显微镜分析其形态。 结果显示Hepa1-6 Exos 呈脂质双层茶托样结构,具有典型的Exos 结构,结果符合Exos 的形态特征(图1)。

图1 Hepa1-6 Exos 的形态特征(标尺=100 nm)Fig.1 Image of morphological characteristics of Hepa1-6 Exos(scale bar=100 nm)
2.1.2 外泌体特异性蛋白表达
Exos 表达特异性蛋白CD63、TSG101 和CD9 等,而不表达高尔基体标志物GM130 蛋白。 Western blot实验结果表明,Hepa1-6 细胞和Hepa1-6 Exos 均表达CD9、CD63 和TSG101 蛋白(图2),证明Hepa1-6 Exos 表达标志性蛋白。

图2 Hepa1-6 Exos 特异性蛋白表达Fig.2 Diagram of Hepa1-6 Exos specific protein expression
2.1.3 外泌体粒径分析性
对提取Hepa1-6 Exos 并进行粒径分析,结果显示,Hepa1-6 Exos 粒径主要分布在50~200 nm,且基本呈正态分布(图3)。 符合Exos 正常粒径大小分布范围。
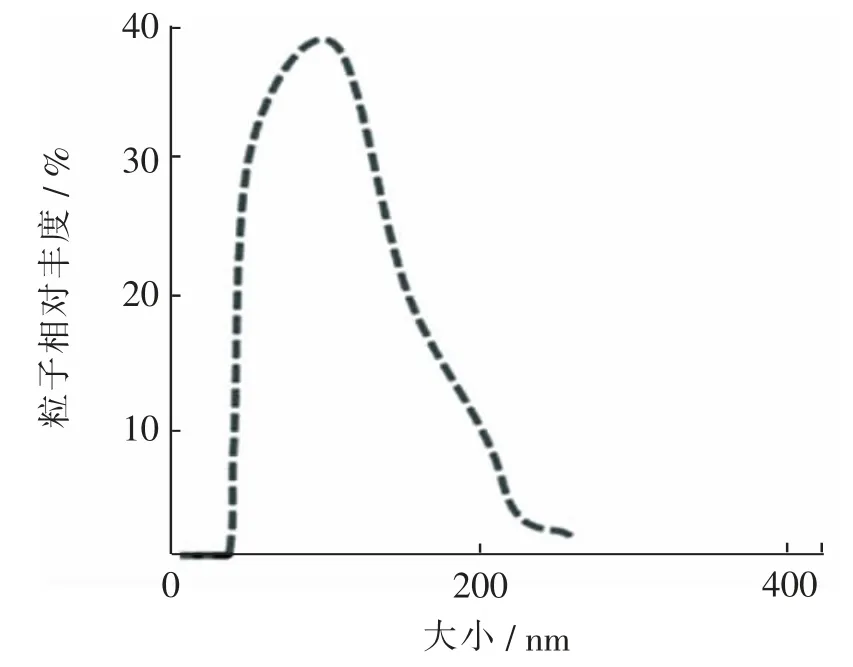
图3 Hepa1-6 Exos 粒径分析Fig.3 Diagram of particle size analysis of Hepa1-6 Exos
2.2 AML12 细胞高效摄取Hepa1-6 Exos
免疫荧光显示,Hepa1-6 Exos 进入AML12 后,主要定位于细胞质中,且被细胞高效摄取(图4)。 说明Hepa1-6 Exos 能与AML12 细胞进行充分信息交流。

图4 AML12 细胞摄取Hepa1-6 Exos 情况(标尺=5 μm)Fig.4 Images uptake of Hepa1-6 Exos by AML12 cells(scale bar=5 μm)
2.3 Hepa1-6 Exos 促进AML12 细胞增殖及抑制其凋亡
将Hepa1-6 Exos 与AML12 细胞共培养24 h、48 h、72 h,CCK-8 实验表明,与对照组相比,实验组细胞的增殖能力得到提高(表1)。 说明Hepa1-6 Exos可促进AML12 细胞增殖。 流式细胞技术检测细胞凋亡,与对照组相比,实验组细胞凋亡率下降(表2)。 上述结果表明Hepa1-6 Exos 能抑制AML12 细胞的凋亡,且其抑制作用较大。

表1 两组AML12 细胞增殖率比较Tab.1 Comparison of proliferation rate of AML12 cells between 2 groups

表2 两组AML12 细胞凋亡率比较Tab. 2 Comparison of apoptosis rate of AML12 cells between 2 groups
2.4 Hepa1-6 Exos 增强AML12 细胞ALB mRNA和A1AT mRNA 的表达
经Hepa1-6 Exos 处理后,采用qPCR 和Western blot 检测两组细胞中ALB mRNA、A1AT mRNA 和其蛋白的表达情况。实验组ALB mRNA、A1AT mRNA 相对表达量分别为4.46±0.50、6.89±1.01,对照组分别为1.00±0.21、1.00±0.35。 与对照组相比, 实验组ALB mRNA、A1AT mRNA 表达水平明显升高,差异有统计学意义(t=3.96、5.27,P<0.05)。 见图5。

图5 两组AML12 细胞表达ALB、A1AT 蛋白电泳图(Western blot)Fig. 5 Electrophoretogram of AML12 cells expressed ALB and A1AT protein(Western blot)
3 讨论
HCC 是一种致命恶性肿瘤, 具有较高的复发风险,其转移受微环境因素的影响较大,迄今肝癌早期诊断仍然缺乏合适的标志物[13]。目前,肝移植、介入放射治疗和化学栓塞治疗仍是治疗不可切除肝癌的主要选择。 Exos 是具有脂质双层膜结构的细胞外小泡,1989 年由Johnstone RM 在研究网织细胞时首次发现[14]。 Exos 是具有多种生物功能的纳米级颗粒,广泛分布于血液、唾液、牛奶、腹水、尿液等体液中,富含核酸、蛋白质、脂类和无机盐离子[15]。Exos 参与细胞之间或细胞与组织之间重要的信息和物质的交换。它们维持着人体细胞发育、生长、分化和衰老的关键生理过程,是人类生命所必需的[7]。 越来越多的研究表明,Exos 的分泌和功能异常在恶性肿瘤的发生、 发展和治疗中起着至关重要的作用。
肿瘤来源的Exos 在侵袭转移过程的几乎所有步骤中都起着至关重要的作用。首先,肿瘤源性Exos 提供自分泌和旁分泌信号, 激活肿瘤上皮细胞中的上皮-间质转化 (epithelial- mesenchymal transition,EMT),使肿瘤细胞具有侵袭周围组织的能力。 其次,肿瘤Exos 被吸收并沉淀到目标组织中, 在转移细胞停止之前形成一个转移前小生境。最后,肿瘤Exos 调节宿主免疫,使疾病无限制地发展,甚至通过激活炎症反应途径逃避免疫细胞,使其得到培养[16,17]。 近年来,肿瘤来源的Exos 已被证实能促进癌症进展。
相关研究表明,通过Exos 的RNA 和蛋白质交换不仅在HCC 的发生发展中具有关键作用, 而且可能是潜在的实时、非侵入性生物标志物和治疗靶点的来源[18]。迄今为止,对肝脏Exos 的研究有限,大多数研究来源于细胞学实验。 既往研究表明,Exos 作为肿瘤微环境中的载体,在肿瘤的发生发展中发挥着重要作用,也是HCC 诊断和预后潜在有效的生物标志物[19,20]。肝癌Exos 分泌的miRNA 可诱导多种生物学功能,通过灭活致癌miRNA 可能是肝癌靶向治疗的新方向。 尽管Exos 和HCC 研究进展令人振奋,但仍有许多问题有待进一步阐明, 如Exos 在HCC 转移的EMT 途径中的作用,以及Exos 在HCC 与靶细胞之间的作用机制等仍有待进一步研究。
笔者通过高速离心法提取Hepa1-6 Exos,保证了实验所需Exos 的纯度。 实验鉴定了Hepa1-6 Exos 的生物特征,其呈脂质双层茶托样结构,表达特征性蛋白, 粒径主要分布在50 ~ 200 nm。 上述结果表明Hepa1-6 Exos 具有Exos 的特征,符合其特性。实验揭示AML12 细胞能高效摄取Hepa1-6 Exos, 表明提取的Hepa1-6 Exos 能与AML12 细胞进行充分信息交流。 在此基础上,将Hepa1-6 Exos 与AML12 细胞共培养, 发现Hepa1-6 Exos 能促进AML12 细胞增殖,并抑制其凋亡;同时Hepa1-6 Exos 增强了AML12 细胞中ALB 和A1AT 的表达。 Exos 作为一种纳米级囊泡,具备克服各种生物屏障的能力。 它通过细胞膜融合、胞饮和内吞等方式进入细胞后,将自身携带的配体或受体、蛋白质或核酸,或作为药物递送载体对细胞发挥作用,影响细胞生长、分裂和迁移等生物学行为,从而改变受体细胞的生理和代谢功能。 Exos 通过膜融合将来源细胞的基因突变信息递送至受体细胞,从而导致原癌基因的激活和抗凋亡基因的表达,使肿瘤细胞获得增殖特性。 在伤口愈合后期,Exos 可抑制胶原蛋白表达,减少瘢痕形成。 研究发现,Exos 介导核酸、蛋白质和脂类等生物活性物质的递送参与肝癌的生长、转移和血管生成。
综上所述,笔者鉴定了肝癌细胞来源的Exos,并分析了其对正常肝细胞的影响, 结果表明Hepa1-6 Exos 可能与肝癌的发生发展相关。 因此Exos 有望成为肝癌诊断标志物,为肝癌早期诊断和治疗提供了新思路。 同时,笔者研究尚存在不足,肝癌细胞的Exos对正常肝细胞促增殖和抑制凋亡的机制还有待进一步研究,仍需体内实验阐明此作用机制,从而为肝癌的临床诊治提供新的策略。
