HPLC法同时测定蜂蜜中3种还原糖成分的含量
2023-09-05黄良江
黄良江
(来宾市检验检测中心,广西 来宾 546100)
蜂蜜是蜜蜂通过采集植物花粉,通过与自身分泌物混合酿造出的一种甜味物质。蜂蜜中富含多种营养成分,主要以果糖和葡萄糖为主,是一种天然的保健食品。有研究表明,蜂蜜具有美容养颜、润肠通便的功效[1-2],因而常常被用于人体保健。同时蜂蜜也是常用的药用辅料,广泛应用于蜜丸等药物的制造[3]。因此,蜂蜜无论作为保健产品还是作为药用辅料使用,对其进行质量的控制都是十分重要的[4-5]。
蜂蜜有天然的野生蜂蜜和人工饲养的养殖蜂蜜,无论是野生蜂蜜还是养殖的蜂蜜,对人体保健和药物制造均具有重要价值。近年来随着人们健康意识的提高,养生逐渐受到人们的关注,蜂蜜作为一种具有高营养价值的产品备受人们的青睐和欢迎[6]。由于天然的野生蜂蜜和农家饲养的土蜂蜜价格较为昂贵,不法分子为追求利益,在蜂蜜中掺糖造假的行为常有发生[7]。蔗糖由于价格低廉,易于取得,常被掺和到蜂蜜中[8],因此对蜂蜜中主要糖分和掺假糖分的检测对于打击制假造假十分重要。笔者通过有关数据库检索有关文献,检索到检测蜂蜜中还原糖分的方法主要有旋光法[9-10]、化学法[11]、近红外光谱法[12]、高效液相色谱法[13-14]等。高效液相色谱法由于灵敏度高、操作简单,因而广泛应用于蜂蜜中还原糖的检测。但由于使用的示差折光检测器使用条件较为严格,实际应用中常因色谱条件选择不当引起各成分之间分离不佳、峰形差、影响准确定量。本研究通过改善和优化色谱条件,建立一种前处理简单、操作方便、色谱条件稳定、测量准确可靠,可实际应用于蜂蜜中3种还原糖成分的含量测定,以期为实验室对蜂蜜的品质质量控制和掺假打假提供可靠、稳定的试验方法。
1 材料与方法
1.1 仪器设备
沃特世e2695高效液相色谱仪,2414示差折光检测器,Empower色谱工作站,电子天平(瑞士梅特勒-托利多),超声波振荡器(鼎泰生化科技设备制造有限公司),离心机(德国西格玛),恒温水浴锅(上海一恒),涡旋仪(广州IKA)。
1.2 试剂耗材
乙腈(色谱纯,德国默克公司),实验用水均为超纯水(一级)。
1.3 样品与标准品
蜂蜜(批号:SP01、SP02、SP03,购于某超市;SP04、SP05、SP06,购于某蜂蜜产品保健专卖店;SP07、SP08、SP09,SP10,购于某蜜蜂养殖基地),果糖(CAS号:57-48-7,上海安谱实验科技股份有限公司),葡萄糖(CAS号:50-99-7,上海安谱实验科技股份有限公司),蔗糖(CAS号:57-50-1,上海安谱实验科技股份有限公司)。
2 方法与结果
2.1 样品的制备
2.1.1 样品前处理
用勺子取适量蜂蜜样品,置于具塞锥形瓶中,盖紧瓶塞,将样品放入50 ℃的恒温水浴锅中加热,使蜂蜜样品全部溶化后从水浴锅中取出,放置于搅拌器上搅拌10 min,使样品充分搅拌混合均匀,放置于阴凉处冷却至室温备用。
2.1.2 样品溶液的制备
用电子天平准确称取冷却至室温的混合均匀蜂蜜样品2 g,置于100 mL具塞锥形瓶中,盖紧瓶塞,将锥形瓶放置到超声波振荡器中超声5 min,冷却至室温后转移到100 mL容量瓶中,每次用少量纯化水洗涤锥形瓶,洗涤3次,每次洗涤后将洗涤液转移到容量瓶中,用水定容至刻度,充分振荡摇匀。将样品转移至20 mL离心管中,置于离心机中以5 000 r/min的速度离心5 min后,吸取离心后的样品上清液,用0.22 μm的微孔滤膜过滤,滤过至2 mL样品上机瓶中,待上机分析。
2.2 标准溶液和空白溶液的制备
2.2.1 标准溶液的制备
2.2.1.1 标准贮备液的制备
将果糖、葡萄糖、蔗糖置于96 ℃的干燥箱中干燥3 h,冷却至室温后,迅速分别准确称取果糖、葡萄糖、蔗糖各2.50 g,用少量纯化水溶解,转移至50 mL容量瓶中,用纯化水定容至刻度,配制成50 mg/mL的标准贮备液(标准溶液编号:①)。
2.2.1.2 标准工作液的制备
取①标准溶液,分别准确吸取0.25,0.50,2.50,5.00,7.50,10.00 mL放置于25 mL容量瓶中,加纯化水稀释并定容至刻度,配置成0.5 mg/mL(标准溶液编号:②)、1.0 mg/mL(标准溶液编号:③)、5.0 mg/mL(标准溶液编号:④)、10.0 mg/mL(标准溶液编号:⑤)、15.0 mg/mL(标准溶液编号:⑥)、20.0 mg/mL(标准溶液编号:⑦)的系列标准工作液。
2.2.2 空白溶液的制备
用纯化水为空白溶液,使用时用0.22 μm微孔滤膜过滤,即得。
2.3 色谱条件
色谱柱类型和规格:NH2柱,规格为4.6 mm×250 mm×5 μm;流动相:V乙腈∶V水=75∶25;流速:1.0 mL/min;柱温:45 ℃;检测池温度:40 ℃;洗脱方式:等度洗脱。
3 方法学考察
3.1 色谱柱的类型
选择C18色谱柱(250 mm×4.6 mm×5 μm)、C8色谱柱(250 mm×4.6 mm×5 μm)和NH2色谱柱(250 mm×4.6 mm×5 μm)分别进行试验,考察不同类型的色谱柱对还原糖的分离效能。试验结果表明,使用C18色谱柱和C8色谱柱时,不能将果糖、葡萄糖、蔗糖有效地分离开来,即使优化流动相比例和色谱柱温度,亦无法达到分离度大于1.5的要求,无法实施准确定量。使用NH2色谱柱进行试验时,果糖、葡萄糖、蔗糖3组成分能较好地分离开来,通过调整和优化色谱条件,能使果糖和葡萄糖这两个临近成分较好地分离,分离度达到1.5以上的定量要求,而且色谱峰峰型也较好,理论塔板数较高,分离还原糖选择氨基色谱柱能实现较好的分离效果。
3.2 色谱条件的优化
色谱条件直接影响物质的分离效果,本试验考察了不同的流动相比例V乙腈∶V水(65∶35,70∶30,75∶25,80∶20,85∶15),柱温(35,40,45,50,60 ℃)对果糖、葡萄糖、蔗糖3组成分分离度的影响。当流动相V乙腈∶V水为65∶35和70∶30时,3种还原糖成分中葡萄糖和蔗糖之间的分离度能达到大于1.5的要求,但果糖和葡萄糖之间的分离度均达不到1.5,增加乙腈的比例能使果糖和葡萄糖之间的分离度增大,当V乙腈∶V水为75∶25,80∶20,85∶15时果糖和葡萄糖之间的分离度能满足大于1.5的要求,增加乙腈的比例虽然能提高分离度,但乙腈的价格比较昂贵,对环境的污染也比较大,为降低检测成本和减少环境污染,因此流动相比例选择为75∶25较为合适,既能达到分离效果又能降低检测成本和减少环境污染。考察色谱柱温度时,当柱温为35 ℃时,果糖和葡萄糖不能有效分离;当柱温为40 ℃时,果糖和葡萄糖的分离度刚好能满足1.5的要求;当柱温为45 ℃时,果糖和葡萄糖能有效分离,分离度大于1.5;当柱温升高为50,60 ℃时,果糖和葡萄糖分离度均大于1.5,但分离度变化不明显。随着色谱柱温度的增高,各成分之间的分离度也相应增大,但温度增高会影响色谱柱的使用寿命,因此选择柱温为45 ℃时,既能使各成分之间有效分离,又能较好地保护色谱柱。通过色谱条件的尝试、改善、筛选和优化,最终得到了“2.3”项下较为稳定、可靠的条件,该色谱条件能使果糖、葡萄糖、蔗糖3组成分有效地分离,并能准确定量。该条件下,标准品和样品的色谱图分别如图1~3所示。
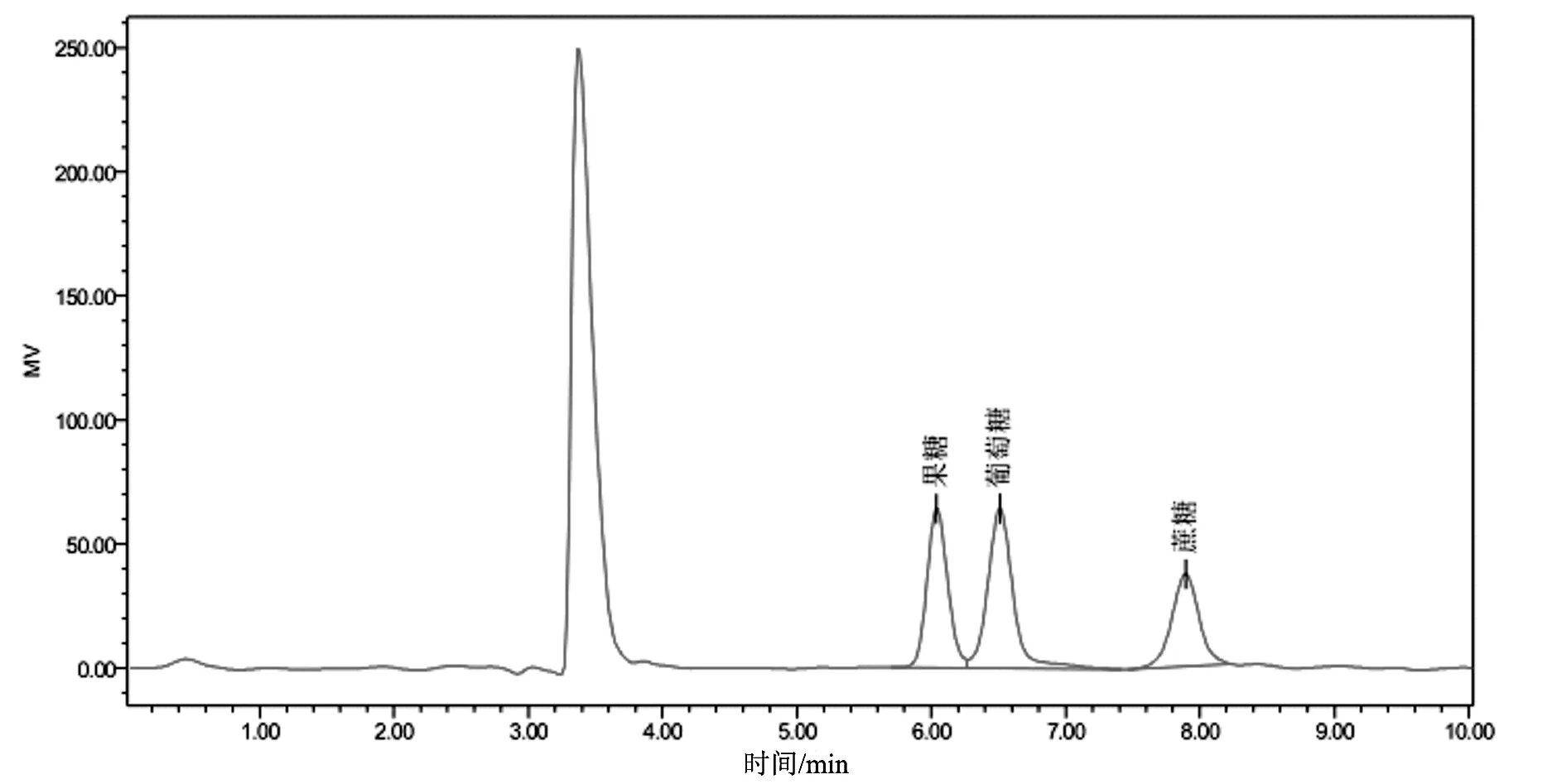
图1 标准品色谱图
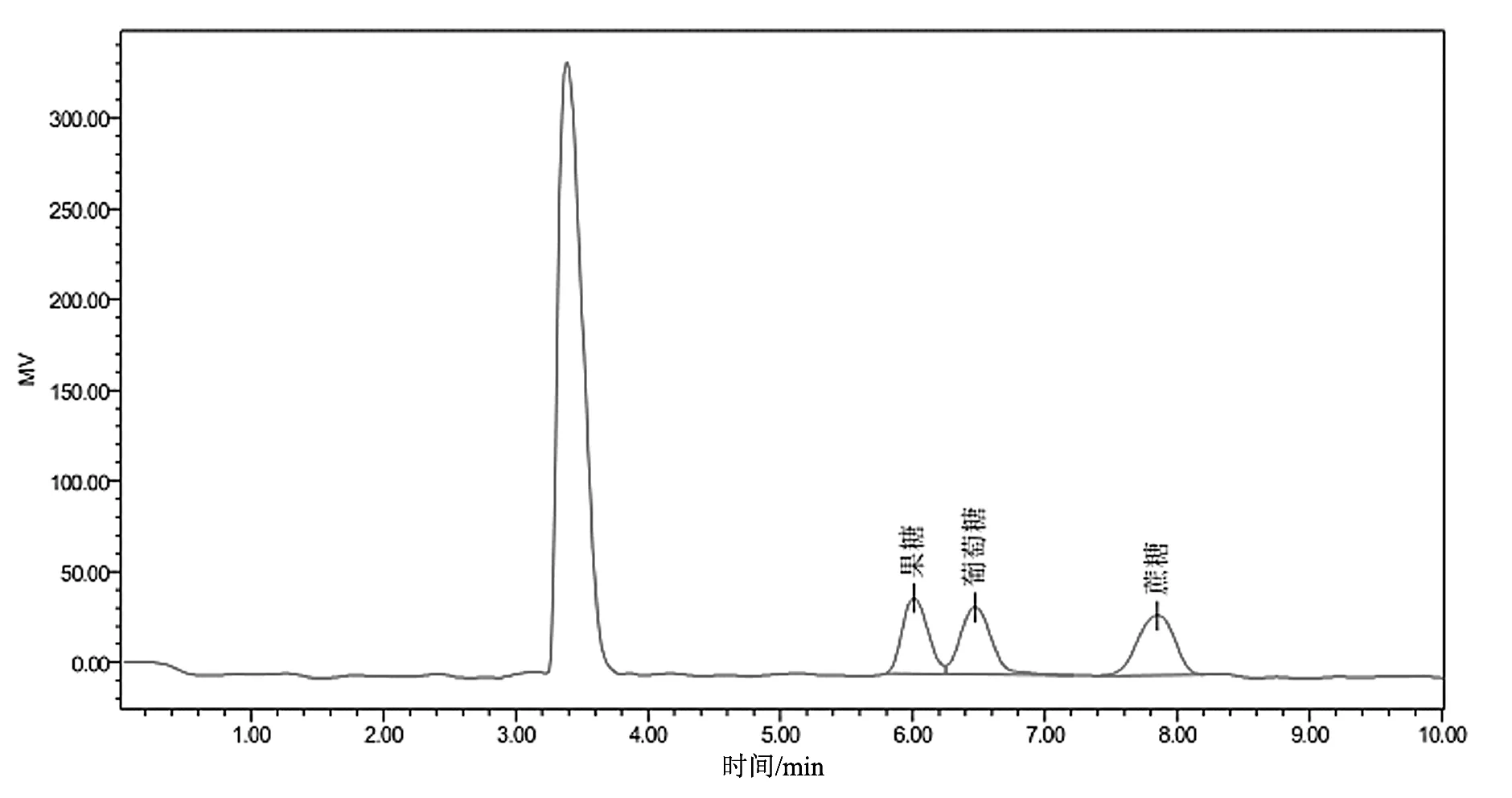
图2 掺糖样品色谱图
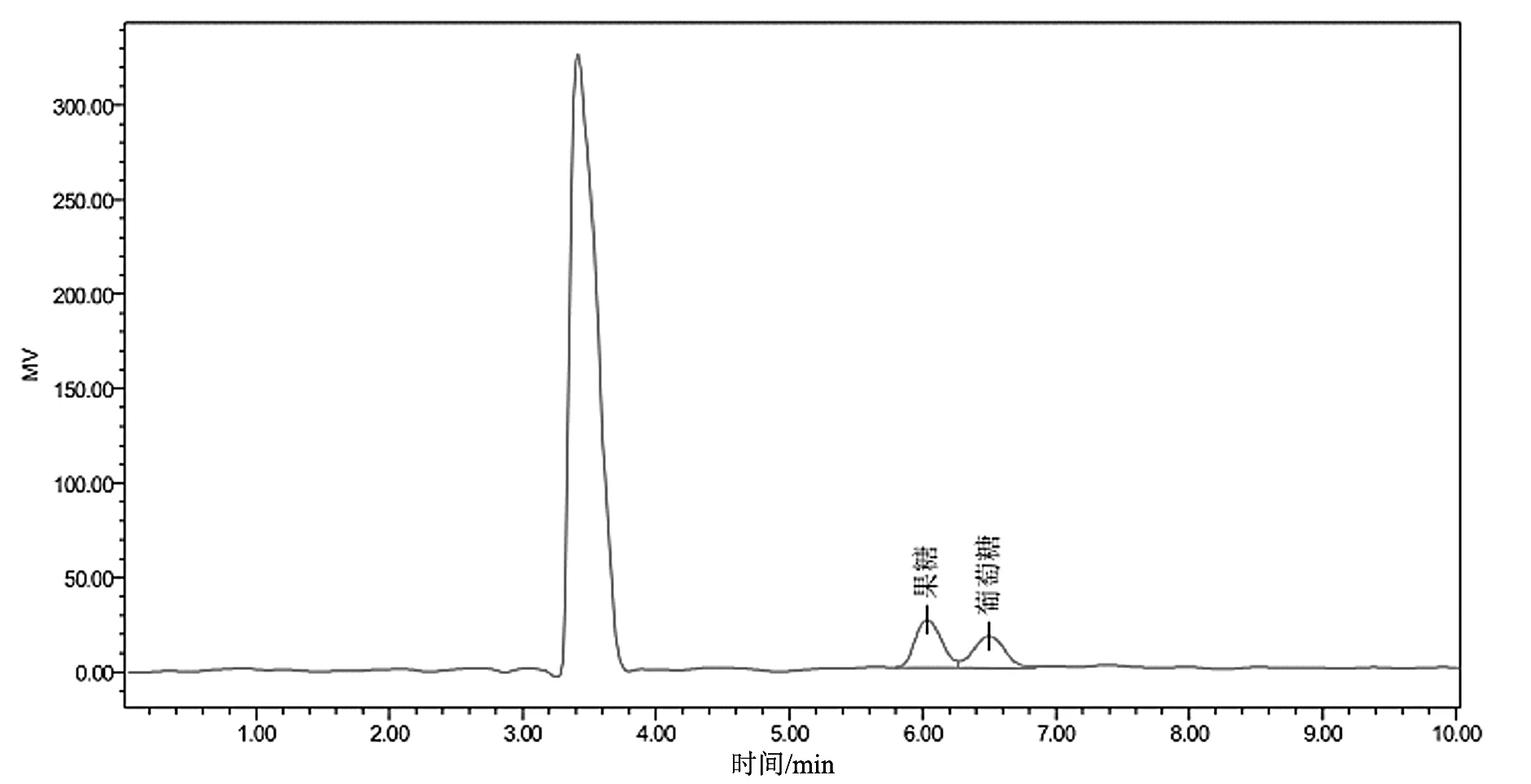
图3 非掺糖样品色谱图
3.3 方法检出限和方法定量限
取“2.2.1.2”项下②号标准溶液逐级定量稀释,按“2.3”中色谱条件进样测定,分别以信噪比(S/N)为3时作为方法检出限,信噪比(S/N)为10作为方法定量限。试验结果表明,当称样量为2 g时,果糖、葡萄糖、蔗糖的方法检出限为0.08 mg/mL,方法定量限为0.25 mg/mL。
3.4 线性关系和范围
分别精密吸取“2.2.1.2”项下②号到⑦号标准工作液各10 μL注入液相色谱仪,按“2.3”项下色谱条件进行测定,分别以果糖、葡萄糖、蔗糖各成分的质量浓度X(mg/mL)为横坐标,以果糖、葡萄糖、蔗糖各成分的峰面积作为纵坐标,建立线性回归曲线。试验测得果糖的回归方程为Y=115 882.942 86X-10 648.685 71,相关系数r=0.999 74;葡萄糖的回归方程为Y=138 564.342 86X-16 217.885 71,相关系数r=0.999 53;蔗糖的回归方程为Y=90 760.071 43X-23 984.142 86,相关系数r=0.999 91。试验结果表明果糖、葡萄糖、蔗糖在0.5~20.0 mg/mL质量浓度范围内线性关系良好。
3.5 精密度测定
取“2.2.1.2”项下⑤号标准溶液,按“2.3”项下的色谱条件重复进样6针,考察仪器的精密度。试验结果显示,重复6次进样果糖、葡萄糖、蔗糖3个成分峰面积的RSD(n=6)分别为1.53%,1.71%,1.26%,表明仪器精密度良好。
3.6 加标回收率试验
称取批号为SP01的蜂蜜样品9份,每份2 g精密称定。分别在9份样品添加低、中、高三种浓度水平的标准品,每个添加水平3个样品进行试验。上述样品按“2.1.2”项下方法制备,按“2.3”项下的色谱条件测定,计算每份样品中果糖、葡萄糖、蔗糖的加标回收率。试验测得低、中、高三种添加水平的样品的平均加标回收率为88.93%~103.94%,RSD=0.37%~1.78%(n=9),表明该方法测定果糖、葡萄糖、蔗糖的准确度良好。结果见表1。
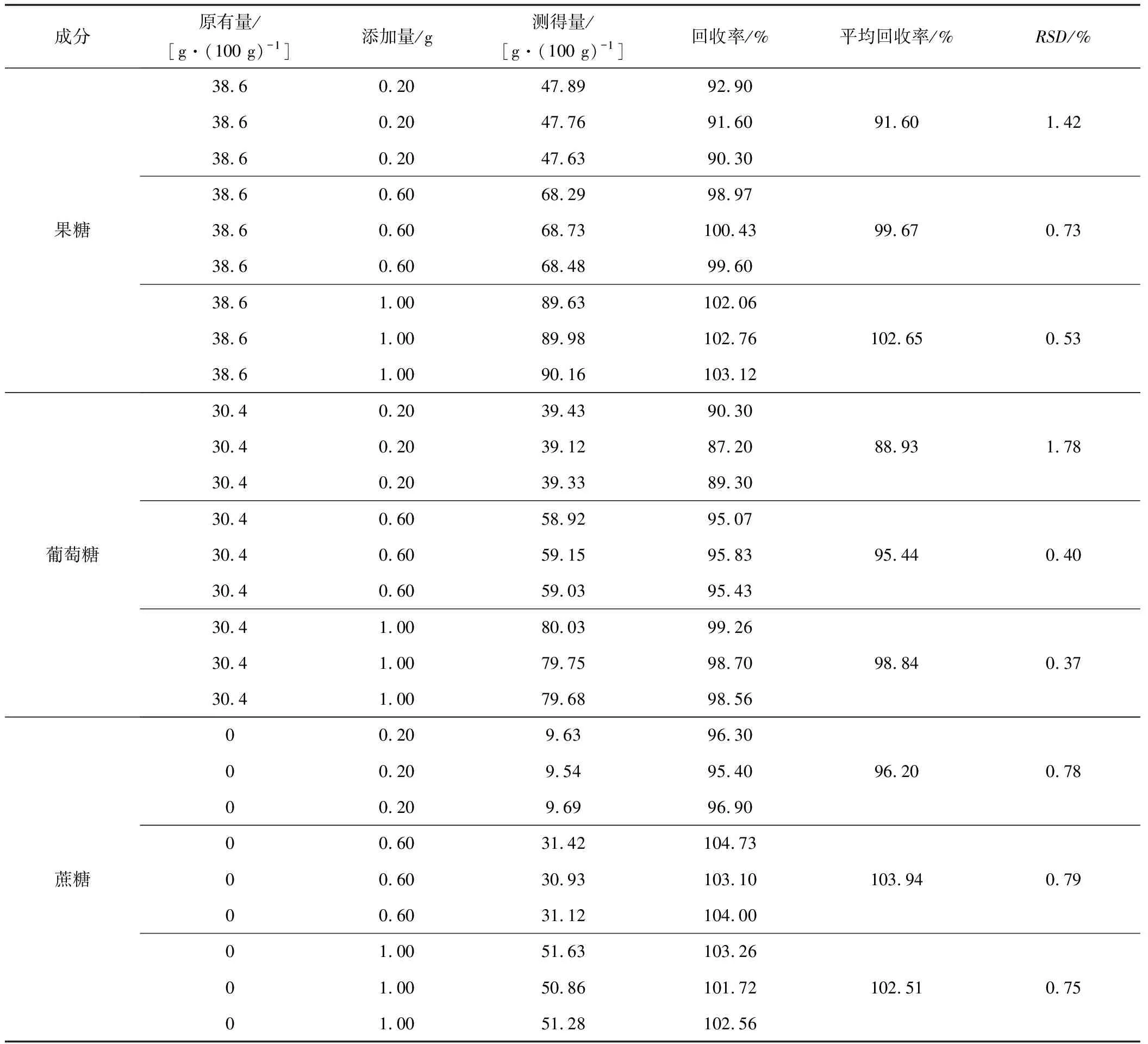
表1 回收率试验结果(n=9)
4 样品测定
利用该方法对10个批次的蜂蜜样品进行果糖、葡萄糖、蔗糖3个成分含量测定,每批样品进行2次平行试验以平均值作为测定结果。10批次蜂蜜样品果糖、葡萄糖、蔗糖各成分含量测定结果见表2。
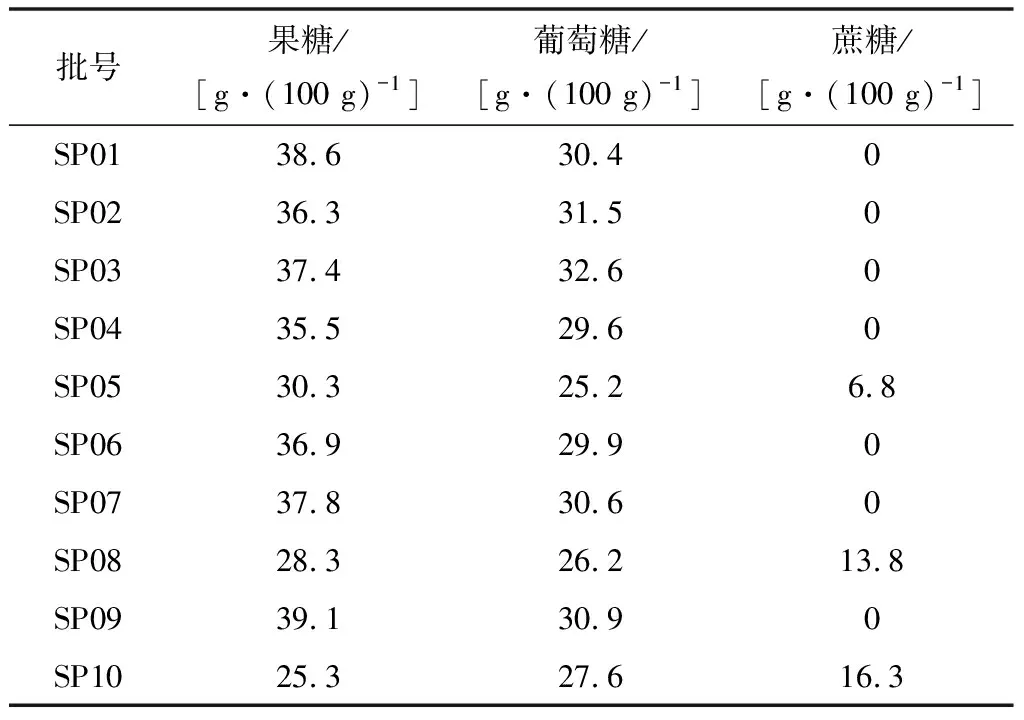
表2 样品含量测定结果
5 讨论
5.1 液相色谱条件的改善与优化
本试验中选择了不同类型的色谱柱对蜂蜜中果糖、葡萄糖、蔗糖3种还原糖成分进行分离效能测试,测试结果表明氨基色谱柱能较好地实现果糖、葡萄糖、蔗糖3种还原糖成分的分离,氨基色谱柱是分离还原糖成分较为理想的色谱柱类型。试验还对流动相比例和色谱柱温度进行了考察和试验,结果表明提高乙腈的比例和升高色谱柱温度对增大3种还原糖成分的分离度有一定作用,而且将乙腈和水按比例混合后单通道系统比使用仪器四元泵按比例双通道洗脱更容易使基线平稳。示差折光检测器的基线比较难稳定和平衡,基线不稳定直接影响积分与定量,因此使用示差折光检测器检测时,用流动相平衡仪器8 h以上再进样,能使基线更为平稳。综合各方面因素,本试验通过对色谱条件的尝试和优化,探索出了较为理想的同时测定蜂蜜中果糖、葡萄糖、蔗糖3种还原糖成分的液相色谱条件,即选用NH2色谱柱(250 mm×4.6 mm×5 μm),柱温:45 ℃,检测池温度:40 ℃,流动相:V乙腈∶V水=75∶25,流速:1.0 mL/min,等度洗脱的色谱条件,果糖、葡萄糖、蔗糖能有效分离和准确定性定量,色谱峰对称性较好,分析时间适宜,该色谱条件稳定、可靠,是液相色谱法测定蜂蜜中果糖、葡萄糖、蔗糖3种还原糖成分含量较为理想的色谱条件。
5.2 结果与小结
建立的方法能较好实现蜂蜜中果糖、葡萄糖、蔗糖3种还原糖成分的分离和定量。试验对10个批次的蜂蜜样品进行检测,测得7个批次的样品没有掺糖造假行为,果糖和葡萄糖的含量总和均大于60 g/100 g,有效成分指标能满足国家标准的要求;3个批次的样品检测出了蔗糖成分,说明蜂蜜中掺糖造假的现象依然存在,必须对蜂蜜的质量进行严格监管和质量把关。本研究在优化色谱条件的基础上,验证了该方法的线性关系、精密度、加标回收试验,方法验证结果较为满意,得到了较好的准确度。该方法样品前处理操作简单,测定结果准确可靠,可用于蜂蜜中果糖、葡萄糖、蔗糖含量的同时测定。
