基于天然材料的自愈水凝胶伤口敷料研究进展
2023-09-05李容恺齐钦兵王春华李诚博
李容恺,齐钦兵,王春华,李诚博
(滨州医学院 药学院(葡萄酒学院),山东 烟台 264003)
皮肤是人体与外界环境之间的主要物理屏障,对维持身体健康有着重要的作用,因此皮肤损伤会引发潜在的健康问题。根据受伤皮肤的层数和面积,将受伤皮肤分级为浅表伤、局部厚度伤和全厚度伤。而伤口愈合是一个连续的过程,包括一系列复杂的生化级联反应,经历了四个主要阶段:稳态、炎症、增殖和成熟[1]。无论是小伤口还是大溃疡,妥善处理伤口是很重要的。理想的敷料应能保护创面免受再次的外部损伤,还能促进创面的愈合,防止细菌感染、促进伤口愈合、促进血管生成和减少瘢痕等[2]。传统的伤口敷料产品,如纱布和绷带,只能提供一定的物理保护,缺少抗菌的有效手段,并且一旦被吸收的渗出液干透,往往会附着在伤口创面上,在换药过程中因粘连而造成继发性损伤。
水凝胶是由具有较多极性官能团的亲水聚合物交联组成的三维网络,在生物医学领域具有很大的应用前景,一方面水凝胶因为其三维网络结构可以在水中充分溶胀而不溶解即保持原有形态,而且可以搭载并释放药物[3];另一方面具有良好的生物相容性,甚至与部分活性组织相似,也不会影响到人体的代谢过程,可以作为理想的伤口愈合材料[4]。因此,水凝胶在伤口治疗过程中能够发挥出其出色的促进愈合的作用,可以作为屏障直接保护伤口,避免伤口被细菌真菌感染或者是二次创伤[5]。其中基于天然产物制备水凝胶具有优异的生物相容性、良好的渗透性和低毒性,因此可以完美地作为天然细胞外基质(ECM)的模拟物,并作为大量亲水性物质(包括细胞因子或核酸)的载体[6]。
越来越多的水凝胶被设计成负载药物或活性分子,在保护伤口的同时,还减少炎症反应,促进伤口的愈合[7]。但是,限制传统水凝胶长期应用的一个重要特性是较弱的机械耐久性。日常身体运动可能会破坏水凝胶的网络结构,从而缩短水凝胶的使用周期。而自愈合水凝胶能够在一定程度上实现结构和功能的重建,从而提高其使用效率,延长其使用周期[8]。
自愈水凝胶是一类无需外界干预就能自动修复损伤的智能材料,与传统水凝胶相比,自愈水凝胶中具有可逆性的动态连接[9],在其网络破裂时,可以在不影响功能的情况下恢复其原有结构[10]。自愈水凝胶作为细胞或药物载体直接注射到受损组织中[11],或作为组织样结构三维(3D)打印的生物油墨[12],因此,自愈水凝胶在伤口敷料方面具有广阔的应用前景。本文就自愈水凝胶伤口敷料的研究进展作一综述。首先,讨论了广泛应用于创面敷料的天然材料聚合物,系统地阐述了自愈合的机理,介绍了自愈合水凝胶敷料在各种伤口上的应用及功能的分类。最后,本综述对伤口敷料自愈水凝胶的未来发展提出了新想法。
1 天然生物活性材料
大多数天然生物活性聚合物是形成身体基质的一部分,或是其中含有参与伤口愈合过程的活性成分。天然生物活性聚合物因其良好的生物相容性和可生物降解性而常用作伤口敷料[13],主要用作水凝胶敷料的天然生物材料包括海藻酸钠(SA)、壳聚糖(CS)、明胶和透明质酸(HA)。
1.1 海藻酸钠
海藻酸盐(图1)是从棕色海藻中获得的阴离子线性多糖,由1,4-连接的β-D-甘露糖醛酸盐和1,4-L-α-葡萄糖酸盐残基以不同比例组成[14]。当与钙等二价离子相互作用产生交联,可以形成机械性能较强的离子水凝胶[15]。由于海藻酸钠具有良好的生物相容性,广泛应用于伤口愈合敷料。其中,海藻酸钠类伤口敷料以水凝胶、薄膜、纳米纤维和海绵等形式生产[16]。

图1 海藻酸钠结构式
Wang等人[17]以海藻酸钠和氧化淀粉交联明胶为原料,通过湿法纺丝工艺成功制备了海藻酸钠/明胶共混水凝胶纤维。通过扫描电镜(SEM)观察海藻酸/明胶水凝胶纤维的结构、表面形态。而机械性能测试、吸水和保水性能测试验证了具有良好的机械、吸水和保水性能。这些海藻酸盐/明胶共混水凝胶纤维可能在生物医学领域有潜在的应用。
1.2 壳聚糖
壳聚糖(CS)(图2)是一种天然多糖,由几丁质的N-脱乙酰化衍生,从螃蟹,虾等甲壳类动物的外骨骼中制备。由于其生物相容性、血液相容性、生物可降解性以及止血、抗菌特性都十分优异,所以CS对伤口愈合具有积极作用[18]。CS可溶于稀含水酸性介质,因为其伯氨基的pKa值为6.3,这是限制其使用的一个主要问题[19]。在CS结构中引入小的化学基团,如羧甲基,可以大大提高CS在中性条件下的溶解度和抗真菌性,从而拓宽其应用范围[20]。
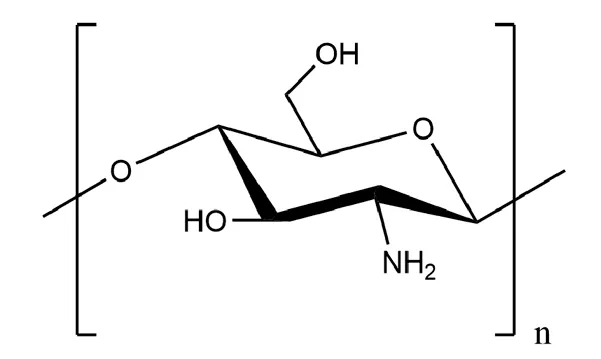
图2 壳聚糖结构式
天然多糖的可生物降解和可注射水凝胶由于其最小的侵袭性和适应不规则伤口表面的能力而在生物医学应用中引起了广泛关注[21]。Li等人[22]报告了由N,O-羧甲基壳聚糖(N,O-CMC)和氧化硫酸软骨素(OCS)的混合物衍生的原位注射、自愈、抗菌、止血和生物相容性水凝胶的开发,该水凝胶不需要任何化学交联,依赖于N,O-CMC的-NH-官能团和OCS的-CHO官能团之间的席夫碱反应。实验结果表明,N,O-CMC2/OCS1水凝胶具有较长的凝胶化时间和稳定的性能。水凝胶提取物培养的NIH3T3细胞和内皮细胞的存活率约为85%,细胞毒性较低。此外,N,O-CMC2/OCS1水凝胶由于N,O-CMC固有的抗菌能力而显示出优异的抗菌性能。水凝胶紧密粘附于生物组织,显示出优异的体内止血性能。
1.3 明胶
天然生物聚合物明胶(图3)通过水解胶原蛋白获得,作为一种天然蛋白质衍生材料,经常被用于制备医用水凝胶,由于其良好的生物相容性、非免疫原性、优异的生物降解性和促进细胞黏附的能力而被广泛应用于伤口敷料和组织工程[23]。明胶水凝胶的功能化是研究和临床应用的热点。通过贻贝启发的化学反应制备明胶基粘合剂水凝胶。通过大鼠肝出血模型用于评估明胶基粘合剂水凝胶的止血潜力,结果表明,明胶基粘合剂水凝胶在组织粘合剂、伤口敷料和可穿戴设备中具有很大潜力[24]。

图3 明胶的结构式[23]
Han等人[25]通过贻贝启发化学制备了一种新型明胶基粘合剂水凝胶。明胶首先被多巴胺功能化,形成多巴胺接枝明胶(GelDA),再与1,4-亚苯基双硼酸和氧化石墨烯(GO)混合后,通过H2O2/HRP催化体系获得GelDA/GO水凝胶。基于水凝胶的自愈合和组织黏附,在大鼠肝出血模型中显示了止血性能(图4)。此外,GO的加入赋予了导电性并增强了GelDA/GO水凝胶的机械性能,使GelDA/GO水凝胶在组织粘合剂、伤口敷料和可穿戴设备中都具有潜在的应用价值。

图4 GelDA/GO水凝胶的大鼠肝出血模型的止血能力[25]
同时,可注射明胶基水凝胶由于其细胞外基质样性质可通过交联程度调节,是药物和细胞递送的有价值工具。研究人员使用含酸酐的低聚物,用于通过酸酐-胺共轭交联明胶制备出可注射水凝胶,其水凝胶的交联度和硬度由组成成分的比例控制,这种凝胶有望成为可注射药物或细胞的载体以及生物墨水[26]。
1.4 透明质酸
透明质酸(图5)是一种高分子量阴离子多糖,来源于糖胺聚糖家族。透明质酸作为人类结缔组织的主要成分之一,也参与组织修复[27]。并且由于其修饰位点众多,可通过接枝、与反应性基团连接进行修饰。作为伤口敷料水凝胶,可以模拟由胶原和HA组成的细胞外基质,在治疗伤口时,透明质酸水凝胶在促进血管系统和胶原形成方面表现出优异的性能[28]。
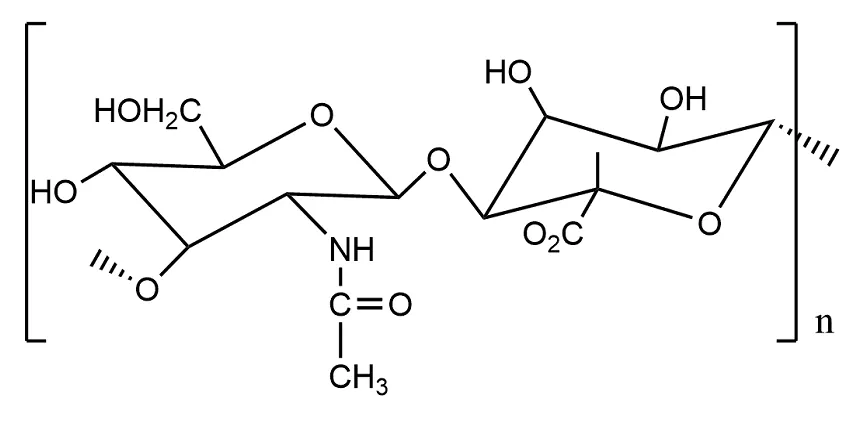
图5 透明质酸结构式
Yang等人[29]开发了一种基于硫醇改性聚(γ-谷氨酸)(γ-PGA-SH)和氧化透明质酸(HA-CHO)的仿生细胞外基质(ECM)水凝胶。γ-PGA-SH中的硫醇和HA-CHO中的醛基的快速可逆硫醇醛加成反应为水凝胶提供了动态共价网络,并赋予其适应性和自愈能力,这些水凝胶还显示出与天然ECM相似的典型粘弹性特征、体外和体内降解性能以及自由基清除能力。此外,可以通过调节聚合物含量来调节水凝胶的流变行为、力学性能、多孔结构和降解过程。此外,与商业敷料(Tegaderm TM)相比,ECM激发的水凝胶通过促进血管生成和促进胶原沉积,在全厚度皮肤缺损模型中显著促进了体内伤口愈合。
2 自愈性原理
选择具有自愈性的合适的材料,避免使用后不可修复的损坏,可最大限度地延长其使用寿命。由于内部化学键的自发重组,自愈合材料在没有任何刺激的情况下可以实现自愈。本节简单概括了常见的可逆键和应用实例,包括化学共价相互作用,包括亚胺键、酰基腙键、二硫键、Diels-Alder反应或配位键,也可以利用物理非共价相互作用,如氢键、疏水缔合、π-π堆积或主-客体相互作用[30]。
2.1 化学交联
2.1.1 亚胺键(希夫碱)
亚胺键是由胺和醛基缩合形成的动态共价键,通常称为希夫碱,可以通过亚胺键的断裂和再生为水凝胶提供自愈合能力。希夫碱是少数可以在没有刺激的情况下形成的动态共价反应之一[31]。希夫碱水凝胶进行宏观自愈实验和流变学测试。此外,在水凝胶网络受损后,由于亚胺键在碎片界面上的移动,重新链接,水凝胶的应力快速恢复到原始状态,使水凝胶具备了优异的自修复性能[32]。
Guo等人[33]设计了一种特殊设计的水凝胶,具有针对难治性伤口特征的智能靶向性,用于治疗慢性感染的糖尿病伤口。胺化明胶与氧化葡聚糖反应,形成与动态希夫碱交联的水凝胶,该水凝胶对难治伤口的低pH环境敏感。将纳米ZnO加载到水凝胶中以杀死微生物。具有ROS响应特性的芍药苷包封胶束通过席夫碱键固定在水凝胶骨架上,以获得低pH值和ROS刺激的血管生成活性。新型水凝胶的顺序反应性使难治性伤口中有害微环境的智能救援成为可能。这种高度生物相容性的水凝胶在体外表现出抗菌和血管生成能力,并通过顺序止血、杀死微生物和血管生成活性显著促进慢性感染糖尿病伤口的愈合。
2.1.2 酰基腙键
与醛或酮的反应可以产生可逆的酰基腙键,类似于亚胺键,也可以发生水解和交换反应,它是一种温度和pH敏感的自愈合效率高的化学共价键[34]。一旦网络被破坏,断裂面上的酰基腙键断裂成酰基和醛基,游离酰基和醛基又会自动反应形成新的酰腙键。酰腙键在温和的酸性环境中很容易形成,因此通过改变酸度可以实现溶胶-凝胶转化,可用于药物递送。然而在温和酸性条件下保持稳定的酰腙键也限制了它们在体内的应用(pH值7.4)[35]。
Hua等人[36]通过酰肼化学合成了含酮基团的共聚物并制备成动态共价水凝胶。通过共聚物的动态共价交联和iota-卡拉胶的超分子相互作用构建了双网络水凝胶。双网络和母体水凝胶的拉伸试验表明,成功构建了强韧水凝胶。将双网络水凝胶前体湿法纺丝以获得具有受控拉伸比的宏观纤维。所得纤维达到了1.35 MPa的高强度或1.22 mJ/m3的大韧性。水凝胶纤维及其大块试样中观察到了高效的自愈合性能。通过在酸性和加热条件下共价和超分子网络的同时愈合,纤维以96%的效率实现了快速和接近完全的愈合。这种自修复和超韧性水凝胶纤维被用作形状记忆纤维,用于响应水的重复驱动,表明其在智能织物中的潜力。
2.1.3 二硫键
二硫键分子间作用力键很强,但在光照射下易于交换。硫化学用于制备氧化还原敏感的溶胶-凝胶系统,该系统具有自由基机制:二硫键可以与硫醇反应,再次生成二硫键和硫醇[37]。Cao等人[38]受角蛋白是一组来源于皮肤和皮肤附属物的天然蛋白质,具有丰富的半胱氨酸残基,以二硫键的形式存在的启发,通过将分子内二硫键转化为分子间二硫键,利用简单的二硫键转移策略开发角蛋白水凝胶(图6)。为了实现这一点,分子内二硫键首先被还原试剂(如半胱氨酸)切割,以释放自由巯基,该自由巯基通过硫醇氧化形成分子间二硫键。研究表明,控制半胱氨酸水平导致可调的二硫化物交联密度,从而改变网络结构、凝胶降解和药物释放速率。此外,由于在制备过程中避免了额外的化学交联剂,该策略使材料具有良好的生物相容性。此外,由于基于二硫键的网络结构,这种角蛋白水凝胶在凝胶降解和药物释放方面具有氧化还原响应能力,在组织工程和药物释放中具有广泛的适用性。

图6 角蛋白水凝胶的交联示意图[38]
2.1.4 Diels-Alder可逆键
由共轭二烯和亲二烯形成的热可逆Diels-Alder(DA)环加成在加热时可以分离并达到新的平衡。该反应因其良好的热可逆特性和简单的反应条件而得到广泛应用[39]。有研究报道,通过Diels-Alder反应制备了一系列自愈合果胶/壳聚糖水凝胶用于药物递送,且具有良好的自愈合性和pH响应性能[40]。其研究用糠醛对果胶进行改性,得到共轭二烯部分。将6-马来酰亚胺基己酸接枝到壳聚糖上合成了亲双烯部分。然后将呋喃改性果胶(PF)和马来酰亚胺改性壳聚糖(CA)混合,通过Diels-Alder反应制备杂化水凝胶(图7)。通过果胶/壳聚糖复合水凝胶作为对比,可以看出Diels-Alder反应大大提高了水凝胶的交联密度。自愈合实验显示了优异的自愈合性能。在不同的溶胀介质中,溶胀比发生了显著变化,表明溶胀性能、pH值和热响应性良好。载药和释放研究显示了高载药效率和缓释性能,细胞毒性试验显示了良好的细胞相容性和高细胞增殖率。

(a)呋喃改性果胶的合成;(B)马来酰亚胺改性壳聚糖;(C)通过D-A反应制备杂化水凝胶[40]
2.1.5 配位键
配位键是一种特殊的共价键。当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键。配位键可以自发形成,因此被利用于自愈水凝胶的制备[41]。
有文献报道,制备可快速形成具有自愈合和可注射羧甲基壳聚糖水凝胶伤口愈合敷料,对小鼠的全层皮肤伤口具有较好的促进愈合效果。通过加入三价铁离子的方式,与羧甲基壳聚糖快速形成配位键,实现交联形成自愈合水凝胶,同时具备较好的自愈合效率和生物相容性,并可以对伤口进行有效止血。如今壳聚糖被越来越广泛应用于伤口敷料,并不断开发出新的功能和效果[42]。
Liang等人[43]通过铁离子与邻苯二酚的配位键和原儿茶醛的醛基和壳聚糖氨基形成希夫键的双动态键交联设计了一系列具有良好性能的抗菌自修复水凝胶(图8),含有儿茶酚和醛基的原儿茶醛(PA)和季铵化壳聚糖(QCS)能够封闭皮肤切口并可以促进耐甲氧西林金黄色葡萄球菌(MRSA)感染的伤口愈合。邻苯二酚交联铁离子和希夫碱键的双动态键的可逆断裂和再形成使水凝胶具有优异的自愈合和按需溶解或去除性能。在大鼠皮肤切口模型和感染的全层皮肤伤口模型中进行的体内评估显示了智能水凝胶的高伤口闭合有效性和伤口闭合后护理,证明了其在处理感染的皮肤伤口方面的巨大潜力。
大概是人以群分,许诺从小到大,身边都是些好看的姑娘,他也从来不掩饰自己的“肤浅”,如果连脸都看不下去,又怎么能产生感情?

(a)季铵盐壳聚糖的合成;(B)配位键原理示意图;(C)大鼠全层皮肤伤口的应用[43]
2.2 物理交联
2.2.1 疏水缔合
当疏水链引入亲水聚合物链时,由于疏水相互作用,它们往往自发聚集在一起形成三维网络结构[44]。开发同时具有良好机械性能、可靠自愈合性能和重塑能力的水凝胶仍然是一个巨大的挑战[45]。受具有优异机械性能和自修复性能的生物软组织的启发,Chen等[46]通过P(S-AA)核壳纳米粒子和聚合物链之间的非共价氢键相互作用以及疏水链的缠结,从紧凑的均质聚合物网络合成了坚韧、自愈合和重整的核壳纳米粒子复合疏水缔合水凝胶(MHA凝胶)。通过丙烯酰胺(AAm)和丙烯酸硬脂酯甲基酯(SMA)的原位自由基胶束共聚合成了MHA凝胶。系统讨论了凝胶强度和自愈合效率与P(S-AA)核壳NPs含量的关系,结果表明,MHA凝胶具有较高的拉伸强度(405 kPa)、压缩强度(1.24 MPa)和良好的自愈合率(77%)。在应力下,动态物理键(包括聚合物链和P(S-AA)核壳纳米颗粒(NPs)之间的氢键)和疏水链的缠结被破坏,以有效耗散能量,均匀的水凝胶网络导致平滑的应力传递,这使得核壳纳米颗粒复合疏水缔合水凝胶(MHA凝胶)具有优异的力学性能,例如优异的机械性能、韧性和延展性,以及良好的自愈合性能。自修复后,MHA凝胶仍具有相当高的机械性能。这些特性使得MHA凝胶在生物医学应用中具有巨大潜力,如组织工程、关节软骨和人工皮肤。
此前大多数疏水缔结水凝胶是通过交联剂实现疏水缔合的,而研究人员通过一种生物启发策略,通过将疏水相互作用作为牺牲键结合到海藻酸盐离子网络中来制备基于丝素蛋白的疏水相互作用(HA)水凝胶[47],这不仅增强了水凝胶的机械延展性、强度和韧性,而且还能够在室温下通过可逆疏水相互作用实现自恢复和自愈性质,而无需外部刺激。疏水相互作用体系由疏水单体甲基丙烯酸硬脂酯(C18M)和两亲性再生丝素蛋白(RSF)溶液组成。机械测试和流变仪表明,疏水相互作用起到了牺牲键的作用,在外部负载下,在海藻酸盐离子网络之前优先断裂,这消耗了大量能量,并提高了机械性能。此外,由于疏水相互作用的存在,注射后HA凝胶的结构可以快速恢复。此外,HA凝胶在蛋白酶XIV溶液中的降解性强烈依赖于C18M组分,这显著提高了HA凝胶的降解速率。体内实验表明,HA凝胶表现出令人满意的生物相容性,小鼠成骨细胞可以附着并扩散到水凝胶上。总的来说,具有自愈合性、生物相容性和高机械性能的HA凝胶可用于药物输送或其他软组织工程。
2.2.2 氢键
氢键是形成生物系统二级和三级结构的最重要的物理相互作用之一。由质子化程度和使极性官能团质子化的化学环境决定的这种分子间相互作用将赋予软材料自愈性能[48]。
Li等人[49]制备了多氢键增强的聚(丙烯酰胺-co-2-乙烯基-4,6-二氨基-2-乙烯-1,3,5-三嗪)/单宁酸(P(Am-co-VDT)/TA)水凝胶。结果表明,制备的水凝胶具有两种类型的氢键交联区域:聚合物链上二氨基三嗪(DAT)部分和TA-邻苯三酚/邻苯二酚基团之间的氢键“软”区域,以及由DAT部分自身形成的氢键的“硬”区域。硬交联区显示出明显高于软交联区的活化能。这种双重物理交联网络以协同方式显著增强水凝胶的机械性能。因为存在多氢键,水凝胶具有良好的pH敏感性和在几分钟内对形状记忆的快速响应(图9)。这些水凝胶具有高机械强度、优异的形状记忆行为和对抗炎药物的吸附能力,在生物医学、组织工程和医疗材料领域具有诱人的应用前景。
2.2.3 主-客体相互作用
主-客体化学描述了大环化合物、基于大空腔的主体分子和一个或多个形状匹配的客体分子之间的复杂相互作用。这些超分子水凝胶的物理化学性质可以通过选择合适的主体来调整[50]。超分子和动态生物材料有希望概括天然细胞外基质(ECM)的时间依赖性特性和刺激响应性。主客体化学是研究最广泛的超分子键之一,但主体的结合特性-相关生物材料中的客体复合物(β-CD/金刚烷)主要集中于单一宿主-客体相互作用或非分散多价悬垂聚合物[51]。 Ooi等人[52]通过研究了多价宿主的逐步协同效应-形成动态生物材料的客体相互作用,表明了一系列多价金刚烷(客体)交联剂是如何影响整体结合亲和力和与海藻酸盐CD(Alg-CD)形成超分子网络的能力(图10)。较高的多价交联剂能够形成水凝胶;通过在交联剂中加入苯基间隔物,观察到结合和凝胶化的增加。将用CD官能化的海藻酸盐与不同价的不同PEG-ADA交联剂混合,以创建动态交联材料库。初步筛选表明,只有将Alg-CD与8臂多价客体交联,才能形成稳定的凝胶。这些材料有望向细胞和小分子递送平台发展,并允许对网络特性进行离散和微调。

图10 主客体匹配示意图[52]
3 伤口应用
类似于关节伤口,糖尿病创面,烧伤创面等复杂的伤口往往不同于简单的皮肤表面创伤。由于创面面临更复杂的外界条件和内部状况,对于创面敷料的要求更高,普通敷料往往难以胜任复杂伤口的治疗,而自愈合水凝胶创面敷料通过赋予多种功能,可以解决复杂创面所带来的多种问题。本节简单阐述了自愈合水凝胶在不同复杂伤口中的应用。
3.1 关节伤口
设计具有优异治疗效果、自愈合性、粘附性和适当机械性能的伤口敷料在医疗保健,尤其是关节皮肤伤口愈合方面具有重要的现实意义。Qu等人[54]设计了一种具有多种功能的自愈注射胶束/水凝胶复合材料,用作关节皮肤损伤的伤口敷料。通过在一个系统中结合动态希夫碱和共聚物胶束交联,通过在生理条件下混合季铵化壳聚糖(QCS)和苯甲醛封端的Pluronic®F127(PF127-CHO),制备了一系列水凝胶。研究了伤口敷料的固有抗菌性能、pH依赖性生物降解和释放行为,以证实伤口敷料具有多种功能。水凝胶敷料显示出合适人体皮肤的拉伸和压缩性能以及良好的粘附性和承受变形的快速自愈能力。
3.2 糖尿病创面
糖尿病皮肤溃疡是糖尿病的严重并发症之一,发病率高,可导致死亡或致残[55]。据之前文献报道[56],利用壳聚糖、丝素蛋白和PRP的复合材料制备了一种自修复和可注射水凝胶(CBPGCTS-SF@PRP)用于促进糖尿病伤口愈合。富含血小板的血浆由于其衍生的生长因子(GFs)的作用而广泛用于治疗糖尿病伤口。然而,GFs的半衰期相对较短,限制了其在临床上的应用。此外,糖尿病伤口微环境中大量蛋白酶的存在导致GFs降解,进一步阻碍血管生成和糖尿病伤口愈合。CBPGCTS-SF@PRP可保护PRP免受酶水解,持续释放PRP,可以增强间充质干细胞的趋化性。结果表明,它能促进体外修复细胞的增殖。此外,它可以通过加速2型糖尿病大鼠模型和大鼠皮肤缺损模型中的胶原沉积、血管生成和神经修复来促进伤口愈合。这项研究将为临床上糖尿病不愈合或难愈合的伤口提供一种新的治疗方法。
3.3 烧伤创面
烧伤是最具破坏性的皮肤创伤之一,每年造成180 000多人死亡。大面积不规则烧伤伤口的患者愈合缓慢[57]。动态烧伤伤口由于其高频运动而对水凝胶敷料有特殊要求。为了适应动态烧伤创面的治疗,研究人员设计了一种双交联水凝胶,由希夫碱和邻苯二酚-Fe3+螯合键制备[58]。该水凝胶的双交联结构导致更好的物理化学性质和治疗效果。提升的理化性能比如更快的凝胶化时间,增强的粘合强度和更好的自愈性,可以使水凝胶更容易贴合动态伤口,尤其是自愈性使水凝胶适用于形状不规则的伤口。水凝胶不仅在伤口愈合过程中表现出具有优异的抗菌活性和止血性能,而且可以促进细胞繁殖和迁移。细胞毒性划痕实验的结果表明,水凝胶促进细胞的迁移能力(图11)。可见自愈合水凝胶是一种很有前途的烧伤创面动态敷料。

(a)细胞毒性;(b)细胞迁移;(c)细胞增殖
可见自愈合水凝胶伤口敷料适合于多种情况复杂的伤口,水凝胶被赋予的多种功能也可以保护伤口,减少感染和炎症反应,促进伤口的愈合,可注射性也可以使水凝胶更贴合伤口,有利于水凝胶功效的发挥,未来通过拓展水凝胶更多的功能,也将可以胜任于更复杂的伤口,比如深层创面,大出血伤口等。
4 水凝胶用途分类
水凝胶可以通过改性、接枝、搭载等多种方式,赋予水凝胶多种功能等。通过对水凝胶近几年常见的用途进行简单的归类,并讨论了一些未来发展的趋势和方向。目前热门的用途是抗菌敷料,细胞/药物递送载体,还有3D打印材料、生物胶水等,本节对近几年代表性的研究进行了汇总。
4.1 自修复抗菌敷料
伤口治疗中最关键的问题是愈合过程中的感染控制,这是水凝胶广泛用于防止细菌渗透的一个重要原因。然而,没有弹性的水凝胶会因外部机械力而遭受一些变形或损坏,导致水凝胶破裂,破坏了保护屏障的完整性,并导致细菌到达伤口区域。因此,开发具有抗菌能力的自修复敷料材料在该领域是非常必要的[34]。Zhao等人[59]开发了一系列可注射季铵化壳聚糖-g-聚苯胺和苯甲醛官能团水凝胶。聚(乙二醇)-聚(癸二酸甘油酯)作为抗菌、抗氧化和电活性敷料用于皮肤伤口愈合。这些水凝胶具有良好的自愈合性、电活性、自由基清除能力、抗菌活性(图12)、粘附性、导电性、溶胀比和抗微生物活性以及生物相容性。抗菌-导电性-可注射水凝胶敷料依靠自我愈合能力延长了敷料的使用寿命,显著促进体内伤口愈合过程,其多功能特性,这意味着它们是全厚度皮肤伤口的最佳候选敷料。
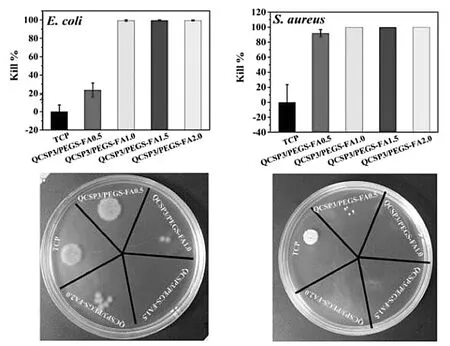
图12 水凝胶对大肠杆菌的表面抗菌活性和对金黄色葡萄球菌的表面抗菌活性[59]
4.2 温和细胞/药物递送载体
许多水凝胶被用作药物释放的载体,由于与天然ECM的结构相似,细胞也可以包裹在其中[60]。然而,当水凝胶受损时,药物突然释放导致的过度局部毒性风险是不可避免的。因此,自愈水凝胶可以在破坏后恢复,是避免药物突然释放的更好选择。
疾病微环境刺激响应性水凝胶在增强生物医学应用的药物递送特异性方面具有特殊的意义。为了在炎症区域实现特定的药物释放特性,Hu等人[61]设计了一种具有自我修复和重塑能力的智能pH和活性氧(ROS)响应性可注射水凝胶。通过将苯硼酸接枝到海藻酸盐聚合物的侧链上,获得了具有低pH和高ROS的高度特异性双响应水凝胶。此外,通过将抗生素阿米卡星(AM)和抗炎药萘普生(Nap)有效组装到胶束中,水凝胶分别具有抗菌和抗炎性能。这种水凝胶制剂不仅保持了水凝胶的结构完整性和优异的流变性能,而且允许在炎症部位的可控药物释放速率。体外抗菌实验结果表明,该水凝胶能通过释放阿米卡星有效杀灭细菌。在pH和ROS的双重反应中,水凝胶显著降低了伤口周围组织的炎症反应,并加速了伤口的愈合。这种含有抗生素和载药胶束的智能水凝胶非常有希望用于局部对抗各种微生物感染,相信这一策略也可以应用于各种疾病的治疗。
合适的药物递送载体是有效药物递送的关键。然而,对于需要长期药物输送的应用,需要改进药物在载体中的突然释放,因为药物的突然释放可能导致过度的局部毒性。因此,能够通过动态网络保持完整结构的自愈合材料是药物缓释系统的理想选择。同时,在组织工程方面,延长使用寿命的自愈水凝胶也可以支持细胞的持续生长。
Sharma等人[62]制备了新的黄原胶-聚(乙二醇)(PEG)水凝胶,由多糖、氧化黄原胶和8臂PEG肼通过动态链接、pH响应和生物可降解的腙键交联而成,并具有优异的自愈能力。MTT分析表明,氧化黄原胶和PEG肼对哺乳动物细胞(NIH-3T3)没有毒性,当质量浓度达到1 mg/mL时,细胞活性分别为84.66%和102%。包封NIH-3T3细胞的活/死试验显示没有显著的死细胞群,表明水凝胶在2D和3D培养中具有良好的相容性。当暴露于从水凝胶释放的培养基时,负载DOX的水凝胶显示出对A549细胞的细胞毒性。总体而言,此研究中开发的水凝胶可能在药物递送和细胞递送的3D细胞培养中具有潜在应用。
4.3 3D打印
3D打印是即快速成型技术的一种,又称增材制造,是一种以数字模型文件为基础,利用可粘合材料,通过逐层打印的方式来构造物体的技术[63]。
壳聚糖因其优异的生物相容性、抗菌活性、生物降解性、零毒性和低成本而作为3D打印水凝胶的生物油墨而受到广泛关注。据文献报道[64],使用酚官能化壳聚糖和二苯甲醛封端的遥螺旋聚(乙二醇)开发了壳聚糖自愈合水凝胶,可用于可注射水凝胶和可打印油墨。壳聚糖的酚官能化可以引入独特的相互作用,使水凝胶具有快速凝胶化速率、良好的自愈能力、长程临界凝胶行为以及二次可见光交联能力。水凝胶易于在注射器中预成型,以产生连续且可堆叠的细丝,成功地将负载细胞的水凝胶印刷成3D构建体。此外,壳聚糖自愈合水凝胶被开发用于模块化3D打印,其中水凝胶模块被单独打印并组装成集成结构,然后进行二次交联。多功能壳聚糖自愈合水凝胶在未来将开辟许多潜在应用,特别是在3D生物打印和模块化3D生物打印方面。
然而,3D打印壳聚糖支架缺乏足够的强度,从而限制了其在组织工程中的应用。Zhou等人[65]利用了通过该壳聚糖油墨在低温下是一种稳定的溶液,但一旦加热,壳聚糖链就会自组装,导致凝胶化的原理,开发了相应的直接墨水书写(DIW)方法来印刷高强度壳聚糖水凝胶。具体而言,将壳聚糖油墨挤出到加热的去离子水中以完成原位凝胶。控制喷嘴和热水的温度稳定,以保持印刷过程稳定,也可以直接印刷高强度和复杂的壳聚糖水凝胶结构。应用3D打印的方法制备的水凝胶印刷支架在组织工程中将具有巨大的前景和价值。
4.4 生物胶水(组织粘合剂)
手术刀口的闭合和止血问题一直是手术治疗后期不可避免的问题,因此需要开发更合适的组织粘合剂和止血剂来解决问题[66]。有研究报道通过在温和条件下原位化学交联明胶(G)和透明质酸(HA)制备了可注射水凝胶[67]。通过研究了水凝胶的流变学分析、生物相容性、组织密封和止血能力,发现自交联明胶(sc-G)和明胶/透明质酸(G/HA)水凝胶可被胰蛋白酶降解,具有良好的生物相容性。该水凝胶的组织密封能力优于对照的蛋白胶,而且止血性能良好,在临床上用作组织密封剂或外科止血剂具有巨大的长期应用潜力。
Li等人[68]利用快速且特异的Diels-Alder环加成反应,通过对壳聚糖使用无铜点击化学来制备一系列生物黏合剂。生物黏合剂的凝胶时间可以优化为小于2 min,这满足了实际手术伤口闭合的需要。通过添加四臂聚乙二醇丙醛作为共交联剂,生物胶的粘合强度优化为传统纤维蛋白胶的2.3倍。通过调整共交联剂的用量,可以调整壳聚糖生物黏合剂的溶胀率和孔径,以适应药物封装和细胞接种的需要。壳聚糖生物黏合剂在体外无明显细胞毒性。通过小鼠皮肤切口伤口模型,发现壳聚糖生物黏合剂比纤维蛋白胶能够更快地闭合伤口并促进伤口愈合。
5 期望和建议
近几十年来,用于促进组织修复,抑制微生物,减少炎症的智能伤口敷料备受关注。水凝胶由于其独特的性质,如生物相容性、高含水量、保湿性和搭载药物或细胞的控制释放,被认为是最有希望的伤口治疗敷料之一。同时,水凝胶自愈合机械损伤的能力在创伤应用中至关重要。本文简要介绍了天然材料为基础制备的自愈水凝胶敷料的主要材料,自愈原理过程,伤口应用和创新应用。总的来说,自愈凝胶有望在未来解决更多的问题。迄今为止,随着人口老龄化加重,肥胖和糖尿病病例的不断增加,患有慢性或难愈合伤口的病患数量显著增加,抗生素耐药性普遍,有些病患的伤口甚至是多重感染、深层创伤等,情况极其复杂,如何减轻患者的病痛,减少伤口感染风险已经成为临床治疗中的重中之重。
天然材料自愈水凝胶伤口敷料的功能和应用在不断地全面和完善可以通过抑制感染,减少炎症,促进细胞迁移增殖,以及增强伤口血管的形成,以缩短伤口愈合时间,减少患者的病痛。因此,在伤口敷料应用方面,具有生物活性的天然材料水凝胶值得在现有研究的基础上作进一步研究,而未来对于自愈合水凝胶新形态应用的探索将是重中之重,比如用自愈合水凝胶通过其可注射性进行3D打印或静电纺丝,新的形态将赋予水凝胶更多的优势,甚至有望解决水凝胶透气性较差的问题。此外,如何使自修复水凝胶更好应用于复杂伤口以及提高水凝胶促进伤口愈合的效率也是未来的研究重点。
