单金属Ni-MOF材料的制备及在无酶葡萄糖催化的应用
2023-09-05袁梦显汪李超李克睿张青红李耀刚侯成义王宏志
袁梦显,汪李超,李克睿,张青红,李耀刚,侯成义*,王宏志
(1.东华大学 材料科学与工程学院 化学纤维及高分子材料改性国家重点实验室,上海 201620;2.东华大学 材料科学与工程学院 先进玻璃制造技术教育部工程研究中心,上海 201620)
糖尿病作为一种慢性病,正在越来越受到当代人们的重视[1]。糖尿病患者的身体不能充分产生胰岛素或不能正确使用胰岛素。如果胰岛素不足或细胞停止对胰岛素产生反应,过量的血糖就会留在血液中。随着时间的推移,体内不能正常分解的过量的血糖不断累积,人体将会出现心脏病、视力衰弱和肾脏衰竭等严重健康问题[2],因血糖浓度异常升高引起的各类并发症也是导致糖尿病患者死亡的主要原因之一。2017年的一项新研究估计糖尿病是全球第三大主要死因[3]。因为大多数糖尿病患者无法识别糖尿病的早期征兆,而且忽视它会付出惨痛的代价,所以定期监测和灵敏检测血糖水平对于诊断和控制这种危及生命的疾病至关重要。
目前,大多数市售的电化学葡萄糖生物传感器都是以葡萄糖氧化酶作为电极修饰材料。葡萄糖氧化酶是检测血糖的首选酶[4-5],它们具有一些优势,例如灵敏的安培响应、选择性和实时检测[5]。然而,研究人员从未满足于现有技术,试图用无酶传感器取代有酶葡萄糖传感器。原因是酶传感器存在多种缺陷[6],例如酶变性、稳定性低、电极上的酶固定性弱以及酶纯化过程复杂[7]。
金属有机框架是一种新型的将金属离子和有机连接体配位形成的多孔结晶材料。其中,金属离子团簇作为接头存在,而有机配体以支柱的形式存在。配位键和分子间的相互作用力形成互相交联的网络结构[8]。其中金属离子中心被认为是驱动催化氧化反应的重要活性位点。因此,MOF的结构需要保持大的比表面积,从而促进对活性位点的访问,提高离子传输的性能。通过调整制备条件,变换配体,就可以在MOF材料制备的过程中,调整其三维框架结构,提升葡萄糖催化氧化的性能。
以镍离子为团簇,以苯二甲酸为有机配体制备了2D片层状单金属Ni-BDC MOF,利用乙腈溶剂化金属离子并控制其形态,聚乙烯吡咯烷酮控制纳米片的成核生长并驱动片层材料的组装,在120 ℃下油浴24 h,合成了镍金属有机框架化合物(Ni-MOF)。这种Ni-MOF具有了初步的葡萄糖电化学催化氧化的性能。其较高的灵敏度且较低和检测限来源于金属离子和有机配体间的协同作用。
1 实验部分
1.1 实验试剂
实验中所使用的实验试剂如表1所示。

表1 实验使用的主要试剂
1.2 实验仪器
实验中所使用的实验仪器如表2所示。
表2 实验使用的主要设备
1.3 制备方法
将0.3 g的硝酸镍前体溶解在含有10 mL的N,N-二甲基甲酰胺(DMF)和30 mL乙腈的溶剂混合物中以形成溶液A。将0.3 g H2BDC溶解在含有30 mL DMF和10 mL乙腈,然后在搅拌下将聚乙烯吡咯烷酮(PVP)添加到以H2BDC为溶质,DMF和乙腈为溶剂的混合溶液中以形成溶液B。金属前体与PVP的优化质量比为1∶3(即0.9 g PVP用于制备Ni-BDC)。接下来,将4 mL溶液A与4 mL溶液B在50 mL烧杯中混合,然后将混合物超声处理2 min。随后在不搅拌的情况下将混合溶液在135 ℃的油浴中加热24 h。将所得沉淀物以14 000 r/min离心8 min,连续用DMF和甲醇分别洗涤3次,然后在60 ℃下干燥。
2 结果与讨论
2.1 Ni-MOF的表征
通过扫描电子显微镜对Ni-MOF的微观形貌和结构进行分析。如图1(a)、(b)所示,Ni-MOF的片层状结构可以起到增大比表面积,提高活性位点数量的作用,让Ni-MOF的电催化氧化性能进一步提高。同时也为电子的传导提供了导电的通路,有利于信号输出。
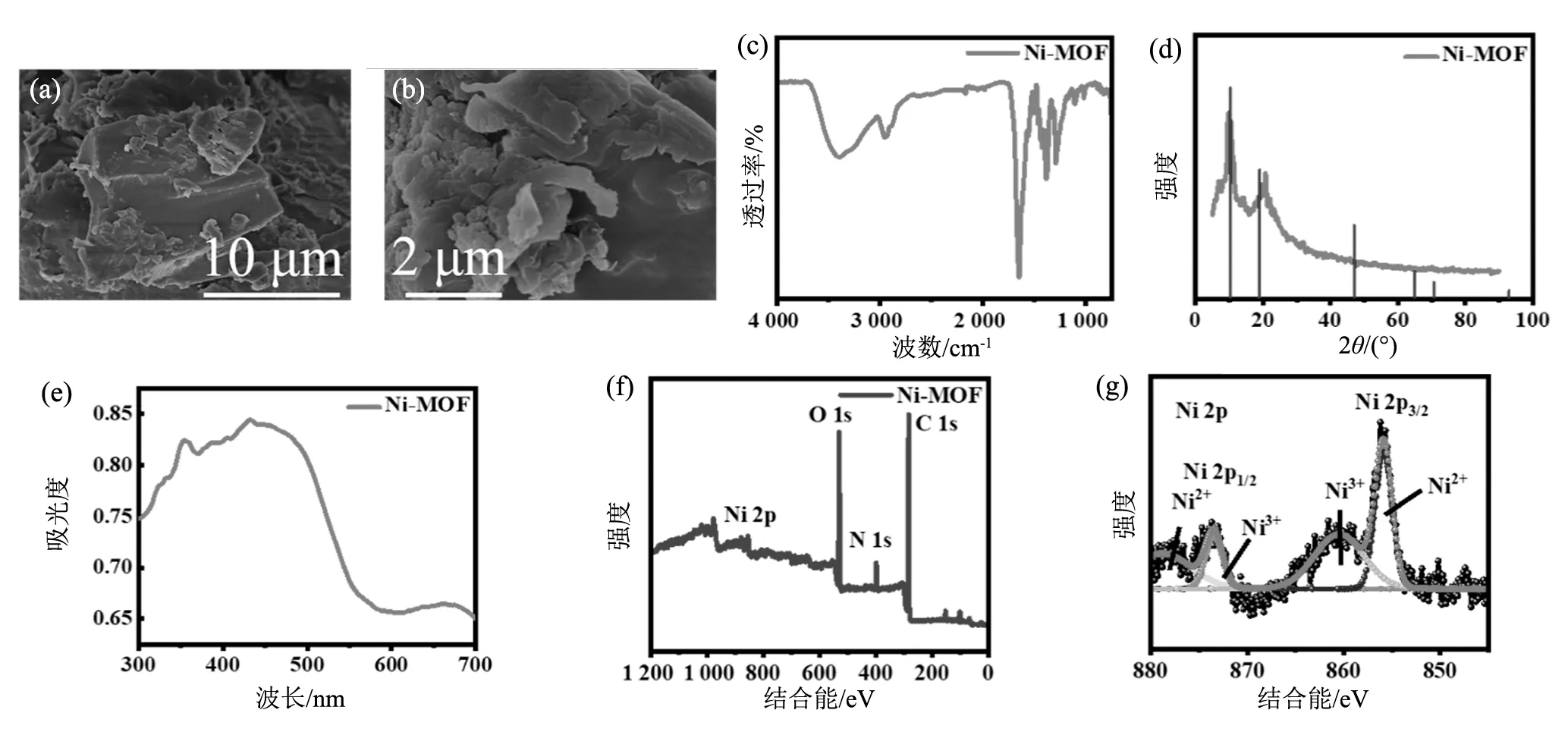
(a,b)Ni-MOF的扫描电子显微镜图像;(c)Ni-MOF的傅里叶红外图谱;(d)Ni-MOF的X射线衍射图谱;(e)Ni-MOF的紫外可见光光谱;(f)Ni-MOF的XPS扫描光谱;(g)Ni-MOF中含有Ni 2p的XPS扫描光谱
对Ni-MOF进行傅里叶红外光测试,如图1(c)所示,确认Ni-MOF的形成,其中波数为2 850~2 950 cm-1的红外波段可以指示Ni-MOF骨架链中PVP的CH2的不对称伸缩振动。1 465和1 370 cm-1处的峰可以认为是CH2的弯曲振动峰,而1 440 cm-1位置的峰则可以与-OH的弯曲振动峰相匹配。同样匹配的还有1 295 cm-1处的峰,这处振动峰和PVP中的C-N处的伸缩振动峰相匹配[9]。而Ni-MOF的C=O伸缩振动峰位于1 665~1 705 cm-1处,这表明了H2BDC发生了去质子化[10]。Ni-MOF还存在和羧基的不对称伸缩振动峰、对称伸缩振动峰相匹配的振动峰,两者分别位于1 490~1 600 cm-1和1 350~1 450 cm-1处。除此之外,1 080~1 200 cm-1的IR波段可归因于C-O伸缩振动。在1 293~1 300 cm-1观察到芳香胺的C-N伸缩,而脂肪胺的C-N伸缩位于1 019 cm-1左右。对于Ni-MOF,C-N=O的弯曲振动出现在675 cm-1左右,而750~880 cm-1的IR波段可归属于C-H弯曲振动。在1 293~1 300 cm-1观察到芳香胺的C-N伸缩的存在,而脂肪胺的C-N伸缩位于1 019 cm-1左右。这些新红外光谱带的存在表明金属镍与BDC配体成功配位形成Ni-BDC MOF,标志着Ni-MOF的成功制备。

如图1(e)所示,之后还对Ni-MOF进行紫外可见光分光光度计测试,通过朗伯-比尔(Lambert-Beer)定律可知,物质在一定浓度的吸光度与它的吸收介质的厚度呈正比,通过UV图谱了解到这种类型的峰的左右移动(红移/蓝移)和峰的上下(高度)变化。由于苯环发生了π→π*的跃迁,在340 nm处可以观察到苯环的B吸收紫外光或可见光的生色团。同时因为苯环上含有取代基,当芳环上的-CH基团被取代之后,B吸收带发生红移且强度增加。而且由于引入了单原子,Ni-MOF还产生了n→π*的吸收带。所以紫外可见光光谱和傅里叶红外光谱、X射线衍射光谱可以互相映衬,表明金属镍与BDC配体成功配位形成Ni-BDC MOF,证明Ni-MOF被成功制备。
通过XPS测量进一步分析Ni-MOF,以便更好地了解其化学结构和环境。如图1(f)所示,分别对应于C 1s、N 1s和O 1s的峰值信号集中在XPS光谱上以284.2,399.4和531.0 eV为中心的区域。N 1s光谱中只有一个主基团位于399.4 eV,它来源于N-(C)3键或H-N-(C)2键形成的三级N键。在534.8 eV的结合能(BE)处与O 1s光谱分离的组分与C-O基团相匹配。通过XPS再一次表明金属镍与BDC配体成功配位形成Ni-BDC MOF,同样也标志着Ni-MOF成功制备。为了进一步研究MOF中各元素的化学价态和化学环境,分析了Ni 2p核心级XPS光谱,如图1(g)所示。Ni 2p核心级XPS光谱Ni 2p3/2的BEs集中在855.1和856.1 eV,分别对应于Ni2+和Ni3+离子,而860.0和862.7 eV的BEs是由Ni2+和Ni3+离子的卫星峰引起的。Ni 2p1/2的Ni2+和Ni3+在872.5和873.3 eV处确认了峰,并且在877.3和880.6 eV处检测到了它们的卫星峰。上述表征证明这种MOF由Ni2+/Ni3+组成,Ni2+/Ni3+可以提高电子转移效率,加速催化氧化反应,从而提高MOF催化氧化葡萄糖的效率。
对Ni-MOF样品进行比表面积测试,其的比表面积为286 m2·g-1,孔容为0.014 2 cm3·g-1。这种片层状疏松多孔结构暴露出大量的活性位点,使Ni-MOF能够促进葡萄糖分子的扩散和吸附。
2.2 Ni-MOF的电化学性能表征
经过测试,Ni-BDC的最大电导率为1.78×10-4S·cm-1(300 K)。Ni-BDC架构的分层结构和裸露的金属位置使人们相信其在传感领域能大有可为。将制备好的Ni-BDC样品涂在玻碳电极(GCE)上,用于电化学非酶促葡萄糖传感。葡萄糖传感测量是通过使用具有三电极系统的电化学工作站进行的。如图2所示,Ni-BDC显示一对CV曲线中的不对称氧化还原峰,阳极峰在0.6 V附近,阴极峰在0.2 V附近,表明Ni2+/Ni3+和OH之间存在氧化还原反应,具有可逆的法拉第机制,并形成中间产物NiOOH和Ni(OH)2。这些结果表明,分层片状Ni-MOF具有良好的葡萄糖传感性能,这是由于更容易接近和增加的活性位点以及相互连接的3D结构,可以为生物分子的扩散提供空间,降低接触电阻,提高电极和电解质界面的质量或电荷转移速率。分层片状Ni-BDC电极的电化学葡萄糖传感机制基于NaOH电解质中Ni2+与葡萄糖可能发生的氧化还原反应,如公式(1)和(2)[13]。

(a)循环伏安响应;(b)氧化还原峰电流与扫描速率平方根的关系

(1)

(2)
绘制Ni-MOF的稳态电流值与其浓度之间的关系,并对其电流-时间曲线图进行线性拟合。如图3所示,在葡萄糖浓度0~4.27 mmol/L范围内,葡萄糖传感器的电流响应随时间逐渐变化而渐趋于一个恒定值,且随着葡萄糖浓度的增加电极修饰材料的电流响应渐次不断提高。通过线性拟合后发现,该浓度范围内电极修饰材料的灵敏度为0.884 μA·L·mmol-1,检测限(LOD)为2.647 mmol/L。片层状的Ni-MOF避免了金属纳米颗粒的团聚,大幅提高了电极与电解液之间的接触面积,相比于传统MOF材料,单原子Ni-MOF具有良好的葡萄糖催化氧化电化学动力学特性,更适合于用作无酶葡萄糖电化学催化剂。这证明金属有机框架材料有机会应用于无酶葡萄糖电化学检测中。
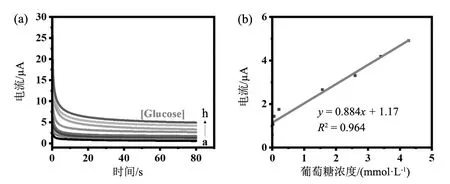
葡萄糖浓度为(a)0,(b)0.02,(c)0.058,(d)0.21,(e)1.57,(f)2.60,(g)3.40,(h)4.27 mmol/L,pH值为13,恒定电压0.6 V
在1 mmol/L葡萄糖溶液中对Ni-MOF进行了评估,并使用计时电流法确定了电极修饰材料的长期稳定性。如图4所示,Ni-MOF稳定长期传感性能较为一般,这归因于Ni-MOF内部的片层状纳米多孔结构作为Ni-MOF的传感区域。相互连接的片层状结构为汗液的持续渗透和扩散提供了通道,而高孔体积为有效的活性位点提供了接触空间,并且由于毛细管作用,片层状结构有利于葡萄糖与活性位点的充分接触。伴随着Ni2+和葡萄糖的可逆反应进行,活性位点被可逆反应生成的中间产物阻塞,导致Ni2+和葡萄糖的可逆反应无法继续长期持续,直至反应最终停止。

图4 Ni-MOF电化学汗液传感在1 mmol/L葡萄糖溶液中的长期稳定性
3 结论
制备以镍离子为金属团簇,苯二甲酸为配体的2D纳米片组片层状单金属Ni-MOF材料,利用乙腈溶剂化金属离子并控制其形态,聚乙烯吡咯烷酮控制纳米片的成核生长并驱动片层材料的组装。金属前驱体与PVP的质量比和乙腈的量对分层片状/片状M-BDC MOF的形成产生强烈影响。乙腈有助于维持金属前体的溶剂化,而PVP有助于MOF晶体的成核和生长。分层片状Ni-BDC电极的电化学葡萄糖传感机制基于NaOH电解质中Ni2+与葡萄糖可能发生的氧化还原反应。活性位点的增加以及3D结构的相互连接可以为生物分子的扩散提供空间,降低接触电阻,提高电极和电解质界面的质量或电荷转移速率,片层状Ni-MOF具有良好的葡萄糖传感性能。通过拟合葡萄糖标准曲线,可知此时该浓度范围内葡萄糖传感器的灵敏度为0.884 μA·L·mmol-1,检测限为2.647 mmol/L(S/N=3)。这种金属有机框架材料为无酶汗液检测提供了一种高效、快速且高灵敏度的检测平台,但是单一金属团簇的长期稳定性较差,不适合长期长时间监测,未来有待进一步改进。
